检测代谢标志物的试剂在制备睡眠障碍筛查或诊断产品中的用途
1.本发明涉及生物医药领域,具体涉及检测代谢标志物的试剂在制备睡眠障碍筛查或诊断产品中的用途。
背景技术:
2.睡眠对人类十分重要,人类一生中大约有三分之一的时间是在睡眠中度过的,睡眠与人的健康息息相关。首先,睡眠不足、睡眠障碍可能是由某些疾病导致的,反应人体出现某些健康问题;同时,睡眠不足、睡眠障碍也会对人的认知功能和情绪产生显著影响,易造成注意力不集中、警觉能力减弱、记忆力下降、行动迟缓、反应变慢、出现视听幻觉、易激惹和躁狂等焦虑症状,甚至导致更为严重的疾病发生。调查显示,很多人都患有睡眠方面的障碍或者和睡眠相关的疾病,成年人出现睡眠障碍的比例高达30%,其中老年人更是常见。
3.目前,针对睡眠障碍的诊断,最重要方法是应用脑电图多导联描记装置进行全夜睡眠过程的监测;同时结合各种量表对睡眠质量进行评定。但是对睡眠监测既昂贵又费时,而利用各种量表对睡眠质量进行评定时受到患者主观的影响,均无法快速、准确对睡眠障碍进行诊断;更无法对具有高患睡眠障碍风险的人群准确、有效的筛查,进行预防。
4.此外,老年人出现睡眠障碍可能是由于与年龄相关的共病和药物使用的增加,以及睡眠结构的改变所致。虽然睡眠障碍、相关共病和衰老之间的密切联系是众所周知的,但它们之间的联系仍无法从分子层面得到解释。因而无法正确筛查或诊断出睡眠障碍的真正原因,从而无法针对性地预防或治疗睡眠障碍。
5.专利wo2016044338a3公开了一种用于诊断睡眠障碍的方法和系统,该方法公开了多种可用于诊断睡眠障碍的生物标记物,这些生物标记物虽然可用以诊断睡眠障碍,但不能对睡眠障碍类型进一步诊断,无法判定睡眠障碍共病,找到导致睡眠障碍的原因。找到一种可以判断睡眠障碍共病的标志物,确定导致睡眠障碍的原因,用于筛查或诊断睡眠障碍,对针对性预防或治疗睡眠障碍有重要意义。
技术实现要素:
6.为了解决上述问题,本发明提供了检测代谢标志物的试剂在制备睡眠障碍筛查或诊断产品中的用途。本发明的目的在于提供与睡眠障碍相关的代谢标志物,通过检测代谢标志物水平,判断患者是否患有睡眠障碍或是否有患睡眠障碍的风险,以及何种原因导致的睡眠障碍,从而为睡眠障碍的早期筛查、诊断提供一种新的手段。
7.本发明提供了检测代谢标志物的试剂在制备睡眠障碍筛查或诊断产品中的用途;
8.所述代谢标志物选自甘油三酯类代谢物、磷脂酰胆碱类代谢物、胆固醇脂类代谢物、磷脂酰乙醇胺类代谢物、神经酰胺类类代谢物、氨基酸、多肽及其类似物、苯甲酸及其衍生物、脂肪酸类代谢物、脂肪酸酯类代谢物、类固醇类及衍生物类代谢物、其他类别代谢物中的一种或多种。
9.进一步地,
10.所述甘油三酯类代谢物选自tg(53:2)、tg(52:2)、tg(52:7)、tg(54:2)、tg(50:3)中的一种或多种;
11.和/或,所述磷脂酰胆碱类代谢物选自pc(37:2)、pc(33:2)、pc(44:6)、pc(35:2)、pc(36:2)、pc(38:7)、pc(34:3)、pc(36:4)、pc(34:2)中的一种或多种;
12.和/或,所述胆固醇脂类代谢物选自che(22:6)、che(20:4)、che(18:3)中的一种或多种;
13.和/或,所述磷脂酰乙醇胺类代谢物选自pe(42:10)、pe(40:5)、pe(38:4)、pe(40:4)、pe(40:7)、pe(36:4)、pe(38:8)、pe(38:5)中的一种或多种;
14.和/或,所述神经酰胺类类代谢物选自cer(42:0)、cer(40:1)、cer(42:1)中的一种或多种;
15.和/或,所述氨基酸、多肽及其类似物选自l-丝氨酸、谷氨酰甘氨酸、肌酸、二氨基己酸酯、2-苯基甘氨酸、l-天冬氨酸、胍基乙酸、3-羟基-n6,n6,n6-三甲基-l-赖氨酸中的一种或多种;
16.和/或,所述苯甲酸及其衍生物选自水杨尿酸、己基间苯二酚、腺苷酸琥珀酸、羟基苯甲酸中的一种或几种;
17.和/或,所述脂肪酸类代谢物选自十一烷酸、十三烷酸中的一种或几种;
18.和/或,所述脂肪酸酯类代谢物选自硬脂酰肉碱、棕榈酰肉碱、亚油酸肉碱、羟基丁酰肉碱中的一种或几种;
19.和/或,所述类固醇类及衍生物类代谢物选自钙二醇、孕烯醇酮中的一种或几种;
20.和/或,所述其他类别代谢物选自l-犬尿氨酸、lysope(16:0)、5-羟基吲哚乙酸、鞘氨醇中的一种或几种。
21.进一步地,
22.所述代谢标志物che(20:4)、che(22:6)、pc(44:6)、pe(40:4)、tg(54:2)、硬脂酰肉碱、棕榈酰肉碱、2-苯基甘氨酸、羟基丁基肉碱中一种或多种是特征性的用于筛查或诊断睡眠障碍的代谢标志物;
23.和/或,所述代谢标志物pe(42:10)、l-犬尿氨酸、5-羟基吲哚乙酸、孕烯醇酮中一种或多种是用于筛查或诊断衰老相关睡眠障碍发生的代谢标志物;
24.和/或,所述代谢标志物che(18:3)、pc(33:2)、pc(34:2)、pc(35:2)、pc(36:2)、pc(37:2)、tg(52:7)和己基间苯二酚中一种或多种是用于筛查或诊断认知功能障碍相关睡眠障碍发生的代谢标志物;
25.和/或,所述代谢标志物pc(38:7)、pe(40:5)、3-羟基-n6、n6、n6-三甲基-l-赖氨酸中一种或多种是用于筛查或诊断高血压导致睡眠障碍发生的代谢标志物。
26.进一步地,所述代谢标志物含量在人体中上调或下调。
27.进一步地,所述试剂为酶联免疫吸附试验用试剂;
28.和/或,所述试剂为western blot试剂;
29.和/或,所述试剂为蛋白芯片检测方法用试剂。
30.进一步地,所述试剂通过以下一种或多种方法检测代谢物水平:色谱法、光谱法、质谱法、化学分析法。
31.进一步地,所述试剂检测的样本为人外周血。
32.进一步地,所述试剂检测的样本为血浆。
33.进一步地,
34.所述检测代谢标志物che(20:4)、che(22:6)、pc(44:6)、pe(40:4)、tg(54:2)、硬脂酰肉碱、棕榈酰肉碱、2-苯基甘氨酸、羟基丁基肉碱中一种或多种的试剂用于制备特征性筛查或诊断睡眠障碍的产品;
35.和/或,所述检测代谢标志物pe(42:10)、l-犬尿氨酸、5-羟基吲哚乙酸、孕烯醇酮中一种或多种的试剂用于制备筛查或诊断衰老相关睡眠障碍的产品;
36.和/或,所述检测代谢标志物che(18:3)、pc(33:2)、pc(34:2)、pc(35:2)、pc(36:2)、pc(37:2)、tg(52:7)和己基间苯二酚中一种或多种的试剂用于制备筛查或诊断认知功能障碍相关睡眠障碍的产品;
37.和/或,所述检测代谢标志物pc(38:7)、pe(40:5)、3-羟基-n6、n6、n6-三甲基-l-赖氨酸中一种或多种的试剂用于制备筛查或诊断高血压导致睡眠障碍的产品。
38.本发明揭示了睡眠障碍的风险代谢物,并研究出这些风险代谢物与睡眠障碍共病之间的关系。这些风险代谢物可作为用于筛查或诊断睡眠障碍的标记物,用于筛查或诊断睡眠障碍,特别是对于不同共病影响的睡眠障碍的筛查或诊断,具有良好的应用前景。
39.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
40.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
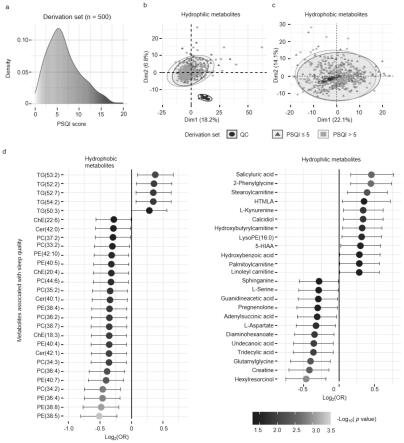
41.图1为睡眠障碍的风险代谢物筛选结果:a为从中国西部健康与老龄化趋势研究队列(wchat)随机抽取用于代谢组学检测的500人的psqi得分分布;b为用代谢组学数据绘制主成分图的结果;c为用脂质组学数据绘制主成分图的结果;d为用logistic回归分析后显示的与睡眠质量显著相关的52种代谢物,左边为28种疏水性脂质代谢物,右边为24种亲水性代谢物,代谢物根据粗比值比(or)在图中由上往下进行排序,每个代谢物的宽度表示95%置信区间,tg表示甘油三酯,lysope表示溶血磷脂酰乙醇胺,che表示胆固醇酯,cer表示神经酰胺,pc表示磷脂酰胆碱,pe表示磷脂酰乙醇胺;5-hiaa表示5-羟基吲哚乙酸;htmla表示3-羟基-n6,n6,n6-三甲基-l-赖氨酸。
42.图2为风险代谢物与psqi组分间的相关性结果,网络图显示了睡眠障碍的风险代谢物与psqi的6个组成部分之间的相关性,包括主观睡眠质量、睡眠持续时间、睡眠潜伏期、习惯性睡眠效率、日间功能障碍和睡眠障碍;通过r软件的wgcna包获得的spearman相关系数表示为psqi组分和代谢物节点之间的连接线(边)(相关系数》0.1或《0.1,算法为as 89,p《0.05);边缘宽度与相关强度成正比;节点大小与与其他节点的连接数成比例;红色线段表示正相关,绿色线段表示负相关;节点颜色表示代谢物的种类和psqi的成分;图形在gephi 0.9.2中生成;che为胆固醇酯;pc为磷脂酰胆碱;pe为磷脂酰乙醇胺;lysope为溶血磷脂酰乙醇胺;tg为甘油三酯;5-hiaa为5-羟吲哚乙酸。
43.图3为识别睡眠障碍的预测模型:a为可视化每个惩罚的系数;b和c为训练集(b)和测试集(c)曲线下的面积(auc);通过对52种睡眠障碍风险代谢物的lasso回归分析,建立了预测模型;d和e外部验证集的主成分分析图(34人),去除了95%置信区间外的两个异常值;f为外部验证集的auc。
44.图4为疾病和症状对睡眠质量评估的影响:a为根据问卷评估和代谢模型预测将所有参与者分为四组:第一组psqi评定为好的睡眠质量,代谢组学预测好的睡眠质量;第二组psqi评定为差的睡眠质量,代谢组学预测好的睡眠质量;第三组psqi评定为好的睡眠质量,代谢组学预测差的睡眠质量;第四组psqi评定为差的睡眠质量,代谢组学预测差的睡眠质量;b为四组间年龄、血液常规指标的差异;所有y轴值都通过“最小-最大”(min-max)标准化缩放到0到1的范围;c为四组间慢性疾病数量差异;d和e为高血压(d)和骨关节病(e)在代谢组学预测组间流行病学的差异。f为认知功能障碍参与者在在代谢组学预测组间流行病学的差异,认知障碍是由一个10分短期便携式心理状况问卷(spmsq)结合文化水平进行评估;g为四组间临床症状的差异。血液生化检查、疾病和临床症状的p值已按年龄和性别进行调整,*代表p《0.05,**代表p《0.01,**代表p《0.001。
45.图5为ⅰ组与ⅳ组危险代谢物强度差异分析:a箱线图显示了ⅰ组(psqi评估为好,代谢组学预测为好)与ⅳ组(psqi评估为差,代谢组学预测为差)的风险代谢物的强度差异;b为
ⅰ‑ⅳ
组htmla的强度,htmla为3-羟基-n6,n6,n6-三甲基-l-赖氨酸。
46.图6为睡眠障碍、衰老和相关共病间的共同风险代谢物:52种睡眠障碍相关的风险代谢物与年龄及共病的相关性;代谢物与年龄的相关分析调整性别,分别采用线性回归logistic回归进行分析,其中logistic回归中以69岁为中位年龄进行分组;52种睡眠相关的风险代谢物与慢性病、认知障碍、焦虑、抑郁和焦虑抑郁障碍的相关性按年龄和性别进行调整;sd为睡眠障碍,ci为认知障碍,hp为高血压,dia为糖尿病,chd为冠心病,str为中风,copd为慢性阻塞性肺疾病,anx为焦虑,dep为抑郁,anx-dep为焦虑抑郁障碍,gd为胃肠道疾病,ld为肝病,kd为肾脏疾病,ost为骨关节炎,用于相关分析的参与者人数展示在括号中。
47.图7为:睡眠风险代谢物的不同年龄以及睡眠相关疾病中变化。a为箱线图显示69岁以下和69岁以上参与者风险代谢物强度的差异。b-l分别为箱线图显示患有认知障碍、高血压、糖尿病、中风、慢性阻塞性肺病、抑郁症、焦虑抑郁症、胃肠道疾病、肝脏疾病、肾脏疾病和骨关节病等疾病的参与者,与没有上述疾病的参与者之间的风险代谢物强度差异。
具体实施方式
48.本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
49.实施例1、用于诊断睡眠障碍的生物标记物的确定
50.1、方法
51.(1)赫尔辛基伦理原则宣言
52.研究样本来自中国西部健康与老龄化趋势(wchat)研究的基线,这是一项正在进行的前瞻性队列研究,旨在评估中国西部地区的健康状况及其影响因素。该研究在中国临床试验注册中心(chictr1800018895)注册,并由四川大学华西医院伦理委员会批准(编号:2017-445),于2018年开始。根据赫尔辛基道德原则宣言,所有参与者签署书面知情同意书参与试验。通过面对面访谈收集被试信息。匹兹堡睡眠质量指数(psqi)包括7个方面(主观
睡眠质量、睡眠潜伏期、睡眠持续时间、习惯性睡眠效率、睡眠障碍、睡眠药物使用和日间功能障碍)来评估睡眠质量,其总分为21分。在研究中,定义psqi》5.0表示睡眠质量差。在有睡眠障碍的参与者中观察到较高的合并症比例,包括冠心病、高血压、慢性阻塞性肺病(copd)、糖尿病、胃肠道疾病、中风、肝脏疾病、肾脏疾病、骨关节炎、认知障碍、抑郁、焦虑和焦虑-抑郁症。
53.(2)血样采集
54.受试者早上到达研究中心时,由培训后的护士采集三管空腹血,当天进行血液常规检测,另外两管血液在静脉穿刺后30分钟内以3500g离心15分钟,其中血浆被收集并储存在-80℃环境中。整个血液处理过程是在严格的标准化方案下进行的。
55.(3)非靶向代谢组学分析
56.亲水性代谢产物用甲醇提取,脂质用二氯甲烷/甲醇(v/v=2:1)液-液萃取。加入
13c6 l-赖氨酸盐粉末(silantes)和
13c615n4 l-精氨酸盐粉末(silantes)监测亲水性代谢物的提取效率,加入pe(16:0-d31-18:1)监测脂质的提取效率。质谱代谢组学和脂质组学分析由清华大学代谢组学和脂质组学研究中心完成。beh酰胺柱(waters,usa)和beh c18柱(waters,usa)分别用于正离子和负离子模式下的代谢组学分析。cortecs c18柱(waters,usa)用于阳性模式下的脂质组学。每注射15-20次血浆样品,加入混合质量控制(qcs)。基于内部数据库,使用追踪器(thermo,ca)分配极性代谢物。数据库中包括了1500多种代谢物的标准ms/ms光谱。使用脂质研究(thermo,ca)软件鉴定脂质。以下统计分析仅使用具有可靠ms/ms的脂质。
57.(4)数据处理与统计分析
58.所有保留代谢物至少存在于80%的发现集样品中,质量控制(qc)样品的变异系数(cv)低于30%。代谢物的总相对强度被归一化。对强度值进行log2变换,以减少偏斜度,并稳定方差。使用r或spss软件版本26(ibm corporation,chicago,il,usa)进行统计分析。分类变量以计数和百分比表示。利用柯尔莫可洛夫-斯米洛夫检验对正态分布的连续变量进行了探讨,并将正态分布的变量表示为均值
±
标准差。非正态分布的变量以中位数和四分位间距(iqr)表示。两组间的差异采用皮尔逊卡方检验(分类变量)、独立样本t检验(正态分布连续变量)和曼尼u检验(非正态分布连续变量)。采用等方差分析和克鲁斯卡尔-沃利斯检验检验3组及以上组间的差异。在预测模型中,将433人按8:2的比例分成训练集和测试集,然后进行交叉验证,优化超参数进行内部验证。
59.2、结果
60.(1)wchat队列中睡眠障碍的临床特征
61.6887名wchat队列参与者包含完整的匹兹堡睡眠质量指数(psqi)信息。他们年龄从50到95岁不等,平均年龄为62.43
±
8.27岁。统计分析显示,6887名参与者中有47.2%的人存在睡眠障碍,psqi得分高于5.0,说明睡眠障碍在老年人中十分常见。此外,伴有睡眠障碍的参与者存在较高的并发症比例,包括冠状动脉疾病、高血压、慢性阻塞性肺病、糖尿病、胃肠道疾病、卒中、肝病、肾病、骨关节炎、认知障碍、抑郁症、焦虑和焦虑-抑郁症。
62.(2)识别睡眠障碍的风险代谢物
63.为了揭示睡眠障碍和代谢紊乱之间的关系,随机抽取了500名汉族老年人作为代谢分析的初始发现集。这500人的psqi得分分布与wchat队列分布一致(图1a),表明这个初
始发现集具有良好代表性。在去除16名正在服药的参与者和主成分分析(pca)中的51个异常值后(图1b-1c),433名参与者的代谢数据被用来筛选代谢物和建立对睡眠障碍的风险预测模型。采用logistic回归分析确定与psqi评分显著相关的代谢物,所有代谢物的丰度进行了log2转换和z-score归一化。结果,通过使用r中的glm函数,52种代谢物(包括28种疏水性和24种亲水性代谢物)与睡眠质量显著相关(p《0.05)(图1d)。在疏水的代谢物中,甘油三酯(tgs)是睡眠障碍的危险因素,而磷脂酰胆碱(pc)、胆固醇酯(ches)、磷脂酰乙醇胺(pes)和神经酰胺(cers)是睡眠障碍的保护性因素(图1d左)。对于亲水代谢产物,一些如l-犬尿氨酸、5-羟基吲哚乙酸、钙二醇、硬脂酰肉碱增加了睡眠障碍的风险,另一些如肌酸、l-丝氨酸、十一酸可以保护参与者免受睡眠障碍的影响(图1d右)。
64.接下来,研究了通过logistic回归分析得到的52种风险代谢物是如何影响睡眠质量的。通过wgcna软件包中的spearman相关性分析,分别分析了风险代谢产物与除药物治疗外的psqi各个领域之间的关系(算法as 89,p《0.05,相关系数》0.1或《-0.1)(图2)。研究发现,更多风险代谢物与主观睡眠质量、睡眠延迟(睡眠潜伏期)和日间功能障碍有关。具体而言,tg(53:2)、tg(52:7)、pc(34:2)、pc(44:6)、pc(35:2)、pc(36:4)、pc(34:3)、che(20:4)、che(18:3)、che(22:6)、水杨尿酸、lysope(16:0)、l-犬尿氨酸、5-羟基吲哚乙酸和胍基乙酸等代谢物与主观睡眠质量相关;tg(52:7)、pc(36:2)、pc(37:2)、pc(44:6)、pc(35:2)、pc(34:2)、pe(40:5)、pe(36:4)、pe(38:8)、cer(40:1)、cer(42:1)、cer(42:0)、lysope(16:0)、水杨尿酸、鞘氨醇、二氨基己酸酯、十三烷酸、十一烷酸等代谢物对睡眠潜伏期有影响;代谢物tg(50:3)、lysope(16:0)、pc(38:7)、cer(42:0)、pe(38:8)、pe(36:4)、pe(40:7)、pe(38:4)、pe(38:5)、pe(42:10)、谷氨酰甘氨酸、肌酸、二氨基己酸酯、天冬氨酸、腺苷基琥珀酸、己基间苯二酚、十三烷酸、孕烯醇酮、十一烷酸会影响白天的功能障碍。其中,一些风险代谢物如水杨尿酸、十三烷酸、十一烷酸、lysope(16:0)、pc(34:2)和pe(38:8)与psqi的睡眠质量三个方面有显著相关性。上述分类部分揭示了代谢物在睡眠调节中的作用。
65.(3)睡眠障碍的预测模型
66.为了建立诊断睡眠障碍参与者的代谢模型,用r中等glmnet包了52种风险代谢物进行了岭回归分析。将443份样本按8:2的比例随机分为训练集和测试集。通过10倍交叉验证训练模型的质量,以优化惩罚参数(图3a),并通过计算灵敏度、特异度和受试者操作特征曲线(roc)下面积来评估模型质量。训练集的曲线下面积(auc)为72.24%(95%ci:66.94%~77.54%)(图3b),测试组的曲线下面积(auc)为71.62%(95%ci:60.25%~82.99%)(图3c)。去除异常值后34名参与者中有32名被用作外部验证集(图3d-3e),auc统计值为75.42%(95%ci:57.17%-93.66%)(图3f)。cronbach's alpha是一种通常用于衡量信度的统计指标。研究发现,代谢模型的预测精度与psqi的cronbach'salpha值一致(0.70~0.83)37。说明本发明代谢物可以用于构建睡眠障碍的预测模型。
67.(4)共病和症状对睡眠质量评估的影响
68.为了评估共病对睡眠质量的影响,将参与者分为四组。第i组(n=133),通过问卷评估为好,通过模型预测为好;第ii组(n=73),评估为差,预测为好;第iii组(n=71),评估为好,预测为差;第iv组(n=156),评估为差,预测为差(图4a)。
69.统计分析显示,被评估为睡眠差但被预测为睡眠好的参与者(第ii组)年龄要小得多(图4b),患慢性病的次数也少得多(图4c)。而被评价为良好但被预测为睡眠不良的参与
者(第iii组)有更高的tg和vldl,较低的hdl,表明睡眠质量与血浆脂质谱密切相关。此外,他们患有更多类型的合并症(图4c)。在相关共病中,预测为良好睡眠者的受试者高血压、骨关节病和认知功能障碍的患病率要低得多(图4d-4f),说明共病可能会显著影响代谢平衡和模型的预测准确性。接下来,检查了所有参与者的临床症状,发现被评价为差但被预测为良好的睡眠者(第ii组)患有更多的头痛、心悸、胸闷、心前区疼痛、腹泻、苦味、眼睛干涩、背痛和牙痛,表明轻微症状可能会影响基于问卷的评估,但对睡眠障碍风险代谢物平衡的影响较小(图4g)。
70.此外,比较了i组和iv组中52种风险代谢物的丰度(图5a),发现除3-羟基-n6,n6,n6-三甲基-l-赖氨(htmla)外,其余大部分代谢物在两组间存在显著性差异。有趣的是,那些被评估为差但被预测为差的参与者的htmla水平要低得多(补充图5b)。总的来说,研究揭示了衰老、共病和临床症状对代谢平衡和睡眠质量评估的影响。
71.(5)睡眠障碍与衰老和相关共病的代谢标志物研究
72.为了建立睡眠障碍、相关合并症和衰老之间的直接联系,接下来对睡眠障碍的52种风险代谢产物进行了融合分析(图6和图7)。研究发现,风险代谢物che(20:4)、che(22:6)、pc(44:6)、pe(40:4)、tg(54:2)、硬脂酰肉碱(stearoylcarnitine)、棕榈酰肉碱(palmitoylcarnitine)、2-苯甘氨酸(2-phenylglycine)、羟基丁基肉碱(hydroxybutyrylcarnitine)和羟基苯甲酸(hydroxybenzoic acid)与衰老和/或某些相关合并症无关,仅与睡眠障碍相关,是睡眠障碍的标志物,可特征性用于筛查或诊断睡眠障碍(图6)。
73.同时,许多与睡眠障碍密切相关的风险代谢物也显示与衰老和/或某些相关合并症密切相关。
74.研究发现,在52种睡眠障碍风险代谢物中,包括pe(42:10)、l-犬尿氨酸、5-羟基吲哚乙酸、孕烯醇酮在内的4种代谢产物的变化表明其衰老的风险高于睡眠障碍和相关合并症(图6),暗示这些代谢物的变化可能是衰老所造成的,但也对睡眠障碍和相关共病有重要影响。这些代谢标志物可用于筛查或诊断衰老相关睡眠障碍。
75.在相关的共病中,认知障碍、高血压和糖尿病与睡眠障碍有最共同的风险代谢物。其中,代谢物che(18:3)、pc(33:2)、pc(34:2)、pc(35:2)、pc(36:2)、pc(37:2)、tg(52:7)和己基间苯二酚的认知功能损害风险高于睡眠障碍和其他共病,但也对睡眠障碍和相关共病有重要影响,这些代谢标志物可用于筛查或诊断认知功能障碍相关睡眠障碍。
76.代谢物pc(38:7)、pe(40:5)、3-羟基-n6,n6,n6-三甲基-l-赖氨酸则是可用于筛查或诊断高血压导致睡眠障碍发生的生物标志物。
77.本发明揭示了睡眠障碍的风险代谢物,并研究出这些风险代谢物与睡眠障碍共病之间的关系。这些风险代谢物可作为用于筛查或诊断睡眠障碍的标记物,用于筛查或诊断睡眠障碍,特别是对于不同共病影响的睡眠障碍的筛查或诊断,具有良好的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1