一种检测D-二聚体的试剂盒及其制备方法与流程
一种检测d
‑
二聚体的试剂盒及其制备方法
技术领域
1.本发明涉及免疫学检测技术领域,具体而言,涉及一种检测d
‑
二聚体的试剂盒及其制备方法。
背景技术:
2.d
‑
二聚体是人体内凝血系统和纤溶系统共同作用的产物。在生理或各种病理状态下,即机体发生凝血时,凝血系统激活,凝血酶原转化为凝血酶;纤维蛋白原在凝血酶的作用下,裂解形成纤维蛋白单体;形成的纤维蛋白单体在活化因子fxiiia的作用下交联在血管壁上,形成交联纤维蛋白;交联纤维蛋白的形成又促使纤溶系统激活,纤溶酶原转化为纤溶酶,血管壁上的交联纤维蛋白在形成的纤溶酶作用下,分解成各种大小不同的纤维蛋白降解产物(fibrin degradation prodμcts,fdp),d
‑
二聚体则是降解产物中最小的片段。
3.已有研究表明,在各种血栓性疾病中d
‑
二聚体的水平均有升高。如静脉血栓栓塞、严重感染、急性心肌梗死、脑卒中、妊娠高血压、严重肝疾病等。d
‑
二聚体检测的主要价值在于排除静脉血栓(vte),尤其是低度可疑患者,当d
‑
二聚体检验结果为阴性时,可以基本排除vte存在的可能性。近期对新型冠状病毒covid
‑
19的研究中发现,相较于存活患者的d
‑
二聚体结果正常,死亡患者体内的二聚体水平不断上升,7
‑
9天突破正常值,且此后维持在较高水平。因此,d
‑
二聚体的检测具有重大的临床应用价值。
4.通常情况下血液类免疫检测项目所使用的抗凝剂类型为乙二胺四乙酸(edta)盐,而目前临床上测定d
‑
二聚体时,常用枸橼酸盐抗凝的血浆样本类型;当进行d
‑
二聚体检测,则需要针对患者单独抽一管血液,同时,还要将抽取的血液进行离心得到血浆,才能进行检测;这不仅增大了医院工作人员采集血液的工作量,同时也对患者身体存在一定的损伤。
5.目前,d
‑
二聚体检测方法主要包括:免疫比浊法、酶联免疫法、免疫胶体金法、荧光免疫层析法和化学发光法等。免疫比浊检测范围由于hook作用,普遍偏窄,需要通过额外的稀释作用才能检测更高浓度的d
‑
二聚体;另外免疫比浊法由于检测浊度的原理,无法检测全血样本,其样本类型局限为枸橼酸盐血浆。酶联免疫法和化学发光法由于试剂中蛋白酶,其对保存环境和检测环境要求较高,一般是2
‑
8℃,且有多步骤的洗脱,检测时间相对较长,也很难满足目前胸痛中心d
‑
二聚体20分钟出结果的检测周转时间(tat)的要求。免疫胶体金法由于检测颜色的原理,易受血脂、血细胞的影响,其检测全血样本的准确性差。
6.而目前的荧光免疫层析法在检测全血样本时,样品垫一般不经过处理,通过样品垫的多孔物理吸附性质起到拦截红细胞,但这种方式存在检测结果重复性差,检测结果不准确的问题。另外现有的荧光免疫层析法会存在诸如专利cn212031502u中描述的检测灵敏度和准确度较低,均一性和检测信号响应值较低,层析效率差和使用试剂条检测得到的信号扫描曲线的基线容易翘曲、精密度较低等缺点;同时目前检测的d
‑
二聚体荧光层析法还存在专利cn210090472u中所描述无法区分已使用试剂条和未使用试剂条的缺点。
7.鉴于此,特提出本发明。
技术实现要素:
8.本发明的目的在于提供一种检测d
‑
二聚体的试剂盒及其制备方法以解决上述技术问题。
9.发明人发现,在测定d
‑
二聚体时,导致荧光免疫层析检测准确性差、重复性差的问题的原因在于,样品垫的多孔物理吸附结构容易破坏红细胞表面的亲疏水性质从而导致红细胞易破裂,增大了干扰检测结果的风险。从而导致荧光检测仪器设备无法准确检测硝酸纤维膜上的荧光度。有鉴于此,发明人特提出一种新的检测d
‑
二聚体的试剂盒,该检测试剂盒可以实现高准确度的对d
‑
二聚体的检测,且重复性较好。
10.本发明是这样实现的:
11.本发明提供了一种检测d
‑
二聚体的试剂盒,其包括底板、样品垫、结合垫、反应垫、抗体膜和吸水垫,其中,样品垫上包被有抗红细胞的抗体,结合垫上包被有荧光微球与x抗d
‑
二聚体的单克隆抗体a的偶联物,抗体膜上包被有x抗d
‑
二聚体的单克隆抗体b、x抗d
‑
二聚体的多克隆抗体和光活化剂依次作为检测线、质控线和i线,样品垫、结合垫、反应垫、抗体膜和吸水垫依次搭接并设置在底板上;x为鼠源、兔源、羊源或猪源。
12.发明人研究发现,通过对样品垫进行抗红细胞处理,可以使得样品垫上包被上抗红细胞的抗体,这样使得样品垫可以通过抗原抗体表位识别,实现红细胞的吸附,从而在极大程度上有效减少了红细胞的破裂现象的发生。为后续层析后的免疫荧光检测提供了有利的基础。通过对样品垫进行处理,使其具有过滤全血样本中红细胞的作用,避免了大量红细胞对后面免疫反应和检测的干扰,从而实现全血样本类型中d
‑
二聚体的检测。
13.发明人在结合垫和抗体膜之间添加了一层反应垫,形成了一种结合垫
‑
反应垫
‑
抗体膜这样的架桥结构,延长了抗原与抗体反应的时间,这样有利于在检测样本中保证d
‑
二聚体时信号扫描曲线基线平直,也即达到了精密度高的效果。
14.此外,在传统的荧光层析结构的基础上添加一条目视可见的指示线(i线)区域,从而实现了能够快速、便捷地辨别d
‑
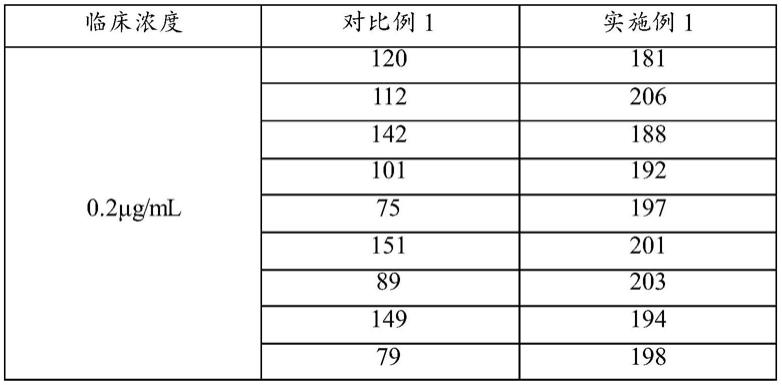
二聚体检测试剂条是否有使用过。
15.需要说明的是,x抗d
‑
二聚体的单克隆抗体a和x抗d
‑
二聚体的单克隆抗体b为两种能特异性识别d
‑
二聚体的单克隆抗体。均为igg,抗原识别表位不同。
16.在本发明应用较佳的实施方式中,上述样品垫上包被有兔抗人红细胞多克隆抗体。在其他实施方式中,上述样品垫上也可以包被其他来源的抗人红细胞多克隆抗体,例如猪、猴、马或羊。
17.在一种实施方式中,上述样品垫上的兔抗人红细胞多克隆抗体是由兔抗人红细胞多克隆抗体溶液的包被制得,兔抗人红细胞多克隆抗体溶液的包被浓度为0.01
‑
1mg/ml;在一种可选的实施方式中,上述包被浓度为0.05
‑
0.5mg/ml。发明人发现在上述包被浓度下,可以满足样品垫对于红细胞的高效拦截。
18.在本发明应用较佳的实施方式中,上述检测线上的x抗d
‑
二聚体的单克隆抗体b是由x抗d
‑
二聚体的单克隆抗体b溶液包被制得,x抗d
‑
二聚体的单克隆抗体b溶液的包被浓度为0.5
‑
4mg/ml。发明人发现,在上述包被浓度下,可以满足较高准确度和极低检测限的样本检出。
19.x抗d
‑
二聚体的单克隆抗体b溶液中的溶剂为pbs,pbs的摩尔浓度为0.005
‑
0.3m。上述pbs的ph为7
‑
7.5。
20.在本发明应用较佳的实施方式中,上述质控线上质控线上x抗d
‑
二聚体的多克隆抗体是由x抗d
‑
二聚体的多克隆抗体溶液包被制得,质控线上x抗d
‑
二聚体的多克隆抗体溶液的包被浓度为0.5
‑
4mg/ml。在上述包被浓度下可以满足后续的荧光定量检测需求。
21.x抗d
‑
二聚体的多克隆抗体溶液中的溶剂为pbs,pbs的摩尔浓度为0.005
‑
0.3m。pbs的ph为7
‑
7.5。
22.在本发明应用较佳的实施方式中,上述i线上光活化剂是由光活化剂溶液包被制得,i线上光活化剂溶液的包被浓度为1
‑
8mg/ml。
23.在其他实施方式中,光活化剂为呫吨衍生物染料、偶氮染料、生物染色剂和类胡萝卜素。
24.呫吨衍生物染料选自芴染料、荧光酮染料或rhodole染料;芴染料选自焦宁染料和罗丹明染料;焦宁染料选自焦宁y和焦宁b;罗丹明类染料及其衍生物(例如包括但不限于红色罗丹明(rbitc)、四甲基罗丹明(tamra)、罗丹明b(tritc)等或其类似物);荧光酮染料选自荧光素和荧光素衍生物,例如包括但不限于异硫氰酸荧光素(fitc)羟基光素(fam)、四氯光素(tet)等或其类似物),荧光素衍生物选自焰红染料b、玫瑰红和汞溴红。
25.偶氮染料选自甲基紫、中性红、对位红、苋菜红、淡红、诱惑红ac、酒石黄、橘黄g、丽春红、甲基红或紫脲酸铵
‑
红紫酸铵。
26.生物染色剂选自番红o、碱性品红、酸性品红、碘化3,3'
‑
二己基羰花青、胭脂红酸或吲哚菁绿。
27.类胡萝卜素选自藏红花酸、α
‑
藏红花原色素(8,8
‑
双脱辅基
‑
8,8
‑
类胡萝卜素酸)、玉米黄素、番茄红素、α
‑
胡萝卜素、β
‑
胡萝卜素、红木素或岩藻黄质。
28.光活化剂为丽春红。发明人发现,将丽春红包被至硝酸纤维膜上后,在样本检测前的试纸条硝酸纤维膜靠近吸水垫的一侧呈红色(丽春红),而当在样品垫上样后,随着层析作用丽春红逐渐层析至吸水垫上,肉眼可见丽春红消失。由此,可以实现试纸条检测与否的鉴别。在上述包被浓度下可以满足常规的d
‑
二聚体的检测需求。
29.在一种可选的实施方式中,光活化剂溶液的溶剂为质量体积百分比3%
‑
30%蔗糖的pbs溶液,pbs溶液的摩尔浓度为0.005
‑
0.05m。
30.在本发明应用较佳的实施方式中,上述反应垫选自如下至少一种的材料制得:
31.滤纸、棉质纤维、聚酯纤维、玻璃纤维和聚醚砜。
32.在其他实施方式中,上述反应垫也可以是用于减缓液体流速、延长抗原
‑
抗体微球特异性反应时间的结构,只要能满足延缓液体从结合垫上进入抗体膜上的功能垫均在本发明所述的反应垫中的保护范围之内。
33.本发明还提供了一种检测d
‑
二聚体的试剂盒的制备方法,其包括如下步骤:
34.分别将样品垫、结合垫、反应垫、抗体膜和吸水垫放置于底板上,组装成试纸条。
35.在本发明应用较佳的实施方式中,上述制备方法还包括样品垫的制备,其包括:将待包被抗体的样品垫上铺设兔抗人红细胞多克隆抗体溶液,干燥制得包被抗体的样品垫。
36.在一种可选的实施方式中,干燥是在类真空环境下或真空环境下干燥;兔抗人红细胞多克隆抗体溶液的ph为5.0
‑
6.5。
37.在本发明应用较佳的实施方式中,上述制备方法还包括结合垫的制备,其包括:将活化后的荧光微球与x抗d
‑
二聚体的单克隆抗体a混合孵育,形成荧光微球与x抗d
‑
二聚体
的单克隆抗体a的偶联物,然后将偶联物用含bsa的pbs溶液进行稀释,平铺至待包被的结合垫上,干燥。上述干燥是在类真空环境下进行。
38.在一种可选的实施方式中,荧光微球与x抗d
‑
二聚体的单克隆抗体a的混合质量比为5
‑
20:1;
39.稀释偶联物时,pbs溶液为含质量百分比0.5
‑
0.6%bsa的0.01
‑
0.05m的pbs溶液,pbs溶液的ph为7
‑
7.5。
40.在本发明应用较佳的实施方式中,上述制备方法还包括在待包被的抗体膜上进行抗体的包被;其包括通过划膜仪分别将检测线包被液、质控线包被液和i线包被液包被至硝酸纤维膜上,然后进行干燥。
41.在一种实施方式中,反应垫与样品垫的距离为0.5
‑
4mm,优选地,反应垫与样品垫的距离为1.5
‑
2.5mm。
42.本发明具有以下有益效果:
43.本发明提供的检测d
‑
二聚体的试剂盒通过对样品垫进行抗红细胞处理,可以使得样品垫上包被上抗红细胞的抗体,这样使得样品垫可以通过抗原抗体表位识别,实现红细胞的吸附,从而在极大程度上有效减少了红细胞的破裂现象的发生。为后续层析后的免疫荧光检测提供了有利的基础。通过对样品垫进行处理,使其具有过滤全血样本中红细胞的作用,避免了大量红细胞对后面免疫反应和检测的干扰,从而实现全血样本类型中d
‑
二聚体的检测。
44.在结合垫和抗体膜之间添加了一层反应垫,形成了一种结合垫
‑
反应垫
‑
抗体膜这样的架桥结构,延长了抗原与抗体反应的时间,这样有利于在检测样本中保证d
‑
二聚体时信号扫描曲线基线平直,也即达到了精密度高的效果。
45.此外,在传统的荧光层析结构的基础上添加一条目视可见的指示线(i线)区域,从而实现了能够快速、便捷地辨别d
‑
二聚体检测试剂条是否有使用过。
46.本发明提供的试剂盒的制备方法简单易行,易于推广应用。
附图说明
47.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
48.图1为本发明的免疫层流层析试剂条的主视图;
49.图2为图1的侧视图;
50.图3a为实施例1提供的试剂盒检测浓度为3.2μg/ml的d
‑
二聚体时信号扫描图;
51.图3b为对比例1提供的试剂盒检测浓度为3.2μg/ml的d
‑
二聚体时信号扫描图;
52.图4为实施例1和对比例2的试剂盒检测edta全血样本后的结果图;
53.图5a为用实施例1的试剂盒和西门子d
‑
dimer检测试剂盒参比方法检测枸橼酸钠血浆样本中d
‑
dimer时两者的线性相关关系图;
54.图5b为用实施例1的试剂盒检测edta全血样本和枸橼酸钠血浆样本中d
‑
二聚体时两者的线性相关关系图;
55.图6为实施例1的试剂盒检测d
‑
二聚体的结果图;
56.图7为对比例3的试剂盒检测d
‑
二聚体的结果图。
57.附图标记:1
‑
pvc底板;2
‑
样品垫;3
‑
抗体微球结合垫;4
‑
反应垫;5
‑
抗体膜;6
‑
吸水纸;51
‑
t检测线;52
‑
c质控线;53
‑
i线指示区域。
具体实施方式
58.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
59.以下结合实施例对本发明的特征和性能作进一步的详细描述。
60.实施例1
61.参照图1和图2所示,本实施例提供了一种检测d
‑
二聚体的检测试剂盒,其包括pvc底板1、样品垫2、抗体微球结合垫3、反应垫4、抗体膜5和吸水纸6(即为吸水垫)。在样品垫2上包被有兔抗人红细胞多克隆抗体溶液,在抗体微球结合垫3上包被有荧光微球与鼠抗d
‑
二聚体单克隆抗体的偶联物。在抗体膜5上依次包被有t检测线51和c质控线52以及i线指示区域53。
62.该检测试剂盒的制备方法如下:
63.(1)抗红细胞(rbc)处理的样品垫1的制备。
64.兔抗人红细胞多克隆抗体溶液配制:用ph6.5,0.1m pb稀释液将上海捷宁兔抗人红细胞多克隆抗体至0.1mg/ml,2
‑
8℃下保存备用;
65.样品垫处理:将上述兔抗人红细胞多克隆抗体溶液均匀平铺到样品垫上,经过类真空环境2h干燥;
66.(2)抗体膜5的制备。
67.t线包被液的配制:用ph7.3,0.01m pbs稀释液将一种roche鼠抗d
‑
dimer单克隆抗体稀释至2mg/ml,2
‑
8℃备用;
68.c线包被液的配制:用ph7.3,0.01m pbs稀释液将一种长沙博优鼠抗d
‑
dimer抗体的多克隆抗体稀释至1mg/ml,2
‑
8℃备用。
69.i线包被液的配制:用含5%(w/v)蔗糖的ph7.3,0.01m pbs稀释液将立春红稀释至5mg/ml,2
‑
8℃备用。
70.包被线:通过划膜喷金仪分别将t线包被液、c线包被液、i线包被液同时包被至nc膜上,之后将包被后的nc膜经过类真空环境下2h干燥。
71.(3)抗体微球结合垫3的制备:选用merck的300nm荧光微球的羧基经过edc/nhs活化后,按质量比10:1加入roche另一种鼠抗d
‑
dimer单克隆抗体,抗体上的氨基可以与微球上活化后的羧基偶联,形成荧光微球与抗体的偶联标记复合物;用含0.6%bsa的ph7.3,0.01m pbs溶液50倍稀释抗体微球复合物,并均匀平铺到结合垫上,经过类真空环境2h干燥。
72.(4)组装试剂条:按照图1和图2所示将样品垫、抗体微球结合垫、反应垫、抗体膜以及吸水纸依次粘贴组装至pvc底板上。组装完成后用切条机切成宽度为3.2mm的试剂条,装
进试剂条,压壳,制备成检测卡(即为检测试剂盒)。
73.本实施例中的反应垫的材质为棉质纤维,在其他实施方式中,反应垫包括但不限于:滤纸、棉质纤维、聚酯纤维、玻璃纤维、聚醚砜、或其组合。反应垫可以用于减缓液体流速、延长抗原
‑
抗体微球特异性反应时间。
74.对比例1
75.本实施例将微球结合垫直接与抗体膜连接,不含反应垫,其他均同实施例1中的试剂盒。
76.对比例2
77.样品垫未经过抗rbc处理,其余均同实施例1中的试剂盒。
78.对比例3
79.抗体膜5制备时不包被i线,其余均同实施例1中的试剂盒。
80.实验例1
81.本实验例分别使用实施例1与对比例1的试剂条检测d
‑
二聚体(d
‑
dimer):
82.检测方法如下:取出检测卡,上海同济医院样本经过稀释后从加样口加样,稀释后的液态样本层析至抗体微球结合垫,将抗体微球结合垫中抗体微球从结合垫中复融出来,样本中的待检测物和抗体微球一起层析至反应垫,在反应垫内部发生充分的特异性反应和结合,然后形成的抗原
‑
抗体微球复合物在毛细作用下层析至抗体膜上,利用荧光定量检测系统检测t线和c线区域富集的荧光强度。
83.用实施例1和对比例1的试剂盒对含不同浓度的d
‑
dimer的样品进行测试,检测结果如表1所示。
84.表1对照组和本发明实验组定量检测各浓度数据表
[0085] 浓度(μg/ml)12.83.20.80.20.050对比例1信号值22779923021206243实施例1信号值355218616821916516
[0086]
(1)重复性效果验证
[0087]
每个浓度分别利用实施例1的试剂条与对比例1的试剂盒进行重复检测10次(检测时间10分钟),求出变异系数做出对比,检测结果如表2
‑
4所示。
[0088]
表2 0.2μg/ml时对照组与实验组的结果对比表
[0089]
[0090][0091]
表3 0.8μg/ml时对照组与实验组的结果对比表
[0092][0093]
表4 3.2μg/ml时对照组与实验组的结果对比表
[0094][0095]
使用实验例1和对比例1的试剂盒检测浓度为3.2μg/ml的d
‑
dimer时信号扫描图如图3所示。从图3中可以看出,对比例1中基线ab段以及cd段有明显的翘曲(图3b);而实施例1中基线ab段和cd段则较为平直(图3a),本发明的试剂盒具有更好的精密度。
[0096]
从上述结果可以看出,无论是在信号值、在重复性还是精密度上,本发明提供的试剂盒均明显优于对比例1的试剂盒。也即通过设置反应垫显著提高了试剂盒的检测精密度,
且检测重复性好,信号值高。
[0097]
实验例2
[0098]
本实验例使用实施例1与对比例2的试剂盒分别检测全血样本类型。
[0099]
检测方法:取出检测卡,将上海同济医院全血样本经过稀释后从加样口加样,观察反应前后试剂盒的情况。
[0100]
用实施例1和对比例2的试剂盒检测edta全血样本后的结果如图4所示,其中图4a)为实施例1未检测全血样本时的示意图,图4b)为实施例1检测全血样本后的示意图,图4c)为对比例2检测全血样本后的示意图。
[0101]
从图中可以看出,对比例2中试剂盒检测edta全血样本后抗体膜5泛红,说明红细胞并未在抗体膜5前面被完全拦截,有部分红细胞或者红细胞破裂后释放物进入抗体膜5中;而实施例1中抗体膜5未出现明显泛红,说明红细胞在抗体膜5前被基本拦截。
[0102]
需要说明的是由于此试剂盒中存在反应垫,若红细胞较多时,反应垫也具有一定的拦截少量红细胞的作用。
[0103]
实验例3
[0104]
本实验例使用实施例1的试剂盒检测不同样本类型样本中d
‑
dimer。
[0105]
检测方法:选取上海同济医院57例枸橼酸钠血浆样本以及同源的edta全血样本,分别用已有西门子d
‑
dimer检测试剂盒作为参比方法对照组,与上述制备的实施例1的试剂盒的结果作为试验组,二者进行线性相关分析。试验组检测方法同实验例1,不再详细说明。
[0106]
用实施例1的试剂盒检测不同样本类型样本中d
‑
dimer的结果如图5所示,其中图5a为实施例1的试剂盒和西门子d
‑
dimer检测试剂盒参比方法检测枸橼酸钠血浆样本中d
‑
dimer时两者的线性相关关系;图5b为实施例1的试剂盒在检测edta全血样本和枸橼酸钠血浆样本中d
‑
dimer时两者的线性相关关系。结果表明本发明提供的试纸条检测线性和临床相关性良好。
[0107]
实验例4
[0108]
使用实施例1与对比例3的试剂盒分别检测d
‑
dimer。
[0109]
检测方法:取出检测卡,将全血样本经过稀释后从加样口加样,观察反应前后试剂盒的情况。
[0110]
用实施例1和对比例3的试剂盒检测d
‑
dimer的结果如图6和图7所示。
[0111]
其中图6a)为实施例1未反应时的试剂盒示意图,图6b)为实施例1反应后的试剂盒示意图;图7a)为对比例3未反应时的试剂盒示意图,图7b)为对比例3反应后试剂盒的示意图。从图中可以看出,对比例3中反应前后很难通过裸眼观察出差异,而实施例1中反应前存在一条裸眼可见的红色条带,而待反应完后,红色条带消失,即能很容易对反应前后的试剂盒进行区分。
[0112]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1