一种检测黄曲霉毒素B1的自支撑电极传感器及其制备与应用
一种检测黄曲霉毒素b1的自支撑电极传感器及其制备与应用
技术领域
1.本发明属于电化学生物传感器领域,具体涉及信号放大探针的自支撑来检测黄曲霉毒素b1的电化学生物传感器及其制备与应用。
背景技术:
2.黄曲霉毒素(aflatoxins,afts)是一类具有相似结构的化合物总称,而黄曲霉毒素b1(afb1)在黄曲霉毒素中具有最强的毒性和致癌性,为i类致癌物。afb1主要存在于谷物,油及它们的农产品中。世界卫生组织认可的食品中afb1的最大允许浓度为15μg kg-1
。人乳中afb1的浓度不应超过0.5μg kg-1
。在我国规定动物饲料中的afb1最高允许检出量为20μg kg-1
,而发酵食品中的最大允许量为5μg kg-1
。
3.当前,有几种检测afb1的方法,例如高效液相色谱(hplc),薄层色谱(tlc),微柱法,酶联免疫吸附测定(elisa)和色谱串联质谱法(lc-ms)。但是,这些方法都有其自身的局限性。例如,hplc的样品预处理繁琐,tlc的精度低;elisa可能导致假阳性结果,lc-ms成本高。
技术实现要素:
4.针对以上现有技术存在的缺点和不足之处,本发明的首要目的提供一种检测黄曲霉毒素b1的自支撑电极传感器及其制备方法。本发明的传感器特异性强、精度高、方法简单、灵敏度高、易于操作。本发明主要以cf为基底,ni-cu为催化剂,甲烷为碳源,生成了碳纳米管sse,再用au置换sse上的ni/cu颗粒,提高电化学性能。随后将apt与au结合,用bsa钝化后再与afb1进行孵育。由于ps-cooh与afb1属于竞争关系,则多余的apt能够继续与ps-cooh结合,而ps-cooh作为信号放大探针辣根过氧化物酶(hrp)的载体,其含有的游离羧基与hrp结合,从而将hrp固定在电极上。通过hrp催化电解液中h2o2的氧化还原反应,显著放大了电极的电化学信号,从而构建一种具有放大信号检测afb1的自支撑电化学生物传感器。
5.本发明的另一目的在于提供上述自支撑电化学生物传感器在检测afb1中的应用。
6.本发明目的通过以下技术方案实现:
7.一种基于具有放大信号的自支撑技术检测afb1的电化学生物传感器(即检测黄曲霉毒素b1的自支撑电极传感器)的制备方法,包括以下步骤:
8.1)将碳毡进行高温煅烧,获得活化的碳毡;通过共同沉淀法获得镍铜的沉淀,将镍铜的沉淀分散于溶剂中,获得悬浮液;
9.2)将活化的碳毡浸入悬浮液中,获得负载有沉淀的碳毡;将负载有沉淀的碳毡置于装置中,通入含有碳源的气体,高温裂解,获得自支撑电极;
10.3)将自支撑电极置于氯金酸溶液中,反应,洗涤,干燥,获得负载金的自支撑电极;
11.4)将黄曲霉毒素b1核酸适配体(apt)配成溶液,获得适配体溶液(apt);将适配体溶液覆盖负载金的自支撑电极,获得apt功能化电极;将牛血清白蛋白溶液(bsa)与apt功能化电极反应,洗涤,干燥,获得钝化电极;
12.5)将钝化电极置于afb1溶液中孵育,获得吸附afb1的电极;
13.6)将羧基化聚苯乙烯纳米球分散于水中,获得羧基化聚苯乙烯纳米球溶液(ps~cooh纳米球溶液);吸附afb1的电极与羧基化聚苯乙烯纳米球溶液进行反应,随后将电极与hrp进行孵育,获得传感器。
14.步骤1)中所述高温煅烧的温度为400~500℃,高温煅烧的时间为9~15h
15.所述镍铜的沉淀是指镍盐和铜盐通过共沉淀法制备得到;具体为在将草酸溶于有机溶剂中,获得草酸溶液;将镍盐和铜盐溶于有机溶剂中,获得混合溶液;将草酸溶液与混合溶液混合,置于高压反应器中进行反应,后续处理,获得镍铜的沉淀。
16.所述草酸溶液中有机溶剂为乙醇,混合溶液中有机溶剂为乙醇;所述草酸溶液在搅拌的条件下通过滴加的方式加入混合溶液中。所述滴加的速度为1~2滴/秒;所述搅拌的转速为400~800转/分钟。(在乙醇中颗粒均一性比在水中好)
17.所述混合溶液中镍盐与有机溶剂的质量体积比为(0.5~3)g∶30ml;所述草酸溶液中草酸与有机溶剂的质量体积比为(1~6)g∶30ml。所述镍盐:铜盐:草酸的摩尔比为(1~2)∶(1~2)∶(2~4.5)。
18.所述反应的条件为于100~125℃反应10~24h。所述反应为溶剂热反应。
19.所述后续处理为水洗涤,离心,干燥。
20.步骤1)中将镍铜的沉淀分散于溶剂中,溶剂为乙醇,所述分散为超声分散;所述悬浮液的浓度为5~10mg ml-1
。
21.步骤2)中将活化的碳毡浸入悬浮液中是指将活化的碳毡置于悬浮液中浸泡0.5~45min,取出烘干,再浸入,再取出,如此循环操作直至碳毡上镍铜的沉淀满足以下条件每立方厘米的碳毡上负载有70~85mg的沉淀。
22.所述碳源为甲烷,所述高温裂解的温度为400~600℃,高温裂解的时间为1~3h,升温速率为5~10℃/min,裂解完后,降温的速率为5~10℃/min。
23.含有碳源的气体是指氮气和甲烷的混合气体。流速比为1∶3。
24.步骤3)中所述氯金酸溶液为0.1~0.8mm,所述反应的温度为50~60℃,所述反应时间为12~24小时,洗涤是指用水洗涤,干燥的温度为70~80℃,干燥的时间为12~24h。
25.步骤4)中黄曲霉毒素b1核酸适配体的序列为5
′
~tgg ggt ttt ggt ggc ggg tgg tgtacg ggc gag gg~3
′
,且5
′
端有氨基基团修饰。
26.步骤4)所述适配体溶液是采用ph为7.4的磷酸盐缓冲液配制而成,适配体溶液的浓度为0.1~10μm;适配体溶液通过滴加的方式覆盖负载金的自支撑电极;滴加完后,静置10~20min分钟,洗涤,烘干,获得apt功能化电极。所述牛血清白蛋白溶液(bsa)的浓度为1~10mg/ml。
27.牛血清白蛋白溶液(bsa)与apt功能化电极反应,反应的时间为0.5~4h。
28.步骤5)中所述afb1溶液为afb1的缓冲溶液即afb1与pbs配制得到。afb1溶液的浓度为0.1pg ml-1
~10ng ml-1
。
29.步骤5)所述孵育的时间为1~4h;孵育的温度为室温。
30.步骤6)中所述羧基化聚苯乙烯纳米球通过以下方法制备得到:在保护性气氛下,将乳化剂、弱碱性化合物、水以及苯乙烯在40~100℃搅拌混合30~180min,加入引发剂并搅拌10~90min,加入单体反应12~24h后,用水洗涤,30~80℃干燥6~36h,得到羧基化聚
苯乙烯纳米球。
31.所述单体为丙烯酸、甲基丙烯酸、甲基丙烯酸甲酯中一种以上。
32.所述乳化剂为十二烷基硫酸钠、聚乙烯醇中一种以上。
33.所述弱碱性化合物为碳酸钠、碳酸钾、碳酸氢钠中一种以上。
34.所述引发剂为过硫酸钾、偶氮二异丁腈、过硫酸铵中一种以上。
35.所述苯乙烯在使用前经过前处理,该前处理为常规的前处理,去除苯乙烯中的阻聚剂等。
36.步骤6)中羧基化聚苯乙烯纳米球溶液的浓度为0.3~0.5mg ml-1
。
37.步骤6)中吸附afb1的电极与羧基化聚苯乙烯纳米球溶液进行反应,反应的时间为0.5~2h;
38.hrp以溶液的形式使用,hrp溶液为hrp的水溶液或hrp的pbs缓冲溶液;hrp溶液的浓度为2~5mg ml-1
;
39.所述将电极与hrp进行孵育,孵育的条件为0~4℃孵育0.5~1h。
40.吸附afb1的电极与羧基化聚苯乙烯纳米球溶液进行反应,反应完后采用水冲洗,干燥。
41.一种基于层层自组装技术检测afb1的电化学生物传感器,通过上述方法制备得到。
42.上述基于层层自组装技术检测afb1的电化学生物传感器用于检测afb1。特别是在酱油和葡萄酒中应用,检测酱油和葡萄酒中是否含有afb1。
43.本发明的原理为:在cf上成功还原ni-cu合金颗粒并作为催化剂促使碳纳米管的生长;利用金属置换反应成功将au修饰到sse(自支撑电极)上。sse是由相互交错的碳纤维形成的多孔隙三维空间结构,而在碳纤维表面生长的致密的碳纳米管并没有改变其空间结构,这种结构能够提高传感器的稳定性能和灵敏度。而金的成功置换更为电极材料提供了丰富的电化学活性位点。bsa溶液钝化au/sse电极上的未与apt结合的非特异性活性位点,而后未与afb1结合的apt上的-nh2则能够与ps-cooh通过酰胺键结合,而ps-cooh的游离羧基与hrp结合,从而将hrp固定在电极上。通过hrp催化电解液中h2o2的氧化还原反应,来放大电化学信号,从而制备出检测黄曲霉毒素b1的具有高灵敏度、精确度、特异性、操作简单的自支撑电化学生物传感器。
44.本发明的制备方法及所得到的产物具有如下优点及有益效果:
45.本发明制备了一种具有高灵敏度、精确度、特异性、操作简单等优点的电化学生物传感器。本发明的电化学生物传感器利用了黄曲霉毒素b1的核酸适配体的特异性识别,实现了对靶标afb1的高特异性检测;由于以活化碳毡为基底因而具有优异导电性和高比表面积,且使用hrp作为信号放大探针,使传感器更加灵敏;该传感器能够在两个线性范围内准确定量样品中的afb1(低浓度范围(0.1~10pg ml-1
)和高浓度范围(1~10ng ml-1
)),灵敏度高(最低检测限为0.016pg ml-1
)、检测范围宽(0.1pg ml-1
~10ng ml-1
);且不受其他毒素和物质的干扰,特异性和抗干扰性强;还具有优异的重复性和稳定性,反应条件温和,反应速度快;本发明的电极易携带,可以回收重复;电极的重复性好,适用于食品安全中的黄曲霉毒素b1的检测和生物传感器产业化的实际应用;用于制作电极的材料成本低,时间短,适用于产业化中成本低的要求。
附图说明
46.图1为本发明的自支撑电化学生物传感器的原理示意图;
47.图2为未活化碳毡的fesem图,a的标尺为100μm;b的标尺10μm;
48.图3为实施例1中ni-cu合金负载在碳纳米管尖端的电极材料(负载金的自支撑电极)的fesem图,a的标尺为10μm;b的标尺1μm;
49.图4为实施例1制备的自支撑电化学生物传感器的cv曲线;ps-bsa-apt-au/sse表示实施例1的步骤(6)中将bsa-apt-au/sse直接与ps-cooh分散液进行反应得到;图中hrp-ps-bsa-apt-au/sse即为实施例1中最后制备的hrp-ps-afb
1-bsa-apt-au/sse;
50.图5为实施例1制备自支撑传感器检测黄曲霉毒素b1时,不同浓度黄曲霉毒素b1(afb1)与电化学信号ip的关系曲线;
51.图6为实施例1制备的自支撑电化学生物传感器的稳定性柱状图;#1~#6表示6个电极,a为重复性图,b为稳定性图;
52.图7为实施例1制备的传感器的干扰性能测试图;a为干扰毒素对传感器性能的影响图,b为干扰物质对传感器性能的影响图,图b中aa表示抗坏血酸,ca表示柠檬酸,starch表示淀粉,g表示葡萄糖。
具体实施方式
53.下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。图1为本发明自支撑电化学生物传感器的制备原理示意图。
54.实施例中羧基化聚苯乙烯纳米球可以通过以下方法制备:将0.2g十二烷基硫酸钠,0.1g碳酸钠和300ml蒸馏水引入反应容器中,充入氮气;然后加入30ml苯乙烯并加热至60℃,搅拌30分钟后;加入0.062g的过硫酸钾,加热至75℃,30分钟后,加入3ml丙烯酸,在75℃下反应24小时,将产物分离,采用蒸馏水洗涤并在60℃的真空烘箱中干燥12小时。
55.实施例1
56.(1)碳毡的活化:cf裁剪成为3.0
×
3.0
×
0.5cm大小的形状,在管式炉中依次放入10块裁剪后的cf,每块之间的间距约为0.5cm,以便空气能够充分与其表面进行接触,管式炉的设定温度为420℃,升温速率为10℃每分钟,在420℃下保持10小时后再以相同的速率进行降温;cf高温热活化处理的整个过程都是在空气中,反应后的尾气经过浓硫酸吸收过滤再进行排放;
57.(2)将1.7g六水合硝酸镍和0.7g三水合硝酸铜混合溶解于30ml乙醇中,获得混合溶液;将1.11g草酸溶于30ml乙醇,获得草酸溶液;在搅拌的条件下(转速为800转/分钟),降草酸溶液以每秒1滴的速度滴入混合溶液中形成催化剂前体物质(镍铜草酸盐沉淀),滴完后,将混合物转移至90ml高压反应釜中,在120℃下反应12小时,随后用去离子水分别洗涤离心3次,最后在80℃下烘干12h,获得共沉淀,研磨成细粉密封储存;
58.(3)将共沉淀分散于乙醇当中,配置成5mg/ml的溶液;将活化后的cf完全浸入到共沉淀的溶液中0.5h,随后将其取出放在80℃下烘干,如此反复操作直到每立方厘米cf上的镍铜草酸盐负载量为85mg;然后置于管式炉中,材料之间的距离约为2cm,去除管式炉中的氧气后,通入氮气和甲烷的混合气体(流速比为1∶3),以每分钟10℃的速率升温到600℃保持2小时,随后再以相同速率降到室温,获得自支撑电极(sse);
59.(4)将3块裁剪后的sse(1.5
×
0.6
×
0.25cm)浸入到0.5mm氯金酸溶液中,在50℃下反应24小时,用去离子水清洗3次后在80℃下干燥12h,获得负载金的自支撑电极(au/sse);
60.(5)在au/sse上均匀滴入1um apt溶液(核酸适配体,pbs溶液),反应10分钟后,用pbs去除过量的apt并进行干燥,获得apt-au/sse;随后用5mg ml-1
的bsa溶液钝化电极上的未与apt结合的非特异性活性位点,钝化时间为1h,用去离子水冲洗过量的bsa后干燥,获得bsa-apt-au/sse;
61.(6)afb1的检测及电化学生物传感器的制备
62.将bsa-apt-au/sse浸入含有afb1的pbs中(5ng ml-1
)孵育1h后,用pbs冲洗未结合的afb1;将吸附了afb1的材料立即与0.3mg ml-1 ps-cooh分散液进行反应,反应时间为1h(未与afb1结合的apt上的-nh2则能够与ps-cooh通过酰胺键结合),冲洗干燥,获得ps-afb
1-bsa-apt-au/sse;再与2mg ml-1 hrp溶液在4℃下孵育1h,获得hrp-ps-afb
1-bsa-apt-au/sse,即可用于检测。
63.本实施例中未经过热处理碳毡置于水中,沉入水底,而经过热处理(高温活化后)的碳毡置于水中浮在水面。
64.图2为未活化碳毡的fesem图,a的标尺为100μm;b的标尺10μm;
65.图3为实施例1中ni-cu合金负载在碳纳米管尖端的电极材料(负载金的自支撑电极)的fesem图,a的标尺为10μm;b的标尺1μm。
66.实施例2
67.本实施例与实施例1的不同之处:
68.(2)称取六水合硝酸镍0.87g和1.45g三水合硝酸铜,将两者混合溶解于30ml乙醇中,获得混合溶液;将1.13g草酸溶于30ml乙醇后,获得草酸溶液,将其转移至滴定管中;在磁力搅拌器的运作下(其转速为800转/分钟),草酸以每秒1滴的速度滴入硝酸镍铜混合物中形成催化剂前体物质(镍铜草酸盐沉淀),滴完后,将混合物转移至90ml反应釜中,在120℃下反应12小时,随后用去离子水分别洗涤离心3次,最后在80℃下烘干过夜,烘干后的镍铜草酸盐用研钵磨成细粉后密封储存,即得到共沉淀。
69.(3)将共沉淀分散于乙醇中,配置成5mg ml-1的悬浮液;将活化后的cf完全浸入到共沉淀的悬浮液中,随后将其取出放在80℃下烘干,如此反复操作直到每立方厘米cf上的镍铜草酸盐负载量为75mg;将其放置于管式炉中,材料之间的距离约为2cm,去除管式炉中的氧气后,通入氮气和甲烷的混合气体(流速比为1∶3),以每分钟10℃的速率升温到600℃保持2小时,随后再以相同速率降到室温。
70.实施例3
71.本实施例与实施例1的不同之处:
72.(1)称取六水合硝酸镍1.31g和1.09g三水合硝酸铜,将两者混合溶解于30ml乙醇中,获得混合溶液;将1.13g草酸溶于30ml乙醇后,获得草酸溶液,将其转移至滴定管中;在磁力搅拌器的运作下(其转速为800转/分钟),草酸以每秒1滴的速度滴入硝酸镍铜混合物中形成催化剂前体物质(镍铜草酸盐沉淀),滴加完后,将混合物转移至90ml反应釜中,在120℃下反应12小时,随后用去离子水分别洗涤离心3次,最后在80℃下烘干过夜,烘干后的镍铜草酸盐用研钵磨成细粉后密封储存。
73.(2)将共沉淀分散于乙醇当中,配置成5mg ml-1
的溶液;活化后的cf完全浸入到共
沉淀悬浮液中,随后将其取出放在80℃下烘干,如此反复操作直到每立方厘米cf上的镍铜草酸盐负载量为70mg;将其放置于管式炉中,材料之间的距离约为2cm,去除管式炉中的氧气后,通入氮气和甲烷的混合气体(流速比为1∶3),以每分钟10℃的速率升温到600℃保持2小时,随后再以相同速率降到室温。
74.性能测试:
75.(1)传感器制备过程的电化学表征
76.使用cv测试实施例1制备的基于sse的电化学生物传感器的电化学行为特征。所有的测试均采用单池,所制备的自支撑材料为we,碳棒为ce,氯化银为re,所有的电化学行为表征都是在这三种电极形成的三电极体系中完成的。
77.修饰过程的cv测试所使用的电解液为1mm k3[fe(cn)6]+0.5m kcl,体积为50ml,扫描电位区间为-0.1v至+0.6v,扫速为10mv s-1
。
[0078]
测试结果如图4所示。图4为实施例1制备的自支撑电化学生物传感器的cv曲线;ps-bsa-apt-au/sse表示实施例1的步骤(6)中将bsa-apt-au/sse直接与ps-cooh分散液进行反应得到。
[0079]
(2)检测不同浓度afb1的ip响应
[0080]
将修饰后的电化学生物传感器(实施例1制备)与不同浓度的待测黄曲霉毒素b1溶液(溶剂为ph为7.4的磷酸盐缓冲液)孵育3h,随后在1mm[fe(cn)6]
3~/4~
电解液中,以ag/agcl为参比电极,pt为对电极,dpv测试的电解液为10mm h2o2,扫速为1mv s-1
。如图5所示,计算该传感器的最低检出限(lod)得出:当afb1的浓度为0.1至10pg ml-1
时,电化学生物传感器的lod为0.016pg ml-1
,而当afb1的浓度为1至10ng ml-1
时,电化学生物传感器的lod为0.3ng ml-1
。该结果证明了所制备的生物传感器确实可以定量检测afb1。
[0081]
afb1浓度与电化学信号ip的关系曲线,通过进一步实验发现,在低浓度区间和高浓度区间内,ip与afb1浓度之间均存在线性关系。对于三个独立的修饰电极,其ip值的相对标准偏差均小于3%。且当afb1的浓度为0.1至10pg ml-1
时,电化学生物传感器的lod为0.016pg ml-1
。
[0082]
图5为实施例1制备自支撑传感器检测黄曲霉毒素b1时,不同浓度黄曲霉毒素b1与电化学信号ip的关系曲线。
[0083]
(3)电极的稳定性和重复性测试
[0084]
按照实施例1的条件制备六个电极(hrp-ps-afb
1-bsa-apt-au/sse),随机取出三个(#1,3,5为刚制备的电极)检测相同浓度的afb1,每三块作为一次平行试验取出3个电化学传感器用于检测相同浓度的afb1,每个传感器重复测量3次,取平均值,所得结果如图6。图6为实施例1制备的自支撑电化学生物传感器的稳定性柱状图;#1~#6表示6个电极,a为重复性图,b为稳定性图;
[0085]
稳定性检测:同时制备的电化学生物传感器密封保存于4℃下,每隔一周检测相同浓度的afb1,使用dpv方法重复测量3次取平均值。由图6可见,该电化学生物传感器在4℃下储存1个月后的电流响应约为原来的90%,说明其稳定性良好。
[0086]
(4)电化学生物传感器的特异性研究
[0087]
按照实施例1的条件制备电极,干扰毒素的研究:在相同条件下同时制备9个电化学传感器,每3个划分为一组作为平行试验。将相同浓度的afb1(1pg ml-1
)和赭曲霉毒素ota
(1pg ml-1
)以及两种毒素的混合溶液作为样品,3次测量结果取平均值后以柱状图显示,如图7中a所示。
[0088]
干扰物质的研究:在传感器进行i-t实时测量时,先加入5mm的h2o2,待电流稳定后每隔60秒依次加入5mm nacl、5mm kcl、5mm mgcl2、5mm抗坏血酸(aa)和5mm h2o2,待电流稳定每隔60秒再依次加入5mm柠檬酸ca、5mm淀粉(starch)、5mm葡萄糖(glucose,g)和5mm h2o2,观察电流的变化,如图7中b所示。结果显示,干扰性测试结果证实了电极材料可以不受ota,na
+
,k
+
,mg
2+
,aa,ca,starch(淀粉)和g的干扰,特异性识别样品中的afb1从而间接产生电化学信号。
[0089]
图7为实施例1制备的传感器的干扰性能测试图;a为干扰毒素对传感器性能的影响图,b为干扰物质对传感器性能的影响图。
[0090]
(5)电极在实际样品中的加标回收实验
[0091]
加标实际样品(葡萄酒和酱油)的制备:5g的葡萄酒和酱油分别加入25ml的甲醇溶液,超声处理混合均匀后在6000转/分钟下离心10分钟,得到上清液。将afb1标准储备液定量加入到样品上清液中配制成不同浓度用于检测。修饰后的电极在含有afb1的pbs或者是加标样中孵育一段时间后用pbs小心冲洗,即可用于电化学检测。
[0092]
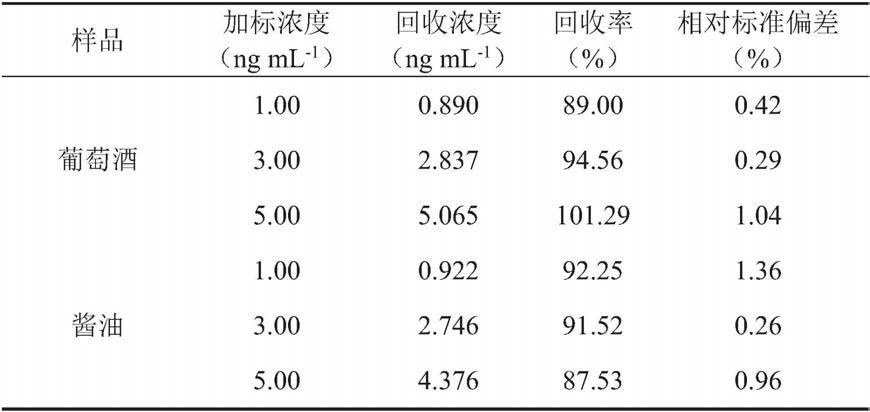
使用实施例1制备的电极检测加标样品(葡萄酒和酱油)中的黄曲霉毒素b1。表1和表2分别显示了在低浓度线性范围和高浓度线性范围中葡萄酒和酱油中加入的afb1回收率。结果表明,所得回收率在87.5-101.3%的范围内,相对标准偏差小于2%,这表明该生物传感器具有出色的灵敏度,可靠性和可操作性。
[0093]
表1在葡萄酒和酱油高浓度线性范围加标样中的回收率
[0094][0095]
表2在葡萄酒和酱油低浓度线性范围加标样中的回收率
[0096][0097]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1