一种提取血液样本中白细胞的方法与流程
1980;11:353
–
356.通过白膜层分离法提取白细胞会造成部分淋巴细胞的丢失。并且,白膜层分离法无法获取白细胞成分中的粒细胞,因此不能对粒细胞的特性进行分析。
7.也就是说,通过现有技术提取白细胞会造成部分白细胞的破裂或损伤或丢失,从而影响白细胞的得率和活性,甚至无法获取白细胞组分中的粒细胞,不能分析粒细胞的特性。
技术实现要素:
8.本发明提供一种提取血液样本中白细胞的方法,主要解决的技术问题是,解决了现有技术中分离白细胞过程中造成白细胞的破裂或损伤或丢失从而影响白细胞的得率和活性,甚至无法获取粒细胞,不能分析粒细胞的特性的技术问题。
9.为解决上述技术问题,本发明采用的一个技术方案是:一种提取血液样本中白细胞的方法,其特征在于用毛细管将离心分层后的微小体积白细胞层拉长放大,在毛细管处注入介质,将微小体积的白细胞层分开取出,包括以下步骤:采集血液样本;将血液样本放入含有毛细管部件的容器中;将存储有血液样本的容器放入离心机中离心,从而使分散在血液样本中体积占比很小的白细胞组分在毛细管中被富集且为白细胞层被拉长,白细胞层位于红细胞层上方;在毛细管处注入介质,隔开白细胞层;取出白细胞层。
10.其中,在采集血液样本之后,还可以包括将所采集的血液样本进行初步处理,比如将所采集的血液样本中的大部分红细胞通过离心去除或将所述采集的血液样本中的血浆通过离心去除。血液样本的预处理使更方便从大体积血液样本中提取白细胞。
11.其中,毛细管的内径最好小于3毫米;毛细管内径的变小使得相同体积的白细胞层被进一步拉长,从而更容易取出离心后的白细胞层。
12.其中,含有毛细管部件的容器还包括比毛细管横截面积大的中空部件且与毛细管相通;毛细管与毛细管连通的中空部件的横截面积比1:3 到1:20之间;毛细管的体积小于中空部件的体积;毛细管的体积与所述中空部件的体积比最好不大于1:200。毛细管最好为软性材料制成。毛细管可以为透明或半透明。含有毛细管的容器为一体成型;比毛细管横截面积大的部件用于存储离心前后的悬浮液,从而使更方便从大体积血液样本中提取白细胞。
13.其中,容器中包括比毛细管横截面积大的中空部件,离心时,毛细管在于离心时位于比毛细管横截面积大的中空部件的上方;其中,在毛细管处注入介质,可采用注射器的针头刺穿毛细管的侧壁,注入介质,隔开白细胞层;刺穿毛细管的位置是在白细胞层处或在白细胞层下方的红细胞层处注入介质,在白细胞层处注入介质,可以确保取出的高纯度的白细胞组分,在红细胞层,特别是白细胞层下方包含部分红细胞处,注入介质,可以减少白细胞的丢失。注入介质优选为等渗溶液,特别是所注入的介质为磷酸盐缓冲液(pbs)。
14.其中,取出白细胞层是将离心后富集在毛细管处的白细胞吸出,可以用注射器或移液枪将白细胞层吸出。取出白细胞层也可以截取离心后富集了白细胞层的毛细管段进而取出白细胞层。也可以是通过注入介质后推送介质,最后将白细胞层推出。
15.其中,离心时离心力为最好1000-4000g。
16.其中,离心时间最好为5-30分钟。
17.本发明的有益效果是:区别于现有技术的情况,本发明提供的提取血液样本中白细胞的方法其特征在于用毛细管将离心分层后的微小体积白细胞层拉长放大,在毛细管处注入介质,将微小体积的白细胞层分开取出,包括以下步骤:采集血液样本;将血液样本放入含有毛细管部件的容器中;将存储有血液样本的容器放入离心机中离心,从而使分散在血液样本中体积占比很小的白细胞组分在毛细管中被富集且为白细胞层被拉长,白细胞层位于红细胞层上方;在毛细管处注入介质,隔开白细胞层;取出白细胞层。
18.通过上述方式,本发明的有益效果在于,能够提高提取出的白细胞组分的得率和活性,且易于取出白细胞组分。本发明通过毛细管拉长离心分层后体积占比小的白细胞层的层高,从而易于取出白细胞组分,进一步在毛细管处注入介质隔开白细胞层,分离离心后的红细胞层和白细胞层,使得白细胞层不仅易于取出,而且能够按照需要高得率地取出全血样本中的白细胞成分或高纯度提取白细胞组分(减少红细胞的污染)。
19.与全血裂解法相比,本发明可以提高血液样本中白细胞组分的活性的比例,且易于取出白细胞组分。本发明还可以更容易地提取大体积全血样本中的白细胞。
20.与白膜分离法相比,本发明可以提取出血液样本中的粒细胞,提高淋巴细胞的得率,减少白细胞的丢失,该发明为白细胞的免疫分型、基因表达分析以及功能性试验提供了可靠的材料。本发明还可以更容易地提取大体积全血样本中的白细胞。
21.附图说明
22.图1是本发明提取血液样本中白细胞的方法的流程示意图;图2是实施例1通过本发明方法提取血液样本中白细胞层2的实验结果图,可以直观地看到毛细管将离心分层后的微小体积白细胞层拉长放大,白细胞组分在毛细管中被放大成为白细胞层;图2的毛细管中的上层为血浆层1,白色中间层为白细胞层2,下层为红细胞层3;图3是实施例1通过本发明方法提取血液样本中白细胞层,通过流式细胞仪检测到的白细胞层检测结果图,可以证明本发明可以提取出的粒细胞(granulocyte)、单核细胞(monocyte)和淋巴细胞(lymphocyte);图4是实施例2通过本发明方法提取血液样本中白细胞层,通过流式细胞仪检测到的白细胞层检测结果图,可以证明本发明可以提取出的粒细胞(granulocyte)、单核细胞(monocyte)和淋巴细胞(lymphocyte);图5是实施例3通过本发明方法提取血液样本中白细胞层,通过流式细胞仪检测到的白细胞层检测结果图,可以证明本发明可以提取出的粒细胞(granulocyte)、单核细胞(monocyte)和淋巴细胞(lymphocyte);图6是实施例4通过本发明方法提取血液样本中白细胞层,通过流式细胞仪检测到的白细胞层检测结果图,可以证明本发明可以提取出的粒细胞(granulocyte)、单核细胞(monocyte)和淋巴细胞(lymphocyte);图7是实施例5中通过本发明方法提取出的白细胞层(即粒细胞(granulocyte)、单核细胞(monocyte)和淋巴细胞(lymphocyte))的活性通过流式细胞仪检测结果图;图7中显示的是p1是提取出的淋巴细胞(lymphocyte)中死细胞比例, p2是提取出的单核细胞
(monocyte), p3是提取出的粒细胞(granulocyte)中死细胞比例;图8是实施例5的对比实验中,通过红细胞裂解法提取出的白细胞(即粒细胞(granulocyte)、单核细胞(monocyte)和淋巴细胞(lymphocyte))通过流式细胞仪检测结果图;图8中显示的是p1是提取出的淋巴细胞(lymphocyte)中死细胞比例, p2是提取出的单核细胞(monocyte), p3是提取出的粒细胞(granulocyte)中死细胞比例;图9是实施例6的对比实验中,通过本发明和白膜层法提取白细胞所得淋巴细胞得率统计结果对比通过流式细胞仪分析图。
23.具体实施方式
24.下面结合附图和实施方式对本发明进行详细说明。需要说明的是,实施例并不构成对本发明要求保护范围的限制。
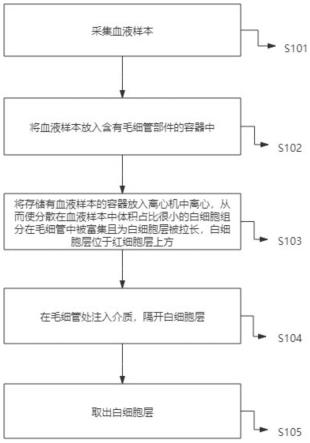
25.如图1所示,本发明提取血液样本中白细胞的方法的流程示意图。该方法包括以下步骤:步骤s101:采集血液样本;步骤s102:将血液样本放入含有毛细管部件的容器中;步骤s103:将存储有血液样本的容器放入离心机中离心,从而使分散在血液样本中体积占比很小的白细胞组分在毛细管中被富集且为白细胞层被拉长,白细胞层位于红细胞层上方;步骤s104:在毛细管处注入介质,隔开白细胞层;步骤s105:取出白细胞层。
26.下面结合实施例说明本发明的工作原理。
27.实施例1采集3mledta血液样本;置上述血液样本于含有毛细管的容器中,毛细管的远端开口朝上,与毛细管连通的横截面积大的中空部件位于下方,离心力设定为2000g,离心上述样本5分钟;离心后,白细胞层位于毛细管处,因为红细胞比重比白细胞大,红细胞层落在了白细胞层的下方;用1ml注射器吸取1mlpbs,用注射器的针头在离心后的白细胞层和红细胞层的分界处,注入pbs,使白细胞层从毛细管的开口处流出到接纳容器中;取100uμl的上述白细胞层悬浮液,加入cd45 fitc荧光抗体10μl标记细胞,室温孵育15分钟后,加入2ml pbs离心洗涤细胞,在流式细胞仪上检测。
28.如图2所示,通过实施例1,可以直观地看到毛细管将离心分层后的微小体积白细胞层拉长放大,白细胞组分在毛细管中被放大成为白细胞层2。其中,毛细管中的上层为血浆层1,白色中间层为白细胞层,2,下层为红细胞层3;如图3所示,通过实施例1,通过流式细胞仪检测,可以证明本发明可以提取出的粒细胞(granulocyte)、单核细胞(monocyte)和淋巴细胞(lymphocyte)。
29.实施例2采集5mledta血液样本;
离心力设定为2000g,离心上述全血样本5分钟,吸去大部分血浆;置上述离心后的样本于含有毛细管的容器中;毛细管的远端开口朝上,与毛细管连通的横截面积大的中空部件位于下方,离心力设定为2000g,离心上述样本20分钟;离心后,白细胞层位于毛细管处,因为红细胞比重比白细胞大,红细胞层落在了白细胞层的下方;用1ml注射器吸取1mlpbs,用注射器的针头在白细胞层和红细胞层的分界处的上方,注入pbs,将白细胞层和红细胞层隔开,用剪刀从pbs所在的毛细管处剪断,取出白细胞;将取出的白细胞制成1ml的白细胞悬浮液,取出100μl白细胞悬浮液,加入cd45 荧光抗体标记细胞,室温孵育15分钟后,加入2ml pbs离心洗涤细胞,在流式细胞仪上检测;如图4所示,通过实施例2,通过流式细胞仪检测,可以证明本发明可以提取出的中粒细胞,单核细胞和淋巴细胞。
30.实施例3采集5ml edta血液样本;离心力设定为1000g,离心上述全血样本5分钟,吸去大部分血浆;置上述离心后的样本于含有毛细管的容器中,毛细管的远端开口朝上,与毛细管连通的横截面积大的中空部件位于下方,离心力设定为1000g,离心上述样本5分钟;离心后,白细胞层位于毛细管处,因为红细胞比重比白细胞大,红细胞层落在了白细胞层的下方;用1ml注射器吸取1mlpbs,用注射器的针头在离心后的白细层胞和红细胞层的分界处下方约1mm处,注入pbs,使白细胞与红细胞分开。
31.从毛细管远端开口处,用注射器或移液器吸出白细胞;将取出的白细胞制成1ml的白细胞悬浮液,取出100μl白细胞悬浮液,加入cd45 荧光抗体标记细胞,室温孵育15分钟后,加入2ml pbs离心洗涤细胞,在流式细胞仪上检测;如图5所示,通过实施例3,通过流式细胞仪检测,可以证明本发明可以提取出的中粒细胞,单核细胞和淋巴细胞。
32.实施例4采集10ml edta血液样本;离心力设定为2000g,离心上述全血样本5分钟,吸去大部分血浆和部分底层红细胞;自上吸取合适体积的血细胞置于含有毛细管的容器中,毛细管的远端开口朝上,与毛细管连通的横截面积大的中空部件位于下方,离心力设定为4000g,离心上述样本5分钟;离心后,白细胞层位于毛细管处,因为红细胞比重比白细胞大,红细胞层落在了白细胞层的下方;用1ml注射器吸取1mlpbs,用注射器的针头在离心后的白细胞层和红细胞层的分界处,注入pbs,使白细胞与红细胞分开。
33.从毛细管远端开口处,用注射器或移液器吸出白细胞。
34.如图6所示,通过实施例4,通过流式细胞仪检测,可以证明本发明可以提取出的中粒细胞,单核细胞和淋巴细胞。
35.实施例5本实施例用于比较本发明与红细胞裂解法提取白细胞方法之间的差别。
36.采集10 mledta抗凝全血,分成两等份,分别用红细胞裂解法和本发明方法提取白细胞并用荧光染料标记。
37.红细胞裂解法:在血液样本中加入红细胞裂解液(bd pharmingen)至50ml,室温孵育15分钟后,离心,离心力为500 g,离心时间为5分钟,吸去上清液;加入pbs 2ml,混匀后,离心,离心力为500g,离心时间为5分钟,吸去上清液;加入1 ml pbs悬浮细胞,制成白细胞悬液;本发明方法:将5ml血液样本离心,离心力为2000g,离心时间为20分钟,吸去血浆,并吸去底层的部分红细胞,将剩余的细胞悬浮液放入含有毛细管的容器中,毛细管的远端开口朝上,与毛细管连通的横截面积大的中空部件位于下方,离心力设定为2000g,离心时间20分钟;离心后,白细胞层位于毛细管处,红细胞层落在了白细胞层的下方;用1ml注射器吸取1mlpbs, 用注射器的针头在离心后的白细胞层和红细胞层的分界处,注入pbs,使白细胞层从毛细管的开口处流出到接纳容器中,制成1ml的白细胞悬液;白细胞标记方法:取出上述两种方法制备的各100μl 细胞悬液,分别标记如下:加入20μl cd45 percp荧光抗体,室温孵育15分钟,加入2ml pbs,混匀后,离心,离心力为500g,离心时间为5分钟,吸去上清液;加入1μl的fvs440荧光染料标记死细胞,室温孵育15分钟;加入2ml pbs,离心,离心力500g,离心时间为5分钟,吸去上清液;加入300μl pbs重悬细胞;在流式细胞仪上检测;如图7所示,实施例5中的通过本发明方法提取出的白细胞组分的活性通过流式细胞仪检测结果图。图6中p1, p2, p3中显示的是死细胞比例。
38.如图8所示,实施例5的对比实验中,通过红细胞裂解法提取白细胞所得白细胞的活性通过流式细胞仪检测结果图。图8中p1, p2, p3中显示的是死细胞比例。
39.比较结果:通过红细胞裂解法提取出白细胞组分中淋巴细胞的活性为85%,通过本发明方法提取出白细胞组分中淋巴细胞的活性大于98%;通过红细胞裂解法提取出白细胞组分中单核细胞活性为80%,通过本发明方法提取出出白细胞组分中单核细胞活性大于98%;通过红细胞裂解法提取出白细胞组分中粒细胞活性为70%,通过本发明方法提取出出白细胞组分中粒细胞活性大于90%;实施例6本实施例用于比较本发明与白膜分离法提取白细胞组分中淋巴细胞得率的差别。
40.白膜分离法:抗凝全血加入等体积pbs混匀,成稀释血液。在15ml离心管中加入抗凝全血等体积的 ficoll溶液,在ficoll溶液上小心加入上述稀释后的血液,离心力800g,离心20分钟,缓降使离心终止。取出白膜层。加入5ml pbs离心洗涤白膜层的细胞。离心力500g,离心时间5分钟。共离心洗涤两次。去掉上清,留下白细胞沉淀。在白细胞沉淀中加入pbs制成白细胞悬液。
41.采集10 mledta抗凝全血;取出1ml抗凝全血用白膜分离法得到白细胞,在白细胞沉淀中加入300μl pbs制成白细胞悬液。取出100μl白细胞悬液,加入cd45和cd3荧光抗体和hoechst33342标记分离所得白细胞,在流式细胞仪上检测出cd45+ cd3+ hoechst33342+ 标记阳性的细胞;
将剩余9ml的抗凝全血平均分成两等份,分别放入a管和b管中。用流式细胞仪分选上述cd45+ cd3+ hoechst33342+ 标记阳性的细胞各20000个到a管和b管的全血中;a管中的4.5ml血液用上述ficoll的白膜分离法提取白细胞,提取所得白细胞制成1ml白细胞悬液,在流式细胞仪上检测,检测之前用流式细胞仪分选入荧光微球20000个作为内参计数,计数cd45+ cd3+ hoechst33342+ 标记阳性的细胞数目,计算cd45 + cd3 + hoechst33342 + 标记阳性的细胞得率;b管中的4.5ml血液用本发明方法提取白细胞,方法如下:将4.5ml血液样本离心,离心力为2000g,离心时间为20分钟,吸去血浆,并吸去底层的部分红细胞,将剩余的细胞悬浮液放入含有毛细管的容器中,毛细管的远端开口朝上,与毛细管连通的横截面积大的中空部件位于下方,离心力设定为2000g,离心时间20分钟;离心后,白细胞层位于毛细管处,红细胞层落在了白细胞层的下方;用1ml注射器吸取1mlpbs, 用注射器的针头在离心后的白细胞层和红细胞层的分界处,注入pbs,使白细胞层从毛细管的开口处流出到接纳容器中,制成1ml的白细胞悬液;提取所得白细胞在流式细胞仪上检测,检测之前分选入荧光微球20000个作为内参计数,计数cd45+cd3+hoechst33342+标记阳性的细胞数目,计算cd45+ cd3+ hoechst33342+标记阳性 的白细胞得率。
42.如图9所示,实施例6的对比实验中,通过流式细胞仪检测,统计检测结果,对比本发明和白膜层法提取白细胞所得淋巴细胞得率。
43.检测结果:本发明方法获得的cd45+ cd3+ hoechst33342+ 标记阳性的白细胞平均得率为85%,白膜分离法的白细胞平均得率为60%。
44.综上,本发明的提取白细胞的方法是通过用毛细管将离心分层后的微小体积白细胞层拉长放大,在毛细管处注入介质,将微小体积的白细胞层分开取出,包括以下步骤:采集血液样本;将血液样本放入含有毛细管部件的容器中;将存储有血液样本的容器放入离心机中离心,从而使分散在血液样本中体积占比很小的白细胞组分在毛细管中被富集为白细胞层被拉长,白细胞层位于红细胞层上方;在毛细管处注入介质,隔开白细胞层;取出白细胞层。本发明将全血样本中体积小且数量少的白细胞组分通过离心在毛细管中将其富集为白细胞层,并放大其层高,然后在白细胞层下端或红细胞层上端或白细胞层与红细胞层的交界处注入介质,将白细胞层和红细胞层分离,继而提取出含量稀少的白细胞。
45.本发明的有益效果在于,能够提高白细胞组分的得率和活性,且易于取出白细胞组分。本发明通过毛细管拉长离心分层后体积占比小的白细胞层的层高,从而易于取出白细胞组分。进一步在毛细管处注入介质隔开白细胞层,分离离心后的红细胞层和白细胞层,使得白细胞层不仅易于取出,而且能按照需要高得率地提取出全血样本中的白细胞组分或高纯度提取出白细胞组分,减少红细胞的污染。。
46.与全血裂解法相比,本发明可以提高血液样本中白细胞组分的活性,还可以更容易地提取大体积全血样本中的白细胞。因全血裂解法需加入大量红细胞裂解液(1ml全血加入10-20ml红细胞裂解液),且溶血时间不易掌控,裂解时间控制不当会造成部分白细胞的破裂或损伤,从而降低了白细胞的活性,也不适合大体积血液样本(比如(大于5ml))中白细胞提取。
47.与白膜分离法相比,本发明可以提取出血液样品中淋巴细胞的得率比白膜分离法多25%,可以提取出粒细胞,减少整体白细胞的丢失。
48.该发明为白细胞的免疫分型、基因表达分析以及功能性试验提供了可靠的材料。本发明还可以更容易地提取大体积全血样本中的白细胞。
49.以上所述仅为本发明的部分实施方式,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1