一种人肺癌免疫多标及空间转录组检测组合方法与流程
1.本发明涉及一种医疗技术领域,具体涉及一种人肺癌免疫多标及空间转录组检测组合方法。
背景技术:
2.恶性肿瘤一直以来都是人类健康的一大主要威胁。who在2020年的调查中指出,癌症已是人类的第二大致死原因,每年都约有1000万人死于癌症,这占每年死亡人数的15%以上。因而,围绕着肿瘤的治疗与药物开发都是目前的研究热点。
3.近年来对于癌症的精准治疗方案不断的发展进步,主要是源于肿瘤异质性及个体差异研究的深入。肿瘤内部是一个非常复杂的环境,除了肿瘤细胞以外,各免疫细胞类群相互作用,肿瘤细胞和免疫细胞等共同组成了一个非常复杂而又异质化的组织场景,其对于肿瘤的发生、发展和转移有至关重要的影响,也给肿瘤的定性和治疗带来了一定的困难。
4.在癌症病人组织异质性和免疫微环境检测当中,过去常使用的方法为获得病人的组织样本后进行流式细胞分型,从而了解肿瘤细胞的数量及其中各类免疫细胞的比例。但此方法无法获得组织原位的细胞标记信息。另一种免疫细胞分型的方法为在组织层面进行免疫组化标记。但免疫组化标记每次只能对一种细胞标记物进行标记。因而在一个组织样本上只能获得一种生物标记物的信息,对于细胞类群的确定或细胞分型没有任何应对能力。
5.另一方面,随着二代测序等分子水平的检测方式的发展,其可以对均值化的组织悬液进行分析。但是对于肺组织来说,其具有肺泡、气管等不同的组织结构,其次,在肿瘤环境中也有肿瘤内部和肿瘤外部的基因表达和蛋白表达的异质性。在基因表达水平上,若使用均值化的测试方式(bulk analysis),则所有的亚克隆数据都会被平均化,最终只会显示哪些表达水平最高的克隆。而这样的检测方法必然是不准确的。
技术实现要素:
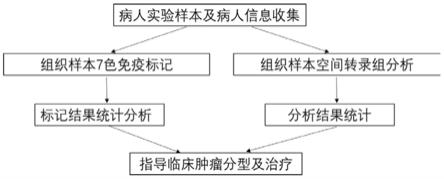
6.本发明所要解决的技术问题是提供了一种人肺癌免疫多标及空间转录组检测组合方法;通过一次性在同一组织样本上的两张连续切片上完成,一张进行组织多标的标记,标记6种抗原,从而可以获得组织中6种蛋白的表达水平,获得6种以上不同细胞类群的分类及原位信息,特别是在检测各细胞类群的同时对pd-1/pd-l1免疫检测点同步进行检测,对肿瘤的免疫治疗提供依据;
7.另外一张连续切片进行10x空间转录组的分析、定量,可以从不同的位点(spot)中收集到多维度和具有空间信息的基因表达分析,对于每一个位点(spot)的测序结果,其都可以通过空间定位对应到组织样本上,可以获得细胞亚群的分布和表达的信息,便于判断肿瘤的增殖转移。
8.本发明人肺癌免疫多标及空间转录组检测组合方法是通过以下技术方案来实现的:具体包括以下几个步骤:
9.s1、在组织样本上同时标记pd-1/pd-l1/cd8/cd68/foxp3/panck六种抗原,并同时使用dapi对细胞核进行染色,并对颜色进行采集;
10.s2、对六种抗原进行分别标记;
11.s3、计算肿瘤区和非肿瘤区中各细胞类群的数量;
12.s4、通过10x genomics技术,对同一样本上的基因水平进行检测。
13.作为优选的技术方案,s1、在组织样本上同时标记pd-1/pd-l1/cd8/cd68/foxp3/panck六种抗原,并同时使用dapi对细胞核进行染色,具体操作方式如下:
14.ss1、对pd-1/pd-l1/cd8/cd68/foxp3/panck六种抗原分别与一种染料相搭配对应;
15.ss2、在荧光显微镜对每种荧光信号进行采集,不同的抗原表达强弱可指征不同的细胞类群。
16.作为优选的技术方案,s2、对六种抗原进行分别标记,具体操作方式如下:
17.ss1、panck作为肿瘤标志物,其标记区域则为肿瘤区域;cd8阳性为杀伤性t细胞的标记;foxp3阳性细胞为调节性t细胞;cd68+细胞为巨噬细胞;pd-1和pd-l1作为重要的免疫检测点分别进行标记。
18.作为优选的技术方案,s4、通过10x genomics技术,对同一样本上的基因水平进行检测,具体操作方式如下:
19.ss1、通过he染色,获得组织原位的空间信息;
20.ss2、将组织细胞中的mrna进行透化释放与切片表面的barcode互补结合(spatially barcoded oligo-deoxythymidine microarrays),后续通过建库、测序,获得细胞中完整的转录组数据。
21.本发明的有益效果是:
22.通过一次性在同一组织样本上的两张连续切片上完成,一张进行组织多标的标记,标记6种抗原,从而可以获得组织中6种蛋白的表达水平,获得6种以上不同细胞类群的分类及原位信息,特别是在检测各细胞类群的同时对pd-1/pd-l1免疫检测点同步进行检测,对肿瘤的免疫治疗提供依据;
23.另外一张连续切片进行10x空间转录组的分析、定量,可以从不同的原位位点中收集到多维度和具有空间信息的基因表达分析,对于每一个位点的测序结果,其都可以通过空间定位对应到组织样本上,可以获得细胞亚群的分布和表达的信息,便于判断肿瘤的增殖转移。
附图说明
24.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
25.图1为panel组成及细胞类群分类实例的示意图;
26.图2为空间转录组的操作流程的示意图;
27.图3为人肺癌肿瘤免疫多标panel实例的示意图;
28.图4为人肺癌肿瘤免疫多标panel单通道展示的示意图;
29.图5为各细胞类群在不同组织类型区的细胞数量分布的示意图;
30.图6为人肺癌免疫多标及空间转录组检测组合的示意图;
31.图7为空间转录组细胞类群分布示意图;
32.图8为细胞类群分布t-sne展示图;
33.图9为cluster 3细胞类群高表达基因清单;
34.图10为人肺癌免疫多标及空间转录组组合检测流程的示意图;
35.图11为免疫多色标记染色的实验流程的示意图;
36.图12为空间转录组基因表达方案实验流程的示意图。
具体实施方式
37.本说明书中公开的所有特征,或公开的所有方法或过程中的步骤,除了互相排斥的特征和/或步骤以外,均可以以任何方式组合。
38.本说明书(包括任何附加权利要求、摘要和附图)中公开的任一特征,除非特别叙述,均可被其他等效或具有类似目的的替代特征加以替换。即,除非特别叙述,每个特征只是一系列等效或类似特征中的一个例子而已。
39.在本发明的描述中,需要理解的是,术语“一端”、“另一端”、“外侧”、“上”、“内侧”、“水平”、“同轴”、“中央”、“端部”、“长度”、“外端”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
40.此外,在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
41.本发明使用的例如“上”、“上方”、“下”、“下方”等表示空间相对位置的术语是出于便于说明的目的来描述如附图中所示的一个单元或特征相对于另一个单元或特征的关系。空间相对位置的术语可以旨在包括设备在使用或工作中除了图中所示方位以外的不同方位。例如,如果将图中的设备翻转,则被描述为位于其他单元或特征“下方”或“之下”的单元将位于其他单元或特征“上方”。因此,示例性术语“下方”可以囊括上方和下方这两种方位。设备可以以其他方式被定向(旋转90度或其他朝向),并相应地解释本文使用的与空间相关的描述语。
42.在本发明中,除非另有明确的规定和限定,术语“设置”、“套接”、“连接”、“贯穿”、“插接”等术语应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系,除非另有明确的限定。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
43.如图1-图12所示,本发明的一种人肺癌免疫多标及空间转录组检测组合方法,具体包括以下几个步骤:
44.s1、在组织样本上同时标记pd-1/pd-l1/cd8/cd68/foxp3/panck六种抗原,并同时使用dapi对细胞核进行染色,并对颜色进行采集;
45.s2、对六种抗原进行分别标记;
46.s3、计算肿瘤区和非肿瘤区中各细胞类群的数量;
47.s4、通过10x genomics技术,对同一样本上的基因水平进行检测。
48.本实施例中,s1、在组织样本上同时标记pd-1/pd-l1/cd8/cd68/foxp3/panck六种抗原,并同时使用dapi对细胞核进行染色,具体操作方式如下:
49.ss1、对pd-1/pd-l1/cd8/cd68/foxp3/panck六种抗原分别与一种染料相搭配对应;
50.ss2、在荧光显微镜对每种荧光信号进行采集,不同的抗原表达强弱可指征不同的细胞类群。
51.本实施例中,s2、对六种抗原进行分别标记,具体操作方式如下:
52.ss1、panck作为肿瘤标志物,其标记区域则为肿瘤区域;cd8阳性为杀伤性t细胞的标记;foxp3阳性细胞为调节性t细胞;cd68+细胞为巨噬细胞;pd-1和pd-l1作为重要的免疫检测点分别进行标记。
53.本实施例中,s4、通过10x genomics技术,对同一样本上的基因水平进行检测,具体操作方式如下:
54.ss1、通过he染色,获得组织原位的空间信息;
55.ss2、将组织细胞中的mrna进行透化释放与切片表面的barcode互补结合(spatially barcoded oligo-deoxythymidine microarrays),后续通过建库、测序,获得细胞中完整的转录组数据。
56.本实施例中,s3、计算肿瘤区和非肿瘤区中各细胞类群的数量,可以了解各种免疫细胞的富集情况,从而了解各免疫细胞类群及亚群对肿瘤发生和发展的影响;
57.已有文献证明,当肿瘤组织中,随cd8+细胞的增加,肿瘤浸润的抑制程度更高,肿瘤细胞越难发生转移和扩散;而当foxp3+调节性t细胞越多时,t细胞呈现疲惫态,此时辅助性t细胞无法正常发挥其机能,即无法激活、诱导其他免疫细胞的聚集和活化;当调节性t细胞数量的增加,会影响肿瘤细胞的分化,进一步影响病人的治愈率。巨噬细胞也是免疫微环境当中一种关键的细胞类群。巨噬细胞可分泌多种细胞因子,既可以吸引其他免疫细胞,也可能发挥相反的作用,促进肿瘤细胞的生长和发展;因而当杀伤性t细胞的数量较多时,肿瘤组织可通过自身的免疫对肿瘤细胞发起抵抗,此类病人的治愈率更高。但当调节性t细胞数量较多时却会产生相反的作用;因而,通过同时监控肿瘤组织中的多种免疫细胞;不仅可以帮助预测病人的疾病发展情况,同时,也可能会对肿瘤的治疗提供新的治疗方案;
58.另一方面,免疫治疗已经从根本上转变了癌症治疗的思路,对于免疫表型的研究也被在新药开发的领域当中被给予厚望;因而我们通过panck+pd-l1+为受免疫检查点影响的肿瘤细胞,这一类群的细胞易于从机体的免疫杀伤反应中逃脱,也被称为免疫逃逸肿瘤细胞;而cd8+t细胞表达pd-1时,它们的杀伤性功能受到抑制,因而cd8+pd-1+细胞也被称为衰竭性t细胞。当panck+pd-l1+和cd8+pd-1+细胞比例较高时,肿瘤组织将无惧免疫系统的抗癌反应,持续增殖、转移(5);此时,若通过pd-1或pd-l1抗体药物,阻断pd-1和pd-l1的相互结合,可重新激活机体的免疫杀伤作用,进而对肿瘤细胞重新攻击;因而,检测pd-1和pd-l1在肿瘤组织中的分布以及其表达水平,对于癌症的临床检测和治疗有重要的评估作用;
59.本实施例中,通过s1-s4,最终可获得和组织切片完全对应的具有空间信息的cdna文库,从而可建立可视化基因表达水平图谱。即将高分辨率的显微成像图片与基因表达数
据相关联。通过空间转录组信息从而可进一步识别特异的基因靶标,对肿瘤进行早期预测,结合病理多标分析数据,对肿瘤分型提供依据。
60.工作过程如下:
61.如图1-图12所示:
62.一、检测流程第一部分(免疫多标):
63.a.实验试剂
64.leica ar6/ar9抗原修复液、tbst、leica wash buffer、akoya opal kit#nel811001kt(blocking buffer,hrp二抗,dmso,opal荧光素+dapi)、抗猝灭荧光封片剂
65.b.组织切片前期处理:
66.1.切片从冰箱取出,恢复室温,将切片置于tbst洗液中浸泡3min。
67.2.将切片置于10%甲醛(in tbst)中固定10min。
68.c.抗原修复:使用适用于待检测靶点的ar6或ar9溶液高温处理切片。
69.微波修复的主要作用:暴露抗原;打开抗原抗体之间的非共价键,洗脱一抗和二抗;去除内源性及上一轮染色中引入的过氧化物酶;有效去除样本和荧光因子的非特异性结合;降低组织本身的自发荧光。
70.d.封闭:使用疏水滤芯笔圈出待染色的组织区域。在室温下,使用抗体稀释/封闭溶液孵育组织10分钟。
71.e.一抗孵育:去除封闭液,然后对组织应用一抗溶液。
72.f.二抗孵育:对组织应用二抗溶液。opal聚合物hrp应在室温下孵育10分钟。使用tbst冲洗切片,然后使用tbst清洗两次,每次三分钟。
73.g.opal荧光团孵育:对组织应用opal荧光团溶液,然后在室温下孵育10分钟。使用tbst清洗切片三次,每次两分钟。
74.h.抗体去除。使用下一轮抗体对应的抗原修复液对组织切片进行高温处理。
75.i.重复【封闭--opal荧光团孵育】的步骤,直至完成所有目标抗体的标记。
76.j.光谱dapi染色:在dapi溶液中于室温下孵育切片五分钟。使用tbst清洗切片两分钟。
77.k.封片:针对荧光显微镜和盖玻片应用封片剂。
78.l.通过akoya公司的vectro polaris多光谱成像定量系统进行成像。
79.m.图像结果导入inform 2.5.0软件进行分析。
80.二、检测流程第二部分(空间转录组):
81.a.实验试剂
82.甲醇、异丙醇、去离子水、苏木精、伊红、反蓝液、10x visium芯片、visium透化载玻片、visium试剂、tris溶液、20x ssc
83.b.切片:对冰冻样本进行切片。使切片位于捕获区域内。
84.c.固定:切片置于-20℃冰甲醇中孵育30分钟,进行固定。
85.d.he染色:进行异丙醇固定,之后,苏木精染色7分钟,伊红染色1分钟。
86.e.成像:使用明场成像设备成像。
87.f.质检:rin值,是预测rna的完整性的重要参数,切5-10片10um的组织切片,抽提rna,检测rin值,大于等于7,为质控合格的样本,可继续实验。
88.g.组织透化:透化的时间是正式实验透化的参考,由于组织的异质性。连续的7张切片,贴在透化的芯片上,甲醇固定,he染色扫描保存位置信息,酶透化,带荧光基团cdna扩增,荧光信号的强弱代表rna信号的释放,从而推断出最佳透化时间。
89.h.正式实验:切一张有最佳区域的切片(切片和透化的切片来源于同一个组织),贴在正式的芯片上,甲醇固定,he染色扫描保存位置信息,对4个捕获区域进行物理分割后,在独立的空间中进行酶透化(根据透化实验推断的时间),mrna释放后会跟芯片带有barcode的寡核苷酸序列结合,随后进行cdna第一链和第二链的合成。碱变性出的第二链,离开芯片的独立区域,在pcr管中进行后续的建库。
90.i.文库构建:cdna合成、cdna收集到试管内进行pcr扩增和建库一系列实验流程。采用illumina hiseq pe150或novaseq pe150测序策略,推荐每个位点(spot)测50,000-100,000reads,即每个样本(5000个spots)测75-100g数据量。测序深度与样本在载玻片上捕获区域的覆盖面积和样本类型及复杂度有关,适当加大测序数据量可提高基因的检出率。
91.j.数据通过10x genomics的cell ranger和loupe browser进行分析。
92.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何不经过创造性劳动想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书所限定的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1