一种无抗体酶辅助的光电化学传感器用于检测m6A的方法
一种无抗体酶辅助的光电化学传感器用于检测m6a的方法
技术领域
1.本发明涉及光电化学分析技术领域,具体涉及一种检测n
6-甲基腺嘌呤的无抗体酶辅助光电化学生物传感器及其制备方法。
背景技术:
2.rna的甲基化主要发生在碱基环外的氨基基团上、环上的n原子和c原子上以及核糖第二位羟基位点上。而n
6-甲基腺嘌呤(n
6-methyladenosine,m6a)是指在甲基转移酶的作用下rna腺嘌呤(a)碱基第6位氮原子发生甲基化,它是真核生物mrna中最丰富、动态的内部修饰。在动物体内,n
6-甲基腺嘌呤在基因表达调控中发挥重要作用,影响基因剪接和稳定性、翻译、干细胞多能性以及免疫反应,广泛参与胚胎发育、细胞凋亡、昼夜节律等生命活动。在植物体内,n
6-甲基腺嘌呤具有同样的功能,而且是植物正常发育所必需的物质,n
6-甲基腺嘌呤的缺失会导致拟南芥的胚胎致病和水稻小孢子的早期退化。另外,脂肪量和肥胖相关蛋白(fto)作为n
6-甲基腺嘌呤的去甲基化酶,在急性髓系白血病和肺癌中的表达上调,在促进肿瘤发生中起着重要作用。因此检测n
6-甲基腺嘌呤的含量,以及研究其生物学功能具有非常重要的意义。
3.由于n
6-甲基腺嘌呤的惰性化学性质,目前针对n
6-甲基腺嘌呤的检测方法大多依赖于n
6-甲基腺嘌呤抗体,如n
6-甲基腺嘌呤免疫共沉淀结合高通量测序的方法(m6a-seq)、光交联的免疫沉淀结合测序的方法(miclip)、tlc、lc-ms、斑点杂交法等。这些方法作为早期的n
6-甲基腺嘌呤检测方法,对n
6-甲基腺嘌呤的研究起到了推进作用。但是抗体价格昂贵,保存时间短,而且具有假阳性。因此,以上检测n
6-甲基腺嘌呤的方法都受到了一定程度上的限制,开发新的无抗体检测方法具有重要意义。
4.光电化学生物传感器是一种记录细胞相关生物事件的有效工具,通过生物识别元件和信号转换器将生物现象转化为光电流信号,利用光电流信号的变化实现对目标物的定性及定量分析。光电化学检测技术相比较于荧光、电化学和电化学发光技术而言,由于其独立的激发光源和信号采集系统,使其具有低的背景信号和高的检测灵敏度,因此已成为具有巨大应用价值的分析技术。但目前尚未有利用无抗体酶辅助的光电化学分析方法检测n
6-甲基腺嘌呤的报道。
技术实现要素:
5.针对上述现有技术,本发明的目的是提供一种无抗体酶辅助的光电化学传感器用于检测n
6-甲基腺嘌呤的方法,实现了对n
6-甲基腺嘌呤的快速、简单和灵敏检测。
6.为实现上述目的,本发明采用如下技术方案:
7.本发明的第一方面,提供一种检测n
6-甲基腺嘌呤的无抗体酶辅助光电化学生物传感器,包括电极;所述电极的表面依次修饰有二硒化钼(mose2)、钼酸铋(bi2moo6)、羧基化二氧化硅(sio2@cooh)、探针dna(ss dna)、n
6-甲基腺嘌呤(m6a)、脂肪量和肥胖相关蛋白(fto)、二硫苏糖醇(dtt)和硫化镉(cds)。
8.所述电极为ito电极。
9.本发明的第二方面,提供所述的无抗体酶辅助光电化学生物传感器的制备方法,包括以下步骤:
10.(1)对电极进行预处理;
11.(2)将mose2修饰到预处理后的电极表面;
12.(3)利用物理吸附作用,依次将bi2moo6、sio2@cooh修饰于步骤(2)处理后的电极表面;
13.(4)利用edc溶液和nhs溶液对步骤(3)处理后的电极表面的sio2@cooh上的羧基进行活化;利用活化后的羧基与ss dna上的氨基之间的共价反应,将ss dna修饰到步骤(3)处理后的电极表面;
14.(5)利用ss dna与m6a之间的碱基互补配对,将m6a修饰到步骤(4)处理后的电极表面;
15.(6)利用fto对m6a的氧化作用,将m6a氧化为hm6a并将fto修饰到步骤(5)处理后的电极表面;
16.(7)利用dtt与hm6a之间的硫醇加成反应,将hm6a转化为dm6a并将dtt修饰到步骤(6)处理后的电极表面;
17.(8)利用dm6a上的巯基与cds之间的共价反应,将cds修饰到步骤(7)处理后的电极表面,得到无抗体酶辅助光电化学生物传感器。
18.优选的,步骤(2)中,所述mose2的修饰方法为:
19.将mose2纳米材料分散于去离子水中得mose2分散液,将mose2分散液滴加到步骤(1)预处理后的电极表面,红外灯照射下干燥;
20.优选的,所述mose2纳米材料由以下方法制备:
21.将钼酸钠溶于去离子水和无水乙醇的混合液中,依次加入硒粉、硼氢化钠、聚乙二醇400,搅拌后进行水热反应,反应完成后进行洗涤、离心收集固体,干燥后将固体置于氮气氛围中煅烧,即得mose2纳米材料。
22.优选的,步骤(3)中,所述bi2moo6和sio2@cooh的修饰方法为:
23.将bi2moo6纳米材料分散于去离子水中,得bi2moo6分散液,将sio2@cooh纳米材料均匀分散于去离子水中,得sio2@cooh分散液,依次将bi2moo6分散液和sio2@cooh分散液滴加在步骤(2)处理后的电极表面,并分别在红外灯照射下进行干燥;
24.优选的,所述bi2moo6纳米材料由以下方法制备:
25.将硝酸铋和钼酸钠分别溶于乙二醇中,磁力搅拌后,将两种溶液混合并滴加到无水乙醇中,进行水热反应,收集沉淀,洗涤,干燥收集固体,即得bi2moo6纳米材料;
26.优选的,所述sio2@cooh纳米材料由以下方法制备:
27.(1)将正硅酸乙酯、浓氨水、去离子水和无水乙醇混合并搅拌,然后再加入正硅酸乙酯,继续搅拌水解;再经离心,水洗至中性,得到sio2纳米粒子;
28.(2)将制得的sio2纳米粒子超声分散在无水乙醇中,加入γ-氨丙基三乙氧基硅烷,室温搅拌反应;然后离心,依次用乙醇、丙酮、四氢呋喃洗涤,得到氨基化sio2纳米粒子;
29.(3)将氨基化sio2纳米粒子超声分散在四氢呋喃中,再加入苯偏三酸酐,室温搅拌反应;离心并水洗,干燥后即得sio2@cooh纳米材料。
30.优选的,步骤(4)中,所述sio2@cooh上的羧基进行活化的方法为:
31.将edc溶液和nhs溶液滴加到步骤(3)处理后的电极表面,于37℃潮湿条件下反应,然后清洗;
32.所述ss dna的修饰方法为:
33.将ss dna溶液滴加到edc溶液和nhs溶液处理后电极表面,于37℃潮湿条件下反应,然后清洗;
34.所述ss dna的核苷酸序列为:5
’‑
gagcacccttcattgcaa-nh
2-3’。
35.优选的,所述edc溶液和nhs溶液分别用pbs缓冲溶液配置而成,edc溶液和nhs溶液浓度均为0.5mg/ml。
36.优选的,步骤(5)中,所述m6a的修饰方法为:
37.将m6a溶液滴加到步骤(4)处理后的电极表面,于37℃潮湿条件下反应,然后清洗;
38.优选的,步骤(6)中,所述fto的修饰方法为:
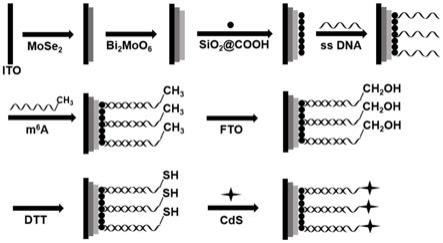
39.将含有硫酸亚铁铵、l-抗坏血酸、4-(2-羟乙基)-1-哌嗪乙磺酸、α-酮戊二酸、fto蛋白的溶液滴加到步骤(5)处理后的电极表面,于37℃潮湿条件下反应,然后清洗。
40.含有硫酸亚铁铵、l-抗坏血酸、4-(2-羟乙基)-1-哌嗪乙磺酸、α-酮戊二酸、fto蛋白的溶液是将硫酸亚铁铵、l-抗坏血酸、4-(2-羟乙基)-1-哌嗪乙磺酸、α-酮戊二酸、fto蛋白溶于灭菌二次水中得到的。
41.所述fto蛋白为重组人fto蛋白(ab271525)。
42.优选的,步骤(7)中,dtt的修饰方法为:
43.将含有4-(2-羟乙基)-1-哌嗪乙磺酸和dtt的溶液滴加到步骤(6)处理后的电极表面,于37℃潮湿条件下反应,然后清洗;
44.含有4-(2-羟乙基)-1-哌嗪乙磺酸和dtt的溶液为将4-(2-羟乙基)-1-哌嗪乙磺酸和dtt溶于灭菌二次水中得到的。
45.优选的,步骤(8)中,所述cds的修饰方法为:
46.将cds纳米材料分散液滴加到步骤(7)处理后的电极表面,于37℃潮湿条件下反应,然后清洗;
47.优选的,所述cds纳米材料由以下方法制备:
48.将氯化镉溶于去离子水中,用naoh调节ph至10-11,再加入巯基乙酸和硫化钠,然后在氮气氛围中加热。
49.本发明的第三方面,提供所述的无抗体酶辅助光电化学生物传感器在检测n
6-甲基腺嘌呤中的应用。
50.本发明的第三方面,提供利用所述的无抗体酶辅助光电化学生物传感器检测n
6-甲基腺嘌呤的方法,所述方法为:
51.以所述的无抗体酶辅助光电化学生物传感器作为工作电极、以饱和甘汞电极作为参比电极、以pt丝作为辅助电极,组成三电极系统进行光电化学信号检测,以tris-hcl缓冲溶液作为电极检测液,采用电流-时间法对n
6-甲基腺嘌呤含量进行检测,建立电流与n
6-甲基腺嘌呤浓度之间的标准曲线,对n
6-甲基腺嘌呤含量进行检测。
52.优选的,所述tris-hcl缓冲溶液ph为5.5-8.5、浓度为0.1-100mmol
·
l-1
;应用电位为:-0.5-0.5v。
53.本发明的有益效果:
54.(1)本发明利用fto对n
6-甲基腺嘌呤的特异性氧化作用,以及dtt介导的硫醇加成反应,构建了无抗体酶辅助的光电化学生物传感器,实现了对n
6-甲基腺嘌呤的特异性定量检测。
55.(2)本发明利用cds、bi2moo6、mose2三者之间的能带匹配作用,实现光电信号的扩增,提高n
6-甲基腺嘌呤的检测灵敏度。
56.(3)本发明的检测方法简单,成本低,实现了仪器小型化,仅对ito电极表面进行简单的处理,即可实现对n
6-甲基腺嘌呤的检测。
附图说明
57.图1:本发明光电化学生物传感器构建以及n
6-甲基腺嘌呤检测的原理图。
58.图2:光电流强度与n
6-甲基腺嘌呤浓度的对数值的线性拟合曲线。
59.图3:不同dna和rna条件下的光电化学响应变化的柱状图。
具体实施方式
60.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
61.说明:本发明中的“室温”的范围为25℃。
62.本发明中的“潮湿条件”为湿度大于90%;优选的湿度为95-99%。
63.本发明中所使用的清洗液的成分为:3-15mm tris-hcl和20-60mm kcl,ph 7.4。
64.本发明中所使用的rna溶解液的成分为:5-100mm tris、1-50mm乙二胺四乙酸(edta),ph 5.0-8.5,溶剂为灭菌水。
65.正如背景技术部分所介绍的,现有技术虽然能检测n
6-甲基腺嘌呤,但也存在一些不足之处,特别是抗体价格昂贵,保存时间短,而且具有假阳性。
66.基于此,本发明构建了一种无抗体酶辅助的光电化学生物传感器,用于检测n
6-甲基腺嘌呤,本发明的光电化学生物传感器构建和检测的原理图见图1。本发明的光电化学生物传感器以ito电极为基体电极,将mose2、bi2moo6、sio2@cooh依次修饰到电极表面。利用sio2@cooh表面的羧基和ss dna的氨基之间形成酰胺键的原理,将ss dna修饰到电极表面。利用碱基互补配对原则,将m6a修饰到电极表面。利用fto对m6a的特异性氧化作用,将m6a氧化为hm6a。利用dtt介导的硫醇加成反应,将hm6a转化为dm6a。利用dm6a上的巯基与镉离子之间的特异性结合将cds修饰到电极表面。其中,mose2作为二维层状材料,可以作为优秀的光活性材料。mose2与bi2moo6之间能带匹配,增大了光电流强度。sio2@cooh作为一种不溶于水的纳米材料,起到了联接剂的作用,将ss dna修饰到电极表面,进而将m6a修饰到电极表面。通过fto介导的氧化作用以及dtt介导的硫醇加成反应,将带有甲基的m6a转换为带有巯基的dm6a。由于空间位阻效应,阻碍了电极表面的光生电子的迁移,光电流强度降低。最后引入cds作为信号扩增单元,由于cds、bi2moo6、mose2三者之间的能带匹配作用,增大了光电流强度。因为cds的修饰量由m6a浓度决定,所以利用m6a与光电流强度的线性关系,可以实现对m6a的定量检测。m6a氧化为hm6a,进一步转化为dm6a的过程如下:
[0067][0068]
在本发明的一个实施方案中,给出的光电化学生物传感器的构建过程为:
[0069]
(1)mose2的制备:将3-7mmol钼酸钠溶于含有10-30ml去离子水和10-30ml无水乙醇的混合液中,依次加入3-7mmol硒粉、3-7mmol硼氢化钠、0.1-0.5ml聚乙二醇400,磁力搅拌30-60分钟后,转移至反应釜中150-200℃,进行水热反应20-30h,以6000-12000rpm离心5-10min收集沉淀,用水和无水乙醇分别洗涤2-6次,每次洗涤后离心。然后在40-60℃下干燥,收集固体。将固体置于氮气氛围的管式炉中,在400-500℃的温度下煅烧1-3小时,即得mose2纳米材料。
[0070]
(2)bi2moo6的制备:将1-3mmol硝酸铋和0.1-1mmol钼酸钠分别溶于1-10ml乙二醇中,磁力搅拌30-60分钟后,将两种溶液混合并滴加到10-30ml无水乙醇中,转移至反应釜中150-200℃,进行水热反应20-30h,收集沉淀,用水和乙醇离心洗涤2-6次,40-60℃干燥收集固体,即得bi2moo6纳米材料。
[0071]
(3)sio2@cooh的制备:将1-3ml正硅酸乙酯、1-3ml浓氨水、1-3ml去离子水和40-60ml无水乙醇加入到圆底烧瓶中,在30-60℃下缓慢搅拌1-5h,然后再加入1-3ml正硅酸乙酯,继续搅拌水解1-5h;再经10000-12000rpm离心5-15min,水洗至中性,得到sio2纳米粒子。将制得的sio2纳米粒子超声分散在40-60ml无水乙醇中,加入0.1-0.3mlγ-氨丙基三乙氧基硅烷,室温搅拌反应5-7h;然后,10000-12000rpm离心5-15min,依次用乙醇、丙酮、四氢呋喃洗涤1-3次,得到氨基化sio2纳米粒子。将氨基化sio2纳米粒子超声分散在40-60ml四氢呋喃中,再加入0.1-0.3g苯偏三酸酐,室温搅拌反应6-10h;10000-12000rpm离心5-15min并水洗2-6次,40-60℃干燥后即得sio2@cooh纳米材料。
[0072]
(4)cds的制备:将0.05-0.15g氯化镉溶于去离子水中,用naoh调节ph至10-11,慢慢加入0.2-0.5ml巯基乙酸和0.1-0.2g硫化钠,然后在氮气氛围中100-130℃加热3-5h。
[0073]
(5)mose2分散液的制备:称取2-10mg步骤(1)制备的mose2纳米材料,加入到2-10ml去离子水中,超声分散0.5-3小时。
[0074]
(6)bi2moo6分散液的制备:称取2-20mg步骤(2)制备的bi2moo6纳米材料,加入到2-10ml去离子水中,超声分散0.5-3小时。
[0075]
(7)sio2@cooh分散液的制备:称取2-10mg步骤(3)制备的sio2@cooh纳米材料,加入到2-10ml去离子水中,超声分散0.5-3小时。
[0076]
(8)电极清洗缓冲液的制备:以灭菌水为溶剂,将3-15mm的tris-hcl和20-60mm的kcl混合,调节ph为7.4。
[0077]
(9)edc、nhs溶液的制备:用灭菌水配置ph为5.5-8.5、浓度为5-500mm的pbs缓冲溶液,用该pbs溶液做溶剂分别配置浓度均为0.5mg
·
ml-1
的edc溶液和nhs溶液。
[0078]
(10)ito电极预处理:将ito导电玻璃分割成5
×
1cm2,分别用丙酮、1-4m naoh的醇水溶液(v
无水乙醇
:v
二次水
=1:(1-6))、二次水将ito电极超声处理15-60min,然后用二次水冲洗,自然晾干,待用。
[0079]
(11)mose2的固定:将20-80μl mose2分散液滴加到预处理的ito电极表面,红外灯照射干燥。然后用电极清洗缓冲液清洗1-5次。氮气吹干。制备的电极标记为mose2/ito。
[0080]
(12)bi2moo6的固定:将20-80μl bi2moo6分散液滴加到mose2/ito电极表面,红外灯照射干燥。然后用电极清洗缓冲液清洗1-5次。氮气吹干。制备的电极标记为bi2moo6/mose2/ito。
[0081]
(13)sio2@cooh的固定:将20-80μl sio2@cooh分散液滴加到bi2moo6/mose2/ito电极表面,红外灯照射干燥。然后用电极清洗缓冲液清洗1-5次。氮气吹干。制备的电极标记为sio2@cooh/bi2moo6/mose2/ito。
[0082]
(14)sio2@cooh的活化:向sio2@cooh/bi2moo6/mose2/ito电极表面分别加入10μl的edc溶液和10μl nhs溶液,37℃活化10-90min,即得活化后的sio2@cooh/bi2moo6/mose2/ito电极。
[0083]
(15)ss dna的固定:将10-50μl 0.2-1.5μmol
·
l-1
ss dna(核苷酸序列为:5
’‑
gagcacccttcattgcaa-nh
2-3’)溶液滴加到活化后的sio2@cooh/bi2moo6/mose2/ito电极表面,于37℃潮湿条件下反应0.5-3h,然后清洗1-5次。制备的电极标记为ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0084]
(16)m6a的固定:将10-50μl m6a溶液滴加到ss dna/sio2@cooh/bi2moo6/mose2/ito电极表面,于37℃潮湿条件下反应0.5-3h,然后用电极清洗缓冲液清洗1-5次。制备的电极标记为m6a/ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0085]
(17)fto的氧化:将10-50μl含有600nmol
·
l-1
硫酸亚铁铵、4μmol
·
l-1
l-抗坏血酸、200μmol
·
l-1 4-(2-羟乙基)-1-哌嗪乙磺酸、600nmol
·
l-1
α-酮戊二酸、500μg/l fto蛋白(重组人fto蛋白,abcam公司,ab271525)的灭菌二次水溶液滴加到m6a/ss dna/sio2@cooh/bi2moo6/mose2/ito电极表面,于37℃潮湿条件下反应3-8min,然后用电极清洗缓冲液清洗1-5次。制备的电极标记为hm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0086]
(18)dtt的加成:将10-50μl含有400μmol
·
l-1
dtt and 200μmol
·
l-1 4-(2-羟乙基)-1-哌嗪乙磺酸的灭菌二次水溶液滴加到hm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito电极表面,于37℃潮湿条件下反应2-4h,然后用电极清洗缓冲液清洗1-5次。制备的电极标记为dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0087]
(19)cds的固定:将10-60μl cds溶液滴加到dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito电极表面,与37℃潮湿条件下反应0.5-5h,然后用电极清洗缓冲液清洗1-5次。制备的电极标记为cds/dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito,即为本发明的无抗体酶辅助的光电化学生物传感器。
[0088]
上述光电化学传感器的构建过程中,各步骤相辅相成,顺序是严格限定的,每一步都为下一步的固定修饰服务,缺少上一步,可能会导致后面的修饰失败。固定修饰在ito电极表面的材料可以是市售产品,也可自行制备得到,只要性能上满足使用要求即可,本发明不做特别的限定。
[0089]
为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
[0090]
本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
[0091]
实施例1:
[0092]
(1)mose2的制备
[0093]
将5mmol钼酸钠溶于含有20ml去离子水和20ml无水乙醇的混合液中,依次加入5mmol硒粉、5mmol硼氢化钠、0.24ml聚乙二醇400,磁力搅拌30分钟后,转移至反应釜中200℃放置24h,进行水热反应,以转速10000rpm离心10min收集沉淀,用水和无水乙醇离心洗涤3次,60℃干燥收集固体,并将固体置于氮气氛围的管式炉中,在500℃的温度下煅烧2小时,即得mose2纳米材料。
[0094]
(2)bi2moo6的制备
[0095]
将1mmol硝酸铋和0.5mmol钼酸钠分别溶于5ml乙二醇中,磁力搅拌30分钟后,将两种溶液混合并滴加到20ml无水乙醇中,转移至反应釜中160℃放置24h,进行水热反应,收集沉淀,用水和乙醇离心洗涤3次,60℃干燥收集固体,即得bi2moo6纳米材料。
[0096]
(3)sio2@cooh的制备
[0097]
将1.5ml正硅酸乙酯、1.7ml浓氨水、1ml去离子水和50ml无水乙醇加入到圆底烧瓶中,在40℃下30rpm搅拌3h,然后再加入1ml正硅酸乙酯,继续搅拌水解3h;再经11000rpm离心10min,水洗至中性,得到sio2纳米粒子。将制得的sio2纳米粒子超声分散在50ml无水乙醇中,加入0.2mlγ-氨丙基三乙氧基硅烷,室温搅拌反应5h;然后,11000rpm离心10min,用乙醇、丙酮、四氢呋喃依次洗涤2次,得到氨基化sio2纳米粒子。将氨基化sio2纳米粒子超声分散在50ml四氢呋喃中,再加入0.2g苯偏三酸酐,室温搅拌反应8h;11000rpm离心10min并水洗3次,60℃干燥后即得sio2@cooh纳米材料。
[0098]
(4)cds的制备
[0099]
将0.0916g氯化镉溶于去离子水中,用naoh调节ph至10-11,5分钟内慢慢加入0.25ml巯基乙酸和0.1201g硫化钠,然后在氮气氛围中110℃加热4h。
[0100]
(5)mose2分散液的制备
[0101]
称取10mg实施例1制备的mose2,加入到5ml去离子水中,超声分散1小时。
[0102]
(6)bi2moo6分散液的制备
[0103]
称取15mg实施例1制备的bi2moo6,加入到5ml去离子水中,超声分散1小时。
[0104]
(7)sio2@cooh分散液的制备
[0105]
称取5mg实施例1制备的sio2@cooh,加入到5ml去离子水中,超声分散1小时。
[0106]
(8)电极清洗缓冲液的制备
[0107]
以灭菌水为溶剂,将10mm tris-hcl和50mm kcl混合,调节ph为7.4。
[0108]
(9)edc溶液和nhs溶液的制备
[0109]
用灭菌水配置ph为7.4、浓度为10mm的pbs缓冲溶液,用该pbs溶液做溶剂分别配置浓度均为0.5mg/ml的edc溶液和nhs溶液。
[0110]
(10)ito电极预处理
[0111]
将ito导电玻璃分割成5
×
1cm2,分别用丙酮、1m naoh的醇水溶液(v
无水乙醇
:v
二次水
=1:1)、二次水将ito电极超声处理20min,然后用二次水冲洗,自然晾干,待用。
[0112]
(11)mose2的固定
[0113]
将40μl mose2分散液滴加到预处理的ito电极表面,红外灯照射干燥。然后将电极用实施例8制备的电极清洗缓冲液清洗3次。氮气吹干。制备的电极标记为mose2/ito。
[0114]
(12)bi2moo6的固定
[0115]
将40μl bi2moo6分散液滴加到mose2/ito电极表面,红外灯照射干燥。然后,将电极用实施例8制备的电极清洗缓冲液清洗3次。氮气吹干。制备的电极标记为bi2moo6/mose2/ito。
[0116]
(13)sio2@cooh的固定
[0117]
将40μl sio2@cooh分散液滴加到bi2moo6/mose2/ito电极表面,红外灯照射干燥。然后,将电极用实施例8制备的电极清洗缓冲液清洗3次。氮气吹干。制备的电极标记为sio2@cooh/bi2moo6/mose2/ito。
[0118]
(14)sio2@cooh的活化
[0119]
向sio2@cooh/bi2moo6/mose2/ito电极表面分别加入10μl的edc溶液和nhs溶液,37℃活化60min,即得活化后的sio2@cooh/bi2moo6/mose2/ito电极。
[0120]
(15)ss dna的固定:将20μl 0.6μmol
·
l-1
ss dna溶液滴加到活化后的sio2@cooh/bi2moo6/mose2/ito电极表面,于37℃潮湿条件下反应80min,然后,将电极用实施例8制备的电极清洗缓冲液清洗3次。氮气吹干。制备的电极标记为ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0121]
(16)m6a的固定:将20μl m6a溶液滴加到ss dna/sio2@cooh/bi2moo6/mose2/ito电极表面,于37℃潮湿条件下反应40min,然后,将电极用实施例8制备的电极清洗缓冲液清洗3次。氮气吹干。制备的电极标记为m6a/ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0122]
(17)fto的氧化:将20μl含有600nmol
·
l-1
硫酸亚铁铵、4μmol
·
l-1
l-抗坏血酸、200μmol
·
l-1 4-(2-羟乙基)-1-哌嗪乙磺酸、600nmol
·
l-1
α-酮戊二酸、500μg/l fto蛋白的溶液滴加到m6a/ss dna/sio2@cooh/bi2moo6/mose2/ito电极表面,于37℃潮湿条件下反应5min,然后,将电极用实施例8制备的电极清洗缓冲液清洗3次。氮气吹干。制备的电极标记为hm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0123]
(18)dtt的加成:将20μl含有400μmol
·
l-1
dtt and 200μmol
·
l-1 4-(2-羟乙基)-1-哌嗪乙磺酸的溶液滴加到hm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito电极表面,于37℃潮湿条件下反应3h,然后,将电极用实施例8制备的电极清洗缓冲液清洗3次。氮气吹干。制备的电极标记为dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0124]
(19)cds的固定:将20μl cds溶液滴加到dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito电极表面,与37℃潮湿条件下反应50min,然后,将电极用实施例8制备的电极清洗缓冲液清洗3次。氮气吹干。制备的电极标记为cds/dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito。
[0125]
实施例2:光电化学检测
[0126]
以电化学工作站为信号采集仪器,3w led灯为光源,实施例1制备的cds/dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito电极为工作电极,饱和甘汞电极为参比电极,pt电极为对电极,tris-hcl缓冲溶液为电极检测液,以-0.3v电压为工作电压,采用i-t技术进行待测物的检测研究,建立光电流强度与n
6-甲基腺嘌呤浓度之间的标准曲线(图2)
[0127]
实施例3:检测选择性实验
[0128]
选择性是光电化学传感器性能的一个重要指标,为了研究构建的传感器的特异性,选择5-羟基胞嘧啶(5hmc)、microrna-21(mirna-21)、microrna-319(mirna-319)、microrna-159(mirna-159)、单链dna1(ss dna-1)、单链dna2(ss dna-2)作为干扰物对实施
例1制备的传感器的选择性进行研究。并对不同干扰试剂参与实施例1构建的传感器的光电流变化值(δi=i
2-i1,i1是cds/dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito的电流值,i2是cds/dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito经过不同干扰物处理后的电极的光电流值)进行了对比。结果表明,干扰物参与构建传感器的电流值变化明显低于n
6-甲基腺嘌呤,表明构建的传感器具有很好的特异性(图3)。
[0129]
实施例4:稳定性实验
[0130]
采用实施例1的方法制备7支cds/dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito电极(n
6-甲基腺嘌呤浓度为5-50nmol
·
l-1
),在检测液中检测光电流。得到光电流的相对标准偏差为3.67%,说明该方法有很好的重现性。对cds/dm6a/ss dna/sio2@cooh/bi2moo6/mose2/ito传感器连续测量7个周期,在检测液中检测光电化学信号,得到光电流的标准偏差为1.5%,说明该方法有很好的稳定性。
[0131]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1