一种促甲状腺激素受体抗原试剂及促甲状腺激素受体抗体定量检测试剂盒的制作方法
1.本发明涉及体外诊断技术领域,具体是一种促甲状腺激素受体抗原试剂及促甲状腺激素受体抗体定量检测试剂盒。
背景技术:
2.促甲状腺激素受体(tshr)是位于甲状腺滤泡上皮细胞膜上的一种大分子糖蛋白,属于g蛋白偶联受体家族成员。生理条件下,促甲状腺激素(tsh)与其受体tshr结合,经g蛋白激活产生级联反应以实现生物学效应。在遗传和环境作用下,tshr结构发生变异,产生了抗原性,引起自身免疫反应,产生大量的促甲状腺激素受体抗体(trab)。trab是一组异质性抗体,根据其功能不同可分为甲状腺刺激抗体(tsab)、甲状腺刺激阻断抗体(tsbab)和中性甲状腺激素受体抗体。tsab可与tsh竞争性结合在tshr上,通过产生camp,刺激甲状腺滤泡细胞分泌合成甲状腺素,继而可引起毒性弥漫性甲状腺肿(graves病)。tsbab与tshr结合,可直接干扰tsh与其受体的结合,从而减弱tsh的生物学效应。另外,tsbab还可抑制腺苷酸环化酶的活化引起甲减。中性抗体与tshr结合后既不刺激也不抑制甲状腺功能。
3.tshr由含764个氨基酸的单一多肽链组成,分子量约为84kda,胞外域大约有414~418个氨基酸,包含六个潜在的n连接糖基化位点,而剩余的序列形成跨膜结构域和细胞内羧基末端。正确的折叠、糖基化和存在tshr的跨膜区和胞外域是高亲和力配体结合所必需的,同时,跨膜区和细胞内结构的稳定对于维持tshr的稳定有重要作用。有大量文献表明tshr本身稳定性很差(参考文献1:furmaniakj,sandersj,sandersp,miller-gallacherj,rydermm,reessmithb.practicalapplicationsofstudiesonthetshreceptorandtshreceptorautoantibodies.endocrine.2020may;68(2):261-264.doi:10.1007/s12020-019-02180-9.epub2020may29.pmid:32472423;pmcid:pmc7266850.参考文献2:iiday,amirsm,ingbarsh.stabilization,partialpurification,andcharacterizationofthyrotropinreceptorsinsolubilizedguineapigfatcellmembranes.endocrinology.1987nov;121(5):1627-36.doi:10.1210/endo-121-5-1627.pmid:3665836.)。在体外诊断检测技术领域中,检测试剂在液体状态下长期保存是其能在自动化检测仪器中正常使用的必要条件,而tshr稳定性差,易失去活性,很难在2-8℃条件下长期保存,因而限制了其在自动化监测仪器上的应用。
4.trab是graves患者血清中存在对tshr的特异性自身抗体。血清trab的测定可以作为graves病诊断、治疗及预后判断的良好指标,对妊娠期甲状腺功能亢进症的治疗以及新生儿甲状腺功能异常的风险评估也具有重要价值。目前trab的检测方法主要有生物分析法和免疫分析法。生物分析法能区分刺激性抗体和阻断性抗体,但因耗时、操作繁琐,成本高而不能应用于临床实验室的检测。常见的免疫分析法为放射免疫法、酶联免疫法、化学发光法,目前临床应用最广泛的为全自动磁微粒化学发光法。
5.现有技术已经公开了多种用于测定trab的方法,例如,申请号为
cn201910875687.6的中国专利公开了一种刺激性促甲状腺激素受体抗体浓度的检测试剂盒,包括:包被有刺激性促甲状腺激素受体抗体的磁微粒,含有标记物标记的刺激性促甲状腺激素受体,刺激性促甲状腺激素受体抗体校准品,其固相包被为刺激性促甲状腺激素受体抗体,其解决的问题是避免了抑制性促甲状腺激素受体抗体对测量系统的影响。申请号为cn201611018792.0 的中国专利公开了一种促甲状腺激素受体抗体化学发光免疫测定试剂盒包括:促甲状腺激素受体包被的磁微粒、鼠抗人igg抗体包被的吖啶酯、促甲状腺激素受体抗体定标品,其固相包被为促甲状腺激素受体,其解决的问题是克服了现有测定方法测定成本高、测定灵敏度低、测定线性范围窄、重现性低、不能定量、操作复杂的缺点。申请号为cn201710115161.9的中国文献公开了一种促甲状腺激素受体抗体的检测方法,其试剂盒组分主要包括fitc 标记的羊抗人球蛋白等试剂及生物薄片,生物薄片为取自大鼠甲状腺细胞制成,包被在载片的反应区内;测定方法为:在反应区内加待测血清,经孵育、漂洗、甩干后,加入fitc标记的羊抗人球蛋白,经孵育、漂洗、甩干后,在荧光显微镜下,甲状腺细胞膜上形成fitc标记的羊抗人球蛋白荧光复合物,产生黄绿色荧光;其解决的问题是克服了促甲状腺激素受体抗体的检测方法中的漏检问题。申请号为cn201810506744.9的中国专利公开了一种能同时检测促甲状腺激素受体分型抗体的酶联免疫试剂盒及检测方法,该试剂盒主要包括:包被抗原、预包被酶标板、漂洗液、促甲状腺激素受体抗体标准品、酶标液,该试剂盒解决的主要问题是可用于定量检测促甲状腺激素受体分型抗体的浓度。文献《evaluation of the application of tsh receptor stimulatingautoantibodies and the optimization of detection strategy in graves'disease》(tongm,ding j,huang b,chen j,wei x,li z,shu j,hu z,jiang x,sheng h.clinchim acta.2021oct;521:34-39.doi:10.1016/j.cca.2021.06.017.epub 2021jun16.pmid:34144042)公开了某国外厂家的促甲状腺激素受体刺激性抗体检测试剂盒(化学发光法)是由一对重组的人tshr构建,其检测原理为夹心法,并且只检测刺激性抗体。市面上另有其他采用竞争法原理检测trab的商品化试剂盒,其检测系统可大致分为两种:生物素-亲和素系统或fitc-抗fitc 系统,这两种系统均有一定的弊端:生物素-亲和素系统:当标本中含有一定量的生物素会干扰检测结果(参考文献3:张国峰,郭锐,关海霞.重视化验单之外的信息——由生物素干扰检验而被误诊为graves病甲状腺功能亢进症的实例谈诊断甲状腺疾病的要素[j].中华内分泌代谢杂志,2017,33(09):723-725.); fitc-抗fitc系统:一些历经视网膜荧光血管造影术的患者血清中残留的荧光素也会对检测结果有一定影响(参考文献4:bloom jn,herman dc,elin rj, sliva ca,ruddel me,nussenblatt rb,palestine ag.intravenous fluoresceininterference with clinical laboratory tests.am j ophthalmol.1989oct15;108(4):375-9.doi:10.1016/s0002-9394(14)73304-5.pmid:2801858.)。上述两种系统均涉及复杂的标记工艺,同时会引入相应的干扰因素。
技术实现要素:
[0006]
有鉴于此,本发明所要解决的技术问题在于提供一种人促甲状腺激素受体抗原试剂及促甲状腺激素受体抗体定量检测试剂盒,本发明提供的试剂盒稳定性较好,且不受生物素、荧光素等干扰。
[0007]
本发明提供了一种人促甲状腺激素受体抗体定量检测试剂盒,包括:包被有抗
tshr单克隆抗体a的固相载体;
[0008]
抗原试剂,所述抗原试剂为抗tshr单克隆抗体b和tshr的免疫复合物;
[0009]
含有标记物标记的人刺激性促甲状腺激素受体抗体;
[0010]
所述抗tshr单克隆抗体a与抗tshr单克隆抗体b不产生竞争性结合。
[0011]
本发明提供的试剂盒用于检测血清或血浆中促甲状腺激素受体抗体的浓度,其采用竞争法反应原理进行检测,原理如下:标记物标记的人刺激性促甲状腺激素受体抗体与人血浆或血清中trab竞争结合抗tshr单克隆抗体 b-tshr免疫复合物,再与包被有抗tshr单克隆抗体a的固相载体进行反应,通过免疫反应形成固相抗体-抗原-标记抗体复合物,该复合物催化发光底物液发光,发光强度与trab的浓度成反比,通过检测发光强度,从而获得待测血浆或血清中trab的浓度。
[0012]
本发明提供的试剂盒包括包被有抗tshr单克隆抗体a的固相载体,其中,抗tshr单克隆抗体a的识别位点位于tshr跨膜区和细胞内羧基末端,具体为tshr氨基酸序列的414~764位。所述抗tshr单克隆抗体a包括但不限于鼠源性单克隆抗体、兔单克隆抗体、羊单克隆抗体、人源性单克隆抗体和嵌合型单克隆抗体,优选为鼠源性单克隆抗体。
[0013]
在一个实施例中,所述固相载体选自氨基、羧基、醛基、苯肼基或磺酸基表面修饰的磁性微球,进一步地,所述磁性微球的内核为四氧化三铁或三氧化二铁。
[0014]
在一个实施例中,抗tshr单克隆抗体a和磁性微球的比例为5~25μ g/mg的磁性微球,优选为15μg/mg的磁性微球。
[0015]
在一个实施例中,所述包被有抗tshr单克隆抗体a的羧基磁性微球可以按照以下方法制备:
[0016]
将羧基磁性微球用edc和nhs在酸性条件下进行活化,活化缓冲液为 0.1m的mes(2-(n-吗啉代)乙磺酸)缓冲液,活化完成后,在磁场的作用下使羧基磁性微球与液体分开,弃去上清,加入适量的抗人tshr鼠单克隆抗体a,将所述包被有抗tshr单克隆抗体a的羧基磁性微球用含有1%牛血清白蛋白的0.01m的pbs缓冲液进行封闭,封闭结束后,加入封闭液以保存包被有抗tshr单克隆抗体a的羧基磁性微球,其磁性微球的最终浓度为1mg/ml,将该混悬液置于2~8℃保存以备使用。
[0017]
本发明提供的试剂盒还包括抗原试剂,所述抗原试剂为抗tshr单克隆抗体b和tshr的免疫复合物。其中,抗tshr单克隆抗体b的识别位点位于tshr跨膜区和细胞内羧基末端,具体为tshr氨基酸序列的661~764位,进一步的,抗tshr单克隆抗体b的识别位点位于tshr氨基酸序列的 665~698位。所述抗tshr单克隆抗体b包括但不限于鼠源性单克隆抗体、兔单克隆抗体、羊单克隆抗体、人源性单克隆抗体和嵌合型单克隆抗体,优选为鼠源性单克隆抗体。
[0018]
在一个实施例中,所述tshr包括但不限于天然人源tshr、天然猪源 tshr、重组表达的人源tshr或重组表达的猪源tshr。
[0019]
在一个实施例中,所述抗原试剂由抗tshr单克隆抗体b和tshr在冻干液中反应得到或者由抗tshr单克隆抗体b和tshr在冻干液中反应、冻干后得到,或者由tshr单克隆抗体b和tshr在冻干液中反应、冻干、复溶后得到。
[0020]
在一个实施例中,所述抗原试剂按照以下方法制备:
[0021]
将抗tshr单克隆抗体b和tshr在抗原冻干液中反应,冻干得到冻干粉;
[0022]
将所述冻干粉在复溶液中进行复溶,得到抗原试剂。
[0023]
将抗tshr单克隆抗体b和tshr在抗原冻干液中进行反应,所述反应的温度优选为20~25℃,时间为1~5h。抗tshr单克隆抗体b和tshr复合,冻干再复溶后使得tshr的稳定性得到极大提高。实验结果表明,复溶后的含有抗tshr单克隆抗体b和tshr免疫复合物的抗原可以在2~8℃下稳定 28天。
[0024]
在一个实施例中,抗tshr单克隆抗体b的浓度为1~10ug/ml,tshr 稀释的比例为1:10~1:100。
[0025]
在一个实施例中,所述抗原冻干液包括:缓冲液、1wt%-10wt%的甘露醇、 1wt%-10wt%的蔗糖、0.1wt%-1wt%的血清白蛋白和0.1wt%-1wt%的聚乙二醇。其中,缓冲液可以为bis-tris缓冲液,血清白蛋白可以为牛血清白蛋白,聚乙二醇为聚乙二醇5000。
[0026]
反应完毕后,将得到的产物进行冻干,得到冻干粉,本发明对所述冻干没有特殊限制,本领域技术人员熟知的冻干工艺即可。
[0027]
得到冻干粉后,将其在复溶液中复溶。在一个实施例中,所述复溶液包括:缓冲液和1wt%-5wt%的丙三醇。其中,缓冲液可以为bis-tris。
[0028]
在一个实施例中,所述抗原试剂按照以下方法制备:
[0029]
将抗tshr单克隆抗体b和tshr在抗原冻干液中混合反应,形成抗 tshr单克隆抗体b和tshr免疫复合物。
[0030]
抗tshr单克隆抗体b和tshr免疫复合物在20~25℃抗原冻干液中能够稳定128h,在2-8℃抗原冻干液中能够稳定168h。
[0031]
本发明提供的试剂盒还含有标记物标记的人刺激性促甲状腺激素受体抗体,所述标记物选自钌化合物、吖啶化合物、过氧化物酶或碱性磷酸酶,其标记方式可以是直接标记或间接标记。在一个实施例中,所述含有标记物标记的人刺激性促甲状腺激素受体抗体在包含血清白蛋白、防腐剂和缓冲液的溶液中保存待用。在一个实施例中,所述缓冲液为bis-tris缓冲液,血清白蛋白为牛血清白蛋白,含量为3wt~8wt%,优选为5wt%;防腐剂为pc300,含量为0.1wt~5wt%,优选为0.5wt~4wt%。
[0032]
本发明提供的试剂盒还包括样本稀释液和/或刺激性促甲状腺激素受体抗体系列校准品。
[0033]
在一个实施例中,所述样本稀释液包括血清白蛋白、防腐剂和缓冲液。在一个实施例中,所述缓冲液为bis-tris缓冲液,血清白蛋白为牛血清白蛋白,含量为1wt~3wt%;防腐剂为pc300,含量为0.1wt~0.3wt%。
[0034]
在一个实施例中,所述刺激性促甲状腺激素受体抗体系列校准品为浓度 0~100iu/l的系列校准品。在一个实施例中,所述校准品浓度分别是为0iu/l、 2iu/l、5iu/l、10iu/l、20iu/l、50iu/l。
[0035]
本发明提供的试剂盒采用竞争法实现对血清或血浆中促甲状腺激素受体抗体的浓度,原理如下:标记物标记的人刺激性促甲状腺激素受体抗体与人血浆或血清中trab竞争结合抗tshr单克隆抗体b-tshr免疫复合物,再与包被有抗tshr单克隆抗体a的固相载体进行反应,通过免疫反应形成固相抗体-抗原-标记抗体复合物,该复合物催化发光底物液发光,发光强度与 trab的浓度成反比;采用系列刺激性促甲状腺激素受体抗体系列校准品建立定标曲线,再检测待测品的发光强度,根据待测品的发光强度和定标曲线获得待测血
浆或血清中trab的浓度。
[0036]
本发明提供的试剂盒使用方法如下:
[0037]
将待测品或校准品、抗原试剂和样本稀释液混合后、温育,温育温度为 37℃,时间为17min;
[0038]
然后加入包被有抗tshr单克隆抗体a的固相载体和含有标记物标记的人刺激性促甲状腺激素受体抗体,混合均匀后,继续温育,温育温度为37℃,时间为15min;
[0039]
加入发光底物,检测光信号强度;
[0040]
通过校准品反应曲线,根据样本检测光强度计算出待测样本中trab的浓度。
[0041]
本发明以一组抗tshr单克隆抗体a和抗tshr单克隆抗体b构建定量检测试剂盒,其中,抗tshr单克隆抗体b与tshr形成免疫复合物,能够提高tshr的稳定性,从而使得到的试剂盒具有良好的稳定性,实验结果表明,本发明提供的试剂盒,抗tshr单克隆抗体b与tshr免疫复合物在 20~25℃的冻干液中稳定128h,在2-8℃的冻干液中稳定168h,抗原试剂复溶后能够在2~8℃条件下稳定28天。
[0042]
本发明提供的人促甲状腺激素受体抗体定量检测试剂盒包括:包被有抗 tshr单克隆抗体a的固相载体;抗原试剂,所述抗原试剂为抗tshr单克隆抗体b和tshr的免疫复合物;含有标记物标记的人刺激性促甲状腺激素受体抗体。本发明提供的试剂盒采用竞争法反应原理检测血清或血浆中促甲状腺激素受体抗体的浓度,与采用固相包被亲和素、生物素标记抗tshr抗体(生物素-亲和素系统)或固相包被抗异硫氰酸荧光素(fitc)抗体、fitc 标记抗tshr抗体(fitc-抗fitc系统)的商品化试剂盒相比,本发明不仅减少了标记步骤,还能够避免生物素用药患者血浆或血清标本中生物素对生物素-亲和素系统的干扰或经荧光素眼底血管造影术的患者血浆或血清标本中荧光素钠对fitc-抗fitc系统的干扰,制备工艺更简单稳定,重复性良好,在提高产品性能的同时,大大降低了成本。
附图说明
[0043]
图1是本发明实施例1提供的定标曲线;
[0044]
图2是本发明实施例及比较例提供的抗原试剂在冻干液中20~25℃下的稳定性评价结果;
[0045]
图3是本发明实施例及比较例提供的抗原试剂在冻干液中2~8℃下的稳定性评价结果;
[0046]
图4是本发明实施例及比较例提供的抗原试剂在复溶后在2~8℃下的稳定性评价结果;
[0047]
图5是本发明实施例提供的试剂盒与其他试剂盒检测结果的相关性曲线图。
具体实施方式
[0048]
以下结合实施例对本发明提供的促甲状腺激素受体抗原试剂及促甲状腺激素受体抗体定量检测试剂盒进行进一步说明。
[0049]
如无特殊说明,本发明所用的试剂和仪器均为市售产品,本发明采用的试验方法为本领域的常规方法。
[0050]
本发明的试剂盒中未详细提及的试剂组分(例如清洗液等一些必要的缓冲液等)、
试剂盒外包装以及各试剂组分的独立包装容器等均可以按照所属领域的常规操作进行,符合相关行业规定即可。本发明试剂盒的方法中未详细提及的操作步骤也可参照所属领域的常规操作进行。
[0051]
以下各实施例中,抗tshr单克隆抗体b按照以下方法制备:
[0052]
(1)化学合成:将tshr氨基酸序列的665-698位序列片段 pgdkdtkiakrmavliftdficmapisfyalsai作为抗原进行化学合成,通过巯基偶联到klh(keyhole limpet hemocyanin)上作为免疫原,通过巯基偶联到bsa上作为筛选原。
[0053]
(2)免疫:将纯化好的蛋白稀释到适当浓度,与弗氏完全佐剂1:1混合,经乳化后通过皮下注射给6周龄大小的balb/c雌性小鼠。两周后,将等量的蛋白与弗氏不完全佐剂进行等比混合,乳化后进行第二次小鼠免疫。自此之后每隔两周,重复免疫一次。直至细胞融合前3-4天,进行一次加强免疫。
[0054]
(3)细胞融合、亚克隆和腹水制备:此后,对小鼠进行颈托安乐死之后无菌取出脾脏与小鼠骨髓瘤系ns-1细胞进行细胞融合,将融合后的细胞经有限稀释法进行多次亚克隆培养后,经elisa筛选出抗体水平较高的细胞株进行后续的腹水制备工作。
[0055]
(4)抗体纯化:将抗体进行spa亲和层析纯化。
[0056]
实施例1
[0057]
一种人促甲状腺激素受体抗体定量检测试剂盒,包括:包被有抗人tshr 鼠单克隆抗体a的磁微粒、抗原试剂(抗人tshr鼠单克隆抗体b-重组人 tshr复合物)、样本稀释液、辣根过氧化物酶标记的人刺激性促甲状腺激素受体抗体和刺激性促甲状腺素受体抗体系列校准品,其制备过程如下:
[0058]
(1)包被抗人tshr鼠单克隆抗体a的磁微粒混悬液的制备:
[0059]
将羧基磁性微球用edc和nhs在酸性条件下进行活化,活化缓冲液为 0.1m的mes(2-(n-吗啉代)乙磺酸)缓冲液,活化时间为30min,活化完成后,在磁场的作用下使羧基磁性微球与液体分开,弃去上清,加入适量的抗人tshr鼠单克隆抗体a,将所述包被有抗人tshr单克隆抗体a的羧基磁性微球用含有1%牛血清白蛋白的0.01m的pbs缓冲液进行封闭,封闭结束后,加入封闭液以保存包被有抗tshr单克隆抗体a的羧基磁性微球,其磁性微球的最终浓度为1mg/ml,将该混悬液置于2~8℃保存以备使用。
[0060]
(2)抗原试剂的配制:将5μg/ml的抗人tshr鼠单克隆抗体b与1/20 稀释比例的重组人tshr在特定的抗原冻干液中于20~25℃条件下搅拌反应 3h,制成冻干品,用特定复溶液复溶;取0.05mol/l的bis-tris缓冲液、5wt%甘露醇、5wt%蔗糖、0.5wt%牛血清白蛋白、0.2wt%peg5000配制冻干液;取 0.05mol/l的bis-tris缓冲液、含有2wt%的丙三醇配制特定复溶液复溶;
[0061]
(3)样本稀释液的制备:bis-tris缓冲液中包含有3%牛血清白蛋白和 0.2%pc300,然后混合均匀,2~8℃保存待用;
[0062]
(4)辣根过氧化物酶标记的人刺激性促甲状腺激素受体抗体的制备方法为:将辣根过氧化物酶标记的人刺激性促甲状腺激素受体抗体加入到含有5%牛血清白蛋白和3%pc300的bis-tris缓冲液,然后混合均匀;其辣根过氧化物酶标记的人刺激性促甲状腺激素受体抗体的稀释比例为1/1000~1/5000; 2~8℃保存待用;
[0063]
(5)刺激性促甲状腺素受体抗体系列校准品为浓度0~100iu/l的系列校准品,所
述校准品的制备方法为:向bis-tris缓冲液中添加5%的牛血清白蛋白,混合均匀后得校准品稀释液,然后用该校准品稀释液将刺激性促甲状腺素受体抗体稀释成六个浓度点s0~s5,浓度分别是为0iu/l、2iu/l、5iu/l、 10iu/l、20iu/l、50iu/l。
[0064]
该试剂盒在全自动化学发光仪a2000plus上的检测步骤:
[0065]
(1)准备测试样本(校准品或待测样本)并正确放置后,点击启动按钮进行定标程序或样本检测程序,仪器将执行以下操作;
[0066]
(2)将样本架传送到吸样位,将反应容器加载到加样位;
[0067]
(3)执行定标程序时,完成100μl校准品、20μl抗原试剂、50μl样本稀释液的分注;
[0068]
(4)执行样本检测程序时,完成100μl样本、20μl抗原试剂、50μl样本稀释液的分注;
[0069]
(5)对反应液进行混匀、温育,温育温度为37℃,温育时间为17分钟;
[0070]
(6)完成20μl包被抗人tshr鼠单克隆抗体a的磁微粒混悬液、50μl 辣根过氧化物酶标记的人刺激性促甲状腺激素受体抗体的分注;
[0071]
(7)对反应液进行混匀、温育,温育温度为37℃,温育时间为15分钟;
[0072]
(8)温育完成后,使用清洗液对反应液进行清洗分离;
[0073]
(9)完成50μl底物a液和50μl底物b液的分注;
[0074]
(10)对反应液进行混匀,检测发光强度;
[0075]
以校准品浓度值为x轴,以校准品发光强度对数值为y轴,建立定标曲线,根据待测样品的发光强度值回算相应的浓度值,其中,定标曲线见图1,图1是本发明实施例提供的定标曲线。
[0076]
对比例1
[0077]
与实施例1相比,区别在于,抗原试剂未采用抗人tshr鼠单克隆抗体b 复合,直接将重组人tshr冻干后复溶。
[0078]
实施例2稳定性评估
[0079]
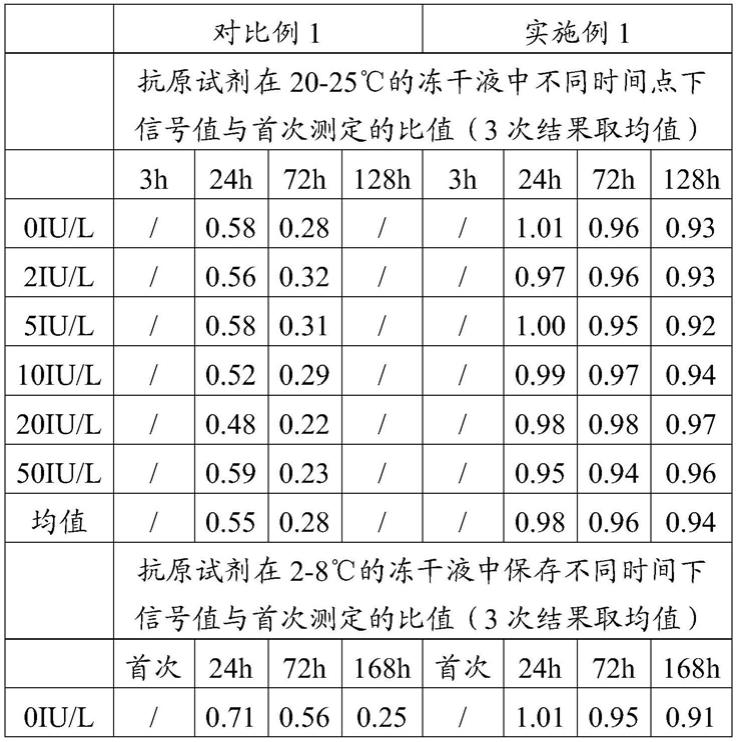
稳定性评估方法:分别采用对比例1和实施例1提供的试剂盒平行检测含有一系列用校准品稀释液稀释得到的刺激性促甲状腺素受体抗体浓度0iu/l、2iu/l、5iu/l、10iu/l、20iu/l、50iu/l的校准品,在全自动化学发光仪a2000 plus系统上按照检测步骤进行测定,得到各组的发光值,以信号值降幅≤10%视为稳定性较好,结果参见表1、图2、图3和图4,表1为本发明实施例及比较例提供的试剂盒的稳定性评价结果,图2是本发明实施例及比较例提供的抗原试剂在冻干液中20~25℃下的稳定性评价结果,其中曲线 a是实施例1提供的抗原试剂的稳定性评价结果,曲线b是对比例1提供的抗原试剂的稳定性评价结果,图3是本发明实施例及比较例提供的抗原试剂在冻干液中2~8℃下的稳定性评价结果,其中曲线a是实施例1提供的抗原试剂的稳定性评价结果,曲线b是对比例1提供的抗原试剂的稳定性评价结果,图4是本发明实施例及比较例提供的抗原试剂在复溶后在2~8℃下的稳定性评价结果,其中曲线a是实施例1提供的抗原试剂的稳定性评价结果,曲线b 是对比例1提供的抗原试剂的稳定性评价结果。
[0080]
表1本发明实施例及比较例提供的试剂盒的稳定性评价结果
[0081]
[0082][0083]
注:/表示无。
[0084]
由表1、图2、图3和图4可知,本发明提供的试剂盒中,抗tshr鼠单克隆抗体b-人tshr免疫复合物在20~25℃的冻干液中稳定128h,在2~8℃的冻干液中稳定168h,同时抗原试剂复溶后稳定性满足2~8℃28天。
[0085]
实施例3试剂盒比对
[0086]
按照实施例1构建的人促甲状腺激素受体抗体定量检测试剂盒与试剂盒c:促甲状腺激素受体抗体定量检测试剂盒(电化学发光法)、试剂盒d:人促甲状腺激素受体抗体检测试剂盒(酶促化学发光法)进行临床样本的检测比对,同时对这三种检测定量试剂盒的重复性和干扰进行分析和比较。
[0087]
试剂盒c的检测原理为:竞争法,用链霉亲和素包被磁粒,通过可溶性猪tshr和生物素化抗猪tshr c-端鼠单克隆抗体免疫复合体以及钌复合物标记的人单克隆自身抗体m22进行测定;
[0088]
试剂盒d的的检测原理为:竞争法,用fitc抗体包被磁微粒,fitc标记的抗人tshr鼠单克隆抗体-人tshr免疫复合物制备抗原试剂,辣根过氧化物酶标记的trab与样本中的trab共同竞争抗原试剂中的人tshr免疫复合物;
[0089]
检测方法:采用本发明试剂盒、试剂盒c和试剂盒d平行考核梯度血清样本193例,其中阴性样本103份,浓度范围为0.8~40iu/l,检测结果进行临床相关性分析,相关性如图
5所示,图5是本发明实施例提供的试剂盒与其他试剂盒检测结果的相关性曲线图,其中图5(a)是与试剂盒c的相关性曲线图,图5(b)是与试剂盒d的相关性曲线图。
[0090]
由图5可知,将本发明试剂盒与试剂盒c、试剂盒d同时对193份临床血清样本进行测定,本发明试剂盒与二者测定结果的相关性较好,相关系数 r2为0.958-0.997之间。
[0091]
实施例4重复性考核
[0092]
考核方式:选取低、高(1.83iu/l;24.37iu/l)两个浓度水平的患者样本,采用实施例1提供的试剂盒和方法以及试剂盒d及其方法进行检测,每个样本连续重复测定20次,计算出均值(av),标准差(sd)和变异系数(cv),结果参见表2,表2为本发明实施例1提供的试剂盒的重复性考核结果:
[0093]
表2本发明实施例1提供的试剂盒的重复性考核结果
[0094][0095]
结果表明,与同类产品相比,本发明试剂盒的重复性较好。
[0096]
实施例5干扰考核:
[0097]
选取低、高(3.58iu/l;20.13iu/l)两个浓度水平的患者样本,向其中加入10ng/ml的生物素,分别采用试剂盒c和实施例1提供的试剂盒进行检测;向其中加入0.5μg/ml的荧光素钠,分别采用试剂盒d和实施例1提供的试剂盒进行检测,结果参见表3,表3为本发明实施例和比较例提供的试剂盒的干扰试验考核结果。
[0098]
表3本发明实施例和比较例提供的试剂盒的干扰试验考核结果
[0099][0100]
试剂盒c的trab检测试剂盒说明书中声称,当标本中生物素浓度>41nmol/l或10ng/ml时,测定结果会偏高;试剂盒d的trab检测试剂盒说明书中声称,当样本中荧光素浓度超过0.5ug/ml时,可导致检测结果变化超过10%;而用本发明试剂盒检测添加10ng/ml的生物素或0.5ug/ml的荧光素钠的样本时,检测结果不受影响(结果变化在
±
10%以内),上述结果表明本发明可避免生物素-亲和素系统或fitc-抗fitc系统引入的相关干扰,提升了试剂盒的抗干扰性能。
[0101]
实施例6
[0102]
一种人促甲状腺激素受体抗体定量检测试剂盒,包括包被有抗猪tshr 鼠单克隆抗体a的磁微粒、抗原试剂(抗猪tshr鼠单克隆抗体b-重组猪 tshr)、碱性磷酸酶标记的人刺激性促甲状腺激素受体抗体和刺激性促甲状腺素受体抗体系列校准品,其制备过程如下:
[0103]
(1)包被抗猪tshr鼠单克隆抗体a的磁微粒混悬液的制备:将羧基磁性微球用edc
和nhs在酸性条件下进行活化,活化缓冲液为0.1m的mes (2-(n-吗啉代)乙磺酸)缓冲液,活化时间为30min,活化完成后,在磁场的作用下使羧基磁性微球与液体分开,弃去上清,加入适量的抗猪tshr鼠单克隆抗体a,将所述包被有抗人tshr单克隆抗体a的羧基磁性微球用含有1%牛血清白蛋白的0.01m的pbs缓冲液进行封闭,封闭结束后,加入封闭液以保存包被有抗tshr单克隆抗体a的羧基磁性微球,其磁性微球的最终浓度为1mg/ml,将该混悬液置于2~8℃保存以备使用。
[0104]
(3)抗原试剂的配制:将5ug/ml的抗猪tshr鼠单克隆抗体b与1/30 稀释比例的重组猪tshr在特定的抗原冻干液中于20~25℃条件下搅拌反应 3h,制成冻干品,用特定复溶液复溶;取0.05mol/l的bis-tris缓冲液、5wt%甘露醇、5wt%蔗糖、0.5wt%牛血清白蛋白、0.2wt%peg5000配制冻干液;取 0.05mol/l的bis-tris缓冲液、含有2wt%的丙三醇配制特定复溶液复溶;
[0105]
(3)样本稀释液的制备:bis-tris缓冲液中包含有1-3%牛血清白蛋白和和0.1-0.3%pc300,然后混合均匀,2~8℃保存待用;
[0106]
(4)碱性磷酸酶标记的人刺激性促甲状腺激素受体抗体的制备方法为:将碱性酶标记的人刺激性促甲状腺激素受体抗体加入到含有5%牛血清白蛋白和0.1-5%pc300的bis-tris缓冲液,然后混合均匀,2~8℃保存待用;
[0107]
(5)刺激性促甲状腺素受体抗体系列校准品为浓度0~100iu/l的系列校准品,所述校准品的制备方法为:向bis-tris缓冲液中添加5%的牛血清白蛋白,混合均匀后得校准品稀释液,然后用该校准品稀释液将刺激性促甲状腺素受体抗体稀释成六个浓度点s0-s5,浓度分别是为0iu/l、2iu/l、5iu/l、 10iu/l、20iu/l、50iu/l;
[0108]
稳定性考核:
[0109]
稳定性评估方法:采用实施例6提供的试剂盒平行检测含有一系列用校准品稀释液稀释得到的刺激性促甲状腺素受体抗体浓度0iu/l、2iu/l、5iu/l、 10iu/l、20iu/l、50iu/l的校准品,在全自动化学发光仪a2000 plus系统上按照检测步骤进行测定,得到各组的发光值。以信号值降幅≤10%视为稳定性较好,结果参见表4,表4为本发明实施例6提供的试剂盒的稳定性评价结果。
[0110]
表4本发明实施例6提供的试剂盒的稳定性评价结果
[0111]
[0112][0113]
注:/表示无。
[0114]
由表4可知,实施例6提供的试剂盒较为稳定。
[0115]
干扰考核:
[0116]
选取低、高(3.58iu/l;20.13iu/l)两个浓度水平的患者样本,向其中加入10ng/ml的生物素,分别采用试剂盒c和实施例6提供的试剂盒进行检测;向其中加入0.5μg/ml的荧光素钠,分别采用试剂盒d和实施例6提供的试剂盒进行检测,结果参见表5,表5为本发明实施例6和比较例提供的试剂盒的干扰试验考核结果。
[0117]
表5本发明实施例6和比较例提供的试剂盒的干扰试验考核结果
[0118][0119]
由表5可知,本发明试剂盒检测添加10ng/ml的生物素或0.5ug/ml的荧光素钠的样本时,检测结果不受影响(结果变化在
±
10%以内),上述结果表明本发明可避免生物素-亲和素系统或fitc-抗fitc系统引入的相关干扰,提升了试剂盒的抗干扰性能。
[0120]
实施例7
[0121]
一种人促甲状腺激素受体抗体定量检测试剂盒,包括包被有抗猪tshr 鼠单克隆抗体a的磁微粒、抗原试剂(抗猪tshr鼠单克隆抗体b-天然猪 tshr)、样本稀释液、吖啶酯标记的人刺激性促甲状腺激素受体抗体和刺激性促甲状腺素受体抗体系列校准品,其制备过程如下:
[0122]
(1)包被抗猪tshr鼠单克隆抗体a的磁微粒混悬液的制备:将羧基磁性微球用edc和nhs在酸性条件下进行活化,活化缓冲液为0.1m的mes (2-(n-吗啉代)乙磺酸)缓冲液,活化时间为30min,活化完成后,在磁场的作用下使羧基磁性微球与液体分开,弃去上清,加入适量的抗猪tshr鼠单克隆抗体a,将所述包被有抗人tshr单克隆抗体a的羧基磁性微球用含有1%牛血清白蛋白的0.01m的pbs缓冲液进行封闭,封闭结束后,加入封闭液以保存包被有抗tshr单克隆抗体a的羧基磁性微球,其磁性微球的最终浓度为1mg/ml,将该混悬液置于2~8℃保存以备使用。
[0123]
(2)抗原试剂的配制:将5ug/ml的抗猪tshr鼠单克隆抗体b与1/10稀释比例的天然猪tshr在特定的抗原冻干液中于20-25℃条件下搅拌反应3h,制成冻干品,用特定复溶液复溶;取0.05mol/l的bis-tris缓冲液、5wt%甘露醇、5wt%蔗糖、0.5wt%牛血清白蛋白、0.2wt%peg5000配制冻干液;取 0.05mol/l的bis-tris缓冲液、含有2wt%的丙三醇配制特定复溶液复溶;
[0124]
(3)样本稀释液的制备:bis-tris缓冲液中包含有1-3%牛血清白蛋白和和0.1-0.3%pc300,然后混合均匀,2~8℃保存待用;
[0125]
(4)标记物标记的人刺激性促甲状腺激素受体抗体的制备方法为:将吖啶酯标记的人刺激性促甲状腺激素受体抗体加入到含有5%牛血清白蛋白和 0.1-5%pc300的bis-tris缓冲液,然后混合均匀,2~8℃保存待用;
[0126]
(5)刺激性促甲状腺素受体抗体系列校准品为浓度0~100iu/l的系列校准品,所述校准品的制备方法为:向bis-tris缓冲液中添加5%的牛血清白蛋白,混合均匀后得校准品稀释液,然后用该校准品稀释液将刺激性促甲状腺素受体抗体稀释成六个浓度点s0-s5,浓度分别是为0iu/l、2iu/l、5iu/l、 10iu/l、20iu/l、50iu/l。
[0127]
稳定性考核:
[0128]
稳定性评估方法:利用实施例7制备的试剂盒平行检测含有一系列用校准品稀释液稀释得到的刺激性促甲状腺素受体抗体浓度0iu/l、2iu/l、5iu/l、 10iu/l、20iu/l、50iu/l的校准品,在全自动化学发光仪a2000 plus系统上按照检测步骤进行测定,得到各组的发光值。以信号值降幅≤10%视为稳定性较好,结果参见表6,表6为本发明实施例7提供的试剂盒的稳定性评价结果。
[0129]
表6本发明实施例7提供的试剂盒的稳定性评价结果
[0130]
[0131][0132]
注:/表示无。
[0133]
由表6可知,实施例7提供的试剂盒较为稳定。
[0134]
干扰考核:
[0135]
选取低、高(3.58iu/l;20.13iu/l)两个浓度水平的患者样本,向其中加入10ng/ml的生物素,分别采用试剂盒c和实施例7提供的试剂盒进行检测;向其中加入0.5μg/ml的荧光素钠,分别采用试剂盒d和实施例7提供的试剂盒进行检测,结果参见表7,表7为本发明实施例7和比较例提供的试剂盒的干扰试验考核结果。
[0136]
表7本发明实施例7和比较例提供的试剂盒的干扰试验考核结果
[0137][0138]
由表7可知,用本发明试剂盒检测添加10ng/ml的生物素或0.5ug/ml的荧光素钠的样本时,检测结果不受影响(结果变化在
±
10%以内),上述结果表明本发明可避免生物素-亲和素系统或fitc-抗fitc系统引入的相关干扰,提升了试剂盒的抗干扰性能。
[0139]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1