一种同步测定细菌多糖中多糖和磷含量的定量核磁方法与流程
1.本发明涉及一种同步测定细菌多糖中多糖和磷含量的定量核磁方法,属于医药工程技术领域。
背景技术:
2.细菌性感染引起的肺炎和脑膜炎是威胁婴幼儿生命健康的严重疾病,流感嗜血杆菌(haemophilus influenzae)和肺炎链球菌(streptococcus pneumoniae)是引起相关疾病的主要致病菌。根据产生荚膜的情况,流感嗜血杆菌可分为产荚膜的6种血清型(a-f型)菌株和不产荚膜的不可分型菌株,而侵袭性感染主要由产荚膜的菌株引起。b型流感嗜血杆菌(hib)是最主要的致病亚型,其引起的脑膜炎致死率高达5-10%,且约30%治愈者存在中枢神经系统缺陷。根据产生荚膜的情况,肺炎链球菌可分为97种血清型菌株,其中1,2,3,4,5,6a,6b,7f,8,9n,9v,10a,11a,12f,14,15b,17f,18c,19a,19f,20,22f,23f和33f这24种血清型涵盖引起婴幼儿重症肺炎的90%以上临床病例。
3.hib和肺炎链球菌的耐药性不断提高,使其成为重要的公共卫生问题,促使了疫苗的开发和应用。荚膜多糖(capsular polysaccharide,cps)作为细胞表面的主要组分,具有高度的结构特异性和免疫原性,广泛应用于疫苗开发。全球已上市的hib疫苗包括各种单联疫苗和多联疫苗,均采用该荚膜多糖作为半抗原,与载体蛋白结合制备hib多糖结合疫苗。目前,我国上市的hib疫苗包括单联疫苗和多联疫苗,其中单联疫苗主要由北京民海生物、沃森生物、赛诺菲、兰州所、智飞生物和成都欧林等生产,而多联疫苗分为赛诺菲的百白破脊灰-hib五联疫苗、北京民海生物的百白破-hib四联疫苗。值得注意的是,自上世纪90年代hib多糖结合疫苗上市,hib引起的侵袭性感染疾病得到了有效的控制。目前,我国上市的肺炎链球菌多糖疫苗包括美国辉瑞13价肺炎链球菌多糖结合疫苗(沛儿13),云南沃森和北京民海生物的23价肺炎链球菌多糖疫苗和13价肺炎链球菌多糖结合疫苗。2020年,美国辉瑞肺炎疫苗沛儿13的销售额为58.3亿美元,是全球最畅销的疫苗品种,被称为“疫苗之王”。
4.多种致病菌多糖含有磷酸酯,如b型流感嗜血杆菌、6a、6b、10a、11a、17f、18c、19a、19f、20、23f型肺炎链球菌的荚膜多糖。作为疫苗生产过程中的重要环节,细菌多糖的品质控制需开展多个理化指标的检定,包括多糖含量和磷含量的测定。目前,实际生产中采用化学法测定上述两个理化指标,而新方法的开发将有助于简化实验流程、提高疫苗生产效率。近年来,定量核磁共振法(quantitative nuclear magnetic resonance,qnmr)作为一种灵活的分析工具(王桂芳等,化学学报,2012,70,2005),已被用于开发细菌多糖品质控制的新方法,比如qiuwei xu等以二甲基亚砜为内标物,建立了可测定hib疫苗生产中荚膜多糖衍生物含量的定量1h-nmr法(q.xu et al.,anal.biochem.2005,337,235)。许美凤等以二甲基砜为内标物建立定量1h-nmr法进行hib荚膜多糖中核糖含量测定,该方法具有良好的专属性、准确度和精密度(许美凤等,中国生物制品学杂志,2019,32,1010)。普元倩等以3-(三甲基硅基)氘代丙酸钠为内标物,发展了用于hib荚膜多糖中核糖含量测定的定量1h-nmr法(普元倩等,中国生物制品学杂志,2014,27,1081)。此外,该课题组进一步以六甲基磷酰三
胺(hexamethylphosphoramide,hmpa)为内标物,通过nmr参数优化发展的
31
p-nmr可用于hib荚膜多糖中磷含量的测定(普元倩等,生物技术通讯,2018,29,825)。许美凤等以二甲基砜为内标物,建立了一种测定6b,10a,17f,19a,19f及20型肺炎链球菌荚膜多糖含量的定量1h-nmr法(许美凤等,中国新药杂志,2020,29,2481)。这些已报道的定量nmr法测定细菌多糖产品中多糖和磷含量依赖于不同内标物的使用,需配制两种不同的核磁检测液,降低了样品测定效率。
技术实现要素:
5.本发明要解决的技术问题是定量nmr方法可以同步准确测定细菌多糖产品中多糖和磷含量。为了解决上述问题,本发明开发基于单一内标物质的定量1h-和
31
p-nmr法同步测定细菌多糖产品中多糖和磷含量的新方法,将可以减少核磁检测液配制的工作量,提高疫苗生产效率。此外,具有大分子量的多糖溶液浓度影响着检测液的粘度,对定量nmr谱图采集效果的影响尚未明确,探究多糖浓度对定量1h-nmr和
31
p-nmr法测定细菌多糖中多糖和磷含量的影响,将有助于提高定量nmr法的准确性和稳定性。
6.本发明涉及可用于细菌多糖生物制品质量控制中多糖和磷含量同步测定的定量核磁共振方法。该定量nmr法的内标物同时含有氢原子和磷原子的化合物,且其1h-和
31
p-nmr的特征峰与细菌多糖的特征峰完全分离,且结构与性质稳定,不与溶剂、样品等反应。定量1h-和
31
p-nmr参数可确保多糖和内标物定量峰的积分值具有良好的准确度和精密度。定量nmr法所用公式计算得到的多糖和磷含量值的单位与中国药典中规定的单位一致。多糖检测液浓度可实现定量nmr谱中定量峰具有良好的信号强度和峰面积准确度。综上,本发明要达到的目标为发展一种单一内标1h-和
31
p-nmr同步测定细菌多糖产品中多糖和磷含量的方法,并证明其测定结果的准确度可以与传统化学法一致,提高细菌多糖结合疫苗品质控制的效率。
7.本发明提供了一种同步测定细菌多糖中多糖和磷含量的定量核磁方法,利用六甲基磷酰三胺作为单一内标,包括如下过程:
8.(1)以六甲基磷酰三胺作为单一内标物,溶于氘代水中配制得到内标溶液;
9.(2)将细菌多糖样品加入到内标溶液中,获得检测样液(供试品);
10.(3)将检测样液装入核磁管中测得1h-nmr图谱、
31
p-nmr图谱;然后通过细菌多糖的1h-nmr特征峰与内标物的1h-nmr特征峰进行关联换算,测得细菌多糖中多糖含量;同时,通过细菌多糖的
31
p-nmr特征峰的积分相应与内标物的
31
p-nmr特征峰的积分进行关联换算,测得细菌多糖中磷含量。
11.在本发明的一种实施方式中,内标溶液的浓度为0.5-5mg/ml。
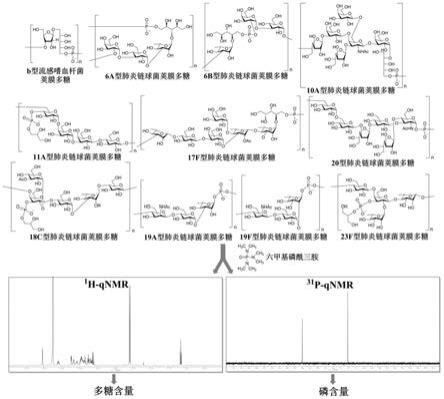
12.在本发明的一种实施方式中,细菌多糖包括b型流感嗜血杆菌荚膜多糖、6a型肺炎链球菌荚膜多糖、6b型肺炎链球菌荚膜多糖、10a型肺炎链球菌荚膜多糖、11a型肺炎链球菌荚膜多糖、17f型肺炎链球菌荚膜多糖、18c型肺炎链球菌荚膜多糖、19a型肺炎链球菌荚膜多糖、19f型肺炎链球菌荚膜多糖、20型肺炎链球菌荚膜多糖、23f型肺炎链球菌荚膜多糖型肺炎链球菌荚膜多糖,以及上述多糖的降解物。
13.在本发明的一种实施方式中,多种细菌多糖的结构如下所示:
[0014][0015]
其中,各物质中的n分别独立选自5-100之间的整数。
[0016]
在本发明的一种实施方式中,内标物六甲基磷酰三胺的1h-nmr定量特征峰可以为6个甲基h,化学位移为2.58ppm和2.60ppm,固定积分范围为2.65-2.53ppm。
[0017]
在本发明的一种实施方式中,细菌多糖为b型流感嗜血杆菌荚膜多糖时,1h-nmr定量特征峰为核糖2-h,化学位移为4.23ppm,固定积分范围为4.27-4.20ppm。
[0018]
在本发明的一种实施方式中,细菌多糖为6a型肺炎链球菌荚膜多糖时,1h-nmr定量特征峰为半乳糖1-h,化学位移为5.64ppm,固定积分范围为5.74-5.56ppm。
[0019]
在本发明的一种实施方式中,细菌多糖为6b型肺炎链球菌荚膜多糖时,1h-nmr定量特征峰为半乳糖1-h,化学位移为5.64ppm,固定积分范围为5.74-5.56ppm。
[0020]
在本发明的一种实施方式中,细菌多糖为18c型肺炎链球菌荚膜多糖时,1h-nmr定量特征峰为鼠李糖6号位甲基,化学位移为1.37ppm,固定积分范围为1.70-0.90ppm。
[0021]
在本发明的一种实施方式中,细菌多糖为19a型肺炎链球菌荚膜多糖时,1h-nmr定量特征峰为鼠李糖1-h,化学位移为5.46ppm,固定积分范围为5.52-5.38ppm。
[0022]
在本发明的一种实施方式中,细菌多糖为19f型肺炎链球菌荚膜多糖时,1h-nmr定量特征峰为鼠李糖1-h,化学位移为5.52ppm,固定积分范围为5.68-5.38ppm。
[0023]
在本发明的一种实施方式中,细菌多糖为23f型肺炎链球菌荚膜多糖时,1h-nmr定量特征峰为两个鼠李糖6号位甲基,化学位移为1.28ppm和1.37ppm,固定积分范围为1.65-1.00ppm。
[0024]
在本发明的一种实施方式中,细菌多糖的
31
p-nmr定量特征峰化学位移为0.17ppm,固定积分范围为0.33-0.02ppm。
[0025]
在本发明的一种实施方式中,内标物的
31
p-nmr定量特征峰化学位移为29.93ppm,固定积分范围为30.10-29.77ppm。
[0026]
在本发明的一种实施方式中,供试品多糖含量可以按照如下公式计算,以b型流感嗜血杆菌荚膜多糖(以重复结构单元质量346.23计)为例得到换算系数:
[0027][0028]
式中,ps表示细菌多糖;is表示内标物;w%
ps
表示多糖含量;i表示定量峰积分值;n表示定量峰所含质子数;c表示检测液质量浓度,单位为mg/ml;m表示摩尔质量;w%
is
表示内标物六甲基磷酰三胺的纯度。
[0029]
在本发明的一种实施方式中,供试品磷含量按照如下公式计算:
[0030][0031]
式中,ps表示细菌多糖;s表示多糖样品中的磷;is表示内标物;w
p
表示多糖样品中磷的含量,单位为mg/g;i表示定量峰积分值;n表示定量峰中磷原子数量;m表示摩尔质量;c表示检测液质量浓度,单位为mg/ml;w%
is
表示内标物的纯度。
[0032]
在本发明的一种实施方式中,一种同步测定细菌多糖中多糖和磷含量的定量核磁方法(图1)具体包括以下步骤:1)六甲基磷酰三胺内标溶液的配制;2)多糖供试液的配制;3)将多糖供试液加入核磁管;4)核磁共振氢谱和磷谱参数的设置;5)1h-nmr定量峰的选择和积分;6)
31
p-nmr定量峰的选择和积分;7)多糖含量的计算;8)磷含量的计算。
[0033]
本发明中细菌多糖供试液的配制中,将多糖样品完全溶解于内标溶液,多糖供试品浓度可以为5-40mg/ml。进一步优选15-20mg/ml。
[0034]
本发明中将多糖供试液加入核磁管中时,可以量取多糖供试液0.5-1.0ml加入核磁管中,可以超声处理3-10分钟排除气泡,超声温度可以为22-26℃。
[0035]
本发明中1h-nmr参数可以为采用脉冲程序zg,脉冲角为30-60度,实验绝对温度控制为294-303k,采样谱宽为9000hz,中心频率位于δ
h 3.5,采样点数为64k,线宽因子为0.3hz,采样时间为3.6s,空扫次数为2次,采样次数大于或等于8次,脉冲延迟时间设定大于或等于10s,预扫描延迟设定为5-8μs。
[0036]
本发明中
31
p-nmr参数可以为采用脉冲程序zgpg,脉冲角为30-60度,实验绝对温度控制为294-303k,采样谱宽为64100hz,中心频率位于δ-8100,采样点数为64k,线宽因子为1hz,采样时间为0.5s,采样次数大于或等于8次,空扫次数为4次,脉冲延迟时间设定大于或等于2s,预扫描延迟设定为5-8μs。
[0037]
有益效果:
[0038]
本发明同步测定细菌多糖中多糖和磷含量的定量核磁方法以六甲基磷酰三胺作为定量1h-和
31
p-nmr法内标物,检测液多糖浓度为5-40mg/ml。通过测量定量峰积分值,根据内标物质量,实现了供试品中多糖和磷含量的快速、准确测定。本方法测定的多糖和磷含量,其准确度与传统化学法一致。本发明“一内标双定量”nmr法在检测含量的同时可鉴定多糖结构,操作简单,成本低,测试准确,无需对比品和制作标准曲线,测试时间短,样品可完整回收,将提高细菌多糖疫苗品质控制的效率。
附图说明
[0039]
图1为本发明同步测定细菌多糖中多糖和磷含量的定量核磁方法的过程示意图。
[0040]
图2为34-20101010批次hib荚膜多糖15mg/ml检测液定量1h-nmr谱图1。
[0041]
图3为34-20101010批次hib荚膜多糖15mg/ml检测液定量1h-nmr谱图2。
[0042]
图4为34-20101010批次hib荚膜多糖15mg/ml检测液定量1h-nmr谱图3。
[0043]
图5为34-20101010批次hib荚膜多糖15mg/ml检测液定量
31
p-nmr谱图1。
[0044]
图6为34-20101010批次hib荚膜多糖15mg/ml检测液定量
31
p-nmr谱图2。
[0045]
图7为34-20101010批次hib荚膜多糖15mg/ml检测液定量
31
p-nmr谱图3。
[0046]
图8为34-20101010批次hib荚膜多糖20mg/ml检测液定量1h-nmr谱图1。
[0047]
图9为34-20101010批次hib荚膜多糖20mg/ml检测液定量1h-nmr谱图2。
[0048]
图10为34-20101010批次hib荚膜多糖20mg/ml检测液定量1h-nmr谱图3。
[0049]
图11为34-20101010批次hib荚膜多糖20mg/ml检测液定量
31
p-nmr谱图1。
[0050]
图12为34-20101010批次hib荚膜多糖20mg/ml检测液定量
31
p-nmr谱图2。
[0051]
图13为34-20101010批次hib荚膜多糖20mg/ml检测液定量
31
p-nmr谱图3。
[0052]
图14为34-20111015批次hib荚膜多糖15mg/ml检测液定量1h-nmr谱图1。
[0053]
图15为34-20111015批次hib荚膜多糖15mg/ml检测液定量1h-nmr谱图2。
[0054]
图16为34-20111015批次hib荚膜多糖15mg/ml检测液定量1h-nmr谱图3。
[0055]
图17为34-20111015批次hib荚膜多糖15mg/ml检测液定量
31
p-nmr谱图1。
[0056]
图18为34-20111015批次hib荚膜多糖15mg/ml检测液定量
31
p-nmr谱图2。
[0057]
图19为34-20111015批次hib荚膜多糖15mg/ml检测液定量
31
p-nmr谱图3。
[0058]
图20为34-20111015批次hib荚膜多糖20mg/ml检测液定量1h-nmr谱图1。
[0059]
图21为34-20111015批次hib荚膜多糖20mg/ml检测液定量1h-nmr谱图2。
[0060]
图22为34-20111015批次hib荚膜多糖20mg/ml检测液定量1h-nmr谱图3。
[0061]
图23为34-20111015批次hib荚膜多糖20mg/ml检测液定量
31
p-nmr谱图1。
[0062]
图24为34-20111015批次hib荚膜多糖20mg/ml检测液定量
31
p-nmr谱图2。
[0063]
图25为34-20111015批次hib荚膜多糖20mg/ml检测液定量
31
p-nmr谱图3。
具体实施方式
[0064]
本发明涉及的同步测定细菌多糖中多糖和磷含量的定量核磁方法包括以下步骤:
[0065]
a.精密称取六甲基磷酰三胺,溶于氘代水中,配制内标溶液;
[0066]
b.精密称取细菌多糖供试品,溶于内标溶液,配制多糖供试液;
[0067]
c.精密量取多糖供试液至核磁管中,超声处理排除气泡;
[0068]
d.设置核磁共振波谱仪的参数,包括脉冲宽度、驰豫延迟时间、采样温度、采样次数,测定供试液的1h-nmr和
31
p-nmr;
[0069]
e.对1h-nmr进行相位和基线调整,对细菌多糖和六甲基磷酰三胺定量峰进行积分;
[0070]
f.对
31
p-nmr进行相位和基线调整,对细菌多糖和六甲基磷酰三胺定量峰进行积分;
[0071]
g.由1h-nmr中细菌多糖和六甲基磷酰三胺定量峰的积分值,计算供试品中多糖含量;
[0072]
由
31
p-nmr中细菌多糖和六甲基磷酰三胺定量峰的积分值,计算供试品中磷含量;
[0073]
步骤a中所述的六甲基磷酰三胺内标溶液浓度可以为0.5-5mg/ml。
[0074]
步骤b中所述的多糖供试液浓度可以为5-40mg/ml。
[0075]
步骤c中所述的核磁管中多糖供试液体积可以为0.5-1.0ml,超声时间可以为3-10分钟,超声温度可以为22-26℃。
[0076]
步骤d中所述的1h-nmr参数可以为采用脉冲程序zg,脉冲角为30-60度,实验绝对温度控制为294-303k,采样谱宽为9000hz,中心频率位于δ
h 3.5,采样点数为64k,线宽因子为0.3hz,采样时间为3.6s,空扫次数为2次,采样次数大于或等于8次,脉冲延迟时间设定大于或等于10s,预扫描延迟设定为5-8μs。
[0077]
步骤d中所述的
31
p-nmr参数可以为采用脉冲程序zgpg,脉冲角为30-60度,实验绝对温度控制为294-303k,采样谱宽为64100hz,中心频率位于δ-8100,采样点数为64k,线宽因子为1hz,采样时间为0.5s,采样次数大于或等于8次,空扫次数为4次,脉冲延迟时间设定大于或等于2s,预扫描延迟设定为5-8μs。
[0078]
步骤e中所述的定量1h-nmr中细菌多糖定量特征峰可以为:b型流感嗜血杆菌荚膜多糖中核糖2-h,化学位移为4.23ppm,固定积分范围为4.27-4.20ppm;6a型肺炎链球菌荚膜多糖中半乳糖1-h,化学位移为5.64ppm,固定积分范围为5.74-5.56ppm;6b型肺炎链球菌荚膜多糖中半乳糖1-h,化学位移为5.64ppm,固定积分范围为5.74-5.56ppm;18c型肺炎链球菌荚膜多糖中鼠李糖6号位甲基,化学位移为1.37ppm,固定积分范围为1.70-0.90ppm;19a型肺炎链球菌荚膜多糖中鼠李糖1-h,化学位移为5.46ppm,固定积分范围为5.52-5.38ppm;19f型肺炎链球菌荚膜多糖中鼠李糖1-h,化学位移为5.52ppm,固定积分范围为5.68-5.38ppm;23f型肺炎链球菌荚膜多糖中两个鼠李糖6号位甲基,化学位移为1.28ppm和1.37ppm,固定积分范围为1.65-1.00ppm。内标物六甲基磷酰三胺定量特征峰可以为6个甲基,化学位移为2.58ppm和2.60ppm,固定积分范围为2.65-2.53ppm。
[0079]
步骤f中所述的定量
31
p-nmr中细菌多糖定量特征峰化学位移为0.17ppm,固定积分范围为0.33-0.02ppm。内标物定量特征峰化学位移为29.93ppm,固定积分范围为30.10-29.77ppm。
[0080]
实验中所用试剂均为分析纯,未经处理直接使用。
[0081]
下述实施例涉及的34-20101010批次hib荚膜多糖、34-20111015批次hib荚膜多糖的结构可参见文献j.am.chem.soc.,1982,104,2898-2910,可来自北京民海生物科技有限公司。
[0082]
本发明涉及的定量1h-nmr和定量
31
p-nmr由bruker ultrashield plus 400兆核磁共振仪测得。
[0083]
本发明涉及的传统化学法测定具体是指《中国药典》四部(2020年版)中通用技术3421-b型流感嗜血杆菌结合疫苗多糖含量测定法、通用技术3103-磷测定法。
[0084]
实施例1
[0085]
量取内标物六甲基磷酰三胺25mg,溶解于10ml氘代水,所得六甲基磷酰三胺内标溶液浓度为2.5mg/ml。称取34-20101010批次hib荚膜多糖30mg,溶解于2ml六甲基磷酰三胺内标溶液,混匀后配制浓度为15mg/ml的多糖检测液。量取0.5ml多糖检测液至核磁管中,常温超声3min,除去核磁管内溶液中的气泡,取三个平行样品用于定量核磁检测。
[0086]
定量1h-nmr法的仪器参数设置为采用zg 30脉冲序列,脉冲角为30
°
,实验绝对温度控制为298k,采样谱宽为9000hz,中心频率位于δ
h 3.5,采样点数为64k,线宽因子为0.3hz,采样时间为3.6s,空扫次数为2次,采样次数为64次,脉冲延迟时间设定为10s,预扫
描延迟设定为6.5μs。得到3个重复样品的定量1h-nmr谱图(图2-图4),经自动相位校正和自动基线校正处理,以避免手动校正对定量结果的干扰。
[0087]
定量
31
p-nmr法的仪器参数设置为采用zgpg 30脉冲序列,脉冲角为30
°
,实验绝对温度控制为298k,采样谱宽为64100hz,中心频率位于δ-8100,采样点数为64k,线宽因子为1hz,采样时间为0.5s,采样次数为64次,空扫次数为4次,脉冲延迟时间设定为2s,预扫描延迟设定为6.5μs。得到3个重复样品的定量
31
p-nmr谱图(图5-图7),经自动相位校正和自动基线校正处理,以避免手动校正对定量结果的干扰。
[0088]
定量1h-nmr中hib荚膜多糖定量特征峰为核糖2-h,化学位移为4.23ppm,固定积分范围为4.27-4.20ppm。内标物六甲基磷酰三胺定量特征峰为6ch3,化学位移为2.58ppm和2.60ppm,固定积分范围为2.65-2.53ppm。根据定量峰积分值和多糖浓度,荚膜多糖样品中多糖的含量(以重复结构单元质量346.23计)按下公式计算。
[0089][0090]
式中,prp表示hib荚膜多糖;is表示内标物;w%
prp
表示hib多糖含量;i表示定量峰积分值;n表示定量峰所含质子数;c表示检测液质量浓度,单位为mg/ml;m表示摩尔质量;w%
is
表示内标物六甲基磷酰三胺的纯度。
[0091]
根据多糖含量,检测样品中核糖含量按下公式计算。
[0092]wribose
=w%prp
×
433.61
[0093]
式中,w
ribose
表示核糖含量,单位为mg/g,w%
prp
表示hib多糖含量。
[0094]
定量
31
p-nmr中hib荚膜多糖定量特征峰化学位移为0.17ppm,固定积分范围为0.33-0.02ppm。内标物定量特征峰化学位移为29.93ppm,固定积分范围为30.10-29.77ppm。根据定量峰积分值和多糖浓度,多糖样品中磷含量按下公式计算。
[0095][0096]
式中,prp表示hib荚膜多糖;s表示hib多糖样品中的磷;is表示内标物;w
p
表示hib多糖样品中磷的含量,单位为mg/g;i表示定量峰积分值;n表示定量峰中磷原子数量;m表示摩尔质量;c表示检测液质量浓度,单位为mg/ml;w%
is
表示内标物的纯度。
[0097]
综上,34-20101010批次hib荚膜多糖在15mg/ml检测液浓度下,测得的多糖含量是89.43
±
1.17%,核糖含量是387.78
±
5.07mg/g,磷含量是78.24
±
1.00mg/g。而传统化学法测定34-20101010批次hib荚膜多糖的核糖含量为363mg/g,磷含量为83mg/g,表明本定量nmr法具有良好的准确度(核糖含量误差为6.8%,磷含量误差为5.7%)。
[0098]
实施例2:
[0099]
量取内标物六甲基磷酰三胺20mg,溶解于8ml氘代水,所得六甲基磷酰三胺内标溶液浓度为2.5mg/ml。称取34-20101010批次hib荚膜多糖40mg,溶解于2ml六甲基磷酰三胺内标溶液,混匀后配制浓度为20mg/ml的多糖检测液。量取0.5ml多糖检测液至核磁管中,常温超声3min,除去核磁管内溶液中的气泡,取三个平行样品用于定量核磁检测。
[0100]
定量1h-nmr法的仪器参数设置为采用zg 30脉冲序列,脉冲角为30
°
,实验绝对温度控制为298k,采样谱宽为9000hz,中心频率位于δ
h 3.5,采样点数为64k,线宽因子为0.3hz,采样时间为3.6s,空扫次数为2次,采样次数为64次,脉冲延迟时间设定为10s,预扫
描延迟设定为6.5μs。得到3个重复样品的定量1h-nmr谱图(图8-图10),经自动相位校正和自动基线校正处理,以避免手动校正对定量结果的干扰。
[0101]
定量
31
p-nmr法的仪器参数设置为采用zgpg 30脉冲序列,脉冲角为30
°
,实验绝对温度控制为298k,采样谱宽为64100hz,中心频率位于δ-8100,采样点数为64k,线宽因子为1hz,采样时间为0.5s,采样次数为64次,空扫次数为4次,脉冲延迟时间设定为2s,预扫描延迟设定为6.5μs。得到3个重复样品的定量
31
p-nmr谱图(图11-图13),经自动相位校正和自动基线校正处理,以避免手动校正对定量结果的干扰。
[0102]
定量1h-nmr中hib荚膜多糖定量特征峰为核糖2-h,化学位移为4.23ppm,固定积分范围为4.27-4.20ppm。内标物六甲基磷酰三胺定量特征峰为6ch3,化学位移为2.58ppm和2.60ppm,固定积分范围为2.65-2.53ppm。根据定量峰积分值和多糖浓度,荚膜多糖样品中多糖的含量(以重复结构单元质量346.23计)按下公式计算。
[0103][0104]
式中,prp表示hib荚膜多糖;is表示内标物;w%
prp
表示hib多糖含量;i表示定量峰积分值;n表示定量峰所含质子数;c表示检测液质量浓度,单位为mg/ml;m表示摩尔质量;w%
is
表示内标物六甲基磷酰三胺的纯度。
[0105]
根据多糖含量,检测样品中核糖含量按下公式计算。
[0106]wribose
=w%prp
×
433.61
[0107]
式中,w
ribose
表示核糖含量,单位为mg/g,w%
prp
表示hib多糖含量。
[0108]
定量
31
p-nmr中hib荚膜多糖定量特征峰化学位移为0.17ppm,固定积分范围为0.33-0.02ppm。内标物定量特征峰化学位移为29.93ppm,固定积分范围为30.10-29.77ppm。根据定量峰积分值和多糖浓度,多糖样品中磷含量按下公式计算。
[0109][0110]
式中,prp表示hib荚膜多糖;s表示hib多糖样品中的磷;is表示内标物;w
p
表示hib多糖样品中磷的含量,单位为mg/g;i表示定量峰积分值;n表示定量峰中磷原子数量;m表示摩尔质量;c表示检测液质量浓度,单位为mg/ml;w%
is
表示内标物的纯度。
[0111]
综上,34-20101010批次hib荚膜多糖在20mg/ml检测液浓度下,测得的多糖含量是89.79
±
0.17%,核糖含量是389.34
±
0.72mg/g,磷含量是79.73
±
1.31mg/g。而传统化学法测定34-20101010批次hib荚膜多糖的核糖含量为363mg/g,磷含量为83mg/g,表明本定量nmr法具有良好的准确度(核糖含量误差为7.3%,磷含量误差为3.9%)。
[0112]
实施例3:
[0113]
量取内标物六甲基磷酰三胺30mg,溶解于12ml氘代水,所得六甲基磷酰三胺内标溶液浓度为2.5mg/ml。称取34-20111015批次hib荚膜多糖33mg,溶解于2.2ml六甲基磷酰三胺内标溶液,混匀后配制浓度为15mg/ml的多糖检测液。量取0.5ml多糖检测液至核磁管中,常温超声3min,除去核磁管内溶液中的气泡,取三个平行样品用于定量核磁检测。
[0114]
定量1h-nmr法的仪器参数设置为采用zg 30脉冲序列,脉冲角为30
°
,实验绝对温度控制为298k,采样谱宽为9000hz,中心频率位于δ
h 3.5,采样点数为64k,线宽因子为0.3hz,采样时间为3.6s,空扫次数为2次,采样次数为64次,脉冲延迟时间设定为10s,预扫
描延迟设定为6.5μs。得到3个重复样品的定量1h-nmr谱图(图14-图16),经自动相位校正和自动基线校正处理,以避免手动校正对定量结果的干扰。
[0115]
定量
31
p-nmr法的仪器参数设置为采用zgpg 30脉冲序列,脉冲角为30
°
,实验绝对温度控制为298k,采样谱宽为64100hz,中心频率位于δ-8100,采样点数为64k,线宽因子为1hz,采样时间为0.5s,采样次数为64次,空扫次数为4次,脉冲延迟时间设定为2s,预扫描延迟设定为6.5μs。得到3个重复样品的定量
31
p-nmr谱图(图17-图19),经自动相位校正和自动基线校正处理,以避免手动校正对定量结果的干扰。
[0116]
定量1h-nmr中hib荚膜多糖定量特征峰为核糖2-h,化学位移为4.23ppm,固定积分范围为4.27-4.20ppm。内标物六甲基磷酰三胺定量特征峰为6ch3,化学位移为2.58ppm和2.60ppm,固定积分范围为2.65-2.53ppm。根据定量峰积分值和多糖浓度,荚膜多糖样品中多糖的含量(以重复结构单元质量346.23计)按下公式计算。
[0117][0118]
式中,prp表示hib荚膜多糖;is表示内标物;w%
prp
表示hib多糖含量;i表示定量峰积分值;n表示定量峰所含质子数;c表示检测液质量浓度,单位为mg/ml;m表示摩尔质量;w%
is
表示内标物六甲基磷酰三胺的纯度。
[0119]
根据多糖含量,检测样品中核糖含量按下公式计算。
[0120]wribose
=w%
prp
×
433.61
[0121]
式中,w
ribose
表示核糖含量,单位为mg/g,w%
prp
表示hib多糖含量。
[0122]
定量
31
p-nmr中hib荚膜多糖定量特征峰化学位移为0.17ppm,固定积分范围为0.33-0.02ppm。内标物定量特征峰化学位移为29.93ppm,固定积分范围为30.10-29.77ppm。根据定量峰积分值和多糖浓度,多糖样品中磷含量按下公式计算。
[0123][0124]
式中,prp表示hib荚膜多糖;s表示hib多糖样品中的磷;is表示内标物;w
p
表示hib多糖样品中磷的含量,单位为mg/g;i表示定量峰积分值;n表示定量峰中磷原子数量;m表示摩尔质量;c表示检测液质量浓度,单位为mg/ml;w%
is
表示内标物的纯度。
[0125]
综上,34-20111015批次hib荚膜多糖在15mg/ml检测液浓度下,测得的多糖含量是84.60
±
0.20%,核糖含量是366.82
±
0.87mg/g,磷含量是74.74
±
2.12mg/g。而传统化学法测定34-20111015批次hib荚膜多糖的核糖含量为387mg/g,磷含量是81mg/g,表明本定量nmr法具有良好的准确度(核糖含量误差为5.2%,磷含量误差为7.7%)。
[0126]
实施例4:
[0127]
量取内标物六甲基磷酰三胺20mg,溶解于8ml氘代水,所得六甲基磷酰三胺内标溶液浓度为2.5mg/ml。称取34-20111015批次hib荚膜多糖38mg,溶解于1.9ml六甲基磷酰三胺内标溶液,混匀后配制浓度为20mg/ml的多糖检测液。量取0.5ml多糖检测液至核磁管中,常温超声3min,除去核磁管内溶液中的气泡,取三个平行样品用于定量核磁检测。
[0128]
定量1h-nmr法的仪器参数设置为采用zg 30脉冲序列,脉冲角为30
°
,实验绝对温度控制为298k,采样谱宽为9000hz,中心频率位于δ
h 3.5,采样点数为64k,线宽因子为0.3hz,采样时间为3.6s,空扫次数为2次,采样次数为64次,脉冲延迟时间设定为10s,预扫
描延迟设定为6.5μs。得到3个重复样品的定量1h-nmr谱图(图20-图22),经自动相位校正和自动基线校正处理,以避免手动校正对定量结果的干扰。
[0129]
定量
31
p-nmr法的仪器参数设置为采用zgpg 30脉冲序列,脉冲角为30
°
,实验绝对温度控制为298k,采样谱宽为64100hz,中心频率位于δ-8100,采样点数为64k,线宽因子为1hz,采样时间为0.5s,采样次数为64次,空扫次数为4次,脉冲延迟时间设定为2s,预扫描延迟设定为6.5μs。得到3个重复样品的定量
31
p-nmr谱图(图23-图25),经自动相位校正和自动基线校正处理,以避免手动校正对定量结果的干扰。
[0130]
定量1h-nmr中hib荚膜多糖定量特征峰为核糖2-h,化学位移为4.23ppm,固定积分范围为4.27-4.20ppm。内标物六甲基磷酰三胺定量特征峰为6ch3,化学位移为2.58ppm和2.60ppm,固定积分范围为2.65-2.53ppm。根据定量峰积分值和多糖浓度,荚膜多糖样品中多糖的含量(以重复结构单元质量346.23计)按下公式计算。
[0131][0132]
式中,prp表示hib荚膜多糖;is表示内标物;w%
prp
表示hib多糖含量;i表示定量峰积分值;n表示定量峰所含质子数;c表示检测液质量浓度,单位为mg/ml;m表示摩尔质量;w%
is
表示内标物六甲基磷酰三胺的纯度。
[0133]
根据多糖含量,检测样品中核糖含量按下公式计算。
[0134]wribose
=w%prp
×
433.61
[0135]
式中,w
ribose
表示核糖含量,单位为mg/g,w%
prp
表示hib多糖含量。
[0136]
定量
31
p-nmr中hib荚膜多糖定量特征峰化学位移为0.17ppm,固定积分范围为0.33-0.02ppm。内标物定量特征峰化学位移为29.93ppm,固定积分范围为30.10-29.77ppm。根据定量峰积分值和多糖浓度,多糖样品中磷含量按下公式计算。
[0137][0138]
式中,prp表示hib荚膜多糖;s表示hib多糖样品中的磷;is表示内标物;w
p
表示hib多糖样品中磷的含量,单位为mg/g;i表示定量峰积分值;n表示定量峰中磷原子数量;m表示摩尔质量;c表示检测液质量浓度,单位为mg/ml;w%
is
表示内标物的纯度。
[0139]
综上,34-20111015批次hib荚膜多糖在20mg/ml检测液浓度下,测得的多糖含量是85.56
±
0.08%,核糖含量是371.01
±
0.35mg/g,磷含量是74.17
±
0.51mg/g。而传统化学法测定34-20111015批次hib荚膜多糖的核糖含量为387mg/g,磷含量是81mg/g,表明本定量nmr法具有良好的准确度(核糖含量误差为4.1%,磷含量误差为8.4%)。
[0140]
对比例1
[0141]
参照实施例1,将定量1h-nmr中hib荚膜多糖定量特征峰替换为核糖1-h,化学位移为5.04ppm,固定积分范围为5.08-5.01ppm,其他不变,测定多糖含量。
[0142]
结果为:34-20101010批次hib荚膜多糖在15mg/ml检测液浓度下,测得的多糖含量为92.66
±
2.25%,核糖含量401.78
±
9.76mg/g,误差达到11%,存在显著差异,准确性较差。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1