8-羟基-2-脱氧鸟苷的检测方法与流程
1.本发明涉及生物检测领域,具体而言,涉及一种8-羟基-2-脱氧鸟苷的检测方法。
背景技术:
2.dna的氧化损伤能被各种因素诱导,包括内源性细胞代谢产物、化学物、电离和非电离辐射等,其机制主要与活性氧自由基产生有关,不同生物体(例如植物、动物、微生物或人等)内均存在多种dna修复途径清除损伤。通过分析dna加合物或dna氧化损伤修复产物等生物学标志物,可以对生物体内氧化负荷进行检测,其中8-羟基-2-脱氧鸟苷与dna氧化损伤明显相关,成为研究最多的dna碱基氧化损伤修复产物。
3.目前分离检测8-羟基-2-脱氧鸟苷的方法主要有高效液相色谱电化学法、标记薄层色谱法、免疫化学分析、荧光后标记、高效毛细管电泳法及气相色谱质谱法等。然而,上述方法都存在一定的缺陷,例如:气相色谱质谱法需先衍生化反应,衍生过程易产生副产物,导致假阳性结果。标记法的特异性有待提高,且易造成放射性污染。免疫化学法的专属性差,且发生交叉反应,导致检测值较真实值偏高。且现有技术中,对于8-羟基-2-脱氧鸟苷的提取方法的关注少,仅使用单一溶剂对样品进行提取。
技术实现要素:
4.本发明的主要目的在于提供一种8-羟基-2-脱氧鸟苷的检测方法,以解决现有技术中的8-羟基-2-脱氧鸟苷的检测中提取率低的问题。
5.为了实现上述目的,根据本发明的第一个方面,提供了一种8-羟基-2-脱氧鸟苷的检测方法,该检测方法包括:s1,利用uplc-ms/ms联用建立8-羟基-2-脱氧鸟苷的浓度和峰面积的标准曲线;s2,用提取液对待测样品进行前处理,获得待检测液;s3,采用uplc-ms/ms联用对待检测液进行检测,得到8-羟基-2-脱氧鸟苷的离子谱峰;根据标准曲线和离子谱峰换算得到待测样品中的8-羟基-2-脱氧鸟苷的含量;提取液包括75~85v/v%甲醇水溶液。
6.进一步地,s2包括:向待测样品中加入提取液,混合,离心,取上清液;将上清液过固相萃取柱,流出液即为待检测液;优选地,待测样品为如下任意一种:肌肉或尿液;优选地,待测样品为固体时,在加入提取液前,将待测样品进行剪碎、研磨或粉碎匀浆;优选地,研磨包括在液氮条件下研磨。
7.进一步地,固相萃取柱包括hlb固相萃取柱。
8.进一步地,提取液包括同位素内标;优选地,同位素内标包括胆酸-d4;优选地,提取液中的同位素内标的浓度为200ng/ml;优选地,提取液的添加量为每克待测样品中加入2~5ml提取液,更优选为3ml。
9.进一步地,uplc-ms/ms联用所用的色谱柱为c18色谱柱;优选地,流动相包括a相和b相,a相为0.1%甲酸水溶液,b相为0.1%甲酸甲醇溶液,同时含有a相和b相时,a相和b相的体积比为0:100~95:5;优选地,uplc-ms/ms联用采用的离子源为电喷雾电离源;优选地,离子源的电压为4500v或-4500v;优选地,离子源的温度为550℃。
脱氧鸟苷的浓度和峰面积的标准曲线。利用uplc-ms/ms联用进行检测,得到相应的8-羟基-2-脱氧鸟苷标准品的离子谱峰,根据上述建立的标准曲线进行计算,得出8-羟基-2-脱氧鸟苷标准品的含量。该检测方法不仅操作简便,而且具有优异的精密度、准确度和稳定性。利用75~85v/v%甲醇水溶液,更优选为80v/v%甲醇水溶液对待测样品进行提取,能够将待测样品中的8-羟基-2-脱氧鸟苷大量提取出来,提取率高,从而增加后续检测的准确性。
23.在一种优选的实施例中,s2包括:向待测样品中加入提取液,混合,离心,取上清液;将上清液过固相萃取柱,流出液即为待检测液;优选地,待测样品为如下任意一种:肌肉、或尿液;优选地,待测样品为固体时,在加入提取液前,将待测样品进行剪碎、研磨或粉碎匀浆等处理;优选地,研磨包括在液氮条件下研磨。
24.在一种优选的实施例中,所述固相萃取柱包括hlb固相萃取柱。
25.利用固相萃取等方法,减少待测样品中的杂质,防止样品中的杂质产生基质效应,对检测的准确度和精密度产生影响,也能防止样品中的蛋白质对uplc-ms/ms联用设备造成损伤。
26.在一种优选的实施例中,提取液包括同位素内标;优选地,同位素内标包括胆酸-d4、硬脂酸-d35或花生酸-d39;优选地,提取液中的同位素内标的浓度为200ng/ml;优选地,提取液的添加量为每克待测样品中加入2~5ml提取液,更优选为3ml。
27.若样品为不溶于水或有机试剂的固体样品,通过切碎、研磨、匀浆等方法处理后,加入提取液,将8-羟基-2-脱氧鸟苷从待测样品中提取出来并进行后续检测。由于8-羟基-2-脱氧鸟苷在上述待测样品中的含量极低,因此本技术利用上述配比的提取液进行提取,具有较好的提取效果,提取效率高,从而确保对于样品中8-羟基-2-脱氧鸟苷含量检测的准确性。通过优选待测样品和提取液的混合比例,防止若提取液加入过少,难以将待测样品中的8-羟基-2-脱氧鸟苷大量提取出来;也防止提取液加入过多,导致最终获得的待检测液中8-羟基-2-脱氧鸟苷的浓度过低。
28.上述样品包括但不限于肌肉、尿液等常见生物样品,肌肉进一步包括但不限于心肌、骨骼肌或平滑肌。通过将固体样品剪碎、研磨、粉碎匀浆等操作,增大待测样品的表面积。通过震荡、超声、涡旋等方法,增加提取液与待测样品的接触。利用上述手段,增加提取液提取8-羟基-2-脱氧鸟苷的效率。提取结束后,通过离心将混合物中的固体样品与提取液分离,此时上清液即为溶有8-羟基-2-脱氧鸟苷的液体,通过离心去除不溶的固体杂质。由于待测样品中的成分复杂,因此将离心获得的上清液过固相萃取柱,优选为hlb固相萃取柱,能够降低背景干扰,降低基质效应,提高后续uplc-ms/ms联用检测的准确度和精密度。
29.利用胆酸-d4、硬脂酸-d35、花生酸-d39等常用同位素内标即能够精确定量测定样品中的8-羟基-2-脱氧鸟苷,降低了同位素内标获取的难度,降低检测成本。
30.在一种优选的实施例中,uplc-ms/ms联用所用的色谱柱为c18色谱柱;优选地,流动相包括a相和b相,a相为0.1%甲酸水溶液,b相为0.1%甲酸甲醇溶液,同时含有a相和b相时,a相和b相的体积比为0:100~95:5;优选地,uplc-ms/ms联用采用的离子源为电喷雾电离源;优选地,离子源的电压为4500v或-4500v;优选地,离子源的温度为550℃。
31.利用c18色谱柱,能够在uplc中对8-羟基-2-脱氧鸟苷进行分离,利用在后续的质谱装置中对8-羟基-2-脱氧鸟苷进行精确地定性和定量。为了保证分离效率,流动相包括0.1%甲酸水溶液的a相作为水相,和0.1%甲酸甲醇溶液的b相作为有机相,待测样品在上
述流动相中能够保持稳定。上述流动相中的甲酸,能够使流动相保持一定的ph和离子强度,减少拖尾,改善峰形,利于待测样品中不同成分的分离。在色谱方法中,a相和b相的体积比为0:100~95:5,通过逐渐调整a相和b相的比例,改变流动相的极性,改变色谱柱对待检测液的保留能力。
32.在一种优选的实施例中,s3中采用梯度洗脱,梯度洗脱过程中,流动相自初始流动相开始以a相逐渐减小b相逐渐增加的方式进行梯度变化,至所述b相占比为100%,并以与初始流动相相同组成的流动相洗脱结束梯度洗脱,初始流动相中所a相与b相的体积比为95:5;优选地,梯度洗脱的流速为0.2~0.5ml/min,更优选为0.3ml/min。
33.在uplc-ms/ms联用对待检测液进行检测中,采用梯度洗脱的方法,流动相的极性由大逐渐变小,对结合在色谱柱上的样品进行梯度洗脱,极性越大的物质约容易被洗脱,出峰时间越短。在梯度洗脱结束后,利用与初始流动相相同组成的流动相洗脱,使下一次进样时色谱柱中的流动相极性与初始流动相相同,避免对下一次进样的样品保留时间产生影响。
34.在一种优选的实施例中,初始流动相洗脱的时间为0.5min,且初始流动相洗脱结束后在1.5min内,流动相中a相和b相的体积比自95:5逐渐变化至0:100,以b相洗脱2min后再以初始流动相进行洗脱1min。
35.利用上述流动相对结合在色谱柱上的待检测成分进行洗脱,根据不同成分的极性差异、与色谱柱结合能力差异的不同,对待测样品中的8-羟基-2-脱氧鸟苷进行分离,在较短的洗脱时间内即可将8-羟基-2-脱氧鸟苷从待测样品复杂的成分中进行区分,能够准确进行定量分析,防止杂质的干扰,影响测定结果。利用上述洗脱方法,分析速度快,能够大大缩短检测时间。
36.在一种优选的实施例中,uplc-ms/ms联用所用的色谱柱的柱温为50℃;优选地,色谱柱的柱参数为100
×
2.1mm,1.8μm。
37.利用上述柱温和色谱柱,能够较好且较快的对8-羟基-2-脱氧鸟苷进行分离。防止分离效果不好导致不同种的成分同时进入质谱检测器中,对待检测的8-羟基-2-脱氧鸟苷的准确定量产生影响。
38.在一种优选的实施例中,s1包括:s11.精密称取8-羟基-2-脱氧鸟苷,用甲醇水溶液溶解得8-羟基-2-脱氧鸟苷母液;s12.将8-羟基-2-脱氧鸟苷母液用甲醇水溶液稀释,获得8-羟基-2-脱氧鸟苷标准液;s13.利用uplc-ms/ms联用检测8-羟基-2-脱氧鸟苷标准液,获得8-羟基-2-脱氧鸟苷标准液的峰面积;s14.以8-羟基-2-脱氧鸟苷标准液与同位素内标的浓度比为x轴,8-羟基-2-脱氧鸟苷标准液与同位素内标的峰面积比为y轴,建立标准曲线。
39.在一种优选的实施例中,8-羟基-2-脱氧鸟苷标准液的浓度为0.125~500ng/ml;优选地,甲醇水溶液包括50v/v%甲醇水溶液。
40.通过分步配置,先配置浓度较高的8-羟基-2-脱氧鸟苷母液,再分别将8-羟基-2-脱氧鸟苷母液进行稀释得到相应的8-羟基-2-脱氧鸟苷标准液。能够避免若直接配置8-羟基-2-脱氧鸟苷标准液,由于称量质量过小而导致的误差。高浓度的母液,利于储存,也便于配置不同浓度的标准液,从而进行标准曲线的制作。在后续配置标准液时可直接稀释配置,也能够避免由于多次称量带来的不同批次间的误差。
41.下面将结合具体的实施例来进一步详细解释本技术的有益效果。
42.实施例1
43.标准液的配制:
44.用分析天平准确称量8-羟基-2-脱氧鸟苷标准品1.0mg,用移液器移取1000μl的50v/v%甲醇水溶液,溶解,混匀,得到1.0mg/ml的8-羟基-2-脱氧鸟苷母液。
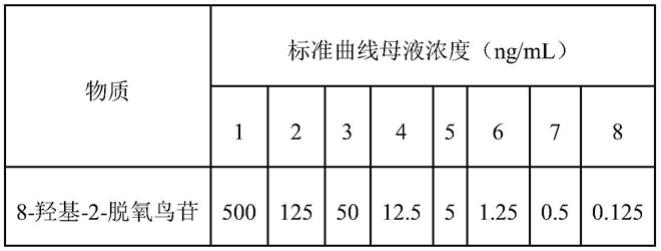
45.8-羟基-2-脱氧鸟苷标准液浓度按照表1所示,用50v/v%甲醇水溶液逐一进行配制。
46.表1
[0047][0048]
提取液的配制
[0049]
用量筒量取适量的甲醇和纯水,定量混合,配置为80v/v%的甲醇水溶液。
[0050]
含有内标的提取液为用分析天平准确称量1.0mg内标胆酸-d4,用移液器移取1000μl的80v/v%的甲醇水溶液,溶解,混匀,得到1.0mg/ml的内标母液,再准确移取8μl内标母液至39.992ml的得到含有内标的80v/v%的甲醇水溶液中,制得含有内标200ng/ml的胆酸-d4提取液。
[0051]
线性前处理
[0052]
准确吸取8份80μl空白基质溶液(生理盐水)于1.5ml离心管内,加入8个浓度的线性点标准液20μl,涡旋混匀,随即加入300μl含内标的提取液,涡旋混匀,全部转移至hlb萃取柱中,加压使溶液渗至萃取柱填料中,静置吸附10min,加入350μl的5v/v%甲醇水清洗液清洗,用离心管1收集清洗液,再用350μl的80v/v%乙腈甲醇洗脱,用离心管2收集洗脱液,合并离心管1与离心管2溶液,冻干,用50μl的80v/v%甲醇水涡旋复溶,12000rpm离心10min后取上清待检测。8-羟基-2-脱氧鸟苷的标准曲线参见图2。
[0053]
质控溶液配制
[0054]
高、中、低质控溶液配制方法与标准液3、标准液5、标准液7配制方法相同。
[0055]
质控样品前处理
[0056]
准确量取3份80μl空白基质溶液(生理盐水),从8个浓度点的线性梯度中选取低(7)、中(5)、高(3)3个浓度,吸取20μl加入到空白基质溶液中制成质控品,涡旋混匀,随即加入300μl含内标的萃取剂(80v/v%的甲醇水溶液),涡旋混匀,全部转移至hlb固相萃取柱中,加压使溶液渗至萃取柱填料中,静置吸附10min,加入350μl的5v/v%甲醇水清洗液清洗,用离心管1收集清洗液,再用350μl的80v/v%乙腈甲醇洗脱,用离心管2收集洗脱液,合并离心管1与离心管2溶液,冻干,用50μl的80v/v%甲醇水涡旋复溶,12000rpm离心10min后取上清待检测,平行制备3组。
[0057]
质控样品是线性范围内的不包含线性最低点与最高点的其余按低中高浓度设置
的质控点,作用是计算该方法验证中的验证项,如准确度,是用线性计算出低中高质控的检测数值与理论值进行比较计算得出,其余验证项也包括精密度。此外,在检测实际样本队列中插入质控品,可以质控样品的偏差和准确度来判断样本检测正常与否,起到监控整个检测流程的作用。
[0058]
待测样品的前处理
[0059]
将样本用液氮研磨成粉末,准确称量样本100mg,随即加入300μl含内标的提取液,涡旋混匀,全部转移至hlb萃取柱中,加压使溶液渗至萃取柱填料中,静置吸附10min,加入350μl的5v/v%甲醇水清洗液清洗,用离心管1收集清洗液,再用350μl的80v/v%乙腈甲醇洗脱,用离心管2收集洗脱液,合并离心管1与离心管2溶液,冻干,用50μl的无内标的提取液涡旋复溶,12000rpm离心10min后取上清检测。
[0060]
待测样品的分析
[0061]
根据上机得到的数据结果,带入标准曲线的线性方程中,得到样本浓度值。
[0062]
色谱方法
[0063]
色谱柱:acquity uplc hss t3,100x 2.1mm,1.8μm
[0064]
流动相:a相:0.1%甲酸水溶液
[0065]
b相:0.1%甲酸甲醇溶液
[0066]
柱温:50℃
[0067]
进样量:2μl
[0068]
色谱梯度如表2所示:
[0069]
表2
[0070]
时间min流速ml/mina%b%00.39550.50.39552.00.301004.00.301004.10.39555.00.3955
[0071]
质谱方法:
[0072]
电喷雾电离(esi)源,正(负)离子电离模式。离子源温度550℃,离子源电压4500v(负模式-4500v),气帘气35psi,雾化气60psi,辅助气60psi。采用多重反应监测(mrm)进行扫描。表3为标准品和内标的质谱检测参数。对于8-羟基-2-脱氧鸟苷的定量分析,选择284.2-168.2的离子对进行计算。8-羟基-2-脱氧鸟苷子离子的离子谱峰参见图1,相应的离子谱峰面积结果见表7。表3中其他离子对作为辅助定性使用。
[0073]
表3
[0074]
母离子子离子物质名称去簇电压碰撞电压284.2168.28-羟基-2-脱氧鸟苷-12018284.2140.18-羟基-2-脱氧鸟苷-22040411.3347.4胆酸-d4-80-45
[0075]
方法学验证:
[0076]
定量下限:样品中目标物能被定量测定的最低量,一般为标准曲线最低点。要求信噪比值大于等于10(s/n≥10);定量下限平行3组检测结果cv≤20%。
[0077]
相对标准偏差(rsd)可用cv%表示,公式为:
[0078]
其中s为标准偏差,为均值。
[0079]
线性:在给定的测量范围内,测量结果与样品中目标物浓度成比例关系的程度。要求相关系数r≥0.9900;各个目标物最低点的3组线性点检测结果cv≤20%,其他点的3组线性点检测结果cv≤15%。
[0080]
方法学验证的参数见表4。
[0081]
表4
[0082][0083]
准确度:该检测方法测定的结果与真实值或参考值的接近程度。要求各个目标物回收率r%在85%至115%范围内;各个目标物的3组回收点检测结果cv≤15%。
[0084]
计算公式:r%=(qc回收样
–
b空白)/s加标量
×
100%;
[0085]
注:r%为回收率、qc回收样为基质加回收点样品、b空白为空白基质样品、s加标量为理论加入浓度。
[0086]
精密度:相互独立的测量结果间的一致程度,包括日内(重复性)和日间精密度(重现性)。要求日内各个目标物的3组检测结果cv≤15%;日间三天各个目标物的测定结果均值cv≤15%。
[0087]
实施例2
[0088]
除了提取液不同外,本实施例同实施例1。本实施例所用的提取液为75v/v%甲醇水溶液。
[0089]
方法学验证的参数见表5。相应的离子谱峰面积结果见表7
[0090]
表5
[0091][0092]
实施例3
[0093]
除了提取液不同外,本实施例同实施例1。本实施例所用的提取液为85v/v%甲醇水溶液。
[0094]
方法学验证的参数见表6。相应的离子谱峰面积结果见表7
[0095]
表6
[0096][0097]
对比例1
[0098]
除了提取液不同外,本对比例同实施例1。本对比例所用的提取液为50v/v%甲醇水溶液。相应的离子谱峰面积结果见表7
[0099]
对比例2
[0100]
除了提取液不同外,本对比例同实施例1。本对比例所用的提取液为纯甲醇。相应的离子谱峰面积结果见表7
[0101]
对比例3
[0102]
除了提取液不同外,本对比例同实施例1。本对比例所用的提取液为纯乙腈。相应的离子谱峰面积结果见表7
[0103]
表7
[0104][0105]
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:本技术利用uplc-ms/ms联用方法对待测样品中的8-羟基-2-脱氧鸟苷进行定量分析,能够达到的定量下限低,利用提取液进行提取,操作简便,分析时间短,提取效率高,能够在短时间内对样品中的8-羟基-2-脱氧鸟苷进行提取和精确定量。
[0106]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1