用于预测对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的方法与流程
1.本发明涉及用于预测对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的方法。
2.本技术基于在2020年3月26日在日本技术的特愿2020-056752号来主张优先权,将其内容援用到本文中。
背景技术:
3.作为抗pd-1/pd-l1抗体等免疫检查点抑制剂(ici)的伴随诊断,采用肿瘤组织中的pd-l1表达进行的诊断、采用微卫星不稳定性(msi)检查进行的诊断等被实用化。然而,在采用pd-l1表达进行的诊断中,有根据抗体而判定结果不同、在被判定为阴性的病例中施与ici也奏效的例子。在采用msi检查进行的诊断中,具有微卫星不稳定性(msi-high)的患者在大部分癌种中为10%以下,在msi-high患者中也有显示药剂耐性的例子。因此,这些诊断方法难以说其灵敏度和特异度是充分的,用于预测治疗效果的生物标志物的探索成为大课题。
4.另一方面,已知细胞将被称为外泌体的、由其内部包含蛋白质、核酸、脂质、糖这样的各种细胞内容物的脂质双层膜形成的小泡释放到细胞外。外泌体是成为用于知晓生物体的病况的重要线索的物质,关于外泌体如何参与各种疾病的研究盛行。
5.在专利文献1中公开了利用血液试样中的穿孔素作为用于评价采用ici进行的癌治疗的效果的生物标志物。
6.在非专利文献1中,作为用于预测转移性胃癌中的pd-1抑制剂的治疗效果的生物标志物,公开了pd-l1阳性的外泌体。
7.然而,肺癌中的ici的伴随诊断用生物标志物虽然存在,但是期望灵敏度和特异度进一步高的、肺癌中的ici的效果预测方法的开发。
8.现有技术文献
9.专利文献
10.专利文献1:日本专利第6630026号公报
11.非专利文献
12.非专利文献1:kim st et al.,“comprehensive molecular characterization of clinical responses to pd-1inhibition in metastatic gastric cancer.”,nat med.,vol.24,pp.1449-1458,2018.
技术实现要素:
13.发明所要解决的课题
14.本发明是鉴于上述情况而成的,提供用于预测对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的新的方法。
15.用于解决课题的方法
16.即,本发明包含以下方案。
17.(1)一种用于预测对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的方法,
18.其包含:从来源于上述肺癌患者的生物体试样中分离外泌体,通过质谱分析法来确定存在于上述外泌体中的蛋白质的表达量,
19.上述蛋白质为选自以下表1-1~表1-6所示的蛋白质组中的1种以上蛋白质。
20.[表1-1]
[0021]
[0022][0023]
[表1-2]
[0024]
[0025]
[0026][0027]
[表1-3]
[0028]
[0029][0030]
[表1-4]
[0031]
[0032][0033]
[表1-5]
[0034]
[0035][0036]
[表1-6]
[0037]
[0038][0039]
根据上述(1)所述的方法,上述蛋白质为选自以下表2所示的蛋白质组中的1种以上膜蛋白质。
[0040]
[表2]
[0041][0042][0043]
(3)根据上述(1)所述的方法,上述蛋白质为选自以下表3所示的蛋白质组中的1种以上蛋白质。
[0044]
[表3]
受体相互作用等,从而能够通过生物体的免疫功能进行有效率的癌的排除。
[0054]
<免疫检查点抑制剂>
[0055]
作为免疫检查点抑制剂,可举出pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂等。
[0056]
作为pd-1抑制剂,可举出纳武利尤单抗(nivolumab;作为
オブジーボ
(注册商标)而被销售)、帕博利珠单抗(pembrolizumab;作为
キイトルーダ
(注册商标)而被销售)等抗pd-1抗体等,但不限定于此。
[0057]
作为pd-l1抑制剂,可举出阿维鲁单抗、度伐鲁单抗、阿特珠单抗(atezolizumab;作为
テセントリク
(注册商标)而被销售)等抗pd-l1抗体等,但不限定于此。
[0058]
作为ctla-4抑制剂,可举出伊匹单抗、替西木单抗等抗ctla-4抗体等,但不限定于此。
[0059]
作为免疫检查点抑制剂的其它例,可举出将tim-3、lag-3、b7-h3、b7-h4、b7-h5(vista)、tigit等免疫检查点蛋白质作为靶标的药剂等。
[0060]
其中,作为被应用于本实施方式的方法的免疫检查点抑制剂,优选为pd-1抑制剂或pd-l1抑制剂,更优选为抗pd-1抗体或抗pd-l1抗体。如果为抗pd-1抗体或抗pd-l1抗体,则应用本实施例所记载的选自纳武利尤单抗、帕博利珠单抗、和阿特珠单抗中的1种以上也同样是优选的。
[0061]
<用于判定免疫检查点抑制剂感受性的来源于外泌体的蛋白质>
[0062]
发明人等如后述实施例所示那样,解析了对免疫检查点抑制剂的感受性明显的肺癌患者的应答者10例和非应答者10例的血液中的外泌体。其结果,鉴定存在于外泌体中的2406种蛋白质,从其中发现了成为药剂感受性判定中的判别能力的指标的roc曲线的auc(曲线下面积,area under the curve)的值为0.8以上的来源于外泌体的蛋白质。进一步,基于roc曲线的auc值和最佳截断(cut off)值用python来构建算法,发现了将上述蛋白质组合而成的、具有在临床上能够使用的灵敏度和特异度的多标志物。
[0063]
<用于预测对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的方法>
[0064]
本发明的一种实施方式涉及的用于预测对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的方法(以下,有时简称为“本实施方式的方法”)是包含从来源于肺癌患者的生物体试样中分离外泌体,通过质谱分析法来确定存在于上述外泌体中的蛋白质的表达量(以下,有时称为“本工序”)的方法。在本说明书和权利要求书中,“伴随诊断药”是指为了预测药品对各肺癌患者的效果、副作用的风险、适当的投药量,而在实际开始投药前进行的检查中使用的诊断药。
[0065]
上述蛋白质为选自以下表4-1~表4-19所示的蛋白质组中的1种以上蛋白质。这些蛋白质如后述实施例所示那样,可以说是成为药剂感受性判定中的判别能力的指标的roc曲线的auc值为0.8以上,且用于预测对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的灵敏度和特异度优异的生物标志物。因此,根据本实施方式的方法,可以高精度地预测对肺癌患者的采用免疫检查点抑制剂进行的治疗的有效性。
[0066]
以下表4-1~表4-19所示的蛋白质组与上述表1-1~表1-6所示的蛋白质组相同,关于上述表1-1~表1-6所示的蛋白质组,显示编码人的各蛋白质的mrna的碱基序列的genbank的登录号、人的各蛋白质的氨基酸序列的genbank的登录号、编码人的各蛋白质的基因名称、人的各蛋白质的氨基酸序列的uniprot的登录号的信息。
[0067]
[表4-1]
[0068][0069]
[0070][0071]
[表4-2]
[0072]
[0073]
[0074][0075]
[表4-3]
[0076][0077][0078]
[表4-4]
[0079]
[0080][0081]
[表4-5]
[0082]
[0083]
[0084][0085]
[表4-6]
[0086]
[0087]
[0088][0089]
[表4-7]
[0090]
[0091][0092]
[表4-8]
[0093]
[0094]
[0095]
[0096][0097]
[表4-9]
[0098]
[0099][0100]
[表4-10]
[0101]
[0102][0103]
[表4-11]
[0104]
[0105]
[0106][0107]
[表4-12]
[0108]
[0109]
[0110][0111]
[表4-13]
[0112]
[0113][0114]
[表4-14]
[0115]
[0116][0117]
[表4-15]
[0118]
[0119][0120]
[表4-16]
[0121]
[0122][0123]
[表4-17]
[0124]
[0125]
[0126][0127]
[表4-18]
[0128]
[0129][0130]
[表4-19]
[0131][0132]
在上述表4-1~表4-19所示的蛋白质组中,例如,可以将选自上述表2所示的蛋白质组中的1种以上膜蛋白质优选用于本实施方式的方法。上述表2所示的蛋白质组如后述实施例所示那样,是由成为药剂感受性判定中的判别能力的指标的roc曲线的auc值为0.8以上的、36种膜蛋白质构成的组。
[0133]
此外,在上述表4-1~表4-19所示的蛋白质组中,例如,可以将选自上述表3所示的蛋白质组中的1种以上蛋白质优选用于本实施方式的方法。上述表3所示的蛋白质组如后述实施例所示那样,由成为药剂感受性判定中的判别能力的指标的roc曲线的auc值为0.8以上,并且关于具有药剂敏感性的患者(应答者)基于用youden idex计算出的阈值而不发生假阴性的、11种蛋白质构成的组。
[0134]
以下,对本实施方式的方法进行详细说明。
[0135]
作为本实施方式的方法所使用的生物体试样,可举出体液、细胞培养上清液、组织细胞的破碎液等各种液体。其中,优选为体液、或细胞培养上清液。作为体液,可举出全血、血清、血浆、各种血细胞、血块、血小板等、以及尿、精液、母乳、汗、间质液、间质性淋巴液、骨髓液、组织液、唾液、胃液、关节液、胸腔积液、胆汁、腹水、羊水等。其中,优选为血浆。另外,血浆可以用柠檬酸、肝素、edta等抗凝剂进行处理。
[0136]
生物体试样可以使用预先添加于公知的缓冲液等而进行了前处理的物质,但也可以直接使用从生物体摄取的物质。
[0137]
试样的量可以适当调整,例如,可以为1μl以上且1000μl以下,例如,可以为1μl以上且500μl以下。
[0138]
作为从生物体试样中分离外泌体的方法,可举出peg沉淀法、使用超速离心机等的分离法、利用外泌体捕捉用分子的免疫沉降法等,但不限定于此。其中,从可以在不进行前
处理的情况下简便地进行外泌体的选择性分离考虑,优选使用利用外泌体捕捉用分子的免疫沉降法。
[0139]
外泌体捕捉用分子包含与在外泌体表面表达的抗原对应的特异性结合物质。
[0140]
作为在外泌体表面表达的抗原,可举出例如,cd9、cd63、cd81,但不限定于此。
[0141]
外泌体捕捉用分子包含与这些抗原对应的特异性结合物质。
[0142]
作为特异性结合物质,可举出例如,与抗原特异性结合的物质。作为与抗原特异性结合的物质,可举出例如,抗体、适体。
[0143]
作为抗体,只要是对外泌体表面上的抗原序列(表位)具有结合能力的物质即可,具体而言,可举出例如,抗cd9抗体、抗cd63抗体、抗cd81抗体。这些抗体可以为单克隆抗体,也可以为多克隆抗体,但优选为单克隆抗体。此外,也可以混合使用多个抗体。进一步,这些抗体可以为双特异性抗体。作为抗体的种类,可举出例如,igg、igm,但优选为igg。此外,抗体可以为人源化抗体等嵌合抗体。抗体可以来源于人、小鼠、兔、牛、猪、马、绵羊、山羊等哺乳动物、鸡等鸟类等动物种类,没有特别限制。抗体例如可以从来源于上述动物种类的血清通过以往公知的方法来调制,可以使用根据公知的抗体基因序列信息而合成的抗体,也可以使用市售的抗体。
[0144]
此外,也可以代替抗体而使用抗体片段。作为抗体片段,可举出例如,fv、fab、fab’、f(ab’)2、rigg、scfv。
[0145]
所谓适体,是具有对靶物质的特异性结合能力的物质。作为适体,可举出核酸适体、肽适体等。对抗原具有特异性结合能力的核酸适体,例如,可以通过systematic evolution of ligand by exponential enrichment(通过指数富集实现配体的系统进化,selex)法来挑选。此外,对抗原具有特异性结合能力的肽适体,例如,可以通过使用了酵母的双杂交(two-hybrid)法来挑选。
[0146]
外泌体捕捉用分子优选被固定于固相载体。
[0147]
作为固相载体的材质,可举出聚苯乙烯类、聚乙烯类、聚丙烯类、聚酯类、聚(甲基)丙烯腈类、苯乙烯-丁二烯共聚物、聚(甲基)丙烯酸酯类、氟树脂、交联葡聚糖、多糖等高分子化合物;玻璃;金属;磁性体;包含磁性体的树脂组合物;它们的组合。
[0148]
此外,固相载体的形状没有特别限定,可举出例如,托盘状、球状、粒子状、纤维状、棒状、盘状、容器状、单元格、微板、微流体器件、试管。
[0149]
在本工序中,优选为磁性粒子。
[0150]
作为上述磁性粒子,可举出四氧化三铁(fe3o4)、三氧化二铁(γ-fe2o3)、各种铁氧体、铁、锰、镍、钴、铬等金属;由钴、镍、锰等的合金形成的磁性体微粒;树脂中包含这些磁性体的磁性粒子。作为树脂,可举出疏水性聚合物、亲水性聚合物等。
[0151]
其中,优选为树脂中包含磁性体的磁性粒子,更优选为在包含超顺磁性微粒的母粒子的表面形成了聚合物层的物质。可举出例如,日本特开2008-32411号公报(参考文献1)所记载的、在包含超顺磁性微粒的母粒子的表面形成疏水性的第1聚合物层,在该第1聚合物层上形成至少表面具有缩水甘油基的第2聚合物层,将该缩水甘油基进行化学修饰,从而导入了极性基的磁性粒子。
[0152]
这里,作为超顺磁性微粒,粒径20nm以下(优选为粒径5nm以上且20nm以下)的氧化铁系的微粒是代表性的,可举出由xfe2o4(x=mn、co、ni、mg、cu、li
0.5
fe
0.5
等)表现的铁氧体、
由fe3o4表现的磁铁矿、γ-fe2o3,在饱和磁化强、并且残留磁化少方面,优选包含γ-fe2o3和fe3o4中的任一者。
[0153]
此外,用于形成上述疏水性的第1聚合物层的单体被大致区分为单官能性单体、交联性单体。
[0154]
作为上述单官能性单体,可举出苯乙烯、α-甲基苯乙烯、卤代苯乙烯等芳香族乙烯基系单体;丙烯酸甲酯、甲基丙烯酸甲酯、丙烯酸乙酯、甲基丙烯酸乙酯、丙烯酸硬脂基酯、甲基丙烯酸硬脂基酯、丙烯酸环己酯、甲基丙烯酸环己酯、丙烯酸异冰片基酯、甲基丙烯酸异冰片基酯等烯属不饱和羧酸烷基酯系单体。
[0155]
此外,作为上述交联性单体,可举出乙二醇二丙烯酸酯、乙二醇二甲基丙烯酸酯、三羟甲基丙烷三丙烯酸酯、三羟甲基丙烷三甲基丙烯酸酯、季戊四醇三丙烯酸酯、季戊四醇三甲基丙烯酸酯、二季戊四醇六丙烯酸酯、二季戊四醇六甲基丙烯酸酯等多官能性(甲基)丙烯酸酯;丁二烯、异戊二烯等共轭二烯烃、以及二乙烯基苯、邻苯二甲酸二烯丙酯、丙烯酸烯丙酯、甲基丙烯酸烯丙酯。
[0156]
此外,用于形成上述第2聚合物层的单体以向粒子表面导入官能团作为主要目的,包含含有缩水甘油基的单体。作为含有缩水甘油基的单体的含量,在用于形成第2聚合物层的单体中,优选为20质量%以上。这里,作为包含缩水甘油基的共聚性单体,可举出例如,丙烯酸缩水甘油酯、甲基丙烯酸缩水甘油酯、烯丙基缩水甘油基醚。
[0157]
作为通过将第2聚合物层的缩水甘油基进行化学修饰从而被导入的极性基,优选为能够和与在癌细胞表面表达的抗原对应的特异性结合物质反应的官能团,更优选为包含1个以上选自氧原子、氮原子和硫原子中的至少1种原子的基团。其中,更优选为氨基、醛基、羧基、或活性酯基。特别是,在磁性粒子的第2聚合物层具有上述极性基和2,3-二羟基丙基的情况下,和与在外泌体表面表达的抗原对应的特异性结合物质(特别是,与在外泌体表面表达的抗原对应的抗体)的结合性变得良好。
[0158]
作为将与在外泌体表面表达的抗原对应的特异性结合物质结合于固相载体的方法,使用物理吸附法、共价键合法、离子键合法这样的化学结合的方法等。作为物理吸附法,可举出将与在外泌体表面表达的抗原对应的特异性结合物质直接固定于固相载体的方法、与白蛋白等其它蛋白质化学结合后使其吸附而固定的方法等。作为化学结合的方法,可举出利用导入到固相载体表面的、能够和与在外泌体表面表达的抗原对应的特异性结合物质反应的官能团,在固相载体上直接结合的方法;在固相载体和与在外泌体表面表达的抗原对应的特异性结合物质之间将间隔分子(碳二亚胺化合物等)通过化学键合导入后结合的方法;使与在外泌体表面表达的抗原对应的特异性结合物质与白蛋白等其它蛋白质结合后,将该蛋白质与固相载体化学结合的方法等。
[0159]
使用外泌体捕捉用分子的免疫沉降法除了上述各成分以外,可以根据需要使用盐类、白蛋白等蛋白质、表面活性剂等。
[0160]
使用外泌体捕捉用分子的免疫沉降法中的反应温度通常为2℃以上且42℃以下的范围内,反应时间通常为5分钟以上且24小时以下。在2℃以上且8℃以下进行反应的情况下,反应时间优选为8小时以上且30小时以下,在8℃以上且42℃以下进行反应的情况下,反应时间优选为5分钟以上且24小时以下。
[0161]
在使用外泌体捕捉用分子的免疫沉降法中,体系中的ph没有特别限定,但优选为
ph5以上且10以下的范围,更优选为ph6以上且8以下的范围。为了维持目标的ph,通常使用缓冲液,例如,使用磷酸缓冲液、三(羟基甲基)氨基甲烷缓冲液、hepes缓冲液、mes缓冲液。
[0162]
此外,在使用1种以上固定了外泌体捕捉用分子的固相载体的情况下,其使用量和混合比率没有特别限定,但相对于体系内的液相的总量,优选为0.00001~10w/v%,更优选为0.00001~5w/v%,进一步优选为0.001~0.1w/v%。
[0163]
接着,使用质谱分析法,确定存在于被分离出的外泌体的蛋白质的表达量。
[0164]
成为表达量的确定对象的蛋白质为选自上述表4-1~表4-19所示的蛋白质组中的1种以上蛋白质。
[0165]
在使用质谱分析法的情况下,在质谱分析前可以进行用于将存在于外泌体的物质分离的前处理。作为分离方法,可以使用各种色谱分离技术,更具体而言,可举出例如,液相色谱(liquid chromatography;lc)、高效液相色谱(high performance liquid chromatography;hplc)、气相色谱(gas chromatography;gc)、薄层色谱、尺寸排阻色谱,但不限定于此。其中,优选为液相色谱或高效液相色谱。
[0166]
作为质谱分析法,可举出串联四极杆型质谱分析(ms/ms)法、直接注入质谱分析法、傅里叶变换离子回旋共振质谱分析(fourier transform ion cyclotron resonance mass spectrometry;ft-icr-ms)法、毛细管电泳质谱分析(capillary electrophoresis mass spectrometry;ce-ms)法、电感耦合等离子体质谱分析(inductively coupled plasma mass spectrometry;icp-ms)法、热分解质谱分析(pyrolysis mass spectroscopy;py-ms)法、离子迁移率质谱分析法、飞行时间型质谱分析(time-of-flight mass spectromete;tof ms)法等。
[0167]
其中,作为质谱分析法,优选为与上述分离方法结合了的质谱分析法,可举出例如,gc-ms法、lc-ms法、hplc-ms法、lc-ms/ms法、hplc-ms/ms法,但不限定于此。
[0168]
蛋白质的表达量例如可以在质谱分析法中通过使用了dia(数据非依赖性采集,data-independent acquisition)法的解析来确定。dia法是数据非依赖性的解析法,是将某一定的质量范围所包含的离子全部进行ms/ms分析的网罗性的解析法。其中作为dia法之一的swath法例如为反复进行一边错开100da宽度的窗口一边获取10次ms/ms的操作,记录落入到合计1,000da宽度的全部离子的ms/ms光谱(窗口宽度、获取次数可变)的方法。
[0169]
在本实施方式的方法中,基于被确定的蛋白质的表达量,预测成为评价对象的生物体试样来源的肺癌患者的采用免疫检查点抑制剂进行的治疗的有效性。
[0170]
具体而言,在蛋白质的表达量为预先设定的基准值以下的情况下,可以评价或预测:成为评价对象的生物体试样来源的肺癌患者具有对免疫检查点抑制剂的敏感性的可能性,即,具有采用免疫检查点抑制剂的治疗是有效的可能性。另一方面,在蛋白质的表达量超过预先设定的基准值的情况下,可以评价或预测:成为评价对象的生物体试样来源的肺癌患者可能不具有对免疫检查点抑制剂的敏感性,即,可能采用免疫检查点抑制剂的治疗不是有效的。该基准值为用于识别具有对免疫检查点抑制剂的敏感性的肺癌患者组(应答者组)和不具有对免疫检查点抑制剂的敏感性的肺癌患者组(非应答者组)的基准值。
[0171]
该基准值例如可以测定存在于应答者组和非应答者组的外泌体的特定的蛋白质的表达量,作为能够将两组区别的阈值而根据实验求出。作为本实施方式的方法中的特定的蛋白质的表达量的基准值的确定方法,没有特别限定,例如,可以使用一般的统计学的方
法来确定。这里所谓特定的蛋白质,是指选自上述表4-1~4-19所示的蛋白质组中的1种以上蛋白质。
[0172]
作为基准值的确定方法,具体而言,例如,关于通过一般进行的图像诊断等方法而被诊断为肺癌的患者,测定预先在免疫检查点抑制剂施与前收集到的生物体试样中的存在于外泌体的特定的蛋白质的表达量。可以在对多个患者进行了测定后,从其平均值或中心值等算出这些生物体试样中的存在于外泌体的特定的蛋白质的表达量,将包含其的数值作为基准值。此外,优选在与该评价或预测方法有关的试剂盒的说明书等中记载该基准值。
[0173]
此外,可以对多个应答者组和多个非应答者组,分别测定预先在施与免疫检查点抑制剂前收集到的生物体试样中的存在于外泌体的特定的蛋白质的表达量,从平均值或中心值等分别算出应答者组和非应答者组的生物体试样中的存在于外泌体的特定的蛋白质的表达量及其偏差后,也考虑偏差而求出能够区别两数值那样的阈值,将其作为基准值。
[0174]
<其它实施方式>
[0175]
在一种实施方式中,本发明提供由选自上述表1-1~表1-6所示的蛋白质组中的1种以上蛋白质构成的、用于预测或诊断对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的生物标志物。
[0176]
在一种实施方式中,本发明提供由选自上述表2所示的蛋白质组中的1种以上膜蛋白质构成的、用于预测或诊断对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的生物标志物。
[0177]
在一种实施方式中,本发明提供由选自上述表3所示的蛋白质组中的1种以上蛋白质构成的、用于预测或诊断对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的生物标志物。
[0178]
在一种实施方式中,本发明提供一种方法,是诊断对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的方法,即,对肺癌患者的免疫检查点抑制剂的伴随诊断方法,
[0179]
包含:从来源于上述肺癌患者的生物体试样中分离外泌体,通过质谱分析法来确定存在于上述外泌体中的蛋白质的表达量,
[0180]
上述蛋白质为选自上述表1-1~表1-6所示的蛋白质组中的1种以上蛋白质。
[0181]
在一种实施方式中,本发明提供一种方法,是诊断对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的方法,即,对肺癌患者的免疫检查点抑制剂的伴随诊断方法,
[0182]
包含:从来源于上述肺癌患者的生物体试样中分离外泌体,通过质谱分析法来确定存在于上述外泌体中的蛋白质的表达量,
[0183]
上述蛋白质为选自上述表2所示的蛋白质组中的1种以上蛋白质。
[0184]
在一种实施方式中,本发明提供一种方法,是诊断对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性的方法,即,对肺癌患者的免疫检查点抑制剂的伴随诊断方法,
[0185]
包含:从来源于上述肺癌患者的生物体试样中分离外泌体,通过质谱分析法来确定存在于上述外泌体中的蛋白质的表达量,
[0186]
上述蛋白质为选自上述表3所示的蛋白质组中的1种以上蛋白质。
[0187]
实施例
[0188]
以下,通过实施例说明本发明,但本发明不限定于以下实施例。
[0189]
[实施例1]
[0190]
1.外泌体的lc-ms解析
[0191]
(1)生物体试样的调制
[0192]
将作为日本人的肺癌患者20例的edta血浆(施与纳武利尤单抗、帕博利珠单抗、或阿特珠单抗前)用于以下试验。关于肺癌患者组,按照recist指导原则,在施与纳武利尤单抗(12例)、帕博利珠单抗(6例)、或阿特珠单抗(2例)后,将被判定为pr(部分奏效)的患者10例(施与纳武利尤单抗的患者5例、施与帕博利珠单抗的患者4例、和施与阿特珠单抗的患者1例)作为应答者组,将被判定为sd(稳定)的3例(施与纳武利尤单抗的患者3例)和被判定为pd(进行)的患者7例(施与纳武利尤单抗的患者4例、施与帕博利珠单抗的患者2例、和施与阿特珠单抗的患者1例)作为非应答者组。
[0193]
(2)外泌体捕捉用抗体结合粒子
[0194]
使外泌体捕捉抗体(anti-cd9mab(mbl社制,mex001-3)、anti-cd63(lamp-3)mab(mbl社制,mex002-3)或anti-cd81(tapa1)mab(mbl社制,mex003-3))与磁性粒子(jsr
ライフサイエンス
株式会社制,magnosphere
tm ms300/carboxyl)结合,制作出3种抗体结合粒子。接着,将3种抗体结合粒子各等量地混合,将粒子终浓度0.06质量%的溶液作为抗体结合粒子液,用于以下试验。
[0195]
(3)外泌体的分离
[0196]
将冷冻熔化了的edta血浆用孔径0.22μm的膜滤器(merck millipore社制,slgv033rs)进行过滤,添加0.5ml到15ml的低吸附管(住友
ベークライト
株式会社制,ms-52150)中。接着,加入tbs4.5ml进行10倍稀释,进一步添加抗体结合粒子液5ml后,在室温下搅拌一晚。
[0197]
将反应后的抗体结合粒子转移到2ml低吸附管(住友
ベークライト
株式会社制,ms-4220m)中,用洗涤液(exocap
tm
ultracentrifugation/storage booster(mbl社制,mex-usb))洗涤4次。将抗体结合粒子转移到新的2ml低吸附管中,用tbs洗涤2次。然后添加2质量%十二烷基硫酸钠(sds)溶液50μl,在25℃下振荡了10分钟。将反应后的上清液添加到100k的超滤旋转柱(pall社制,od100c34)中,以10,000
×
g离心5分钟后,将滤液回收到2ml低吸附管中,设为外泌体提取液。
[0198]
(4)外泌体蛋白质的lc-ms/ms解析
[0199]
将外泌体提取液25μl转移到1.5ml管(eppendorf社制,0030123328),加入8倍量的冷丙酮,在-20℃下静置2小时。接着,以4℃、15,000
×
g离心15分钟后,在沉淀物中加入含有0.5质量%十二烷酸钠的100mm tris(ph8.5)溶液20μl,通过密闭式超声波破碎机将蛋白质溶解。为了将蛋白质的s-s键切断,以终浓度成为10mm的方式添加二硫苏糖醇(dtt)并在50℃下使其反应30分钟。为了将半胱氨酸残基进行烷基化处理,以终浓度成为30mm的方式添加碘乙酰胺并在遮光条件下在室温下使其反应30分钟。为了停止反应,以终浓度成为60mm的方式添加半胱氨酸,在室温下静置10分钟。然后,添加50mm碳酸氢铵150μl后,添加lys-c(富士
フィルム
和光純薬社制,125-05061)250ng和胰蛋白酶(
プロメガ
社制,v5113)250ng,在37℃下使其反应一晚,将蛋白质分解为肽。为了除去十二烷酸钠而加入5质量%三氟乙酸(tfa)使溶液为酸性后,以15,000
×
g、室温离心10分钟,回收了上清液。使用c18柱进行脱盐后,用离心蒸发器干燥固化,加入含有3质量%乙腈-0.1质量%甲酸的溶液,用样品密闭式超声波破碎机将肽溶解,进行了lc-ms分析。lc-ms分析使用thermo fisher scientific社
制的q exactive
tm hf-x、和scaffold dia软件,进行了蛋白质的鉴定和相对定量值的计算。
[0200]
2.接受者操作特性(roc)曲线下面积(auc)的算出
[0201]
关于“1.(4)”的用scaffold dia软件进行了解析的蛋白质,提取proteinfdr成为1%以下的蛋白质,将被认为是污染的免疫球蛋白组和角蛋白组除外后,进行了相对定量值的标准化。从肺癌患者鉴定了蛋白质2406种。关于这些蛋白质,使用作为编程语言python的开源库的scikit-learn而算出成为判别能力的指标的auc,通过使用了youden index的方法,算出能够判别2组的阈值。将auc的值为0.7以上的蛋白质825种和auc的值示于表5-1~表5-54中。另外,将表5-19的“推测的二磷酸核苷激酶(putative nucleoside diphosphate kinase)”的氨基酸序列示于序列号1中。
[0202]
[表5-1]
[0203]
[0204][0205]
[表5-2]
[0206]
[0207][0208]
[表5-3]
[0209]
[0210][0211]
[表5-4]
[0212]
[0213][0214]
[表5-5]
[0215]
[0216]
[0217][0218]
[表5-6]
[0219]
[0220][0221]
[表5-7]
[0222]
[0223][0224]
[表5-8]
[0225]
[0226][0227]
[表5-9]
[0228]
[0229]
[0230][0231]
[表5-10]
[0232]
[0233]
[0234][0235]
[表5-11]
[0236]
[0237]
[0238][0239]
[表5-12]
[0240]
[0241][0242][0243]
[表5-13]
[0244]
[0245][0246]
[表5-14]
[0247]
[0248][0249]
[表5-15]
[0250]
[0251][0252]
[表5-16]
[0253]
[0254]
[0255][0256]
[表5-17]
[0257]
[0258]
[0259][0260]
[表5-18]
[0261]
[0262]
[0263][0264]
[表5-19]
[0265]
[0266][0267]
[表5-20]
[0268]
[0269][0270]
[表5-21]
[0271]
[0272]
[0273][0274]
[表5-22]
[0275]
[0276][0277]
[表5-23]
[0278]
[0279][0280]
[表5-24]
[0281]
[0282][0283]
[表5-25]
[0284]
[0285][0286]
[表5-26]
[0287]
[0288]
[0289][0290]
[表5-27]
[0291]
[0292][0293]
[表5-28]
[0294]
[0295][0296]
[表5-29]
[0297]
[0298]
[0299][0300]
[表5-30]
[0301]
[0302]
[0303][0304]
[表5-31]
[0305]
[0306][0307]
[表5-32]
[0308]
[0309][0310]
[表5-33]
[0311]
[0312][0313]
[表5-34]
[0314]
[0315]
[0316][0317]
[表5-35]
[0318]
[0319]
[0320][0321]
[表5-36]
[0322]
[0323]
[0324][0325]
[表5-37]
[0326]
[0327][0328][0329]
[表5-38]
[0330]
[0331][0332]
[表5-39]
[0333]
[0334][0335]
[表5-40]
[0336]
[0337]
[0338][0339]
[表5-41]
[0340]
[0341][0342]
[0343]
[表5-42]
[0344]
[0345]
[0346]
[0347]
[0348][0349]
[表5-43]
[0350]
[0351]
[0352][0353]
[表5-44]
[0354]
[0355]
[0356][0357]
[表5-45]
[0358]
[0359][0360]
[表5-46]
[0361][0362]
[表5-47]
[0363]
[0364][0365]
[表5-48]
[0366]
[0367]
[0368][0369]
[表5-49]
[0370]
[0371]
[0372][0373]
[表5-50]
[0374]
[0375]
[0376][0377]
[表5-51]
[0378]
[0379]
[0380][0381]
[表5-52]
[0382]
[0383]
[0384][0385]
[表5-53]
[0386]
[0387][0388]
[表5-54]
[0389]
[0390][0391]
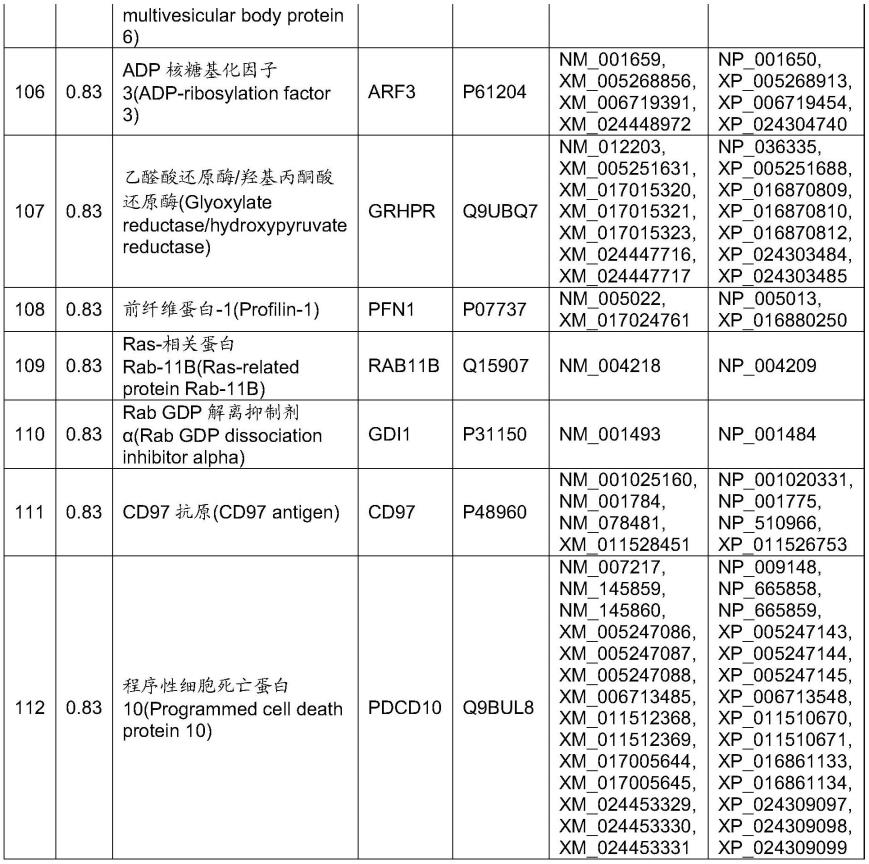
如表5-1~表5-54所示那样,从肺癌患者血液中的存在于外泌体中的蛋白质中,发现了可以用于药剂感受性判定的蛋白质组。
[0392]
3.膜蛋白质组的提取
[0393]
基于the human protein atlas(https://www.proteinatlas.org/)的预测的膜蛋白(predicted membrane proteins)信息,从上述表5-1~表5-54的蛋白质组提取出膜蛋白质组。将所得的膜蛋白质的列表示于表6-1~表6-15中。
[0394]
[表6-1]
[0395][0396][0397]
[表6-2]
[0398]
[0399][0400]
[表6-3]
[0401]
[0402]
[0403][0404]
[表6-4]
[0405]
[0406][0407]
[表6-5]
[0408]
[0409][0410]
[表6-6]
[0411]
[0412][0413]
[表6-7]
[0414]
[0415][0416]
[表6-8]
[0417]
[0418][0419]
[表6-9]
[0420]
[0421][0422]
[表6-10]
[0423]
[0424][0425]
[表6-11]
[0426]
[0427][0428]
[表6-12]
[0429]
[0430][0431]
[表6-13]
[0432]
[0433][0434]
[表6-14]
[0435]
[0436][0437]
[表6-15]
[0438]
[0439][0440]
如表6-1~表6-15所示那样,关于auc0.8以上,检测到36种膜蛋白质,关于0.7以上,检测到168种膜蛋白质。
[0441]
4.关于具有药剂感受性的患者(应答者)不产生假阴性的蛋白质组的提取
[0442]
关于应答者10例,基于用youden index计算出的阈值而提取不产生假阴性的蛋白质组,将按照auc降序排列的结果示于表7-1~表7-4中。
[0443]
[表7-1]
[0444]
[0445]
[0446][0447]
[表7-2]
[0448]
[0449]
[0450][0451]
[表7-3]
[0452]
[0453][0454]
[表7-4]
[0455][0456]
如表7-1~表7-4所示那样,关于auc0.8以上,存在11种蛋白质,关于0.7以上,存在47种蛋白质。可以认为通过将这些标志物组合,从而能够构建抗错误性强的多标志物。
[0457]
产业可利用性
[0458]
根据本实施方式的方法,可以高精度地预测对肺癌患者采用免疫检查点抑制剂进行的治疗的有效性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1