生物电子装置和系统中的电子电导
生物电子装置和系统中的电子电导
1.政府支持
2.本发明是在美国国立卫生研究院颁发的授权号hg006323和r21hg010522下在政府支持下完成的。政府拥有本发明的某些权利。
3.相关申请的交叉引用
4.本技术要求2020年2月12日提交的美国临时专利申请号62/975,748的优先权和权益,该申请以引用的方式整体并入本文用于所有目的。
技术领域
5.本公开提供了与蛋白质生物电子学相关的装置、系统和方法。具体而言,本公开提供了利用确定的电势来使感兴趣的蛋白质的电导最大化的生物电子装置、系统和方法,所述生物电子装置、系统和方法可以作为制造用于蛋白质活性的直接测量的增强型生物电子装置的基础。
背景技术:
6.当蛋白质执行其各种功能时,产生作为这些功能的基础的运动。开发测量与活性蛋白质产生的波动相对应的电学特征的装置、系统和方法的能力可以作为蛋白质功能的无标签检测和分析的基础。例如,监测活性酶的功能波动可以提供一种快速而简单的筛选影响酶的功能的候选药物分子的方法。在其他情况下,监测处理生物聚合物(例如,碳水化合物、多肽、核酸等等)的蛋白质波动的能力可以揭示关于它们的构象变化以及这些变化如何与功能相关的新信息。另外,可以开发利用活性蛋白质产生的电学特征的诊断和分析装置,从而提供利用生物力学性质进行实际应用的新方式。
7.生物电子学研究主要集中于氧化还原活性蛋白质,这是由于它们在生物电荷传输中的作用。在这些蛋白质中,当电子以已知的蛋白质的氧化还原电势注入时,电子电导最大。最近的研究已经表明,很多非氧化还原活性蛋白质是良好的电子导体,但是传导机制尚不清楚。另外,大多数生物电子装置使用金来进行装置制造。金是分子电子装置中使用最广泛的金属,部分原因是在金上制备高质量的分子单层相对容易,部分原因是它被用于制备分子断裂结,这是将分子安装在电极结中的最常见方法。然而,金的一般延展性也给装置制造带来了挑战。因此,需要用于制造具有增强的电导以及改善的组成和几何形状的生物电子装置的替代材料和方法。
技术实现要素:
8.本公开的实施方案包括生物电子装置,所述生物电子装置包括由间隙间隔开的第一电极和第二电极,以及经由连接基附接至所述第一电极和所述第二电极的蛋白质。根据这些实施方案,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约400mv。
9.在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约
250mv至约400mv时,所述蛋白质的电导最大化。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约350mv。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约400mv的表面电势。
10.在一些实施方案中,所述第一电极和所述第二电极中的至少一者包括与另一个电极不同的金属。在一些实施方案中,所述第一电极和所述第二电极中的至少一者包括金或其合金。在一些实施方案中,所述第一电极和所述第二电极二者均包括金或其合金。在一些实施方案中,所述第一电极包括金或其合金,并且所述第二电极包括不同的金属或其合金。在一些实施方案中,所述第二电极包括钯或其合金。在一些实施方案中,所述第二电极包括铂或其合金。
11.在一些实施方案中,所述装置包括参考电极。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约400mv。在一些实施方案中,所述参考电极包括第三电极,所述第三电极浸入电解质溶液中并且与所述第一电极和所述第二电极接触。
12.在一些实施方案中,所述间隙具有约1.0nm至约20.0nm的宽度。在一些实施方案中,所述第一电极和所述第二电极由介电层间隔开。
13.在一些实施方案中,所述蛋白质是非氧化还原蛋白。在一些实施方案中,所述蛋白质选自由以下各项组成的组:聚合酶、核酸酶、蛋白酶体、糖肽酶、糖苷酶、激酶和核酸内切酶。
14.在一些实施方案中,所述连接基附接至所述蛋白质的非活性区域。在一些实施方案中,所述连接基包括共价化学键。在一些实施方案中,所述连接基包括特异性结合所述蛋白质的区域的配体。在一些实施方案中,所述蛋白质是生物素酰化的。在一些实施方案中,所述连接基包括硫代链霉亲和素。在一些实施方案中,所述蛋白质以及所述第一电极和所述第二电极是生物素酰化的,并且其中所述连接基包括链霉亲和素分子,所述链霉亲和素分子包含至少两个生物素结合位点。
15.本公开的实施方案还包括一种用于蛋白质活性的直接电测量的系统。根据这些实施方案,所述系统包括以下中的任一者:本文所述的生物电子装置、用于引入能够与所述蛋白质相互作用的分析物的装置、用于在所述第一电极和所述第二电极之间施加100mv或更低的偏压的装置以及用于监测化学实体与所述蛋白质相互作用时发生的波动的装置。
16.本公开的实施方案还包括阵列,所述阵列包括多个本文所述的生物电子装置中的任一者。
17.在一些实施方案中,所述阵列包括用于引入能够与所述蛋白质相互作用的分析物的装置、用于在所述第一电极和所述第二电极之间施加100mv或更低的偏压的装置以及用于监测化学实体与所述蛋白质相互作用时发生的波动的装置。
18.本公开的实施方案还包括用于蛋白质活性的直接电测量的方法。根据这些实施方案,所述方法包括将能够与所述蛋白质相互作用的分析物引入本文所述的生物电子装置中的任一者,在所述第一电极和所述第二电极之间施加100mv或更低的偏压,以及观察当所述分析物与所述蛋白质相互作用时发生的所述第一电极和所述第二电极之间的电流波动。
19.在一些实施方案中,所述分析物是生物聚合物,所述生物聚合物选自由以下各项
组成的组:dna分子、rna分子、肽、多肽或聚糖。
附图说明
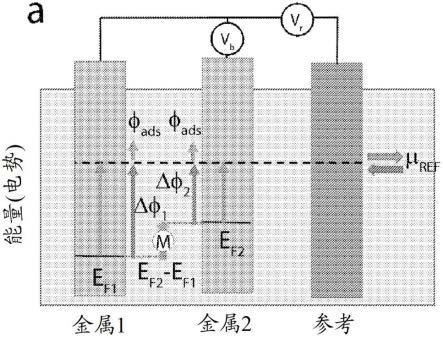
20.图1a至图1d:在电势控制下测量蛋白质电导。(a)示出了当具有不同功函数的两种金属连接至参考电极时产生的表面电势。假设分子m位于由两种金属的表面电势差产生的电势梯度的中间。(b)蛋白质电导的stm测量示出了链霉亲和素蛋白(绿色)通过硫醇化生物素分子(红色)结合至电极。基板相对于盐桥参考电极而言保持在电势vr。对于电导测量,在桥中使用低(10mm)kcl浓度,从而相对于nhe产生360mv的电势差。(c)单个链霉亲和素分子的典型电流-电压(iv)曲线。黑色数据点向上扫描,红色数据点向下扫描。绿线是产生这种特定触点几何形状的电导的线性拟合。(d)如图所标记,来源于针对au、pd和pt电极上的生物素/链霉亲和素的许多此类iv曲线的电导分布。虚线表示在au电极的情况下峰ii和iii在分布中的位置。
21.图2a至图2d:链霉亲和素电导取决于电势。(a)使用连接在电极和盐桥参考电极之间的高阻抗电压计来测量静止电势(v
rest
)。在这种情况下,kcl浓度为3m,对应于相对于nhe标度的210mv偏移。(b)静止电势随表面官能化的变化。使用nhe的功函数将来自uhv的点转换为nhe标度。(c)链霉亲和素分子的电导峰值是电极材料的函数(如图所标记,所列出的第一材料是stm尖端,第二材料是基板)。绿色三角形表示尖端和基板材料的颠倒组合。(d)电导峰作为pd电极上的链霉亲和素的电势(图1a中的vr)的函数测量。图1c和图1d中的误差条是拟合电导分布的不确定性。
22.图3a至图3b:抗体和聚合酶示出了电导对电势的类似依赖性。(a)示出了电极组合的抗dnp ige分子的电导(蓝色三角形表示尖端/基板的颠倒组合)。(b)在链霉亲和素官能化的电极之间捕获的双生物素酰化ф29聚合酶的类似分布。绿色三角形是颠倒金属组合。洛伦兹拟合的参数在表2中给出。
23.图4:在原位氢等离子清洁后三种金属的ups波谱。使用线性拟合法确定二次电子发射截止值。功函数是光子能量与该二次电子发射截止值之间的能量差。功函数是真空能级与费米能量之间的差值的度量。
24.图5:针对尖端(所列出的第一金属)-基板(所列出的第二金属)组合的链霉亲和素-生物素系统(间隙=2.5nm)的电导分布。
25.图6:针对所列出的基板电势与10mm盐桥ag/agcl参考电极以及pd电极的链霉亲和素-生物素系统(间隙=2.5nm)的电导分布。这些电势通过加上380mv转换为nhe。
26.图7:示出了三种金属的dnp-抗dnp igg系统(间隙=4.5nm)的电导分布。
27.图8:针对尖端(所列出的第一金属)-基板(所列出的第二金属)组合的dnp-抗dnp igg系统(间隙=4.5nm)的电导分布。
28.图9:示出了三种金属的生物素-sa-ф29系统(间隙=4.5nm)的电导分布。
29.图10:针对尖端(所列出的第一金属)-基板(所列出的第二金属)组合的生物素-sa-ф29系统(间隙=4.5nm)的电导分布。
30.图11:在测量的表面电势范围内电导分布的可逆性(所示的值与10mm盐桥ag/agcl电极进行比较)。拟合参数列于表8中。
31.图12:链霉亲和素(1vwa)、ф29聚合酶(2pyj)和ige分子(4grg)中的酪氨酸(黄色)
和色氨酸(红色),其中代码是pdb id。
32.图13:用硫醇化生物素修饰的pd、pt和au表面的ftir扫描。顶部记录是散装(二硫化物)粉末。
33.图14:根据本公开的一个实施方案的分子结的代表性示意图,其中底部金电极的边缘被密封。
34.图15:根据本公开的一个实施方案的分子结的代表性示意图,其中第一电极的边缘上具有附加电介质。
35.图16:根据本公开的一个实施方案的完整分子结的代表性示意图,其中在第一电极的边缘处的结金属之间具有附加电介质。
36.图17:根据本公开的一个实施方案的包含感兴趣蛋白质的分子结的代表性示意图。
37.图18:根据本公开的一个实施方案的包括多个生物电子装置的阵列的代表性示意图。
具体实施方式
38.生物电子学研究主要集中于氧化还原活性蛋白质,这是由于它们在生物电荷传输中的作用。在这些蛋白质中,当电子以已知的蛋白质的氧化还原电势注入时,电子电导最大。最近的研究已经表明,很多非氧化还原活性蛋白质是良好的电子导体,但是传导机制尚不清楚。本公开的实施方案展示了作为电子注入能量的函数的在溶液中维持在电势控制下的三种非氧化还原活性蛋白质的电导的单分子测量。全部三种蛋白质在从它们的组成氨基酸的最近氧化电势移开约0.7v的电势下显示出电导共振。如果这种偏移反映了蛋白质内部重组能的减少,那么它可以解释当将载流子注入蛋白质内部时观察到的长程电导。
39.本章节中使用的章节标题和本文的全部公开内容仅用于组织目的,并且不旨在进行限制。
40.1.定义
41.除非另有定义,否则本文使用的所有技术和科学术语与本领域的普通技术人员的通常理解具有相同的含义。如有冲突,以本文档(包括定义)为准。尽管与本文描述的那些方法和材料类似或等效的方法和材料可在本公开的实践或测试中,但在下文中描述了优选方法和材料。本文中提及的所有公布、专利申请、专利和其他参考文献整体以引用方式并入。本文公开的材料、方法和示例仅仅是说明性的而不是旨在作为限制性的。
42.如本文所述,公开的实施方案仅出于说明性目的而不是限制性的。其他实施方案是可能的并且被本公开所覆盖,这将从本文所包含的教导中显而易见。因此,本公开的广度和范围不应受上述实施方案中的任一者的限制,而应仅根据本公开所支持的权利要求及其等同形式来定义。此外,本公开的实施方案可以包括方法、组合物、系统和设备/装置,其可以进一步包括来自任何其他公开的方法、组合物、系统和装置的任何和所有元件,包括对应于检测蛋白质活性的任何和所有元件。换句话说,来自一个或另一个公开的实施方案的元件可以与来自其他公开的实施方案的元件互换。此外,一些另外的实施方案可以通过将本文公开的一个和/或另一个特征与在以引用的方式并入的材料中公开的方法、组合物、系统和装置以及它们的一个或多个特征组合来实现。此外,公开的实施方案的一个或多个特征/
元件可以被移除,并且仍然产生可授予专利的主题(并且因此产生本公开的另外更多的实施方案)。此外,与现有技术的教导相比,一些实施方案对应于特别地缺少一个和/或另一个元件、结构和/或步骤(如适用)的方法、组合物、系统和装置,因此表示可授予专利的主题并且可与现有技术教导区分开(即,针对此类实施方案的权利要求可以包含负面限制,以指出缺少现有技术教导的一个或多个特征部)。
43.如本文所定义和使用的所有定义应理解为支配字典定义、以引用的方式并入的文档中的定义和/或所定义术语的普通含义。
44.如本文在说明书和权利要求中所用的不定冠词“一个”和“一种”,除非明确指明相反,否则应理解为意指“至少一个/一种”。
45.如本文在说明书和权利要求中所用的短语“和/或”应理解为意指这样结合的元件中的“任一者或两者”,即,在一些情况下结合存在而在其他情况下分离存在的元件。用“和/或”列出的多个元件应以相同的方式解释,即“一个或多个”这样结合的元件。除了以“和/或”子句特别标识的元件之外,可以任选地存在其他元件,无论与那些特别标识的元件相关还是不相关。因此,作为非限制性示例,当与开放式语言诸如“包括”结合使用时,对“a和/或b”的引用在一个实施方案中可以仅指a(任选地包括除b之外的元件);在另一个实施方案中,仅指b(任选地包括除a之外的元件);在又一个实施方案中,指a和b二者(任选地包括其他元件);等等。
46.如本文在说明书和权利要求中所用的“或”应理解为与如上定义的“和/或”具有相同的含义。例如,当分隔列表中的项目时,“或”或者“和/或”应解释为具有包容性,即包括至少一个,但还包括多于一个的元件数量或列表,以及任选地其他未列出的项目。仅明确指出相反的术语,诸如“仅一个”或“恰好一个”,或当在权利要求中使用时,“由
……
组成”将指包括多个元件或元件列表中的恰好一个元件。一般而言,如本文所用的术语“或”,当前面带有排他性术语时,诸如“任一个”、“一个”、“仅一个”或“恰好一个”,仅应解释为表示排他性的替代项(即“一个或另一个但不是它们二者”)。权利要求中使用的“基本上由
……
组成”应具有在专利法领域中使用的普通含义。
47.如本文在说明书和权利要求中所用,在提及一个或多个元件的列表时,短语“至少一个”应理解为意指选自元件列表中的任何一个或多个元件的至少一个元件,但是不一定包括元件列表中特别列出的每个和每一个元件中的至少一个,并且不排除元件列表中的元件的任何组合。该定义还允许除在短语“至少一个”所指的元件列表中特别标识的元件之外的元件可以任选地存在,无论与那些特别标识的元件相关还是不相关。因此,作为非限制性示例,“a和b中的至少一个”(或等效地“a或b中的至少一个”,或等效地“a和/或b中的至少一个”),在一个实施方案中,可以指至少一个,任选地包括多于一个a,其中b不存在(并且任选地包括除b之外的元件);在另一个实施方案中,指至少一个,任选地包括多于一个b,其中a不存在(并且任选地包括除a之外的元件);在又一个实施方案中,指至少一个,任选地包括多于一个a,以及至少一个,任选地包括多于一个b(并且任选地包括其他元件);等等。
48.在权利要求以及上述说明书中,所有过渡短语诸如“包括”、“包含”、“携带”、“具有”、“含有”、“涉及”、“持有”、“由
……
组成”等等应理解为开放式的,即意味着包括但不限于。如美国专利局专利审查程序手册第2111.03节所述,过渡短语“由
……
组成”和“基本上由
……
组成”应仅分别为封闭式或半封闭式过渡短语。
49.2.生物电子装置和系统
50.电子电导。通常认为蛋白质是绝缘体,这实际上是因为需要维持高外部电场,理论上是因为捕获载流子的强电子振动耦合。然而,关于蛋白质中的长程电子传输有充分证据,虽然几乎所有这些先前研究都集中在含有氧化还原中心的蛋白质,因为它们在生物电荷传输中的作用,并且因为大量证据表明在这些特定蛋白质中已经进化出最佳电子隧穿通路。受最近一项理论提议的启发,对一系列非氧化还原活性蛋白质的电子电导进行了测量,该提议表明不寻常的电学性质可以是所有功能蛋白质(而不仅仅是涉及电子转移的蛋白质)的特征。在排除离子电流的条件下,这些蛋白质在溶液中维持在电势控制下。只要通过配体或其他良好化学触点将电荷注入蛋白质内部,它们的电导就会很高,并且几乎不表现出随距离而衰减。这种性质具有重要的技术效果。例如,与合成分子线相比,蛋白质分子线可以自组装并且在更长的距离内传输电荷。这种电导已经显示出取决于蛋白质的构象,使得酶促过程,诸如dna合成,可以通过直接电读数来动态跟踪。
51.然而,非氧化还原活性蛋白质中的长程电荷传输的机制目前尚不清楚。电化学门控实验已经展示了氧化还原中心在电荷转移蛋白中的作用,其中电导被测量为与蛋白质结合的表面的电化学电势的函数。在氧化还原蛋白中,峰值电导与活性部位的已知的氧化还原电势一致。如上文所述,溶剂重组能对氧化还原电势有很大贡献,这在很大程度上取决于溶剂化介质。本公开的实施方案表明在三种非氧化还原活性蛋白质中存在电导最大值。在所研究的全部三种蛋白质中,峰值电势几乎相同,这表明存在共同传输机制。它发生的电势比溶液中的芳族氨基酸的氧化还原电势低约0.7v,这表明当这些相同的氨基酸残基被封闭在蛋白质内部时,有效的马库斯(marcus)重组能减少了这个量。
52.如本文所进一步描述,如果将氨基酸残基的氧化还原电势作为蛋白质中的分子状态能量的度量,则在非氧化还原活性蛋白质中观察到电导共振是出乎意料的。在三种电化学惰性蛋白质中观察到类似的共振强烈表明,相同的机制控制全部三种蛋白质的电导,并且负责传输的分子状态的能量位于nhe标度上大约+300mv处。在通过单个电子能级的共振隧穿的最简单模型中,电导对电子能量的依赖性以布赖特-维格纳(breit-wigner)公式描述:
[0053][0054]
右侧的表达式通过以下假设来简化:与左侧电极的耦合γ
l
等于与右电极的耦合,γr(=γ),这应该适用于在本公开的实施方案中产生较高的电导峰的对称键合分子几何形状。这是已经拟合以产生表2中列出的参数的洛伦兹函数,其中列出的半高全宽等于等式3中的γ的值的两倍。r2值表明这种拟合函数的选择是合理的。
[0055]
虽然连接基分子的特定化学性质改变了触点电阻,并且因此改变了系统的总电导,但是循环伏安法显示连接基不是电活性的(如本文所述的蛋白质的情况)。此外,化学连接基的多样化性质与本公开中展示的共振的普遍性质不相容。因此,共振很可能是蛋白质的内在共同特征。传导路径是通过蛋白质:这通过比较igg分子与对应的fab片段的反应、测量电导随距离的内部衰减以及当链霉亲和素结合生物素或聚合酶结合三磷酸核苷酸时感测电导变化的实验来展示。这表明这些蛋白质可以具有解释共振的共同特征。氨基酸中最接近的氧化还原电势是酪氨酸和色氨酸的氧化电势,相对于nhe为约1000至1200mv(虽然在
去质子化的复合物中该值可以非常低,约500mv)。全部三种蛋白质在它们的内部都含有很多这些残基(图12)。因此,蛋白质内部马库斯重组能垒的减少(由马提索夫(matyushov)提出的静电波动的非遍历采样产生)可以解释溶液中的这些氨基酸的氧化还原电势与完整蛋白质中的传导最大能量之间的差异。
[0056]
据报道,对于至少地部分嵌入蛋白质或电荷转移迅速的可接近的氧化还原中心,重组能也有类似的降低。例如,如果将这些相同的离子掺入蛋白质中,则过渡金属水离子的氧化还原电势显著降低,并且与平衡值1.4ev相比,细菌光合作用中的初级电荷分离的快速电子传输的能量损失降低至0.25ev。虽然全部三种蛋白质的峰值电导电势值几乎相同(表2),但是人们可以预期重组能的确切数量取决于原子标度细节,因此所观察到的微小差异可以非常重要。更深入地理解这些影响需要详细的分子建模,并且链霉亲和素蛋白可以足够小,以进行计算。
[0057]
共振隧穿(处于拟合布赖特-维格纳公式的共振形式)的观察,以及至少在一些蛋白质中,长衰减长度和与温度无关的电导似乎与圣捷尔吉(szent-gyorgyi)提出的传导带一致,但是蛋白质中的长寿命量子相干性的可能性是有争议的。然而,将朗道尔(landauer)公式扩展到有限温度的理论可以解释所有这些特征,而无需调用相干传输。在这种改进的朗道尔方法中,等式3中的γ's表示电极与最近的能量可用分子轨道之间的耦合。在简单单隧穿势垒模型中,电子耦合与键寿命呈指数相关,因此更强的耦合(即更大γ)应与更强的键合(或等效地更小的解离常数,kd)相关。dnp-抗dnp ige键的kd为65nm(γ=72mev),并且链霉亲和素-生物素的kd为约10fm(γ=180mev),在定性上与键合强度和电子耦合之间的关系一致(表2)。
[0058]
根据上文,本公开的实施方案包括生物电子装置,所述生物电子装置包括由间隙间隔开的第一电极和第二电极,以及经由连接基连接至所述第一电极和所述第二电极的蛋白质。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约400mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约260mv至约400mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约270mv至约400mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约280mv至约400mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约290mv至约400mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约390mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约380mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约370mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约360mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约350mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约340mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约330mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv
至约320mv。在一些实施方案中,所述第一电极和所述第二电极在零偏压下的表面电势在正常氢电极标度上为约250mv至约310mv。
[0059]
在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约400mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约260mv至约400mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约270mv至约400mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约280mv至约400mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约290mv至约400mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约390mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约380mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约370mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约360mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约350mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约340mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约330mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约320mv时,所述蛋白质的电导最大化。在一些实施方案中,当所述第一电极和所述第二电极在零偏压下的表面电势为约250mv至约310mv时,所述蛋白质的电导最大化。
[0060]
在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约400mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约260mv至约400mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约270mv至约400mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约280mv至约400mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约290mv至约400mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约390mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约380mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约370mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约360mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv
至约350mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约340mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约330mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约320mv的表面电势。在一些实施方案中,所述第一电极和所述第二电极由一种或多种金属组成,所述一种或多种金属在零偏压下赋予约250mv至约310mv的表面电势。
[0061]
在一些实施方案中,所述第一电极和所述第二电极中的至少一者包括与另一个电极不同的金属。在一些实施方案中,所述第一电极和所述第二电极中的至少一者包括金或其合金。在一些实施方案中,所述第一电极和所述第二电极二者均包括金或其合金。在一些实施方案中,所述第一电极包括金或其合金,并且所述第二电极包括不同的金属或其合金。在一些实施方案中,所述第二电极包括钯或其合金。在一些实施方案中,所述第二电极包括铂或其合金。
[0062]
在一些实施方案中,所述装置包括参考电极。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势在nhe标度上维持在约250mv至约400mv。如本领域的普通技术人员基于本公开所认识,在给定参考电极和另一种金属之间施加固定偏压将在该第二金属的表面产生可重现的极化。因此,可以选择电极对的表面电势(例如,通过选择金属和/或相对于参考电极的偏压),为此最初在电极对上施加零偏压。然后,在电极对上施加偏压将使偏压电极的表面电势偏移所施加的偏压量。因此,如果例如希望在施加了+100mv偏压的情况下在nhe标度上将电极对的平均电势保持在300mv,则可以将第一电极在nhe标度上设置为250mv电势,使得相对于第一电极而言施加于第二电极的偏压为+100mv,第二电极在nhe标度上为+350mv,使得两个电极电势的平均值在nhe标度上为所期望的300mv。
[0063]
在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约400mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约260mv至约400mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约270mv至约400mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约280mv至约400mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约290mv至约400mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约390mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约380mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约
370mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约360mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约350mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约340mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约330mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约320mv。在一些实施方案中,由于在所述参考电极与所述第一电极或所述第二电极中的至少一者之间施加的偏压,所述第一电极和所述第二电极的表面电势维持在约250mv至约310mv。
[0064]
在一些实施方案中,并且如图2a进一步所示,所述参考电极可以包括第三电极,所述第三电极浸入电解质溶液中,所述电解质溶液与所述第一电极和所述第二电极接触。电解质溶液可以是用于导电的任何合适的电解质溶液(例如,氯化钾、磷酸钠、磷酸二氢钠等),如本领域的普通技术人员基于本公开将认识到的。还可以使用其他参考电极构型。
[0065]
装置组成和几何形状。金是分子电子装置中使用最广泛的金属,部分原因是在金上制备高质量的分子单层相对容易,部分原因是它被用于制备分子断裂结,这是将分子安装在电极结中的最常见方法。这两个优点都依赖于金的延展性和低熔点。良好的单分子层的形成是因为分子和金属之间的硫醇键削弱了附接的金原子与其邻近原子的键合,以至于附接了分子的金原子可以在表面上非常自由地移动,从而允许单层的密集堆积。在断裂结技术的情况下,在电极对的每个接近/缩回循环中都会挤出新结,这是金的延展性的结果。然而,这种延展性也给装置制造带来了挑战。如果在集成电路上由两个相邻的金特征形成间隙,则特征边缘处的金属可以非常灵活,因此结的尺寸在原子水平上是不稳定的。出于这个原因,具有较高熔点的贵金属在装置制造中是优选的。然而,金电极具有另外的优点,即具有与很多候选分子装置(包括特别地基于蛋白质的装置)的能级非常匹配的费米能级。因此,需要一种这样的结装置组成和几何形状,其提供具有较高熔点的贵金属的形状稳定性,但是具有金的电子性质。
[0066]
如本文所进一步描述,测量分子结的电导分布,其中链霉亲和素分子桥接用硫醇化生物素分子官能化的两个金属电极。使用不同的金属(包括它们的合金)作为触点,可以最大化感兴趣蛋白质的电导。例如,图3示出了六种不同金属组合的测量单分子电导。在混合金属结的情况下,所列出的第一金属是指扫描探针显微镜中的尖端,并且第二金属是基板。如图所示,颠倒尖端和基板金属进行重复测量(例如,au/pt与pt/au)。因此,虽然铂电极在稳定性和抗氧化性方面是优选的,但是金在电子反应方面显然更优异。在一些实施方案中,优选地使用不同金属作为触点,并且在一些情况下,pd/au和pt/au特别有用。在本公开的装置中,金属组合的使用避免了金电极边缘不稳定所带来的问题。
[0067]
参见图14,首先将金电极101沉积于介电基板上。基板可以是任何介电材料,诸如玻璃或石英。介电基板可以是介电绝缘层。或者,基板可以是具有在其上生长的厚(约
500nm)氧化物层的高电阻率硅。金电极可以根据本领域已知的方法,诸如通过标准剥离方法进行图案化。如果使用双层光致抗蚀剂以允许底切掩模,则金电极的边缘可以不具有栅栏凹凸。在一些实施方案中,如果金成角度沉积于具有底切光致抗蚀剂掩模的旋转基板上,则可以使边缘略微倾斜。电极101可以为约50nm至约20μm宽并且约5nm至约1μm厚。
[0068]
在一些实施方案中,使用标准光刻方法在金电极的一端上沉积电介质102,然后进行原子层沉积(ald)。该电介质可以是sio2、hfo2、al2o3或可以使用原子层沉积可靠地沉积为薄膜的任何其他介电材料。通常,沉积的电介质量为约1nm至约50nm。通过用非常薄(约1nm或更薄)的活性金属诸如cr、ti或al层处理第一电极(例如,平面电极、底部电极)的表面来获得非常薄的薄膜的改善的ald生长。
[0069]
在一些实施方案中,使第二电极103沉积,以位于涂覆有电介质的第一电极的顶部,如右侧的横截面所示:113是第一金电极(定位于底部、基板的顶部)、介电层112和第二电极111。第二电极可以是任何贵金属。在一些实施方案中,第二电极由铂或钯制成。第二电极可以为约50nm至约10μm宽并且约5nm至约100nm厚。在确定第二电极的宽度时,约束是第二电极的边缘位于第一电极的平面部分上。
[0070]
在一些实施方案中,然后使用缓慢湿蚀刻剂将电介质从第一电极蚀刻掉,所述缓慢湿蚀刻剂诸如缓冲的hf(通常是hf和nh4f的溶液)、食人鱼溶液(h2so4和h2o2)和/或用于hfo2介电层和sio2的hcl/h2o2溶液以及用于al2o3介电层的四甲基氢氧化铵(tmah)或类似的碱如koh。氧化物沉积的最后一个原子层的两性性质可以产生对碱性蚀刻剂的耐受,并且添加的酸洗剂改善了层消除的完全性。结果是在结下方的电介质的轻微底切,如图14中的114所示。
[0071]
在一些实施方案中,用电介质覆盖金电极的边缘赋予某些有利的特征,例如,防止金电极的边缘原子的运动。通过对第二电极使用更稳定的金属(例如,pd、pt),第二电极的边缘相对于下面的平面金表面限定了尖锐的结。另外,避免rie或其他粒子轰击方法以暴露在一些早期的分层结装置设计中使用的结,可以是一个重要的考虑因素。
[0072]
在一些实施方案中,在第一金电极的边缘处掺入另外的保护可以是期望的。用于此的方案如图15所示。在一些实施方案中,第一金电极201形成在基板的顶部,并且如上文所述的覆盖有电介质202。在一些实施方案中,第二介电层115被图案化在第一金电极的边缘上,如203中所示。参见图16,然后在结上形成第二pd或pt电极111,如301中所示。介电层112的蚀刻清除了结的中间部分,但是留下了由附加电介质115保护的边缘。
[0073]
另外,整个装置可以使用例如约500nm至约15μm厚的su8聚合物层进行钝化,打开以在每侧几微米的小窗口中暴露结。替代方案是约50nm至约200nm厚的hfo2、al2o3或sio2层,优选地通过原子层沉积来进行沉积。
[0074]
一旦打开窗口,分子结就可以通过暴露于氧等离子而进一步清洁并且用分子进行官能化。结果是如图17所示的分子结。第二电极111和第一电极113各自用配体415官能化,所述配体将待掺入的蛋白质414捕获到整个结。
[0075]
本文所述的装置和系统中使用的配体可以是蛋白质特异性的并且被修饰使得它们附接至电极。例如,可以将配体修饰为在一端含有硫醇末端以便与金属耦合。配体的示例是抗体的肽表位(在一端包含半胱氨酸残基)、识别肽(例如,诸如用于结合包含半胱氨酸的整合素的rgd肽)和小分子(已经选择蛋白质与其结合)(例如,诸如结合二硝基苯并且包含
硫醇或硫醇化生物素分子的ige分子)。本公开的生物电子装置的各种构型和几何形状可以包括在美国专利号10,422,787和pct申请号pct/us2019/032707中公开的装置的任何方面,这两个专利均以引用的方式整体并入本文用于所有目的。
[0076]
在一些实施方案中,本领域的普通技术人员将认识到,由于金属合金的功函数通常由它们的组分金属的功函数的加权平均值给出,金合金可以代替第一电极。例如,白金(含有钯和/或银的合金)和其他金合金(诸如含有铜或镍)可以用于代替纯金。类似地,合金可以用于第二电极,诸如钯-铂、钯-银、铂-银等等。
[0077]
本公开的结设计有助于结装置阵列的多重寻址,如图18所示。虽然图18示出了10个装置的阵列,但是本领域的普通技术人员根据本公开将理解,阵列可以包括数百甚至数千个结。每个装置都可以用给定的配体单独官能化,使得阵列可以同时测试多种不同蛋白质的存在。
[0078]
参见图18,第一电极可以形成用于装置的阵列(com1、703、com2、705)的共同结。另外,介电层702可以在将形成结的每个位置处图案化。然后可以使第二电极703沉积,以根据需要穿过尽可能多的共同电极(此处仅示出两个:com1和com2)。每个第二电极被单独寻址。在密集阵列中,这种寻址可以通过与对应于多重电子装置能力的每个装置块相关联的多重电子装置来实现。图18示出了5条地址线,标记为1-5(704)。因此,例如,装置706由com2和地址线5寻址。
[0079]
在一些实施方案中,所述间隙具有约1.0nm至约20.0nm的宽度。在一些实施方案中,所述第一电极和所述第二电极由介电层间隔开,如本文进一步所述。
[0080]
在一些实施方案中,所述蛋白质是非氧化还原蛋白。在一些实施方案中,所述蛋白质包括但不限于聚合酶、核酸酶、蛋白酶体、糖肽酶、糖苷酶、激酶和核酸内切酶。
[0081]
在一些实施方案中,所述连接基附接至所述蛋白质的非活性区域。在一些实施方案中,所述连接基包括共价化学键。在一些实施方案中,所述蛋白质是生物素酰化的。在一些实施方案中,所述连接基包括硫代链霉亲和素。在一些实施方案中,所述蛋白质以及所述第一电极和所述第二电极是生物素酰化的,并且其中所述连接基包括链霉亲和素分子,所述链霉亲和素分子包含至少两个生物素结合位点。
[0082]
本公开的实施方案还包括一种用于蛋白质活性的直接电测量的系统。根据这些实施方案,所述系统包括以下中的任一者:本文所述的生物电子装置、用于引入能够与所述蛋白质相互作用的分析物的装置、用于在所述第一电极和所述第二电极之间施加100mv或更低的偏压的装置以及用于监测化学实体与所述蛋白质相互作用时发生的波动的装置。
[0083]
本公开的实施方案还包括阵列,所述阵列包括多个本文所述的生物电子装置中的任一者。在一些实施方案中,所述阵列包括用于引入能够与所述蛋白质相互作用的分析物的装置、用于在所述第一电极和所述第二电极之间施加100mv或更低的偏压的装置以及用于监测化学实体与所述蛋白质相互作用时发生的波动的装置。所述阵列可以以多种方式构造,如图18所示,这不应被视为限制。
[0084]
本公开的实施方案还包括用于蛋白质活性的直接电测量的方法。根据这些实施方案,所述方法包括将能够与所述蛋白质相互作用的分析物引入本文所述的生物电子装置中的任一者,在所述第一电极和所述第二电极之间施加100mv或更低的偏压,以及观察当所述分析物与所述蛋白质相互作用时发生的所述第一电极和所述第二电极之间的电流波动。在
一些实施方案中,所述分析物是生物聚合物,所述生物聚合物诸如但不限于dna分子、rna分子、肽、多肽或聚糖。
[0085]
3.材料和方法
[0086]
使用电子束蒸发器(lesker pvd 75)将大约200nm的pd、au或pt沉积于一英寸p型si晶片上的10nm cr粘附层上。使用h2(20sccm)和ar(2.5sccm)的混合物在电子回旋共振微波等离子化学气相沉积(ecr-cvd)系统中清洁样品。样品通过uhv传输线(5
·
10-9
托(torr))从ecr-cvd传输到配备有差动泵浦氦放电灯(21.2ev)的光电子能谱室,用于以约4-8
·
10-9
托的工作压力进行紫外光电子发射能谱(ups)。omicron scientia r3000半球形分析仪以2ev的通过能量运行,这对应于3mev的能量分辨率。将1.5v的样品偏压和2.7ev的能量偏移编程到数据采集软件中,以补偿检测器功函数(4.2ev)。ups光谱的拟合示于图4中,并且表3中给出了在清洁前后测量的功函数的汇总。
[0087]
对于电化学测量,盐桥电极如上文所述构建,使用3m kcl进行静止电势测量(nhe标度为210mv),并且使用10mm kcl进行电导测量(nhe标度为360mv)。使用fluke 177仪表(输入阻抗》107ω)测量静止电势,并且电势在数小时内稳定在
±
5mv内。样品间差异为
±
5%。
[0088]
如上文所述制备高密度聚乙烯涂覆的pd和au探针。对于pt探针的制备,使用自制的蚀刻控制器,输出交流电压为30v,频率为约250hz。pt探针的蚀刻溶液是新鲜制备的10m naoh。
[0089]
如上文所述制备基板,并基板如上文所述进行官能化。按照别处描述的程序,使用picospm(agilent)在1mm磷酸盐缓冲液ph7.4中进行电导测量。如前所述,使用双生物素酰化的工程化聚合酶制备用于生物素-链霉亲和素和生物素-链霉亲和素-聚合酶ф29系统的样品和溶液。全部溶液的制备以及基板表面的表征也在这些早期出版物中有所描述。从全部三种金属基板采集的ftir波谱在图13中给出。
[0090]
4.实施例
[0091]
对本领域技术人员来说显而易见的是,本文描述的本公开的方法的其他合适的修改和改编是容易应用和可理解的,并且可以在不脱离本公开的范围或本文公开的方面和实施方案的情况下使用合适的等效物进行。现在已经对本公开进行了详细描述,通过参考以下实施例将更清楚地理解本公开,这些实施例仅用于示出本公开的一些方面和实施方案,并且不应被视为对本公开的范围进行限制。本文引用的所有期刊参考文献、美国专利和公布的公开内容据此通过引用整体并入。
[0092]
本公开具有多个方面,通过以下非限制性实施例示出。
[0093]
示例1
[0094]
通过改变电极金属来控制电子注入能量。大多数蛋白质的计算的homo-lumo间隙很大,使得如果费米能级位于中间间隙,则金属电极的费米能量应远离分子轨道能量。然而,界面极化(以及因此分子轨道相对于金属费米能量的位置)很难计算,因此需要一种稳健的方法来测量这些能量。可以通过测量具有不同电极金属的分子的电导来探测负责传输的分子状态的能量。在这些先前研究中,金属功函数被用作电子注入能量的度量。这个近似值一般不应该成立,因为电极的表面电势对化学改性极为灵敏。因此,本文报告的测量值是在电化学电势控制下进行的,使得经改性的表面的静止电势可以用于定量当表面被化学改
性时的电势变化。
[0095]
实验布置方式在图1a中示意性地示出。第一电极(金属1)相对于参考电极保持在电势vr。第二电极(金属2)相对于金属1保持在电势vb。分子(m)位于金属1和金属2之间的纳米级间隙中。研究电子从电极之一传输到分子时电子的电势。最初考虑了参考偏压vr和分子结偏压vb均为零的情况。参考电极的费米能级通过法拉第过程被固定在溶液中的氧化还原对的氧化还原电势μ
ref
,所述法拉第过程维持参考电极表面的恒定极化。继而,参考从每个金属电极提供或撤出载流子(通过低阻抗连接部),以便将它们的费米能级e
f1
和e
f2
移动到在能量μ
ref
处对齐。功函数被定义为φ=φ-ef,其中φ是表面偶极产生的金属表面的平均静电势的上升(能量以ev表示)。因此,当体电化学电势从ef变化到参考值μ
ref
时,φ的变化为δφ=μ
ref-ef。载流子从电极传输到电极外部的分子所经历的电势差由δφ+φ
ads
给出,其中φ
ads
是整个吸附层的电势差(此处假设两个电极相同)。如果两个电极金属不同,则电极间的净电势差为δφ
1-δφ2=μ
ref-e
f1-(μ
ref-e
f2
)=e
f2-e
f1
。如果假设分子位于这种电势差产生的电场的中间,则载流子从电极1移动到分子所经历的总电势差为:
[0096][0097]
对于载流子从电极2移动到分子的情况,具有相同的表达式。当仅使用一种电极材料时,等式1变为
[0098]
δv1=e
f1
+φ
ads
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2)
[0099]
这个量是静止电势——在无限阻抗下测量的经改性的金属和参考之间的电势差(这些电势被转换为称为正常氢电极(nhe)的那些电势)。对于两种不同的电极金属,两个静止电势的平均值产生等式1的右侧,因此当载流子从任一电极移动到间隙的中间时所经历的电势差。对于两个相同的金属电极的情况,这种差异由等式2给出。
[0100]
使用高阻抗电压计来测量相对于3m ag/agcl参考(图2a)的静止电势。基板通过将205
±
5nm的pt、pd和au溅射到涂覆有10nmcr粘附层的硅基板上来制备。紫外光电子发射能谱(ups,图4;表3)用于确定功函数5.32ev(au)、5.02ev(pd)和5.06ev(pt),这些值在图2b中显示为标记为uhv(超高真空)的点。它们已经被转换为相对于nhe的mv,对于nhe的功函数,使用的值为4.625
±
0.125ev(测量精确到百分之几-误差条显示nhe功函数的不确定性)。这些值在与用于电导测量的1mm磷酸盐缓冲液接触时发生显著变化(标记为“裸1”和“裸2”,其中显示了对不同样品的两次测量值以示出
±
5%的再现性)。后续的改性(表1;图2b)对pt的影响很小,对pd的影响很小,并且对au表面的影响很大。
[0101]
表1:使用3m kcl桥进行的测量静止电势与ag/agcl参考的比较,通过加上210mv转换为nhe。1uhv数据测量为
±
4mev:此处引用的误差(125mev)表示nhe功函数的目前接受的值的分布。2误差反映静止电势测量的稳定性。重复测量值(参见裸芯片重复)表示每次运行的变化为
±
5%(图2b中使用的误差条)。
[0102][0103][0104]
电导测量通过使用具有固定间隙的stm记录iv曲线以及用配体对电极进行官能化以捕获靶蛋白来进行。所研究的第一系统是链霉亲和素,它与用硫醇封端的生物素官能化的电极结合(图1b),电极的间隙被设置为2.5nm。捕获的蛋白质给出了完美的线性电流-电压曲线,显示出特征电报噪声大于
±
100mv(图1c)。这些曲线的梯度的很多重复测量值产生所有采样的触点几何形状的电导分布,它们的示例针对图1d中的三种金属示出。两个较高电导峰(标记为峰ii和iii)的触点电阻最小,因此假设这些峰对分子的内部电子性质最灵敏。在从au到pd电极的过程中,两个峰都移动到较低的电导,并且在从pd到pt的过程中,移动到甚至更低的电导,这示出了电导对电子能量的灵敏度,即使在这种非氧化还原活性蛋白质中。使用混合电极组合(au/pd、pd/pt、au/pt)重复这些测量,以获得三个附加电势的数据点(使用用等式1计算的电势)。另外将用于尖端和基板的金属颠倒,从而发现电导峰值没有改变(虽然峰ii和iii的高度略有变化,可能是由于在au基板上更容易和移动的硫醇键合)。所有实验的电导分布在图5至图10中给出,并且从这些分布的高斯拟合提取的参数在表3至表8中给出。生物素-链霉亲和素结的结果汇总于图2c中。峰iii的数据点已经与洛伦兹拟合(如讨论中所述),以产生相对于nhe的电势为301
±
3mv的峰(半高全宽(fwhm)为183
±
43mv)。
[0105]
示例2
[0106]
通过改变电极金属来控制电子注入能量。在pd电极的情况下,没有法拉第电流的电势区域足够大,以允许通过改变电极电势(图1a中的vr)来测试共振曲线,在这种情况下,载流子能量通过将vr添加到由等式2给出的静止电势来给出。这些测量的结果针对图2d中的生物素-链霉亲和素系统示出。在不同的金属的情况下,峰iii的共振由与图2c中使用的
基本上相同的洛伦兹拟合,其中相对于nhe最大值为287
±
8mv,并且fwhm为154
±
28mv。两种方法之间的一致性验证了模型中使用的关于不同的电极金属所经历的电势变化的假设。
[0107]
作为可逆性检查,进行一组单独的实验,其中在vr=0v下以10mm kcl-ag/agcl标度分析样品,然后再次以相同标度在-223mv下分析样品,然后返回0v并重新分析。结果(图11)与图2d提供的结果完全相同,表明了这些测量的可逆性。
[0108]
示例3
[0109]
其他非氧化还原活性蛋白质的共振。二价抗体与用小表位进行官能化的电极形成了极好的电触点,因此使用涂覆有硫醇化二硝基苯酚(dnp)分子(其捕获抗dnp ige分子)的电极重复进行测量。另一个具有技术重要性的系统是双生物素酰化ф29聚合酶,它被捕获在链霉亲和素涂覆的电极之间。链霉亲和素使用硫醇化生物素连接至电极(如上文实施例所示)。在这两个较大的系统中,间隙尺寸都被设置为4.5nm。抗体电导分布由两个峰组成(图7)。较低的电导峰(峰i)来自一个特定的和一个非特定的触点,并且主要由触点电阻决定。该峰不受载流子电势的影响(图3a中的红点和绿点)。峰ii来自两个特定的触点,并且触点电阻的贡献要小得多。第二峰很大程度上取决于电势。洛伦兹拟合至这种电势依赖性的峰再次接近300mv(表2)。聚合酶分布包含三个峰(图9),其中峰ii和iii对蛋白质的构象变化敏感。这两个峰都受载流子电势的影响,如图3b所示。另外,电导在电势接近相对于nhe而言300mv处达到峰值。拟合参数在表2中给出。
[0110]
表2:3种蛋白质中的洛伦兹共振的参数。此处的峰宽等于等式3中的2γ。
[0111][0112]
在下表中可以找到对本文所述的各种实施方案的另外支持。
[0113]
表3:等离子清洁前后金属的功函数。
[0114][0115]
表4:以不同材料作为电极的链霉亲和素的电导测量。
[0116][0117][0118]
表5:以不同材料作为电极的phi29的电导测量。
[0119][0120][0121]
表6:用不同材料进行的抗dnp抗体的电导测量。
[0122][0123]
表7:作为链霉亲和素系统的表面极化测量的函数的电导(pd-pd)。
[0124][0125][0126]
表8:使用极化控制进行的可逆性测量。
[0127][0128]
本领域的技术人员将容易理解,本公开很好地适用于实现所提及的目标并且获得所提及的目的和优点,以及其中固有的那些。本文所述的本公开目前代表优选的实施方案,是示例性的,并且不旨在限制本公开的范围。本领域的技术人员将想到其中的变化和其他用途,这些变化被涵盖在由权利要求的范围限定的本公开的精神内。
[0129]
不承认任何参考文献,包括本说明书中引用的任何非专利或专利文档,构成现有技术。具体而言,应当理解,除非另外指明,否则对本文中的任何文档的引用不构成承认这些文档中的任一者在美国或任何其他国家形成本领域公知常识的一部分。对参考文献的任何讨论都说明了其作者的主张,申请人保留质疑本文引用的文档中的任一者的准确性和相关性的权利。除非另外明确说明,否则本文引用的所有参考文献均以引用的方式完全并入。如果在引用的参考文献中发现的任何定义和/或描述之间存在任何差异,则应以本公开为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1