测定血液中神经退行性疾病危险因素的方法与流程
本发明涉及药物化学。它描述了一种评估由蛋白质聚集引起的人类神经/认知疾病发生或快速进展的风险,以及评估人类血浆质量及其是否适合输血或进一步储存的方法。该方法是基于测量一种血液富含的蛋白中异天冬氨酸残基的占比,以及对血液中这种残基先天抗体的丰度。
背景技术:
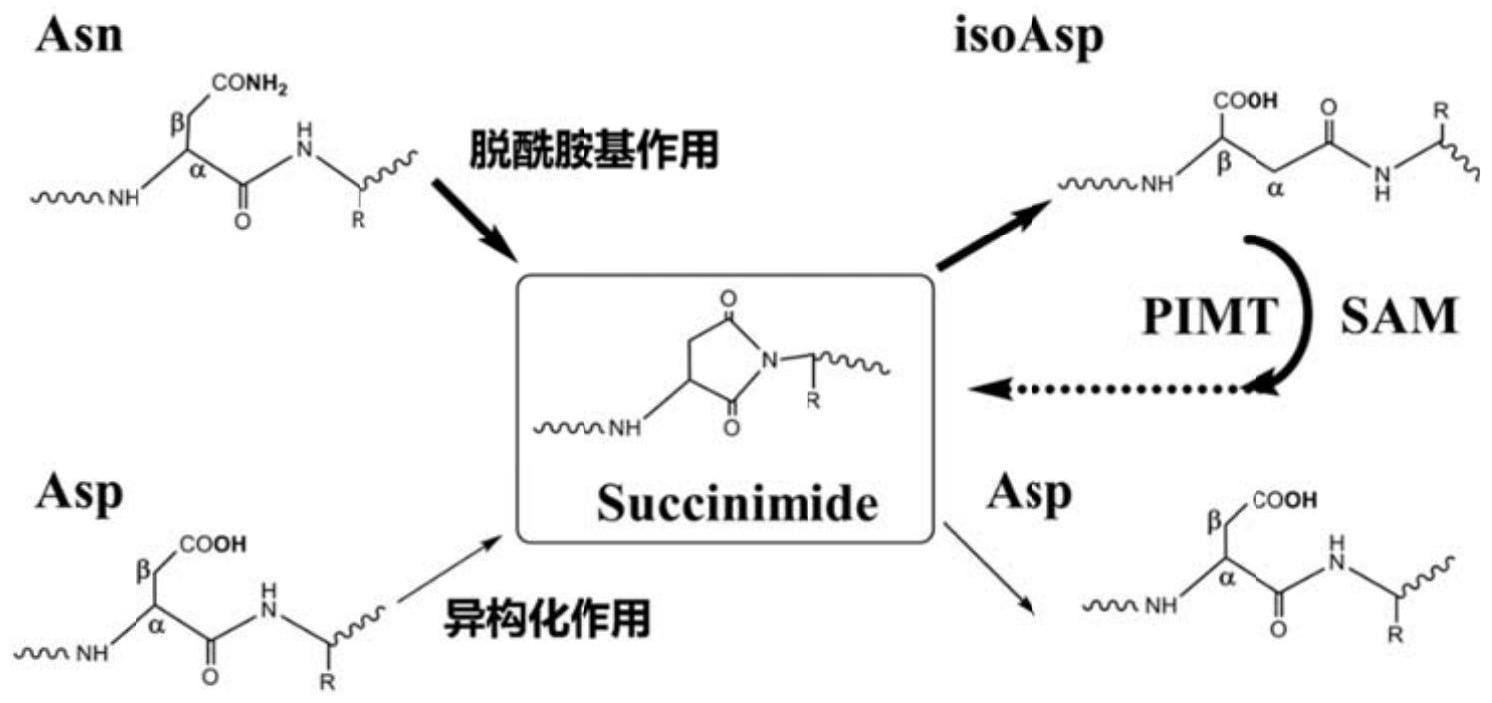
1、蛋白质是由氨基酸残基组成的生物多聚物。在体内,蛋白质的寿命是有限的。蛋白质功能丧失的主要原因之一是天冬酰胺(asn)残基中氨分子的丧失。所得到的环琥珀酰亚胺中间体是不稳定的,并快速附着在水分子上,从而形成非天然氨基酸残基——异天冬氨酸(isoasp,图1)。这一过程被称为asn脱酰胺。isoasp形成的另一个机制是正常l-天冬氨酸(asp)残基的异构化。经过脱酰胺后含有isoasp的蛋白不仅功能异常,而且也失去了原有的结构,变得更容易聚集。异天冬氨酸甲基转移酶(pimt)通过使用一种名为s-腺苷蛋氨酸(sam)的小分子将isoasp残基甲基化,并将其转化为s-腺苷同型半胱氨酸(sah)以修复脱酰胺蛋白。甲基化的isoasp最终会失去甲醇分子并转化为琥珀酰亚胺中间体,而琥珀酰亚胺中间体在水分子附着后,有可能转化成正常的asp残基。这一过程在很大程度上恢复了蛋白质的结构和功能,且主要发生在肝脏。
2、然而,随着年龄的增长,肝脏的修复功能下降,而且修复需求增加,就会导致修复缺陷,从而造成血液蛋白上isoasp的积累。含有isoasp的蛋白质自身聚集并触发其他蛋白质的聚集。有实验证据表明,这一过程最终造成淀粉样变性,即淀粉样蛋白低聚物和原纤维的形成,进而引起氧化应激、炎症等病理过程,结果导致阿尔茨海默病(ad)和类似神经系统疾病的发展(yang h,lyutvinskiy,soininen h,zubarev.alzheimer’s disease and mildcognitive impairment are associated with elevated levels of isoaspartylresidues in blood plasma proteins.j alzhimer’s dis,27,113-118)。因此,血液蛋白中高水平的isoasp残基是发生ad和其他神经退行性疾病的危险因素。根据isoasp-ad假说,这一危险因素的出现先于所有已知的ad病理特征(图2)。我们还获得证据表明,当ad已经被确诊时,血液蛋白中isoasp含量高会增加智力快速下降的风险(图3和4)。
3、抗体是存在于血液中的大蛋白,能够与机体不需要的分子结合,并帮助它们从机体中清除。人类血液中存在着数目惊人的抗体变体,它们特异性针对无数的病毒、细菌以及它们的毒素,还有那些蛋白质中机体不需要的修饰。血液中也存在先天的抗异天冬氨酸(anti-isoasp)抗体,有助于消除脱酰胺后的蛋白。我们发现,ad患者中抗isoasp抗体水平明显低于健康对照组(图7),这使得他们更容易受到异天冬氨酸的破坏作用。
4、ad是高龄性痴呆最常见的形式。根据世界健康排名,瑞典的ad死亡率仅次于芬兰、冰岛和美国,居世界第四位。仅2008年一年,仅北欧国家就花费了530亿欧元用于照顾痴呆症患者(wimo a,l,gustavsson a,mcdaid d,ersek k,georges j,gulácsi l,karpati k,kenigsberg p,valtonen h.2011.the economic impact of dementia ineuropéin 2008–cost estimates from the eurocode project.international journalof geriatric psychiatry 26,825-832)。国际老年精神病学杂志26,825-832)。据估计,65岁以上的人中有十分之一,85岁以上的人中有近一半患有ad。目前,养老金领取者占总人口的比例为20%,而且还在上升,这对瑞典国家卫生和社会保健系统来说是一个沉重的负担。
5、目前还没有治愈ad的方法,批准的药物也只能提供对症治疗。尽管治疗ad非常困难,预防它则是一个更现实的目标。据估计,将ad的发病时间推迟5年将使其病例数量减少一半;如果推迟10年,这种类似流行病的现象几乎是会消失的。为了建立成本效益好的预防方案,对ad进行早期诊断是非常重要的。为了ad患者自身以及他们的亲属和雇主的利益,一旦ad被诊断出来,能够预测ad的发展也是很重要的。由于测量血液蛋白中的isoasp以及抗isoasp抗体的水平可以帮助评估ad发展的风险,或者,当ad已经被诊断出来时,估计快速智力下降的风险,因此创造一种廉价而准确的测量方法是很重要的。
6、与血液中isoasp含量有关的另一个问题是,人类血浆在血库中的保存期限很短,通常为12个月。人类血液是一种宝贵的生物液体,全世界每年收集和分离2800万升血液以获得血浆或血清。大约7%的采集血液被立即丢弃,主要是由于病毒感染。大约3%,即100万升,由于储存问题或过期而最终被丢弃。在储存条件下(通常为-20~-25℃),asn的脱酰胺仍然发生,因此isoasp水平随着储存时间的增加而增加。尤为重要的是测量储存血液中的isoasp含量,以避免输入isoasp水平升高的不健康血液,因为输入这样的血液可能携带神经退行性疾病的风险。
7、测定血液中isoasp的残留量并不简单。其中一种方法是使用复杂而昂贵的液相色谱结合串联质谱(lc-ms/ms)的方法,类似于yang等工作中使用的方法。目前市面上唯一的商用方法名为isoquant,它能测定pimt利用sam分子将isoasp转化为asp的速率。isoquant读出的是反应产物样品中sah的浓度。为了获得蛋白质中isoasp浓度的期望值,测量的sah水平必须通过蛋白质浓度进行标准化,而蛋白质浓度需要通过不同的测定方法测量。图3显示了isoquant分析的结果,显示12例认知功能快速下降的ad患者与12例认知功能缓慢下降的ad患者相比,其血液蛋白质中的isoasp浓度升高。图4显示了根据这些数据得到的受试者工作特征曲线(roc)。曲线下面积为0.82,表明以血液蛋白中isoasp占比预测ad患者认知功能下降速率的分析性能较好。
8、然而,目前基于isoquant或lc-ms/ms来分析isoasp水平具有异质性和高成本的特点,是阻碍其在临床实践中广泛应用的因素。为达到这一目的,利用基于抗体的生化检测将是更简单、更快且更靠谱的方法。
9、这其中有一种方法是酶联免疫吸附测定方法(elisa),最早由engvall和perlmann提出(j immunol 1972,109,129-135)。elisa目前在血液分析中的应用极为广泛。然而,elisa方法需要一个特异性识别isoasp的抗体,而由于isoasp的免疫原性低,其化学基团较小,很难研制出在含有所有氨基酸的环境下对isoasp残基都具有特异性的抗体(泛isoasp抗体)。这是迄今为止尚未报道以抗体为基础的检测大量血液蛋白质中isoasp浓度的主要原因。
技术实现思路
1、本发明基于这样一种认识,即与其通过泛isoasp抗体来测定所有或大多数人体蛋白中的isoasp水平,不如只测定一种血液中丰度高的蛋白上某个代表性位点的isoasp水平就足够了。由于血浆和血清中大约一半的蛋白质含量是由人血清白蛋白(hsa)引起的,因此我们选择这种蛋白作为血液中的代表蛋白。hsa分子在血液中的停留时间通常为25天左右。由于hsa序列含有几个asn残基,在此期间,至少有一个asn残基可通过脱酰胺作用转化为isoasp。当isoasp通过肝脏时,pimt会将其修复并转化为正常的l-asp残基。我们认识到,由于该修复反应对蛋白质特性的特异性较低,hsa中的isoasp水平应该与血液中其他蛋白质的平均水平相同。
2、在本发明中,我们将hsa中的isoasp水平用作“温度计”,来测量血液蛋白中isoasp的一般水平并以此评估某个人机体中isoasp修复机制的状态。此外,由于hsa的丰度极高,在正常人血液里的抗isoasp抗体中,一定有许多针对hsa中isoasp残基的抗体。因此,脱酰胺后的hsa可以作为抗原(诱饵)来固定住这些抗体从而测量它们的丰度,也可以作为一个特定生物体内抗isoasp抗体的一般水平的指标。
3、在hsa蛋白结构里几个潜在的脱酰胺位点中,位于蛋白质表面且容易接触水分子的位点更容易发生脱酰胺作用。与隐藏在蛋白质内部的位点相比,这些位点也更容易被修复机制触及。因此,这些位点应该是全血蛋白质组中脱酰胺作用与其修复之间达到平衡的最具代表性位点。我们发现可以制备一种针对该位点的单克隆抗体,并利用该抗体设计一种elisa方法来检测该位点的isoasp水平,来作为所有血液蛋白质中isoasp总体水平的指标。
4、此外,我们还发现,与先前技术中测量isoasp的丰度不同,本方法对isoasp占比(即在给定位点中转化为isoasp的asn残基的百分比)的测定更为精确。对于isoasp占比的测定,需要在给定的位置检测并分别定量具有isoasp和不具有isoasp的相应分子,并计算这两类分子丰度的比率。我们意识到,当修饰的占用率在百分之几或更低的水平时,在间接elisa中,如果所有样品的体积保持恒定,那么结合在板孔表面的未经isoasp修饰hsa分子的丰度则可被认为是近似恒定的。因此,用间接elisa测定hsa中isoasp的占比只需要测定isoasp分子的相对丰度,这样可以简化分析,且不会造成精度方面的重大损失。
5、此外,选择位于胰蛋白酶或其他特异性蛋白酶裂解位点之间的hsa脱酰胺位点进行isoasp分析是有利的,因为这些蛋白酶裂解hsa后产生的肽易于lc-ms/ms分析,可作为验证elisa结果的参考方法。
6、我们已选择出这样一个具有代表性的位点,并获得了针对一个具有isoasp的肽段的单克隆抗体,而这个肽段能代表hsa的部分序列。通过对hsa进行人工的脱酰胺处理,在60℃、ph 8.5条件下孵育6周,我们获得了一个稳定的脱酰胺hsa标准品,并通过lc-ms/ms对其鉴定。这个标准品用于校正基于抗体的测定方法。
7、脱酰胺后的hsa也被我们用作抗原来固定人体血液中的抗isoasp抗体并测定它们的相对丰度。
8、本公开文件提供了一种评估给定测试血样是否属于正常(健康)组或风险组的方法。根据对正常(健康)的定义,这可以是一群没有换ad和其他相关神经退行性疾病的人,也可以是一群病情缓慢下降的ad患者,也可以是一群血液蛋白中isoasp含量在可接受范围内的献血者,也可以是一群以冷冻状态保存在血库中仍然适合输血的血液样本。所公开的方法包括:获得被认为属于正常(对照)组的第一套测试血液样本和第二套血液样本;从所述血液样本获得血浆;测定每个血浆样本中抗isoasp抗体的相对丰度;测定每个血浆样本中代表性hsa序列位置的isoasp残基水平;根据正常血浆样本中抗isoasp抗体相对丰度的分布和代表性hsa序列位置中isoasp残基的占比,建立预计给定血浆样本为正常样本概率的统计模型;根据测量值及统计模型得出的最大可能性将每个血浆样本归为正常组或风险组。
9、在上述方法中,对于每一组测试对象,可以选择一组健康受试者,使两组受试者在性别、年龄、种族、民族、基因型、教育程度、职业、生活方式、吸毒情况、吸烟习惯等任一参数或其组合方面匹配。
- 还没有人留言评论。精彩留言会获得点赞!