一种基于TP0136NH亚型的神经梅毒诊断试剂盒
一种基于tp0136nh亚型的神经梅毒诊断试剂盒
技术领域
1.本发明涉及生物检测技术领域,具体地说是一种基于tp0136nh亚型的神经梅毒诊断试 剂盒。
背景技术:
2.神经梅毒是指梅毒螺旋体侵入中枢神经系统造成脑膜、大脑、血管或脊髓等损害。神 经梅毒危害大,可造成脑膜炎、脑卒中、麻痹性痴呆、失明、甚至死亡等严重后果。
3.由于神经梅毒早期症状轻微,晚期临床表现不特异,因此神经梅毒的诊断更主要依靠 脑脊液的实验室检测。作为神经梅毒脑脊液诊断“金标准”的性病研究实验室试验(venerealdisease research laboratory test,vdrl),特异性90%,敏感性仅为50%,因此vdrl阴性无 法排除神经梅毒。此外,由于存在生物学假阳性问题(即非梅毒患者出现vdrl阳性), 进一步限制该方法在神经梅毒诊断中的应用。而其他常用的脑脊液检测方法,或不敏感、 或不特异,因此造成神经梅毒诊断困难、误诊率高。一项回顾性研究显示,脑脊液检测神 经梅毒的误诊率高达84.6%(126/149)。
4.荧光素酶免疫共沉淀系统(luciferase immunoprecipitation system,lips)通过在哺乳动 物细胞中将荧光素酶与抗原进行融合表达,以测定血清中未知抗体的检测技术。lips将抗 原与荧光素酶融合表达,血清中抗体与抗原特异性结合,抗体再与大颗粒物质protein a/gplus agarose结合,三者形成复合物,通过分析复合物上的荧光素酶与底物作用时荧光强度, 以评估血清中的抗体水平。lips系统选择在哺乳动物细胞表达会形成空间构象抗原,可以 提高检测效率。同时该系统采用的抗原不需要经过纯化,简化了实验步骤。因此,lips系 统广泛用于多种自身免疫性疾病和病原体检测。然而lips采用单管操作,无法实现高通量 检测,实验费时。
5.因此,亟需开发一种基于tp0136nh亚型的神经梅毒诊断试剂盒。
技术实现要素:
6.针对现有技术的不足,本发明提供了一种基于tp0136nh亚型的神经梅毒诊断试剂盒。 利用分子生物学基因克隆表达技术,获得梅毒nichols houton株tp0136重组蛋白,建立检测 nichols houton株tp0136抗体的荧光素酶免疫共沉淀方法,并组装成试剂盒,基于神经梅毒 感染者nichols houton株tp0136抗体水平来区分神经梅毒,有利于指导临床合理用药,避免 过度腰穿,为神经梅毒的诊治提供一种快速、简便的检测方法。
7.本发明为实现上述目的,采取以下技术方案予以实现:
8.一种基于tp0136nh亚型的神经梅毒诊断试剂盒,包括以下组分:
9.(1)样本稀释液;
10.(2)nanoluc荧光素酶和梅毒螺旋体nichols houton株tp0136抗原组成的融合蛋白液;
11.(3)proteina/g包被的酶标板;
12.(4)洗涤液;
13.(5)荧光素酶底物。
14.优选地,所述样本稀释液为2%脱脂牛奶。
15.优选地,所述融合蛋白液通过以下方法制备而成:
16.a、以nichols houton株tp0136抗原基因序列为模板进行pcr扩增,pcr扩增产物经凝 胶电泳及核酸纯化获得nichols houton株tp0136抗原基因片段;
17.b、将获得的nichols houton株tp0136抗原基因片段与nanoluc荧光素酶基因的pnlf1 载体质粒分别进行eco rⅰ和xbaⅰ双酶切,并使用t4连接酶将酶切产物连接得到重组质粒;
18.c、将重组质粒转化到大肠杆菌dh5α中,通过菌液pcr筛选转基因阳性菌;
19.d、在200ml lb液体培养基中扩繁转基因阳性菌,并用质粒提取试剂盒提取重组质粒;
20.e、通过琼脂糖凝胶电泳验证步骤d提取重组质粒的质量,通过紫外分光光度计检测提 取重组质粒的纯度和浓度;
21.f、在10cm2细胞培养皿中培养he la细胞,当细胞铺板率达到80~90%时,以脂质体核 酸转染试剂:步骤d所得重组质粒按照3μl:1μg的比例进行转染,37℃、5%co2培养箱中培 养48~72h,弃细胞培养液,并加入5ml 0.01m、ph7.4的磷酸缓冲液用细胞刮刀将细胞收 集至15ml离心管中,最后将细胞收集液在冰浴中超声处理15~30min得细胞裂解液,然后将 细胞裂解液于4℃,12000rpm离心15~45min,弃沉淀,收集上清液即为融合蛋白;
22.g、将上述所得融合蛋白用0.01m、ph7.4的pbs磷酸盐缓冲液稀释得融合蛋白液,要求 融合蛋白液每10μl中有107个荧光单位,-20℃保存备用。
23.融合蛋白液是稀释后的融合蛋白,这个稀释液也就是细胞裂解液,只是在细胞裂解之 前要要保证融合蛋白的浓度,所以用量少。裂解后再调整至使用浓度,调整浓度后的融合 蛋白液再放置试剂盒中,这样试剂盒检测过程就方便了(不需要再去检测蛋白的浓度)。
24.优选地,步骤a中,pcr扩增的引物为:
25.上游引物:5'-atgacgtgcgatttcactgg-3',
26.下游引物:5'-ctcgcggttccaggagcacg-3'。
27.优选地,所述proteina/g包被的酶标板的制备方法如下:
28.a、proteina/g用0.01m、ph7.4pbs溶解为1μg/ml的浓度;
29.b、按照100μl/孔将上述proteina/g溶液加入酶标板中,酶标板覆膜,4℃孵育12~16h;
30.c、弃proteina/g溶液,300μl/孔用0.1%pbst洗3次,4℃保存。
31.优选地,所述洗涤液配置方法为:nacl 8g,kcl 0.2g,na2hpo4·
12h2o 3.63g,kh2po
4 0.24g,加水定容至1l,灭菌。
32.优选地,所述荧光素酶底物为promega公司的furimazine荧光素酶底物。
33.与现有技术相比,本发明的有益效果如下:
34.本发明采用荧光素酶免疫共沉淀法,根据荧光强度可以用于神经梅毒诊断,该方法快 速简便、高灵敏度、高信噪比,测量值稳定可靠。
35.本发明通过检测nichols houton株tp0136抗体水平用于神经梅毒诊断,弥补了神经梅毒 诊断检测方法的空白;具有检测通量大、结果确切、灵敏度高、操作简单的特点,易于推 广。
36.本发明在lips基础上进行优化,采用elisa板包被的双抗原夹心法,将protein a/g plusagarose包被elisa白板上,血清中抗体先与protein a/g plus agarose结合,含荧光素酶抗原 再与血清中抗体特异性结合。改良的lips实现高通量检测血清抗体的特点,其敏感性高于 eia的104倍,还可进行定量检测(定量范围从25pg/ml~107pg/ml),因此更符合临床大样 本检测需求。
附图说明
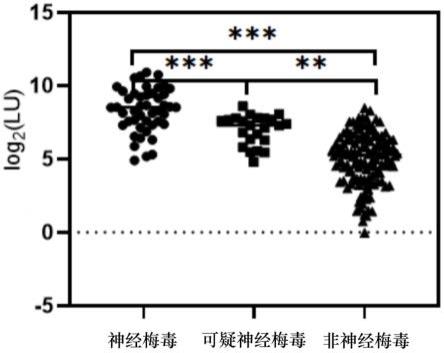
37.图1是本实施例200例梅毒患者脑脊液中nichols houton株tp0136抗体水平经 kruskal-wallis h检验的统计学差异性;
38.图2是脑脊液中nichols houton株tp0136抗体水平根据最大约登指数选择最佳截断值用 于神经梅毒的预测结果。
具体实施方式
39.下面结合实施例对本发明作进一步的描述,但需要说明的是,实施例并不对本发明要 求保护范围的构成限制。
40.本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常规的。下 述实施例中的方法,如无特别说明,均为本领域的常规方法。
41.实施例
42.一种基于tp0136nh亚型(即nichols houton株tp0136蛋白)的神经梅毒诊断试剂盒, 包括以下组分:(1)样本稀释液;(2)nanoluc荧光素酶和梅毒螺旋体nichols houton株tp0136 抗原组成的融合蛋白液;(3)proteina/g包被的酶标板;(4)洗涤液;(5)荧光素酶底物。
43.其中,样本稀释液为2%脱脂牛奶。
44.融合蛋白液通过以下方法制备而成:
45.a、以nichols houton株tp0136抗原基因序列为模板进行pcr扩增,pcr扩增产物经凝 胶电泳及核酸纯化获得nichols houton株tp0136抗原基因片段;
46.b、将获得的nichols houton株tp0136抗原基因片段与nanoluc荧光素酶基因的pnlf1 载体质粒分别进行eco rⅰ和xbaⅰ双酶切,并使用t4连接酶将酶切产物连接得到重组质粒;
47.c、将重组质粒转化到大肠杆菌dh5α中,通过菌液pcr筛选转基因阳性菌;
48.d、在200ml lb液体培养基中扩繁转基因阳性菌,并用质粒提取试剂盒(plasmid plus midi kit,qiagen)提取重组质粒;
49.e、通过琼脂糖凝胶电泳验证步骤d提取重组质粒的质量(条带无拖尾现象,条带大小正 确),通过紫外分光光度计检测提取重组质粒的纯度和浓度(od260/od280=1.8~2.0时纯度 高,质粒浓度ng/ml=od260
×
50ng/ml
×
稀释倍数);
50.f、在10cm2细胞培养皿中培养he la细胞,当细胞铺板率达到80~90%时,以脂质
体核 酸转染试剂(lipofectamine 2000,invitrogen):步骤d所得重组质粒按照3μl:1μg的比例进行转 染,37℃、5%co2培养箱中培养48~72h,弃细胞培养液,并加入5ml 0.01m、ph7.4的磷 酸缓冲液用细胞刮刀将细胞收集至15ml离心管中,最后将细胞收集液在冰浴中超声处理 15~30min得细胞裂解液,然后将细胞裂解液于4℃,12000rpm离心15~45min,弃沉淀, 收集上清液即为融合蛋白;
51.g、将上述所得融合蛋白用0.01m、ph7.4的pbs磷酸盐缓冲液稀释得融合蛋白液,要求 融合蛋白液每10μl中有107个荧光单位,-20℃保存备用。
52.融合蛋白液是稀释后的融合蛋白,这个稀释液也就是细胞裂解液,只是在细胞裂解之 前要要保证融合蛋白的浓度,所以用量少。裂解后再调整至使用浓度,调整浓度后的融合 蛋白液再放置试剂盒中,这样试剂盒检测过程就方便了(不需要再去检测蛋白的浓度)。
53.上述步骤a中,pcr扩增的引物为:
54.上游引物:5'-atgacgtgcgatttcactgg-3',
55.下游引物:5'-ctcgcggttccaggagcacg-3'。
56.proteina/g包被的酶标板的制备方法如下:
57.a、proteina/g用0.01m、ph7.4pbs溶解为1μg/ml的浓度;
58.b、按照100μl/孔将上述proteina/g溶液加入酶标板中,酶标板覆膜,4℃孵育12~16h;
59.c、弃proteina/g溶液,300μl/孔用0.1%pbst洗3次,4℃保存。
60.洗涤液配置方法为:nacl 8g,kcl 0.2g,na2hpo4·
12h2o 3.63g,kh2po
4 0.24g,加水 定容至1l,灭菌。
61.荧光素酶底物为promega公司的furimazine荧光素酶底物。
62.下面对本实施例的一些细节作详细介绍:
63.1、梅毒螺旋体nichols houton株的培养和基因组dna的提取
64.将梅毒螺旋体nichols houton株接种于3月龄新西兰兔睾丸,接种前保证每只兔的梅 毒血清学试验检测结果阴性,予以不含抗生素的饲料和水喂养,4周后无菌取兔睾丸浸于 无菌生理盐水并清洗后,用无菌剪刀将睾丸组织剪碎后置于ep管中,通过暗视野显微镜 鉴定,若发现白色、折光力强、纤细的螺旋状微生物,螺旋整齐,具有蛇行、旋转、伸缩 等缓慢而规律的运动方式,即可判为梅毒螺旋体。
65.经鉴定后的组织样本按照基因组dna提取试剂盒说明书操作:(1)在ep管中按1:1 比例加入buffer atl使组织细胞裂解;(2)吸取20μl蛋白酶k加入ep管;(3)加 入200μl样本充分混匀;(4)加入200μl buffer al,涡旋振荡15s充分混匀;(5)56℃ 孵育10min;(6)10000rpm离心2min,取上清;(7)加入200μl无水乙醇,涡旋振荡 15s充分混匀,取上清;(8)将上清转移至吸附柱,8000rpm离心1min;(9)弃去滤液 和收集管,将吸附柱放入新的收集管,加入500μl buffer aw1,8000rpm离心1min;(10) 弃去滤液和收集管,将吸附柱放入新的收集管,加入500μl buffer aw2,14000rpm离心 3min;(11)弃去滤液和收集管,将吸附柱放入新的收集管,14000rpm离心1min;(12) 弃去滤液和收集管,将吸附柱放入新的收集管,开盖3min;(13)向吸附柱内悬空滴加30μlbuffer ae,室温静置1min,8000rpm离心1min,-20℃保存。
66.2、pcr扩增
67.(1)引物的设计与合成
68.从genbank(https://www.ncbi.nlm.nih.gov/genbank/)中查询nichols houton株tp0136的 基因序列(nc_000919),根据引物设计原则,结合载体质粒pnlf1-n酶切位点,利用primerpremier 6.0软件遵循引物设计原则设计引物,引物由上海生工生物工程股份有限公司合成。
69.(2)pcr扩增
70.以梅毒螺旋体dna为模板,以nichols houton株tp0136为引物,pcr反应总体积为20μl, 扩增体系如下:
71.1)dna模板0.2μl
72.2)upstream primer(p1)0.4μl
73.3)downstream primer(p2)0.4μl
74.4)ddh2o 9μl
75.5)hs dna polymerase 10μl
76.扩增体系总体积20μl。以上操作需在冰上进行,旋涡振荡混匀后短暂离心。pcr扩增 参数设置:94℃预变性5min;94℃变性1min,60℃退火2min,72℃延伸1min,共45 个循环;最后72℃延伸10min,终止反应。扩增产物取5μl,通过1.0%琼脂糖凝胶电 泳检测扩增结果,剩余产物保存于-20℃冰箱备用。
77.(3)pcr扩增产物初步鉴定
78.取5μl pcr产物加入1μl 6
×
loading buffer,混匀,以100v电压在1.0%琼脂糖凝胶 中进行电泳,电泳结束后,置于凝胶成像系统中进行观察,并保存结果。
79.3、真核表达体系pnlf1-n-tp0136构建
80.将纯化回收后nichols houton株tp0136pcr扩增产物与pnlf1-n载体分别经ecorⅰ和xbaⅰ双酶切后进行连接,构建重组质粒pnlf1-n-tp0136。
81.(1)pnlf1-n质粒双酶切,酶切反应体系40μl,反应体系如下:
82.1)pnlf1-n 12μl
83.2)eco rⅰ2μl
84.3)xbaⅰ2μl
85.4)10
×
buffer 4μl
86.5)ddh2o 20μl
87.反应体系总体积40μl。振荡混匀后置于水浴锅内反应2h。
88.(2)pnlf1-n经eco rⅰ和xbaⅰ双酶切,酶切反应体系40μl,反应体系如下:
89.1)pnlf1-n 12μl
90.2)eco rⅰ2μl
91.3)xbaⅰ2μl
92.4)10
×
buffer 4μl
93.5)ddh2o 20μl
94.反应体系总体积40μl。振荡混匀后置于水浴锅内反应2h。
95.(3)pcr回收产物双酶切,酶切反应体系40μl,反应体系如下:
96.1)nichols houton株tp0136回收产物 18μl
97.2)eco r
ⅰꢀ
2μl
98.3)xba
ⅰꢀ
2μl
99.4)10
×
buffer 4μl
100.5)ddh2o 14μl
101.反应体系总体积40μl。振荡混匀后置于水浴锅内反应2h。
102.酶切结束后应用dna纯化回收试剂盒对目的片段进行回收,操作步骤遵循试剂盒说 明书。
103.应用分光光度计检测目的片段回收产物的浓度,根据载体与待连接的目的片段摩尔比 为1:6,连接反应体系15μl,反应体系如下:
104.1)酶切后的pnlf1-n 5.5μl
105.2)酶切后的目的片段 2μl
106.3)dna ligation solution 7.5μl
107.反应体系总体积15μl,振荡混匀,16℃连接12h。
108.4、连接产物的转化
109.(1)从-80℃冰箱中取出e.coli dh5α感受态细胞100μl,置于冰中;
110.(2)预热水浴锅至42℃;
111.(3)加入连接产物5μl至e.coli dh5α感受态细胞,轻轻混匀,冰上孵育30min;
112.(4)42℃热激感受态细胞90s;
113.(5)立即转移至冰上放置2min;
114.(6)加入800μl 37℃预温好的无抗性lb液体培养基;
115.(7)37℃200rpm摇床中复苏1小时;
116.(8)在超净工作台中,取100μl均匀涂抹于含氨苄青霉素的lb培养基,37℃倒置 孵育过夜。
117.5.重组菌的筛选鉴定
118.(1)挑选10个单个菌落接种于500μl含有amp的lb液体培养基中,37℃ 150rpm摇床中培养5h;
119.(2)重组菌的pcr鉴定:用pcr扩增验证转化子,扩增体系如下:
120.1)菌液 1μl
121.2)upstream primer(p1) 0.2μl
122.3)downstream primer(p2) 0.2μl
123.4)taq dna polymerase 5μl
124.5)ddh2o 3.6μl
125.总体积10μl。
126.pcr扩增参数设置:94℃预变性5min;94℃变性1min,60℃退火2min,72℃延伸 1min,共45个循环;最后72℃延伸10min,终止反应。扩增产物取5μl,通过1.0% 琼脂糖凝胶电泳检测扩增结果。取5μl pcr产物加入1μl 6
×
loading buffer,混匀,以100v 电压在1.0%琼脂糖凝胶中进行电泳。将转化正确的菌液取5μl接种于含有amp的lb 液体培养基,37℃200rpm培养过夜。
127.(3)重组质粒的提取:按照质粒小提试剂盒说明书进行操作:1)取5ml菌液,12000rpm 离心1min,弃去上清液;2)向装有菌体沉淀的ep管中加入150μl溶液p1,涡旋振荡 混匀;3)向ep管中加入150μl溶液p2,温和翻转使菌体裂解;4)向ep管中加入300μl 溶液p5,立即温和翻转使充分混匀。12000rpm离心2min;5)收集上清液加入吸附柱cp3 内,12000rpm离心30s,弃去收集管中的废液;6)向吸附柱cp3内加入300μl漂洗液 pw,12000rpm离心30s,弃去收集管中的废液,重复此步骤;7)将吸附柱cp3放入收 集管中,12000rpm离心2min;8)吸附柱cp3开盖后放置于室温5min晾干吸附柱内残 余漂洗液;9)将吸附柱cp3置于新的离心管中,向吸附膜中央悬空滴加50μl洗脱缓冲 液eb,室温放置5min,12000rpm离心2min,将离心后得到的溶液重新加入吸附柱内, 再次离心以增加回收效率。
128.(4)重组质粒分别进行eco rⅰ和xbaⅰ双酶切鉴定。
129.6.序列测定
130.由上海生工生物科技有限公司对重组质粒pnlf1-n-tp0136碱 基序列进行检测。测序结果通过blast(https://blast.ncbi.nlm.nih.gov/ blast.cgi)与已公布的基因序列进行比对。
131.7.细胞转染(脂质体介导法)
132.(1)转染前1d接种he la细胞,细胞融合度达80%时进行转染;
133.(2)a液50μl:4μl lipofectamine 3000+46μl opti-mem,b液50μl:3μl p3000+ 重组质粒+opti-mem;
134.(3)将a、b液混合后静置5min;
135.(4)每孔加入a、b混合液和900μl opti-mem,混匀,37℃培养48h。
136.8.细胞裂解物的制备:
137.(1)从待测细胞孔中将培养液吸出,用pbs仔细漂洗2次,trypsin 37℃消化2min, 1ml培养液终止消化;
138.(2)将细胞吸入离心管中,1500rpm离心5min,弃上清;
139.(3)加入500μl pbs漂洗,12000rpm离心1min,弃上清;
140.(4)加入150μl/孔裂解液放置30min。12000rpm离心4min,取上清。细胞裂解物 于-80℃保存。
141.9.包板:
142.(1)96孔白板中每孔加入50μl protein g(5μg/ml),4℃包被过夜。pbst洗板1次;
143.(2)封闭:每个包被孔中加入300μl封闭液(5%脱脂牛奶),37℃孵育1h。
144.10.试剂盒的检测操作流程如下:
145.(1)加样:每孔中加入50μl神经梅毒患者脑脊液,每个样本重复3个孔,同时设 置阳性对照、阴性对照、空白对照;
146.(2)孵育:37℃恒温箱孵育1h;
147.(3)洗板:洗涤液洗板5次;
148.(4)加裂解液:每孔加入50μl以1:100样本稀释液稀释后的nichols houton株tp0136 裂解液;
149.(5)孵育:37℃恒温箱孵育30min;
150.(6)洗板:洗涤液洗板5次;
151.(7)显色:避光,每孔中加入50μl furimazine荧光素酶底物;
152.(8)结果判读:使用gaomax荧光光度计读取样本荧光值(light units,lu)。
153.11.本发明试剂盒的诊断效能评价
154.根据患者临床症状、体征和血清、脑脊液检查结果将200例梅毒患者分为神经梅毒组、 可疑神经梅毒组和非神经梅毒组,其中神经梅毒组46例,可疑神经梅毒组23例,非神 经梅毒组131例,分别应用本发明试剂盒对三组患者的脑脊液进行检测。神经梅毒患者的 诊断标准为脑脊液中vdrl阳性的任何阶段梅毒患者。可疑神经梅毒患者的诊断标准为任 何阶段的梅毒患者,脑脊液vdrl试验阴性,并且符合以下两项:(1)脑脊液fta-abs 阳性和(2)脑脊液wbc计数升高(》5/ul)或脑脊液蛋白浓度升高(》45mg/dl)或有与神 经梅毒相符合的神经系统症状,排除由其他疾病引起。
155.研究结果显示:
156.(1)脑脊液中nichols houton株tp0136抗体水平经kruskal-wallis h检验:神经梅毒>可 疑神经梅毒>非神经梅毒,三者有统计学差异(如图1所示,其中***p《0.001;**p《0.01;* p《0.05);
157.(2)根据最大约登指数(灵敏度+特异度-1)确定最佳截断值,当脑脊液中nichols houton 株tp0136抗体水平的截断值选择大于7,其曲线下面积(auc)为0.898,敏感性为75.4%, 特异性为89.3%,阳性预测值(ppv)为78.8%,阴性预测值为(npv)为87.3%,预测 准确率(agreement)为84.5%。具体结果见图2;
158.(3)利用logistic回归方程,结合患者年龄、性别、有无神经系统症状、血清trust及 脑脊液中nichols houton株tp0136抗体水平能够进一步提高神经梅毒预测的准确率至 93.3%。
159.预测公式为:ln(p/1-p)=-16.840+0.06
×
年龄+1.009
×
性别+3.967
×
有无神经系 统症状+0.082
×
血清trust+1.621
×
脑脊液中nichols houton株tp0136抗体水平。
160.其中,年龄以患者具体年龄赋值;性别:男性赋值为1,女性赋值为0;有神经系统症 状赋值为1,无神经系统症状赋值为0;血清trust以检测到的具体数值赋值;脑脊液中 nichols houton株tp0136抗体水平以本发明试剂盒检测到的具体数值赋值。
161.根据预测公式,其敏感性为89.2%,特异性为95.6%,阳性预测值(ppv)为92.1%, 阴性预测值为(npv)为94.0%,预测准确率(agreement)为93.3%。
162.可以看出,本发明用于神经梅毒诊断中,和vdrl相比(敏感性仅为50%),敏感性高。
163.以上对本发明实施例所提供的技术方案进行了详细介绍,本文中应用了具体个例对本 发明实施例的原理以及实施方式进行了阐述,以上实施例的说明只适用于帮助理解本发明 实施例的原理;同时,对于本领域的一般技术人员,依据本发明实施例,在具体实施方式 以及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1