一种FeN
一种fen
x
c纳米催化网络及其制备方法与应用
技术领域
1.本发明涉及过氧化氢还原电催化剂技术领域,具体涉及一种fen
x
c纳米催化网络及其制备方法与应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.micrornas(mirnas)是一类短的、内源性的、非编码的rnas,具有调控功能,对生理和病理过程具有至关重要的作用。由于mirnas水平超低、固有尺寸小、片段高度相似,高灵敏度的和高选择性检测mirnas依旧是很大的挑战。
4.到目前为止,除了微阵列和northern印迹技术以外,传统的检测rna的方法实时定量聚合酶链反应(rt-qpcr)也是microrna检测的金标准技术。然而,这些方法费时、费力、费时间且灵敏度低,特异性差。为了解决这些限制,现有技术中还有新的检测mirnas的方法,例如比色法,荧光法,电感耦合等离子体质谱法(icpms),电致发光,光电化学生物传感器,电化学生物传感器等。随着纳米科技的发展,越来越多的新合成的纳米材料为mirna的检测提供了新的可能性。其中,在电化学生物传感器中应用具有类天然酶催化活性的纳米材料有利于电化学信号的转换和增大。例如,具有类辣根过氧化物酶的ag/pt纳米团簇和fe3o4@mil-100(fe)已被广泛用于生物分子的检测。li等人已经合成了一类多功能的钯纳米粒子修饰的fe基金属有机框架(pd nps@fe-mofs)并将其应用于mirna-122超灵敏电化学检测中。wang报道了一种高效的氧化还原催化剂(pmpda-fen
x
/c),并证实了pmpda-fen
x
/c对过氧化氢的还原和氧化都具有较高的催化活性。然而这种类型的催化剂在燃料电池的氧还原反应中是一个热点,但是却很少将其生物分析中。
技术实现要素:
5.针对现有技术中存在的问题,本发明的目的是提供一种fen
x
c纳米催化网络及其制备方法与应用,将fen
x
c纳米催化网络用于制备mirna生物传感器,解决目前mirna检测灵敏度和选择性不高的问题,并与dsn酶辅助的目标物循环放大策略相结合,实现了对mirna-21的高灵敏度和高选择性电化学检测,为mirna的可靠检测提供了有效手段。
6.为了实现上述目的,本发明的技术方案如下所述:
7.在本发明的第一方面,提供一种fen
x
c纳米催化网络的制备方法,包括如下步骤:
8.(1)在sio2悬浮液中加入间苯二胺和浓盐酸,再加入(nh4)2s2o8和fecl3溶液,间苯二胺被氧化成聚间苯二胺(pmpda)涂覆在sio2纳米颗粒的表面,得到粉末样品;
9.(2)步骤(1)得到的粉末在惰性环境中进行高温热解,得到fen
x
c/sio2;
10.(3)将步骤(2)得到的fen
x
c/sio2中加入苯甲酸重氮盐和还原铁粉,将苯甲酸基嫁接到fenxc/sio2表面;去除sio2,得到表面修饰有羧基的fen
x
c纳米颗粒;
11.(4)在步骤(3)得到的fen
x
c纳米颗粒中加入edc溶液和nhs溶液,活化fen
x
c纳米颗粒上的羧酸基团;
12.(5)将氨基修饰的dna加入到活化的fen
x
c纳米颗粒中,得到fen
x
c-dna生物复合物,即fen
x
c纳米催化网络。
13.在本发明的第二方面,提供一种第一方面所述fen
x
c纳米催化网络的制备方法制备得到的fen
x
c纳米催化网络。
14.在本发明的第三方面,提供一种mirna生物传感器的制备方法,步骤如下:
15.(1)将硫醇修饰的捕获探针(cp)在金工作电极(aue)表面孵育一段时间,修饰后的aue在mch中封闭一段时间;
16.(2)在cp/aue传感器制作完成后,将其在含有不同浓度的mirna-21和dsn的dsn缓冲液中孵育;
17.(3)孵育完成后将按照第一方面所述制备方法制备得到的fen
x
c-dna1滴在电极上,孵育一段时间后,在电极上滴加按照第一方面所述制备方法制备得到的fen
x
c-dna1和fen
x
c-dna2的混合液,再孵育一段时间,然后转移到电化学系统进行测量。
18.在本发明的第四方面,提供一种第三方面所述mirna生物传感器的制备方法制备得到的mirna生物传感器。
19.在本发明的第五方面,提供一种第二方面所述fen
x
c纳米催化网络或第四方面所述mirna生物传感器在mirna检测中的应用。
20.本发明的具体实施方式具有以下有益效果:
21.本发明利用dna自组装fenxc纳米催化聚合物网络的优越性能,以及dsn酶的特异性切割活性,构建了一种用于mirna-21超灵敏检测的电化学生物传感器。dsn酶作为工具酶可以水解与mirna-21杂交的cp,释放出mirna-21,使电极上剩余的cp与fen
x
c纳米颗粒上的dna1杂交,同时dna1和dna2的杂交自组装形成纳米催化网络;本发明中的电化学生物传感器的灵敏度有很大的提高,检测极限低至0.43fm;此外,对单碱基错匹配的mirna的识别能力证实了电化学生物传感器的选择性,提供了一种灵敏度高、选择性好的检测mirna的方法。
附图说明
22.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
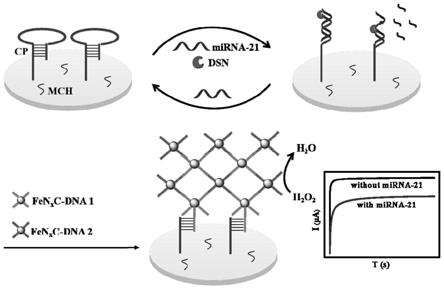
23.图1为用于电化学检测mirna-21的dna自组装fenxc纳米催化网络示意图;
24.图2中,(a)为fen
x
c的透射电镜图;(b)为fen
x
c-dna的透射电镜图;(c)为fenxc-dna纳米催化网络的透射电镜图;(d)为图(c)相应区域的高分辨率tem图像;
25.图3中,(a)为裸aue和fen
x
c修饰的aue的电催化活性,a、裸金电极,b、fen
x
c修饰的金电极在溶解了20mm h2o2的0.1m pbs中的cv曲线;
26.(b)为不同修饰阶段的金电极的eis曲线:a、裸金电极,b、cp/aue,c、mirna-21+dsn/cp/aue,d、fen
x
c-dna1/mirna-21+dsn/cp/aue,e、fen
x
c纳米网络/mirna-21+dsn/cp/aue;插图为奈奎斯特等效电路;
27.(c)为a、fen
x
c纳米催化网络/dsn/cp/aue,b、fen
x
c-dna1/mirna-21+dsn/cp/aue,
c、fen
x
c-dna纳米催化网络/mirna-21+dsn/cp/aue在含10mm h2o2的pbs中的cv曲线;
28.(d)为a、无mirna-21时的对照组,b、fen
x
c-dna1/mirna-21+dsn/cp/aue,c、fen
x
c-dna纳米催化网络/mirna-21+dsn/cp/aue对应的ca曲线;
29.图4中,(a)为cp浓度对检测1.0pm mirna-21的传感器响应的影响;(b)为dsn酶的用量对检测1.0pm mirna-21的传感器响应的影响;
30.图5中,(a)为不同浓度mirna-21(0,1,5,10,50,100,500,1000,5000fm)下的ca曲线;(b)为图(a)对应的校准曲线;
31.图6中,(a)为所开发的生物传感器对a、mirna-21,b、srna,c、trna,d、mirna-141和e、let-7d的响应;(b)为相同条件下制备的5个cp/aue对0.1pm mirna-21的响应;(c)为制备的生物传感器在4℃下存放1、3、5和7天后对mirna-21的电化学响应。
具体实施方式
32.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本技术使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
33.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
34.本发明的一种实施方式中,提供了一种fen
x
c纳米催化网络的制备方法,所述制备方法如下:
35.(1)在sio2悬浮液中加入间苯二胺和浓盐酸,再加入(nh4)2s2o8和fecl3溶液,间苯二胺被氧化成聚间苯二胺(pmpda)涂覆在sio2纳米颗粒的表面,得到粉末样品;
36.(2)步骤(1)得到的粉末在惰性环境中进行高温热解,得到fen
x
c/sio2;
37.(3)将步骤(2)得到的fen
x
c/sio2配置成悬浮液,加入苯甲酸重氮盐和还原铁粉,将苯甲酸基嫁接到fen
x
c/sio2表面;去除sio2,得到表面修饰有羧基的fen
x
c纳米颗粒;
38.(4)在步骤(3)得到的fen
x
c纳米颗粒中加入edc溶液和nhs溶液,活化fen
x
c纳米颗粒上的羧酸基团;
39.(5)将氨基修饰的dna加入到活化的fen
x
c纳米颗粒中,得到fen
x
c-dna生物复合物,即fen
x
c纳米催化网络。
40.在一种或多种实施方式中,步骤(1)中(nh4)2s2o8和fecl3溶液使用前进行预冷;
41.在一种或多种实施方式中,步骤(1)中粉末样品在75~85℃下干燥11~13h,优选80℃下干燥12h;
42.在一种或多种实施方式中,步骤(2)中,所述高温热解包括第一次高温热解和第二次高温热解;第一次高温热解后的样品在酸溶液中浸泡一段时间,然后进行第二次高温热解;
43.优选地,第一次高温热解的温度为900~1000℃,时间0.5~1.5h,进一步优选950℃,时间1h;
44.优选地,第二次高温热解的温度为900~1000℃,时间2.5~3.5h;进一步优选950
℃,时间3h;
45.优选地,75~85℃条件下在盐酸溶液中浸泡7~9h,进一步优选80℃浸泡8h,浸泡后用水洗涤;
46.在一种或多种实施方式中,步骤(3)中,所述苯甲酸重氮盐为对氨基苯甲酸、亚硝酸钠和盐酸在低温下合成的,优选地,所述低温为2.5~3.5℃,优选3℃;
47.在一种或多种实施方式中,步骤(3)中,去除sio2通过hf溶液刻蚀去除;
48.在一种或多种实施方式中,步骤(4)在室温下进行;
49.在一种或多种实施方式中,步骤(5)中,将氨基修饰的dna加入到活化的fen
x
c纳米颗粒中后4℃保存过夜,离心,用tris缓冲液洗涤至少3次;
50.将获得的fen
x
c-dna生物复合物分散在tris缓冲液中,并以4℃保存以供进一步使用。
51.优选地,所述te缓冲液体系为:10mm tris-hcl,100mm nacl,1.0mm edta,ph 7.4;
52.优选地,所述tris缓冲液体系为:50mm tris-hcl,10mm mgcl2,ph 8.0)and 0.1m pbs(ph 7.4。
53.本发明的一种实施方式中,提供了一种上述fen
x
c纳米催化网络的制备方法制备得到的fen
x
c纳米催化网络。
54.本发明的一种实施方式中,提供了一种mirna生物传感器的制备方法,所述制备方法如下:
55.(1)将硫醇修饰的捕获探针(cp)在金工作电极(aue)表面孵育一段时间,修饰后的aue在mch中封闭一段时间;
56.(2)在cp/aue传感器制作完成后,将其在含有不同浓度的mirna-21和dsn的dsn缓冲液中孵育;
57.(3)孵育完成后将按照上述制备方法制备得到的fen
x
c-dna1滴在电极上,孵育一段时间后,在电极上滴加按照上述制备方法制备得到的fen
x
c-dna1和fen
x
c-dna2的混合液,再孵育一段时间,然后转移到电化学系统进行测量。
58.在一种或多种实施方式中,在修饰金工作电极(aue)前,用0.05μm氧化铝粉仔细抛光,然后用水、乙醇和超纯水依次冲洗;抛光好的aue在0.5m硫酸中进行电化学清洗,以获得一个干净的表面;新鲜清洗过的aue用超纯水清洗,用氮气干燥。
59.在一种或多种实施方式中,步骤(1)中孵育的时间为11~13h,温度为3~5℃,优选时间12h温度4℃;
60.在一种或多种实施方式中,步骤(1)修饰后的aue在mch中封闭0.5~1.5h,优选1h,以优化cp的取向,防止非特异性吸附;
61.在一种或多种实施方式中,所述dsn缓冲液为50mm tris-hcl,5mm mgcl2,1mm dtt,ph 8.0;
62.在一种或多种实施方式中,步骤(2)中孵育条件为在50~60℃下孵育0.5~1.5小时,优选55℃下孵育1小时;
63.在一种或多种实施方式中,步骤(3)中孵育条件均为35~39℃孵育0.5~1.5小时,优选37℃孵育1小时;
64.本发明的一种实施方式中,提供了一种上述mirna生物传感器的制备方法制备得
到的mirna生物传感器。
65.具有脱氧核糖核酸酶活性的双链特异性核酸酶(duplex-specific nuclease,dsn)具有信号增强和识别单核苷酸的错配的能力,dsn酶只能水解双链dna(dsdna)或dna-rna双链中的dna(mirna保持不变),例如,dsn可以水解与mirna结合部分的捕获探针(cp),同时释放mirna再次与新的cp结合,以诱导更多的dna水解反应。换句话说就是,一个mirna对应多个电化学信号物质,从而使信号放大,提高检测的灵敏度。此外,dsn酶可以区分精确区分完全匹配和部分匹配的短双链,因此它对mirna家族表现出超高的选择性,甚至是单碱基错配的mirna也有很高的识别能力。
66.上述mirna生物传感器的原理如下:
67.扩增的mirna电化学检测机理如图1所示。硫醇修饰的cp通过金硫(au-s)键固定在aue表面。随后用mch封闭了表面。引入目标物mirna-21后,由于cp与mirna-21杂交,cp的茎环结构展开,形成dna/rna双链。dna/rna双链可以被dsn识别,dsn强烈偏好切割至少10bp的双链dna,或者15bp的dna-rna完美双链,对单链dna和rna几乎没有活性,因此形成的dna/rna双链被dsn切割,mirna-21再次与未展开的cp杂交,进行循环切割。aue表面残留的cp链与fen
x
c-dna1纳米颗粒上的dna1杂交,然后dna1与fen
x
c-dna2上的dna2杂交,从而形成了dna自组装的fen
x
c纳米催化网络,催化h2o2产生电化学信号。反之,如果目标物mirna-21不存在时,dsn酶不会水解cp,cp的颈环结构不会打开,fen
x
c-dna1无法与其杂交,无法在电极上形成dna自组装的fen
x
c纳米催化网络结构。因此,不能催化h2o2产生电化学信号。
68.本发明的一种实施方式中,提供了一种上述fen
x
c纳米催化网络或mirna生物传感器在mirna检测中的应用。
69.下面结合具体的实施例对本发明作进一步的解释和说明。
70.实施例1
71.材料:高效液相色谱纯化的dna和mirna(其序列见表1)、焦碳酸二乙酯(depc)和三羟甲基氨基甲烷-酸盐(tris-hcl)均购买自上海生工生物科技有限公司(上海,中国)。dsn酶购买自深圳纽邦生物科技有限公司(深圳,中国)。1-(3-二甲氨基丙基)-3-碳二亚胺(edc)、n-羟基丁二酰亚胺(nhs)、6-巯基-1-己醇(mch)、三羟甲基氨基甲烷(2-羧乙基)液磷化氢盐酸(tcep)、二氧化硅(sio2)和30%的h2o2均购买自阿拉丁试剂有限公司(上海,中国)。磷酸二氢钠(nah2po4)、磷酸氢二钠(na2hpo4)、氯化钠(nacl)、氯化镁(mgcl2)均购买自国药集团化学试剂有限公司(上海,中国)。间苯二胺(m-pda)、还原性铁粉、氯化铁(fecl3)购买自中医药上海化学试剂有限公司。其他试剂为分析级,使用时无需进一步纯化。
72.实验中用到的缓冲溶液如下:te缓冲溶液(10mm tris-hcl,1mm edta,ph 7.4);tris 1缓冲液(10mm tris-hcl,100mm nacl,ph 7.4);tris 2缓冲液(40mm tris-hcl,10mm mgcl2,ph 7.8);100mm tecp溶液用于固定cp,使用时稀释至10mm和0.1m pbs(ph 7.4)。所有的耗材均用0.1%depc处理,用高温高压蒸汽灭菌。所有溶液均采用超纯水净化系统(电阻率=18.25mω.cm)获得的超纯水。用depc处理后的水制备缓冲溶液,以避免rna的降解。
73.表1本发明实施例1中使用的核酸序列信息
[0074][0075]
仪器:电化学测量是在电化学工作站chi760e上进行的(上海辰华,中国),采用的是典型的三电极体系,ag/agcl(饱和氯化钾)为参比电极,pt丝为对电极以及3mm的金工作电极(aue)。纳米粒子通过低倍透射电子显微镜(tem,ht-7700,日本高新技术公司,日本)和zetasizer nan仪器(zen3590,马尔文仪器有限公司,中国)进行表征.
[0076]
fen
x
c的制备
[0077]
将sio2分散至超纯水中超声制成悬浮液,将其悬浮液和与间苯二胺和浓盐酸混合在一起,然后在该悬浮液中,加入预冷的(nh4)2s2o8和fecl3溶液,将间苯二胺氧化成聚间苯二胺(pmpda)涂覆在sio2纳米颗粒的表面,然后,通过旋转蒸发器除去溶剂,在80℃的烘箱中进一步干燥12h。所得到的粉末在高纯度氩气气氛中,在950℃的温度下进行第一次热处理(ht1)1h。然后将热解的样品在80℃的1m盐酸溶液中酸浸8h,然后离心,用去离子水洗涤。最后,将得到的粉末在相同的温度下热处理第2次(ht2)3h,得到fen
x
c/sio2。将热解后的产物配置成悬浮液,利用还原重氮盐法在其表面接枝上苯甲酸基,通过对氨基苯甲酸、亚硝酸钠和盐酸在3℃冷浴中合成苯甲酸二氮盐。将热解后的fen
x
c/sio2配置成悬浮液,将得到的重氮盐和还原铁粉末倒入fen
x
c/sio2悬浮液中。搅拌反应混合物过夜,苯甲酸基嫁接到了fenxc/sio2表面;最后在hf溶液中刻蚀去除sio2,得到表面修饰有羧基的fen
x
c纳米颗粒。
[0078]
fen
x
c-dna生物复合物的制备
[0079]
将2.5mg fen
x
c纳米颗粒分散到1ml pbs中,然后与1ml 400mm edc和100mm nhs混合,在室温下摇晃15min,活化fen
x
c纳米颗粒上的羧酸基团。离心分离混合物,用pbs洗涤沉积物,去除多余的edc和nhs。然后,将300μl的氨基修饰的dna1(10μm)加入到活化的fen
x
c纳米颗粒中。4℃在冰箱中保存过夜,然后离心,用tris缓冲液洗涤3次。将获得的fen
x
c-dna1生物复合物分散在3ml tris缓冲液中,并以4℃保存以供进一步使用;
[0080]
fen
x
c-dna2生物复合物的制备工艺与fen
x
c-dna1生物复合物的制备过程相同。
[0081]
mirna生物传感器的制备
[0082]
在修饰前,用0.05μm氧化铝粉仔细抛光,然后用水、乙醇和超纯水依次冲洗。抛光好的aue在0.5m硫酸中进行电化学清洗,以获得一个干净的表面。新鲜清洗过的aue用超纯水清洗,用氮气干燥。随后,将5μl硫醇修饰的捕获探针(cp,1μm)在4℃下在aue表面孵育12h,然后修饰后的aue在1mm mch中封闭1h,以优化cp的取向,防止非特异性吸附。在cp/aue传感器制作完成后,将其在5μl含有不同浓度的mirna-21和0.05u dsn的dsn缓冲液(50mm tris-hcl,5mm mgcl2,1mm dtt,ph 8.0)中孵育,在55℃下孵育1小时。然后,洗电极,以去除未结合的mirna-21。洗涤后,将5μl fen
x
c-dna1滴在电极上,37℃孵育1小时,最后在电极上滴加5μl fen
x
c-dna1和5μl fen
x
c-dna2的混合液,于37℃下孵育1h,然后转移到电化学系统进行测量。
[0083]
电化学检测
[0084]
通过纳米材料催化h2o2间接检测mirna,为了测量生物传感器的响应电流,在含有10mm h2o2的0.1m pbs中进行时安培测试,电位为0.45v。使用电化学阻抗谱(eis)测量来验证aue的组装过程。eis在含有5.0mm[fe(cn)6]
3-/4-]的0.1m kcl中进行,频率范围为10mhz~100khz,振幅为5mv。
[0085]
结果与讨论
[0086]
fen
x
c和fen
x
c-dna复合物的表征
[0087]
fen
x
c-dna纳米催化网络的表征
[0088]
利用tem来验证fen
x
c-dna1复合物和fen
x
c-dna2复合物自组装的纳米催化网络的成功构建。如图2中(a)所示,可以观察到fen
x
c纳米粒子的直径大约有30nm~60nm,在溶液中均匀分散。其中,围绕纳米粒子的黑点是被碳层包裹的含铁粒子。在fen
x
c纳米粒子的表面修饰上dna后,可以观察到fen
x
c纳米颗粒的轮廓变得清晰,这是由于fen
x
c纳米颗粒表面的dna链周围聚集了缓冲盐,这些缓冲盐的结晶大大增强了dna修饰的fen
x
c纳米颗粒在高电子辐照下的图像对比度。同时可以看到颗粒的分散度增加了,这主要是因为fen
x
c纳米颗粒表面的dna带负电,fen
x
c-dna之间存在着静电排斥作用,见图2(b)。图2(c)观察到的是fen
x
c-dna1和fen
x
c-dna2共孵育的团聚结构,投影面积为1μm*300nm。对图2(c)进行高倍放大后得到图2(d),发现fen
x
c纳米颗粒不是紧密堆积的状态而是以均匀的间距分布,颗粒间距约为10nm,该间距正好与dna1的长度相当(核苷酸碱基长度为0.34nm),因此推断该间距是dna1-dna2双链所在的空间,表明了fen
x
c纳米颗粒的团聚是通过dna杂交自组装实现的。以上种种结果证明了fen
x
c-dna生物复合物的成功制备以及fen
x
c纳米催化网络的成功构建。
[0089]
表2.纳米材料的zate电位
[0090]
[0091]
利用zate电位来进一步证明fen
x
c-dna生物复合物纳米粒子的成功合成。fen
x
c的zate电位是-10.73mv,分别和dna1、dna2孵育后,fen
x
c-dna1的zate电位是-17.7mv,fen
x
c-dna2的zate电位是-13.53mv。表明fen
x
c纳米颗粒上成功修饰上了dna1和dna2形成了fen
x
c-dna生物纳米复合物。fen
x
c-dna的电位向负移动是因为单链dna带负电,移动程度由dna长度决定。
[0092]
fen
x
c以及生物传感器的电化学表征
[0093]
通过循环伏安法,研究了fen
x
c的催化性能。如图3a所示,与裸aue相比,fen
x
c修饰的aue在约-0.25v时出现了明显的还原峰,表明fen
x
c对过氧化氢还原具有明显的电催化活性。
[0094]
eis用于表征aue的组装过程如图3(b)。插入基于zview软件应用的等效电路包括溶液电阻(rs)、双层电容恒相元件(cpe)、warburg阻抗(zw)和ret),电子传递电阻可以反映电极的表面状态。在奈奎斯特图中,半圆直径指的是电极表面的ret。裸金电极的半圆形区域非常小(曲线a),这表明裸金电极具有高导电性,[fe(cn)6]
3-/4-在界面上转移较快。电极进行了cp固定和mch封闭后,ret值显著增加到2008ω(曲线b),因为cp带负电荷的磷酸盐骨架和[fe(cn)6]
3-/4-阴离子的静电排斥作用阻碍了[fe(cn)6]
3-/4-阴离子的扩散,表明cp成功地固定在了金电极上。当制备的cp/aue传感器与mirna-21和dsn孵育时,ret值明显下降到352ω(曲线c),这是因为cp识别mirna-21形成的dna/mirna-21杂交双链被dsn酶水解,导致cp的水解,金电极上剩余的cp单链变短,带负电的磷酸骨架减少,与[fe(cn)6]
3-/4-阴离子的静电排斥作用相对减弱,[fe(cn)6]
3-/4-阴离子扩散受到的阻碍作用相对减弱。随后在电极上滴上fen
x
c-dna1,由于电极上的剩余的cp单链与大量的dna1杂交,增强了带负电荷的磷酸盐骨架与[fe(cn)6]
3-/4-阴离子的静电作用,因此得到了一个增大的ret值为626.8ω(曲线d)。最后,将fen
x
c-dna1和fen
x
c-dna2的混合液滴在电极上,ret值急剧增加至3281ω(曲线e),这是由于dna1和dna2的杂交自组装在电极表面形成了fen
x
c-dna纳米催化网络结构,空间位阻增加了,严重阻碍了[fe(cn)6]
3-/4-阴离子向金电极表面的扩散。以上种种的结果都表明电极上的层层修饰是成功的。
[0095]
通过比较不同条件下的cv,证明了fen
x
c纳米催化聚合物网络的可行性和催化性能。如图3(c)所示,电极与fen
x
c-dna1和fen
x
c-dna2共孵育,有mirna-21存在时的电极的响应信号相对于没有mirna-21时的(曲线a)显著增加(曲线c),表明只有在mirna-21存在时,fen
x
c纳米催化网络才能连接到电极上,才能显示出其催化性能。当mirna-21存在时,仅连接了fen
x
c-dna1(曲线b)的传感器远远不如连接了fen
x
c纳米催化聚合网络的传感器的响应信号,以上验证了fen
x
c纳米催化聚合网络的成功构建和良好的性能。为了进一步比较催化反应的效果,我们利用了ca的响应电流进行了对比(图3d)。当没有目标物mirna-21时,背景电流为1.819μa。相比之下,连接了fen
x
c-dna1的传感器的响应电流为2.832μa,由fen
x
c纳米催化聚合网络修饰的传感器的响应电流为6.141μa,因此fen
x
c纳米催化网络将响应电流增加了4.27倍,高效的放大了信号。
[0096]
实施例2
[0097]
与实施例1的区别在于捕获探针的浓度为0.1μm;
[0098]
实施例3
[0099]
与实施例1的区别在于捕获探针的浓度为0.25μm;
[0100]
实施例4
[0101]
与实施例1的区别在于捕获探针的浓度为1.5μm;
[0102]
实施例5
[0103]
与实施例1的区别在于捕获探针的浓度为2.0μm;
[0104]
实施例6
[0105]
与实施例1的区别在于dsn酶的数量为0.02u;
[0106]
实施例7
[0107]
与实施例1的区别在于dsn酶的数量为0.04u;
[0108]
实施例8
[0109]
与实施例1的区别在于dsn酶的数量为0.06u;
[0110]
实施例9
[0111]
与实施例1的区别在于dsn酶的数量为0.08u;
[0112]
实施例1-9探索了捕获探针的固定浓度和dsn酶的数量对电化学生物传感器的电化学信号的影响,实验中mirna-21的浓度为1.0pm。如图4(a)所示,在0.1μm到1.0μm范围内,随着cp浓度的增大,δi迅速增加,δi在1.0μm时达到最大值。随后,δi随着cp固定浓度的增加而减小。这是由于一开始cp的固定浓度比较低,随着cp浓度的增加,电极表面固定的cp的自组装密度增大,cp和mirna-21杂交的越多,信号输出越大,但是当cp的自组装密度过大,cp与mirna-21的杂交效率因为位阻效应而降低。因此,cp的最优浓度为1.0μm。dsn酶的用量直接影响到传感器的放大效率,因此优化了dsn酶的用量。如图4(b)所示,dsn酶δi随着dsn酶的用量的增加而增大,且在用量为0.05u后趋于平缓,表明dsn酶辅助的目标物循环达到最大效率。因此,选择0.05u dsn酶为最佳的用量。
[0113]
生物传感器的分析性能
[0114]
在最优条件下,利用本发明制备的生物传感器对一系列不同浓度的mirna-21进行检测。如图5(a)所示,在0fm-5pm范围内,电流响应随着mirna-21浓度的增加而增加。此外,在5fm-1pm范围内,电流的变化与mirna-21浓度的对数有着良好的线性关系。得到的线性校准方程为δi(μa)=-1.6636log(c
mirna-21
(fm))-0.6685,相关系数为0.994,如图5(b)所示。根据3σ标准,所提出的传感器的极限计算为0.43fm。
[0115]
选择性、重现性、稳定性
[0116]
通过检测不同的mirna来评价本发明构建的生物传感器的选择性,例如,mirna-21、单碱基错配的mirna-21(srna)、三个碱基错配的mirna-21(trna)、mirna-141和let-7d等。其中,mirna-21检测浓度为0.1pm,其他mirna检测的浓度为1pm。如图6(a)所示,与mirna-21相比,传感器对srna的响应信号较小。而对trna、mirna-141和let-7d的反应几乎可以忽略不计。结果可以清楚地表明,该生物传感器对在mirna-21具有良好的选择性。
[0117]
通过在相同条件下制备的5个cp/aue电极对检测0.1pm mirna-21的响应电流的对比来评估了所提出的生物传感器的重现性。如图6(b)所示,结果显示相对标准差(rsd)为5.8%,表明所开发的生物传感器具有可接受的重现性。
[0118]
为了探索所开发的生物传感器的稳定性,分别将制备的电极在4℃冰箱中保存1天、3天、5天和7天,用于检测mirna-21。如图6(c)所示,与新制造的电极相比,保存的电极的响应较为稳定。即使在7天后,该传感器也能保持81.2%的原始响应。这表明所开发的生物
传感器具有相对较好的稳定性。
[0119]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1