一种实时监测无机氮离子浓度的微电极及其制备方法和应用
1.本发明涉及微电极生物传感器技术领域,具体涉及一种可实时监测nh
4+
/no
2-/no
3-离子浓度的微电极生物传感器及其制备方法和应用。
背景技术:
2.土壤是人类赖以生存的自然环境和农业生产的重要资源。施用化学肥料是提升土壤质量、提高作物产量的重要措施,以尿素为主的化学氮肥进入土壤后迅速水解为铵离子,微生物又将施入的铵离子氧化为亚硝酸根离子(铵氧化作用)或进一步氧化为硝酸根离子(亚硝酸盐氧化作用),而铵离子、亚硝酸根离子以及硝酸根离子在土壤中的含量及其迁移转化不仅能够影响土壤可生物利用氮素储存,还与土壤氮素损失、环境氮素污染等密切相关。因此,分别监测土壤中铵离子、亚硝酸根离子以及硝酸根离子的含量具有重要意义。
3.由于铵离子在土壤中易被吸附、亚硝酸根离子极易被氧化、硝酸根离子易被反硝化,因此以往的监测方法需破坏性采集土壤样品,经水溶液或盐溶液(如kcl,na2so4等)浸提后,采用靛酚蓝比色法、盐酸萘基乙二胺比色法、镀铜镉柱还原-盐酸萘基乙二胺比色法或离子色谱法等进行测定。但是上述方法无法监测稻田土壤原位环境下的铵离子、亚硝酸根离子以及硝酸根离子的浓度,且无法实时连续监测。因此,亟需设计一种新的技术方案,以综合解决现有技术中存在的问题。
技术实现要素:
4.本发明的目的是提供一种实时监测无机氮离子浓度的微电极及其制备方法和应用,能有效解决现有依赖破坏性采样测定方法无法实时监测稻田土壤原位环境下离子浓度的问题。
5.为解决上述技术问题,本发明采用了以下技术方案:
6.一种实时监测无机氮离子浓度的微电极,所述微电极为玻璃电极,所述微电极包含ag/agcl参比电极和ag/agcl工作电极,微电极的尖端设有离子选择性液膜,微电极内部填充膜后电解液、且内部还连接有ag/agcl丝的电信号连接线,电信号连接线的外端连接微电极工作站,测量电压值;
7.当检测离子为nh
4+
离子,离子选择性液膜配方包括以下化学试剂:nh
4+
离子载体i、四硼酸钾和2-硝基苯辛醚;膜后电解液为nh4cl;
8.当检测离子为no
2-离子,离子选择性液膜配方包括以下化学试剂:no
2-离子载体i、四苯硼钠和2-硝基苯辛醚;膜后电解液为nano2、kcl和na3po4·
12h2o;
9.当检测离子为no
3-离子,离子选择性液膜配方包括以下化学试剂:2-硝基苯辛醚、甲基三苯基溴化膦和三(十二烷基)甲基硝酸铵;膜后电解液为kno3和kcl。
10.其中,所述微电极为复合式、电压型微电极,该微电极长度为11~14cm,直径为0.5cm,厚度为0.05mm;尖端部分长度为10~20mm,直径为10~50μm。
11.同时,本发明还提供一种实时监测无机氮离子浓度的微电极的制备方法,包括以
下步骤:
12.1)制备微电极玻璃外壳:拉制巴斯德玻璃吸管,使巴斯德玻璃吸管的尖端长度为10~20mm、直径为10~50μm,即得微电极玻璃外壳;
13.2)硅烷化:将微电极玻璃外壳置于容器中,加入硅烷化试剂,之后于烘箱中烘烤0.5~2小时,最后打开容器至硅烷化试剂挥发完毕;
14.3)注射膜后电解液:将膜后电解液注入微电极玻璃外壳内,且使膜后电解液充满微电极玻璃外壳尖端;
15.4)吸入离子选择性液膜:在正置显微镜下,将离子选择性液膜吸入微电极玻璃外壳的尖端,且微电极玻璃外壳尖端吸入离子选择性液膜的长度为200~300μm;
16.5)安装ag/agcl丝:将连接有电信号连接线的ag/agcl丝由微电极玻璃外壳直管端放入膜后电解液中,直至接近尖端;采用环氧树脂将ag/agcl丝固定在微电极玻璃外壳中;
17.6)微电极信号采集:将电信号连接线连接至微电极工作站的毫伏通道上,接上ag/agcl参比电极后,即得微电极电压信号。
18.其中,硅烷化试剂的配方为:5%二甲基二氯硅烷,溶剂为正己烷。
19.其中,膜后电解液均是配置后经0.45μm的过滤器过滤后使用的。
20.其中,ag/agcl丝是将丝径0.2mm的银丝于hcl溶液中电镀10分钟制成的。
21.另外,本发明还提供一种实时监测无机氮离子浓度的微电极在水环境/土壤中的应用,包括以下步骤:
22.1)配制含有nh
4+
/no
2-/no
3-离子的标准溶液,然后用与离子相对应的微电极测量标准溶液的电压值,并绘制相应的标准工作曲线;
23.2)将完成标准工作曲线绘制的微电极插入待测水环境/土壤环境中,进行实时动态监测;
24.3)收集监测数据,将测得的电压值代入相应的标准工作曲线中,计算得到水环境/土壤环境中的nh
4+
/no
2-/no
3-离子浓度。
25.其中,当在水环境/土壤中,监测nh
4+
离子时,标准工作曲线是以-log{nh
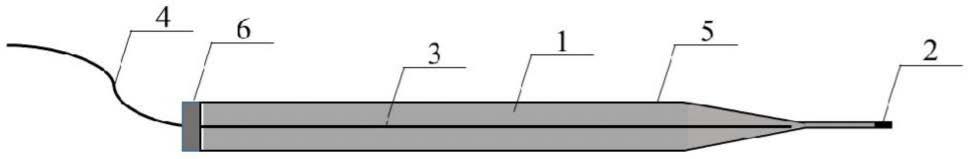
4+
}为横轴,电压值(mv)为纵轴绘制的;当在水环境/土壤中,监测no
2-离子时,标准工作曲线是以-log{no
2-}为横轴,电压值(mv)为纵轴绘制的;当在水环境/土壤中,监测no
3-离子时,标准工作曲线是以-log{no
3-}为横轴,电压值(mv)为纵轴绘制的。
26.上述技术方案中提供了一种实时监测无机氮离子浓度的微电极及其制备方法和应用。离子选择性微电极是一类利用膜电势测定溶液中离子的活度或浓度的电化学传感器,当它和含待测离子的溶液接触时,在它的敏感膜和溶液的相界面上产生与该离子活度直接有关的膜电势。因此,该微电极可不依赖化学分离,是一种简单、迅速、且十分适用于水体、土壤等复环境样品的野外分析和连续监测的分析工具。
27.本发明的无机氮离子浓度检测微电极制备步骤包括制备微电极玻璃外壳、硅烷化、注射膜后电解液、吸入离子选择性液膜、安装ag/agcl丝以及微电极信号采集。其中微电极玻璃外壳尖端尺寸的设置、离子选择性液膜的配方及其注射方法有效提升了微电极的性能。该微电极玻璃外壳尖端长度为10~20mm、直径设置为10~50μm,该玻璃外壳尺寸可有效填充离子选择性液膜并维持其活性,其细长的尖端能够在土壤中使用时不剧烈扰动土壤环境,而合适的玻璃外壳长度和直径配比可保证微电极在水体、土壤等复杂环境中稳定使用
而不致受损,因此该玻璃外壳尺寸的设置有助于提升微电极的稳定性和使用寿命,也使得监测结果更接近原位环境。
28.当检测离子为nh
4+
离子,离子选择性液膜的配方中,nh
4+
离子载体i是选择性检测nh
4+
离子的决定性组分,而合适的四硼酸钾和2-硝基苯辛醚配比有助于提升nh
4+
离子载体i试剂的稳定性和使用寿命;当检测离子为no
2-离子,离子选择性液膜的配方中,no
2-离子载体i是选择性检测no
2-离子的决定性组分,而合适的四硼酸钾和2-硝基苯辛醚配比有助于提升no
2-离子载体i试剂的稳定性和使用寿命;当检测离子为no
3-离子,离子选择性液膜的配方中,三(十二烷基)甲基硝酸铵是选择性检测no
3-离子的决定性组分,而合适的2-硝基苯辛醚和甲基三苯基溴化膦配比有助于提升三(十二烷基)甲基硝酸铵的稳定性和使用寿命。
29.另外,在正置显微镜下将离子选择性液膜吸入微电极玻璃外壳的尖端,确保其吸入长度为200~300μm,可有效提高离子选择性液膜的稳定性和使用寿命。通过连接微电极工作站,能够实时检测水环境/土壤环境中无机氮离子含量动态变化,实时检测时间间隔一般为10秒。
附图说明
30.图1为实施例1实时监测无机氮离子浓度的微电极的结构示意图;
31.图2为实施例5实时监测nh
4+
离子浓度的微电极检测nh
4+
含量的工作曲线;
32.图3为实施例6实时监测nh
4+
离子浓度的微电极的离子选择性测试图;
33.图4为实施例8实时监测nh
4+
离子浓度的微电极的响应时间测试图;
34.图5为实施例8实时监测nh
4+
离子浓度的微电极的稳定性测试图;
35.图6为实施例6实时监测nh
4+
离子浓度的微电极在面施肥后的稻田土壤不同区域的工作曲线;
36.图7为实施例6实时监测nh
4+
离子浓度的微电极与传统靛酚蓝比色法结果对比图。
37.图8为实施例7实时监测no
2-离子浓度的微电极检测no
2-含量的工作曲线;
38.图9为实施例8实时监测no
2-离子浓度的微电极的离子选择性测试图;
39.图10为实施例8实时监测no
2-离子浓度的微电极的响应时间测试图;
40.图11为实施例8实时监测no
2-离子浓度的微电极的稳定性测试图;
41.图12为实施例6实时监测no
2-离子浓度的微电极在面施肥后的稻田土壤不同区域的工作曲线;
42.图13为实施例9实时监测no
3-离子浓度的微电极检测no
3-含量的工作曲线;
43.图14为实施例10实时监测no
3-离子浓度的微电极的离子选择性测试图;
44.图15为实施例10实时监测no
3-离子浓度的微电极的响应时间测试图;
45.图16为实施例10实时监测no
3-离子浓度的微电极的稳定性测试图;
46.图17为实施例6实时监测no
3-离子浓度的微电极在面施肥后的稻田土壤不同区域的工作曲线;
47.图18为实施例6实时监测no
3-离子浓度的微电极与传统铜镉柱还原-盐酸萘基乙二胺比色法结果对比图;
48.图中:1.膜后电解液;2.离子选择性液膜;3.ag/agcl丝;4.电信号连接线;5.微电极玻璃外壳;6.环氧树脂。
具体实施方式
49.为了使本发明的目的及优点更加清楚明白,以下结合实施例对本发明进行具体说明。应当理解,以下文字仅仅用以描述本发明的一种或几种具体的实施方式,并不对本发明具体请求的保护范围进行严格限定。
50.实施例1
51.本实施例采取的技术方案如图1所示,一种实时监测无机氮离子浓度的玻璃微电极,采用复合式、电压型微电极,该微电极长度为11~14cm,直径为0.5cm,厚度为0.05mm;尖端部分长度为10~20mm,直径为10~50μm;包含ag/agcl参比电极和ag/agcl工作电极。该离子选择性微电极外观为微电极玻璃外壳5,内部填充膜后电解液1,尖端有离子选择性液膜2,内部连接有ag/agcl丝3,使用环氧树脂6进行固定,使用电信号连接线4将ag/agcl丝的末端接至微电极工作站毫伏通道(型号为fx-6 uniamp,unisense,denmark)进行电信号采集。
52.实施例2
53.本实施例以检测nh
4+
离子的微电极为例,对实施例1的实时监测无机氮离子浓度的微电极的制备方法进行说明,其具体包括以下步骤:
54.1)制备微电极玻璃外壳5:拉制巴斯德玻璃吸管,使巴斯德玻璃吸管的尖端长度为10~20mm、直径为10~50μm,即得微电极玻璃外壳;
55.2)硅烷化:在通风橱中进行,将拉制好的微电极玻璃外壳置于玻璃容器中,加入2ml硅烷化试剂,硅烷化试剂的配方为5%二甲基二氯硅烷,溶剂为正己烷;之后于150℃烘箱中烘烤半小时,打开容器使硅烷化试剂挥发完全,挥发时间不低于6小时;
56.3)注射膜后电解液:将膜后电解液(为0.5mol/l nh4cl,配置完成后经0.45μm的过滤器过滤后使用)用1ml注射器注入微电极玻璃外壳内,并在微电极玻璃外壳后端加压使膜后电解液充满微电极玻璃外壳尖端;
57.4)吸入离子选择性液膜:在正置显微镜下,用微量注射器将nh
4+
离子选择性液膜(7%(w/w)nh
4+
离子载体i、四硼酸钾0.7%和2-硝基苯辛醚92.4%溶于dmf中)吸入微电极玻璃外壳的尖端,吸入液膜的长度为200-300μm;
58.5)安装ag/agcl丝:将0.2mm粗细、合适长度的银丝于0.1mol/l的hcl溶液中电镀10分钟,电流0.1~0.2a,制成ag/agcl丝;将连接有电信号连接线的ag/agcl丝由微电极玻璃外壳直管端放入膜后电解液中,直至接近尖端;采用环氧树脂将ag/agcl丝固定在微电极玻璃外壳中;
59.6)微电极信号采集:将电信号连接线连接至微电极工作站的毫伏通道上,接上ag/agcl参比电极后,即得微电极电压信号;测量时将参比电极放进样品中即可。
60.实施例3
61.本实施例以检测no
2-离子的微电极为例,对实施例1的实时监测无机氮离子浓度的微电极的制备方法进行说明,其具体包括以下步骤:
62.1)制备微电极玻璃外壳5:拉制巴斯德玻璃吸管,使巴斯德玻璃吸管的尖端长度为10~20mm、直径为10~50μm,即得微电极玻璃外壳;
63.2)硅烷化:在通风橱中进行,将拉制好的微电极玻璃外壳置于玻璃容器中,加入2ml硅烷化试剂,硅烷化试剂的配方为5%二甲基二氯硅烷,溶剂为正己烷;之后于150℃烘箱中烘烤半小时,打开容器使硅烷化试剂挥发完全,挥发时间不低于6小时;
64.3)注射膜后电解液:将膜后电解液(为0.3mol/l kcl、0.01mol/l nano2、0.01mol/l na3po4·
12h2o,调至ph=7;配置完成后经0.45μm的过滤器过滤后使用)用1ml注射器注入微电极玻璃外壳内,并在微电极玻璃外壳后端加压使膜后电解液充满微电极玻璃外壳尖端;
65.4)吸入离子选择性液膜:在正置显微镜下,用微量注射器将no
2-离子选择性液膜(7%(w/w)no
2-离子载体i、1%(w/w)四苯硼钠,溶液于2-硝基苯辛醚中)吸入微电极玻璃外壳的尖端,吸入液膜的长度为200-300μm;
66.5)安装ag/agcl丝:将0.2mm粗细、合适长度的银丝于0.1mol/l的hcl溶液中电镀10分钟,电流0.1~0.2a,制成ag/agcl丝;将连接有电信号连接线的ag/agcl丝由微电极玻璃外壳直管端放入膜后电解液中,直至接近尖端;采用环氧树脂将ag/agcl丝固定在微电极玻璃外壳中;
67.6)微电极信号采集:将电信号连接线连接至微电极工作站的毫伏通道上,接上ag/agcl参比电极后,即得微电极电压信号;测量时将参比电极放进样品中即可。
68.实施例4
69.本实施例以检测no
3-离子为例,对实施例1的实时监测无机氮离子浓度的微电极的制备方法进行说明,其具体包括以下步骤:
70.1)制备微电极玻璃外壳5:拉制巴斯德玻璃吸管,使巴斯德玻璃吸管的尖端长度为10~20mm、直径为10~50μm,即得微电极玻璃外壳;
71.2)硅烷化:在通风橱中进行,将拉制好的微电极玻璃外壳置于玻璃容器中,加入2ml硅烷化试剂,硅烷化试剂的配方为5%二甲基二氯硅烷,溶剂为正己烷;之后于150℃烘箱中烘烤半小时,打开容器使硅烷化试剂挥发完全,挥发时间不低于6小时;
72.3)注射膜后电解液:将膜后电解液(为0.05mol/l kno3和0.05mol/l kcl,配置完成后经0.45μm的过滤器过滤后使用)用1ml注射器注入微电极玻璃外壳内,并在微电极玻璃外壳后端加压使膜后电解液充满微电极玻璃外壳尖端;
73.4)吸入离子选择性液膜:在正置显微镜下,用微量注射器将no
3-离子选择性液膜(0.065g2-硝基苯辛醚、0.001g甲基三苯基溴化膦、0.006g三(十二烷基)甲基硝酸铵溶于4体积四氢呋喃中)吸入微电极玻璃外壳的尖端,吸入液膜的长度为200-300μm;
74.5)安装ag/agcl丝:将0.2mm粗细、合适长度的银丝于0.1mol/l的hcl溶液中电镀10分钟,电流0.1~0.2a,制成ag/agcl丝;将连接有电信号连接线的ag/agcl丝由微电极玻璃外壳直管端放入膜后电解液中,直至接近尖端;采用环氧树脂将ag/agcl丝固定在微电极玻璃外壳中;
75.6)微电极信号采集:将电信号连接线连接至微电极工作站的毫伏通道上,接上ag/agcl参比电极后,即得微电极电压信号;测量时将参比电极放进样品中即可。
76.实施例5
77.本实施例采用实施例2制备的玻璃微电极对稻田土壤nh
4+
含量进行原位动态监测,其监测方法如下:
78.1)绘制工作曲线:将优级纯nh4cl烘4小时,配制成10-1
~10-5
mol/l一系列标准溶液;将nh
4+
微电极连接至工作站,测量各标准溶液的电压值。以-log[nh
4+
]为x轴,电压值(mv)为y轴绘制标准工作曲线(如图2所示),线性方程为y=-42.619x+0.937,r2>0.99,呈
现较好线性关系;
[0079]
2)将完成工作曲线绘制的玻璃微电极插入待测稻田土壤样品,进行实时动态监测;
[0080]
3)收集监测数据,将电压值代入工作曲线的线性方程中,得到稻田土壤中nh
4+
含量(如图6所示)。
[0081]
为验证本实施例玻璃微电极检测结果的准确性,与传统靛酚蓝比色法检测nh
4+
含量进行了比较(如图7所示);
[0082]
传统靛酚蓝比色法的步骤为:
[0083]
1)土壤间隙水采取:利用间隙水采集器于微电极尖端所在位置抽取土壤间隙水,滤纸过滤后备用;
[0084]
2)nh
4+
含量标准曲线绘制:称取烘干的硫酸铵[(nh4)2so4,分析纯]溶于水中,制备成浓度为5mgn/l的nh
4+
标准溶液。吸取0ml、0.5ml、1ml、2ml、3ml、4ml、5mlnh
4+
标准溶液放入50ml容量瓶中,补充去离子水至30ml,依次加入5ml酚溶液[10g/l苯酚(c6h5oh,分析纯),100mg/l硝普钠(na2fe(cn)5no
·
2h2o,分析纯)]和5ml次氯酸钠溶液[10g/l氢氧化钠(naoh,化学纯),7.06g/l磷酸氢二钠(na2hpo4·
7h2o,化学纯),31.8g/l磷酸钠(na3po4·
12h2o,化学纯),10ml次氯酸钠(naocl,化学纯)],摇匀后在20℃左右室温下放置1h。加1ml掩蔽剂[200g/l酒石酸钾钠(knac4h4o6·
4h2o,化学纯),50g/l edta二钠盐(c
10h14
o8n2na2·
2h2o,分析纯),2mol/l氢氧化钠(naoh,化学纯)]以溶解可能生产的沉淀物后,用去离子水定容至50ml。用1em比色皿在625nm波长处进行比色,读取吸光度并绘制标准曲线。用空白试验溶液调节零点。
[0085]
3)样品nh
4+
含量测定:吸取2~10ml间隙水(视nh
4+
含量而定,其n含量控制在2~25μg)放入50ml容量瓶中,按照上述方法获得吸光度,根据标准曲线获得样品nh
4+
含量。
[0086]
实施例6
[0087]
本实施例对实施例2制备的玻璃微电极进行离子选择性测试,具体包括以下步骤:
[0088]
1)将nh4cl优级纯烘4小时,配制成10-1
10-5
mol/l一系列标准溶液,然后用nh
4+
离子选择性微电极测量电压值,以-log{nh
4+
}为横轴,电压值(mv)为纵轴绘制如图2所示的标准工作曲线,线性方程为y=-42.619x+0.937,r2>0.99;
[0089]
2)将nh
4+
离子选择性微电极放入浓度10-3
mol/l的nh
4+
标准溶液中连续监测10min,微电极迅速做出响应,并在短时间稳定,响应时间t
90
<3s(如图4所示);
[0090]
3)离子选择性微电极会受其他相似离子的干扰,本实施例采用“两点,混合溶液法(即单独存在nh
4+
测定溶液和同时存在nh
4+
与干扰离子的测定溶液)”确定电极对干扰离子的选择性系数。本实施例选择k
+
、na
+
、ca
+
作为干扰离子,干扰离子浓度10mmol/l,测得如图3所示的离子选择性系数图;
[0091]
4)将nh
4+
离子选择性微电极放入浓度10-3
mol/l的nh
4+
标准溶液中连续监测10h,确定微电极性能稳定,电势漂移<2mv(如图5所示);
[0092]
5)将性能稳定的nh
4+
离子选择性微电极放入浓度10-3
mol/l的nh
4+
标准溶液中连续监测,直至微电极失效,使用寿命最短为4天。
[0093]
实施例6检测表明该nh
4+
离子选择性微电极具有良好的能斯特响应及检测范围,其响应时间短、灵敏度高、准确度高、稳定性高;其微电极尖端更细,液膜物质稳定性更强,其
使用寿命也较长。
[0094]
实施例7
[0095]
本实施例采用实施例3制备的玻璃微电极对稻田土壤no
2-离子含量进行原位动态监测,其监测方法如下:
[0096]
1)绘制工作曲线:将nano2分析纯烘4小时,配制成10-1
~10-5
mol/l一系列标准溶液;将玻璃微电极连接unisense工作站,然后用玻璃微电极测量标准溶液的电压值,以-log{no
2-}为横轴,电压值(mv)为纵轴绘制标准工作曲线(如图8所示),线性方程为y=37.933x-143.25,r2>0.99,呈现良好的线性关系;
[0097]
2)将完成工作曲线绘制的玻璃微电极插入待测稻田土壤样品,进行实时动态监测;
[0098]
3)收集监测数据,将电压值代入工作曲线的线性方程中,得到稻田土壤中no
2-含量(如图12所示)。
[0099]
为验证本实施例玻璃微电极检测结果的准确性,与传统盐酸萘基乙二胺比色法检测no
2-含量进行了比较;微电极检测结果表明土壤中no
2-含量均低于0.01mg/l,均低于传统盐酸萘基乙二胺比色法的检测下限。传统盐酸萘基乙二胺比色法的步骤为:
[0100]
1)土壤间隙水采取:利用间隙水采集器于微电极尖端所在位置抽取土壤间隙水,滤纸过滤后备用;
[0101]
2)no
2-含量标准曲线绘制:称取干燥24h的亚硝酸钠[(nano2),分析纯]溶于水中,制备成浓度为5mgn/l的no
2-标准溶液。吸取0ml、0.5ml、1ml、2ml、3ml、4ml、5mlno
2-标准溶液放入25ml容量瓶中,加入2ml重氮化试剂[0.05g/l磺胺(c6h8n2o2s,分析纯),2.4mol/l盐酸(hcl,分析纯)]混匀后静置5min,再加入2ml显色剂[0.03g/ln-1萘基-乙二胺二盐酸盐(c
12h14
n2·
2hcl,分析纯),0.12mol/l盐酸(hcl,分析纯)],混匀后定容至25ml。在暗处静置20min,用1cm比色皿在550nm波长处进行比色,读取吸光度后绘制标准曲线。用空白试验溶液调节零点。
[0102]
3)样品no
2-含量测定:吸取2~10ml间隙水(视no
2-含量而定,其n含量控制在2~25μg)放入50ml容量瓶中,按照上述方法获得吸光度,根据标准曲线获得样品no
2-含量。
[0103]
实施例8
[0104]
本实施例对实施例3制备的玻璃微电极进行离子选择性测试,具体包括以下步骤:
[0105]
1)将nano2分析纯烘4小时,配制成10-1
~10-5
mol/l一系列标准溶液,然后用no
2-离子选择性微电极测量电压值,以-log{no
2-}为横轴,电压值(mv)为纵轴绘制如图8所示的标准工作曲线,线性方程为y=37.933x-143.25,r2>0.99。
[0106]
2)将no
2-离子选择性微电极放入浓度10-3
mol/l的no
2-标准溶液中连续监测10min,微电极迅速做出响应,并在短时间稳定,响应时间t
90
<10s(如图10所示)。
[0107]
3)离子选择性微电极会受其他相似离子的干扰,本实施例采用“两点,混合溶液法(即单独存在no
2-测定溶液和同时存在no
2-与干扰离子的测定溶液)”确定电极对干扰离子的选择性系数。本实施例选择no
3-、cl-、hco
3-作为干扰离子,干扰离子浓度10mmol/l,测得如图5所示的离子选择性系数图(如图9所示)。
[0108]
4)将no
2-离子选择性微电极放入浓度10-3
mol/l的no
2-标准溶液中连续监测10h,确定微电极性能稳定,电势漂移<2mv(如图11所示)。
[0109]
5)将性能稳定no
2-离子选择性微电极放入浓度10-3
mol/l的no
2-标准溶液中连续监测,直至微电极失效,使用寿命最短为4天。
[0110]
实施例8检测结果表明该no
2-离子选择性微电极具有良好的能斯特响应及检测范围,其响应时间短、灵敏度高、准确度高、稳定性高;其微电极尖端更细,液膜物质稳定性更强,其使用寿命也较长。
[0111]
实施例9
[0112]
本实施例采用实施例4制备的玻璃微电极对稻田土壤no
3-离子含量进行原位动态监测,其监测方法如下:
[0113]
1)绘制工作曲线:将kno3优级纯烘4小时,配制成10-1
~10-5
mol/l一系列标准溶液;将玻璃微电极连接unisense工作站,然后用玻璃微电极测量标准溶液的电压值,以-log{no
3-}为横轴,电压值(mv)为纵轴绘制标准工作曲线(如图13所示),线性方程为y=56.627x-32.709,r2>0.99,呈现良好的线性关系;
[0114]
2)将完成工作曲线绘制的玻璃微电极插入待测稻田土壤样品,进行实时动态监测;
[0115]
3)收集监测数据,将电压值代入工作曲线的线性方程中,进行面施肥后得到稻田土壤不同区域中no
3-含量变化(如图17所示)。
[0116]
为验证本实施例玻璃微电极检测结果的准确性,与传统铜镉柱还原-盐酸萘基乙二胺比色法检测no
3-含量进行了比较(如图18所示);传统铜镉柱还原-盐酸萘基乙二胺比色法的步骤为:
[0117]
1)土壤间隙水采取:利用间隙水采集器于微电极尖端所在位置抽取土壤间隙水,滤纸过滤后备用;
[0118]
2)镀铜镉还原柱制备:将玻璃棉放在玻璃还原柱(内径1cm,长度30cm,下具活塞)下端,注满稀氯化铵溶液[1.25g/l氯化铵(nh4cl,分析纯)],再倒入厚度为20cm的镀铜镉粒,排除气泡,并使用150ml稀氯化铵溶液[1.25g/l氯化铵(nh4cl,分析纯)]以8ml/min流速平衡还原柱,直至液面降至镀铜镉粒表面。
[0119]
2)no
3-还原成no
2-:称取硝酸钾[(kano3),分析纯]溶于水中,制备成浓度为2mgn/l的no
3-标准溶液。吸取1ml浓氯化铵溶液[50g/l氯化铵(nh4cl,分析纯)]加入到平衡好的镀铜镉还原柱表面,再吸取0ml、2ml、4ml、6ml、8ml、10mlno
3-标准溶液或2~5ml间隙水(视no
2-含量而定,其n含量控制在2~20μg)加入还原柱,使用75ml稀氯化铵溶液[1.25g/l氯化铵(nh4cl,分析纯)]以110ml/min流速通过还原柱,直至液面降至镀铜镉粒表面,流出液收集在100ml容量瓶中。
[0120]
3)no
3-标准曲线绘制:选取no
3-标准溶液的镀铜镉还原柱流出液,加入2ml重氮化试剂[0.05g/l磺胺(c6h8n2o28,分析纯),2.4mol/l盐酸(hcl,分析纯)]混匀后静置5min,再加入2ml显色剂[0.03g/ln-1萘基-乙二胺二盐酸盐(c
12h14
n2·
2hcl,分析纯),0.12mol/l盐酸(hcl,分析纯)],混匀后定容至100ml。在暗处静置20min,用1cm比色皿在550nm波长处进行比色,读取吸光度后绘制标准曲线。用空白试验溶液调节零点。
[0121]
3)样品no
3-含量测定:选取土壤间隙水的镀铜镉还原柱流出液,按照上述方法获得吸光度,根据标准曲线计算后扣除no
2-含量(实施例7方法)即可得到样品no
3-含量。
[0122]
实施例10
[0123]
本实施例对实施例4制备的玻璃微电极进行离子选择性测试,具体包括以下步骤:
[0124]
1)将kno3优级纯烘4小时,配制成10-1
~10-5
mol/l一系列标准溶液,然后用no
3-离子选择性微电极测量电压值,以-log{no
3-}为横轴,电压值(mv)为纵轴绘制如图6所示的标准工作曲线,线性方程为y=56.627x-32.709,r2>0.99(如图13所示)。
[0125]
2)将no
3-离子选择性微电极放入浓度10-3
mol/l的no
3-标准溶液中连续监测10min,微电极迅速做出响应,并在短时间稳定,响应时间t
90
<10s(如图15所示)。
[0126]
3)离子选择性微电极会受其他相似离子的干扰,本实施例采用“两点,混合溶液法(即单独存在no
3-测定溶液和同时存在no
3-与干扰离子的测定溶液)”确定电极对干扰离子的选择性系数。本实施例选择no
2-、cl-、hco
3-作为干扰离子,干扰离子浓度10mmol/l,测得如图7所示的离子选择性系数图(如图14所示)。
[0127]
4)将no
3-离子选择性微电极放入浓度10-3
mol/l的no
3-标准溶液中连续监测10h,确定微电极性能稳定,电势漂移<2mv(如图16所示)。
[0128]
5)将性能稳定no
3-离子选择性微电极放入浓度10-3
mol/l的no
3-标准溶液中连续监测,直至微电极失效,使用寿命最短为4天。
[0129]
实施例10检测表明该no
3-离子选择性微电极具有良好的能斯特响应及检测范围,其响应时间短、灵敏度高、准确度高、稳定性高;其微电极尖端更细,液膜物质稳定性更强,其使用寿命也较长。
[0130]
上面结合实施例对本发明的实施方式作了详细说明,但是本发明并不限于上述实施方式,对于本技术领域的普通技术人员来说,在获知本发明中记载内容后,在不脱离本发明原理的前提下,还可以对其作出若干同等变换和替代,这些同等变换和替代也应视为属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1