新型冠状病毒抗体的检测试剂及其制备方法与流程
1.本公开属于体外诊断医学免疫领域,涉及一种利用胶乳增强免疫比浊法测定人样本中sars-cov-2抗体含量的试剂盒。
背景技术:
2.新型冠状病毒(sars-cov-2)是新型冠状病毒肺炎(covid-19)的病原体,是一种有包膜的β型单链rna冠状病毒。
3.sars-cov-2潜伏期通常是2至14天,该病毒存在人与人之间传播的高风险,在人与人之间主要通过呼吸道分泌物和气溶胶进行传播。因此,及时对携带者或感染者进行诊断对控制疫情和疾病治疗都至关重要。sars-cov-2中至少有27种蛋白质,包括15种非结构蛋白(nsp1至nsp10、nsp12至nsp16)、4种结构蛋白(s、e、m和n)和8种辅助蛋白(3a、3b、p6、7a、7b、8b、9b和orf14)。4种结构蛋白为:棘突蛋白(s)、包膜(e)、膜(m)和核衣壳(n)。
4.s蛋白是一种跨膜蛋白,在冠状病毒表面形成独特的三聚体结构。每个s单体由一个n-末端s1亚单位和膜近端s2亚单位组成。s1亚单位包含受体结合域rbd(receptor binding domain),可与宿主细胞的血管紧张素转化酶2(angiotensin-converting enzyme 2ace2)受体结合。rbd能诱导机体产生中和抗体,是诊断和疫苗研究的理想抗原。
5.血清学检测在了解病毒感染和疫苗研究方面起着重要作用。目前针对血清sars-cov-2特异性抗体检测主要方法有胶体金法,化学发光法等。胶体金法操作简单,无须特殊设备,15-30min内完成检测,成本比较低,对硬件要求不高,可用于基层实验室但是灵敏度较低,只能做定性检测,通量较低。化学发光法灵敏度和特异性均较高,能进行定量检测,可批量操作,但需要特殊仪器,适合在大中型医院开展。胶乳增强免疫比浊法,操作简单,快速,具有高通量,能定量测定人血清或血浆中sars-cov-2抗体。抗体反应的量化有助于测定特异性抗体浓度,可以纵向监测个体的抗体动态水平。
6.cn113252911b公开了一种sars-cov-2中和抗体的检测试剂盒,其特征在于,所述检测试剂盒用于同时检测结合rbd蛋白的中和抗体和结合ntd蛋白的中和抗体;所述检测试剂盒包括组分a和组分b;组分a包括包被于磁性微粒的rbd蛋白和包被于磁性微粒的ntd蛋白;组分b包括吖啶酯标记的ace2蛋白和吖啶酯标记的axl蛋白;所述检测试剂盒还包括ace2抗体和axl抗体。
7.cn113341150a涉及一种sars-cov-2检测试剂盒;所述试剂盒包括a)与固相支持物偶联的rbd特异性配体,b)偶联有吖啶类荧光团的标记物的rbd重组蛋白,以及:用于溶解a组分的第一缓冲液,ph=5.5-6.5;用于溶解b组分的第二缓冲液,ph=5.5-8.5;用于裂解样本以释放病毒中的rbd抗原的第三缓冲液,ph=3.0-4.5。
8.cn113495141a提供一种sars-cov-2igm抗体检测试剂盒,包括吖啶酯标记的两种抗原和包被在固相载体上的鼠抗人igm抗体;其中,两种抗原为sars-cov-2rbd抗原和sars-cov-2n抗原。
9.cn111537743a涉及sars-cov-2新冠病毒抗体检测试剂盒,包括固体载体,以及连
接于所述固体载体上的特定多肽组合,其还包括连接于所述固体载体上的sars-cov-2sars-cov-2的s蛋白的rbd结构域。
10.cn113607957a公开了一种针对sars-cov-2rbd结构域的特异性中和抗体竞争法elisa试剂盒,含有包被有人ace2蛋白的固相载体、生物素标记的rbd蛋白。
11.cn113671184a提供一种用于检测sars-cov-2中和抗体的检测试剂盒及方法,采用蛋白标签对rbd及ace2修饰使其二者具有更好的稳定性和反应性。
技术实现要素:
12.随着更多病毒变异株或亚型(如alpha、beta、gamma、delta、delta plus、epsilon、lambda、mu和omicron等)的出现,单一原生型/野生型rbd并不能满足临床检测的需求。鉴于此,本公开提供了一种rbd联合的技术方案。
13.微球
14.本公开提供一种纳米微球,其表面上包被有抗原。纳米微球和抗原是共价或非共价结合,优选共价结合。
15.在一些实施方案中,抗原是rbd抗原,其选自:sars-cov-2的rbd、包含sars-cov-2rbd的多肽、或包含sars-cov-2rbd的表位的多肽。
16.本公开中,“rbd抗原”应作广泛理解,可以是全长rbd、片段或其表位,只要能被待测样本中sars-cov-2的抗体所识别并结合即可。因此,rbd抗原包含选自以下任一sars-cov-2亚型的rbd或其表位:野生型(本文也作原生型)、alpha、beta、gamma、delta、delta plus、epsilon、lambda、mu和omicron。当未来出现更多亚型时,本公开意图涵盖这些亚型。
17.在一些实施方案中,sars-cov-2rbd通过宿主细胞表达,经过色谱纯化获得。可以通过本领域公认的基因重组技术制备上述抗原,也可以购买商品化的产品。
18.在一些具体的实施方案中,sars-cov-2抗原是s蛋白,优选s蛋白的rbd作为抗原。
19.在一些实施方案中,纳米微球是一种核壳结构。作为一个示例,纳米微球的核是聚苯乙烯聚合物,壳由苯乙烯、丙烯酸正丁酯、甲基丙烯酸共聚物组成。在一些实施方案中,纳米微球是聚苯乙烯纳米微球颗粒。
20.在一些实施方案中,所述纳米微球表面带有选自以下的化学基团:硫酸基、磺酸基、羧基、氨基、羟基、酰肼基、氯甲基、及其组合。
21.在一些实施方案中,所述纳米微球的平均粒径范围为200至450nm(含端点值);包括但不限于200、225、250、275、300、325、350、375、400、425、450nm、以及上述任意两个数值之间的范围。在一些具体的实施方案中,所述纳米微球的粒径是325nm。
22.此处应当强调的是,上下文中“325nm”并不是指试剂中的每一个纳米微球的粒径都刚好是325nm。实际上,325nm是一个统计学意义上的数值;由于纳米微球在制造过程中是存在误差的,因此325nm规格的纳米微球是指粒径范围在325nm左右,例如300至350nm范围内,再比如310至340nm范围内。
23.在本公开中,纳米微球不是均质的,其包含两种纳米微球的混合物,分别包被不同的rbd抗原。
24.在一些实施方案中,纳米微球包含第一纳米微球和第二纳米微球。所述第一纳米微球包被有sars-cov-2第一rbd抗原;所述第二纳米微球包被有sars-cov-2第二rbd抗原。
第一rbd抗原包含选自以下任一sars-cov-2亚型的rbd或其表位:alpha、beta、gamma、delta、delta plus、epsilon、lambda、mu和omicron;所述第二rbd抗原包含选自以下任一sars-cov-2亚型的rbd或其表位:野生型、alpha、beta、gamma、delta、delta plus、epsilon、lambda、mu和omicron。所述第一rbd抗原和所述第二rbd抗原不同。
25.在一些实施方案中,所述rbd抗原可以通过物理吸附或化学偶联结合在纳米微球表面。作为示例,单一的原生型rbd抗原、或者单一突变型rbd抗原、或者两者组合通过化学偶联交联方法结合在纳米微球表面上。在一些具体的实施方案中,还可以分别交联原生型rbd抗原和突变型rbd抗原到纳米微球表面,然后按特定比例进行混合,可以达到更佳的使用效果。
26.试剂/试剂盒
27.在一些实施方案中,提供一种sars-cov-2抗体检测试剂盒,其包含:
28.第一试剂,其包含稳定剂、促聚剂、和缓冲液;
29.第二试剂,其包含:
30.根据本公开的前述第一纳米微球、
31.根据本公开的前述第二纳米微球、
32.任选,稳定剂、和
33.缓冲液。
34.在一些实施方案中,所述第一纳米微球包被有sars-cov-2第一rbd抗原;所述第二纳米微球包被有sars-cov-2第二rbd抗原。
35.在一些实施方案中,所述第一rbd抗原包含选自以下任一sars-cov-2亚型的rbd或其表位:alpha、beta、gamma、delta、delta plus、epsilon、lambda、mu和omicron;所述第二rbd抗原包含选自以下任一sars-cov-2亚型的rbd或其表位:野生型、alpha、beta、gamma、delta、delta plus、epsilon、lambda、mu和omicron。
36.在一些实施方案中,所述第一rbd抗原和所述第二rbd抗原不同。
37.在一些实施方案中,所述稳定剂选自以下的任一项:脂肪醇聚氧乙烯醚、bsa、吐温20、brijl23、蔗糖、或其组合。
38.在一些实施方案中,作为示例,稳定剂选自:按重量/体积计0.1%至5%的牛血清白蛋白(优选0.1%至0.5%)、按重量/体积计1%至10%浓度范围的蔗糖、按重量/体积计0.1%至1%浓度范围的brijl23(优选0.1%至1%;更优选0.1%至0.5%)及其组合。
39.在一些实施方案中,所述促聚剂选自以下的任一项:peg6000、peg8000、peg20000、pvp、葡聚糖或其组合。
40.在一些实施方案中,所述促凝剂选自peg4000、peg6000、peg8000、peg10000、peg20000、葡聚糖t-40、葡聚糖t-70、葡聚糖t-500、pvp及其组合。促凝剂浓度范围是0.1%至10%按重量/体积计;例如0.1%、0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、以及上述任意两个数值之间的范围。
41.在一些实施方案中,所述第一试剂中和第二试剂中的缓冲液独立地选自以下的任一项:磷酸缓冲液、甘氨酸缓冲液、hepes缓冲液、mes缓冲液、硼酸缓冲液、醋酸盐缓冲液、氯化铵缓冲液、或其组合。
42.在一些实施方案中,所述第一试剂中和第二试剂中缓冲液的浓度独立地为10mm至
500mm。在一些实施方案中,缓冲液的浓度包括但不限于10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、250、300、350、400、450、500mm、以及上述任意两个数值之间的范围。
43.在一些实施方案中,所述第一试剂中和第二试剂中缓冲液的ph独立地为6至8,优选7.0至7.5;例如7.2、7.3、7.4、7.5。
44.在一些实施方案中,所述第一试剂中和第二试剂中的缓冲液是相同或不同的。
45.在一些实施方案中,所述纳米微球的浓度为0.025%至0.25%(按重量/体积计)。例如,0.025、0.05、0.1、0.15、0.2、0.25%以及上述任意两个数值之间的范围。在一些具体的实施方案中,rbd包被的聚苯乙烯纳米微球的浓度为按重量/体积计0.125%(两种微球的总计)。
46.在一些实施方案中,所述第一试剂还包含选自以下的任一项或其组合:按质量/体积计1%至10%nacl、按质量/体积计0.05%至0.2%防腐剂。
47.在一些实施方案中,防腐剂选自:叠氮钠、硫柳汞、苯酚、乙基汞硫代硫酸钠及其组合。在一些实施方案中,防腐剂浓度是0.02%至0.1%按重量/体积计;例如0.05%至0.09%。各试剂中的防腐剂类型/浓度可以相同或不同。
48.在一些实施方案中,试剂盒还包含:校准品和/或质控品,所述校准品或质控品包含已知浓度的sars-cov-2抗体。
49.在一些实施方案中,所述校准品中或质控品中的sars-cov-2抗体是单克隆抗体或多克隆抗体,并源自以下的任一项:人、兔、羊、禽、马、牛、猴、骆驼、鼠、重组抗体;sars-cov-2抗体的浓度为选自以下的任一项或其组合:0、15、50、100、150、200、250bau/ml。
50.在一些实施方案中,校准品或质控品包含至少两个浓度的sars-cov-2rbd抗体。
51.在一些具体的实施方案中,第一试剂包含:
52.50mm ph7.0 hepes缓冲液、
53.5%重量/体积计氯化钠、
54.0.45%重量/体积计聚乙烯吡咯烷酮、
55.0.5%重量/体积计bsa、
56.0.5%重量/体积计brijl23、
57.0.09%重量/体积计叠氮钠。
58.在一些具体的实施方案中,第二试剂包含:
59.总计0.125%w/v的第一纳米微球和第二纳米微球、
60.按重量/体积计8%蔗糖、
61.按重量/体积计0.09%叠氮钠、
62.50mm ph 7.5甘氨酸缓冲液。
63.微球的制备方法
64.本公开提供一种包被有sars-cov-2rbd抗原的纳米微球的制备方法,包括步骤:
65.第一步骤,其包括:
66.1.1)对纳米微球进行活化,得到活化的纳米微球;
67.1.2)将第一rbd抗原偶联至所述活化的纳米微球,得到包被有第一rbd抗原的纳米微球;
68.1.3)对步骤1.2)得到的纳米微球进行封闭,得到第一纳米微球;
69.第二步骤,其包括:
70.2.1)对纳米微球进行活化,得到活化的纳米微球;
71.2.2)将第二rbd抗原偶联至所述活化的纳米微球,得到包被有第二rbd抗原的纳米微球;
72.2.3)对步骤2.2)得到的纳米微球进行封闭,得到第二纳米微球;
73.第三步骤:将第一纳米微球和第二纳米微球混合。
74.在一些实施方案中,所述第一步骤和所述第二步骤的顺序是并行的、或者可互换的。
75.在一些实施方案中,所述第一rbd抗原包含选自以下任一sars-cov-2亚型的rbd或其表位:alpha、beta、gamma、delta、delta plus、epsilon、lambda、mu和omicron;所述第二rbd抗原包含选自以下任一sars-cov-2亚型的rbd或其表位:野生型、alpha、beta、gamma、delta、delta plus、epsilon、lambda、mu和omicron;
76.所述第一rbd抗原和所述第二rbd抗原不同。
77.在一些实施方案中,所述第一纳米微球和第二纳米微球按照质量比1:2至2:1,优选1:1进行混合。
78.在一些实施方案中,所述第一纳米微球和第二纳米微球独立地由选自以下的一种或多种聚合而成:聚苯乙烯、丙烯酸、丙烯酸酯;优选地,所述纳米微球是聚苯乙烯胶乳微球。
79.在一些实施方案中,所述第一纳米微球和第二纳米微球的平均粒径独立地为200nm至450nm,优选300nm至350nm。
80.在一些实施方案中,所述第一纳米微球和第二纳米微球是相同或不同的。
81.在一些实施方案中,所述纳米微球是羧基修饰的纳米微球。
82.在一些实施方案中,在缓冲液中提供聚苯乙烯纳米微球。作为一个示例,缓冲液为ph 7至8的hepes缓冲液;浓度为0.02m至0.5m,例如0.05m至0.1m;例如0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.15、0.2、0.25、0.3、0.35m的缓冲液。
83.在一些实施方案中,在缓冲液中提供按重量/体积计0.1%至2.0%的聚苯乙烯纳米微球;例如0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.2%、1.5%、1.8%、2.0%;优选0.5%至1.5%,更优选0.75%至1.25%。
84.在一些实施方案中,分别将sars-cov-2原生型rbd和突变型rbd交联至聚苯乙烯纳米微球上。所述的sars-cov-2rbd在纳米微球缓冲液中浓度为0.05至0.5mg/ml,例如0.05、0.06、0.07、0.08、0.09、0.1、0.12、0.13、0.14、0.15、0.2、0.25、0.30、0.35mg/ml,优选0.05至0.2mg/ml。
85.在一些实施方案中,sars-cov-2rbd和聚苯乙烯纳米微球在28至40℃交联反应1至4小时,优选在37℃反应2至3.5小时。
86.任选地,终止交联反应;优选通过0.1m ph8.4的甘氨酸缓冲液终止交联反应,优选地反应进行4至16小时。
87.任选地,在终止反应步骤之后,冲洗纳米微球。优选地,用50mm ph7.5的甘氨酸缓冲液冲洗纳米微球,获得rbd包被的聚苯乙烯纳米微球。
88.提供一种制备rbd包被的聚苯乙烯纳米微球的方法,包括步骤:
89.1.提供第一微球:
90.1)在0.02m至0.1m ph 6.5至8.0的hepes缓冲液中,提供按重量/体积计0.5%至1.5%的纳米微球;
91.2)使纳米微球和按重量/体积计0.5%至5%碳化二亚胺在28至40℃(优选37℃)接触20至30分钟;
92.3)在步骤2)所得的溶液中加入0.05mg/ml至0.2mg/ml第一rbd;
93.4)在28℃至40℃(优选37℃),第一rbd和纳米微球接触1至4小时,以进行交联;
94.5)任选地,终止交联反应;
95.6)任选地,冲洗交联后所得的颗粒;
96.7)获得第一rbd包被的纳米微球;
97.2.提供第二微球:按相同步骤1)至7)制备第二rbd包被的纳米微球;
98.3.将第一微球与第二微球1:1混合。
99.本公开还提供了通过这种方法获得的包被有sars-cov-2rbd抗原的纳米微球。
100.用途
101.本公开还提供了前述纳米微球在制备检测试剂中的用途。根据本公开的纳米微球用于制备测定sars-cov-2抗体含量的胶乳增强免疫比浊法试剂盒。
102.不限于具体理论,本公开提供了一种优化的交联方法,通过将包被有sars-cov-2一种rbd的纳米微球与包被有sars-cov-2另一种rbd的纳米微球1:1混合,利用突变抗原与原生抗原的互补性,降低了假阴性率,从而使得所制备试剂的灵敏度和特异性得到提高。
103.本技术中所用的序数词“第一”、“第二”等不意图限定特定的顺序或等级,仅用于将不同的特征、步骤、产品、活性成分区分开。
附图说明
104.图1:本公开试剂盒与对照试剂盒的定标吸光度比较。
具体实施方式
105.实施例
106.实施例1.sars-cov-2抗体检测试剂盒的制备
107.1.制备第一试剂,其包含:
108.50mm ph7.0的hepes缓冲液、
109.5%重量/体积计氯化钠、
110.0.45%重量/体积计聚乙烯吡咯烷酮(如k90)、
111.0.5%重量/体积计bsa、
112.0.5%重量/体积计brijl23、
113.0.09%重量/体积计叠氮钠。
114.2.制备第二试剂
115.2.1第一微球
116.直径325nm的聚苯乙烯纳米微球溶液(浓度10%按重量/体积计)0.1ml,加入1.2ml
的0.05m hepes缓冲液(ph8.0),再加入0.18mg/ml的交联剂edac,37℃活化30分钟;
117.将0.12mg sars-cov-2原生型rbd抗原交联至上述聚苯乙烯纳米微球上,在37℃反应2小时,使得抗原浓度为0.16mg/ml;
118.加入0.6ml 0.1m ph8.4的甘氨酸缓冲液终止反应,37℃摇床过夜,离心去掉上清;
119.用6ml 50mm ph7.5的甘氨酸缓冲液洗涤3次;收获包被有sars-cov-2原生型rbd抗原的纳米微球。
120.2.2第二微球
121.用相同的方法收获包被有sars-cov-2omicron突变型rbd抗原的纳米微球。
122.2.3用8ml含有按重量/体积计8%蔗糖、按重量/体积计0.09%叠氮钠的50mm ph7.5的甘氨酸缓冲液,分别将第一微球和第二微球分散成乳白色悬浮液,等体积混合后制备成第二试剂。第二试剂中第一微球和第二微球的总浓度为按重量/体积计0.125%。
123.3.制备校准品
124.将sars-cov-2原生型rbd抗体与omicron突变型抗体按1:1混合后加入基质(如市售正常人血清)中,浓度分别为0、15、50、100、150、250bau/ml(结合抗体单位bau),搅拌均匀,制备成多点校准品。
125.实施例2.对照制备方法1
126.1.制备第一试剂
127.第一试剂的制备方法与实施例1相同。
128.2.制备第二试剂
129.与实施例1相比,区别仅在于只包被了原生型rbd抗原。
130.3.制备校准品
131.校准品的制备与实施例1相同。
132.实施例3.对照制备方法2
133.1.制备第一试剂
134.第一试剂的制备方法与实施例1相同。
135.2.制备第二试剂
136.与实施例1相比,区别仅在于只包被了突变型rbd抗原。
137.3.制备校准品
138.校准品的制备与实施例1相同。
139.实施例4.对照制备方法3
140.1.制备第一试剂
141.第一试剂的制备方法与实施例1相同。
142.2.制备第二试剂
143.直径325nm的聚苯乙烯纳米微球溶液(浓度10%按重量/体积计)0.1ml,加入1.2ml的0.05m hepes缓冲液(ph8.0),再加入0.18mg/ml的交联剂edac,37℃活化30分钟;
144.将0.06mg sars-cov-2原生型rbd抗原与0.06mg sars-cov-2omicron突变型rbd抗原混合,获取混合抗原;在37℃反应2小时把混合抗原交联至上述聚苯乙烯纳米微球;
145.加入0.6ml 0.1m ph8.4的甘氨酸缓冲液终止反应,37℃摇床过夜,离心去掉上清;
146.用6ml 50mm ph7.5的甘氨酸缓冲液洗涤3次;收获包被有sars-cov-2rbd混合抗原
的纳米微球;
147.用8ml含有按重量/体积计8%蔗糖、按重量/体积计0.09%叠氮钠的50mm ph7.5的甘氨酸缓冲液,将包被有抗原的纳米微球分散成乳白色悬浮液,制备成第二试剂;
148.最终第二试剂中纳米微球的浓度为按重量/体积计0.125%。
149.3.制备校准品
150.校准品的制备与实施例1相同。
151.测试例1.sars-cov-2抗体检测试剂盒的测定步骤
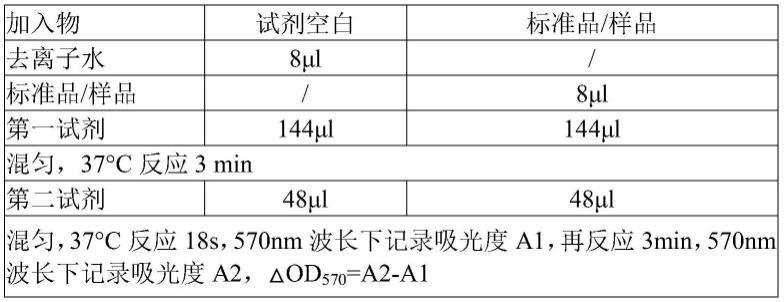
152.以au5800生化分析仪为例:测定波长570nm,首先加入第一试剂144μl,37℃反应18秒后加入校准品8μl,再反应180秒后加入第二试剂48μl,测定反应第18秒、180秒的吸光度值(a1、a2),计算吸光度差值
△
a=a2-a1(表1)。每管重复测定2次,将各校准品管2次测得的吸光度差值
△
a为纵坐标,对应的浓度为横坐标,制作“浓度-吸光度差值”校准曲线,取待测样本。同法测定样本的吸光度差值,代入校准曲线,见图1即可计算出待测样本中sars-cov-2抗体的含量。
153.表1
[0154][0155]
测试例2.本公开试剂盒与对照试剂盒的灵敏度与特异度比较
[0156]
用本公开的试剂盒与对照试剂盒分别对某医院38例sars-cov-2抗体阳性样本,12例sars-cov-2抗体阴性样本进行检测。
[0157]
50例样本有:疫苗接种者、sars-cov-2感染者。检测结果见表2至表3。由下表结果可知,本公开试剂盒的灵敏度与特异度均高于对照制备方法试剂盒。对照方法制备的试剂盒存在较高的假阳性和假阴性率。
[0158]
表2.本公开试剂盒与对照试剂盒测临床样本结果
[0159][0160]
表3.本公开试剂盒与对照试剂盒的灵敏度与特异度比较
[0161]
项目本公开试剂盒对照制备方法1对照制备方法2对照制备方法3灵敏度97.4%84.2%60.5%92.1%特异度100.0%75.0%66.7%91.7%
[0162]
测试例3.本公开试剂盒与对照试剂盒的定标吸光度比较
[0163]
用本公开的试剂盒与对照试剂盒同时定标检测吸光度。从下面数据可以看出,本公开试剂盒定标吸光度高于对照试剂盒1至3。
[0164]
表4.本公开试剂盒与对照试剂盒的定标吸光度比较
[0165][0166]
测试例4.本公开试剂盒对照试剂盒的重复性比较
[0167]
用本公开的试剂盒与对照试剂盒同时检测血清样本重复性。样本重复性变异系数小于5%作为合格的标准。
[0168]
从下面数据可以看出,本公开试剂盒变异系数为3.6%,小于对照试剂盒1变异系数8.40%,小于对照试剂盒2变异系数18.8%,小于对照试剂盒3变异系数13.3%。
[0169]
表5.本公开试剂盒与对照试剂盒的重复性比较
[0170][0171]
[0172]
对比例1
[0173]
参照实施例1至4的方法制备试剂盒,区别仅在于将原生和/或omicron突变型的rbd抗原替换成其他突变型的对应抗原(第一微球和第二微球的亚型不同即可),并采用测试例1至4的方法进行测试比对。所得的结果相似,将第一微球和第二微球混合的制备策略,在改善假阴/阳性、改善重复性方面,均优于其他制备策略(“单一抗原”策略、以及“先抗原混合-后包被”的策略)(数据未显示)。
[0174]
对比例2
[0175]
对于试剂盒的灵敏度与重复性:pvp最优,peg次之(peg8000》peg6000》peg20000)(数据未显示)。
[0176]
对比例3
[0177]
参照实施例1的制备方法,比较在胶乳微球上包被不同浓度(0.05mg/ml、0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml;该浓度是指加入封闭液前,在胶乳缓冲液中的浓度)的sars-cov-2rbd抗原对第二试剂的影响。
[0178]
胶乳缓冲液中sars-cov-2rbd抗原浓度为0.1mg/ml至0.2mg/ml时,制得的试剂盒热稳定性最佳(数据未显示)。
[0179]
对比例4
[0180]
发明人参照实施例1的制备方法,比较了不同浓度(1%、5%、8%、10%)的蔗糖、海藻糖、甘露醇、葡萄糖对第二试剂的影响。
[0181]
蔗糖和海藻糖观察到粘度保护效果优于等浓度的甘露醇和葡萄糖(数据未显示)。不限于具体理论,可能解释为蔗糖和海藻糖具有更高的玻璃化转变温度。
[0182]
理论上,海藻糖的玻璃化转变温度高于蔗糖,理应提供更好的稳定效果。但是,出乎意料地注意到,在8%的特定浓度、以及联合50mm ph7.5甘氨酸缓冲液条件时,蔗糖比海藻糖更兼顾了第二试剂的稳定性(随时间的吸光度变化)和试剂盒的批间、批内重复性(数据未显示)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1