一种基于LC-MS/MS法检测25-羟基胆固醇的方法、试剂盒及其应用与流程
一种基于lc-ms/ms法检测25-羟基胆固醇的方法、试剂盒及其应用
技术领域
1.本发明属于分析化学技术领域,具体涉及一种基于lc-ms/ms法检测25-羟基胆固醇的方法、试剂盒及其应用。
背景技术:
2.含羟基的胆固醇及其代谢物是一类含有游离羟基且浓度较低的生物有机分子,存在于如血浆、脑脊液、肝组织、尿液和粪便等生物样品中。含羟基的胆固醇及其代谢物在大量生物体中都扮演着细胞膜的信号传导、调节和新陈代谢的重要角色。25-羟基胆固醇是含羟基的胆固醇中的一种有机分子,其分子结构如式ⅰ所示,近期研究表明,25-羟基胆固醇的浓度水平与包括阿尔茨海默病的神经退行性疾病有紧密关系,可以作为一些神经退行性疾病的标志物。
[0003][0004]
现有技术中,主要采用高效液相色谱法(hplc)检测25-羟基胆固醇,很少采用液质联用技术检测血浆中的25-羟基胆固醇,但hplc分析时间长、灵敏度较低,因此,迫切需要建立一种灵敏度高、分析时间短的液相色谱质谱联用(lc-ms/ms)方法以检测血浆中的25-羟基胆固醇。
技术实现要素:
[0005]
针对现有技术中存在的上述不足,本发明的目的在于提供一种基于lc-ms/ms法检测25-羟基胆固醇的方法、试剂盒及其应用,该检测方法灵敏度高、分析时间短,可应用于血浆中25-羟基胆固醇的定性或定量检测。
[0006]
为实现上述发明目的,本发明采用的技术方案如下:
[0007]
第一方面,本发明提供了一种基于lc-ms/ms法检测25-羟基胆固醇的方法,所述方法包括:对待测生物样本进行预处理;对经过预处理的所述待测生物样本进行lc-ms/ms检测,得到所述待测生物样本的图谱,利用同位素内标法,以25-羟基胆固醇-d6为内标物,采用25-羟基胆固醇标准品制作标准曲线定量,计算所述待测生物样本中的25-羟基胆固醇的浓度;液相色谱条件包括:采用梯度洗脱,色谱柱为长度不大于50mm的ec-c18色谱柱,流动相包括流动相a和流动相b,流动相a为含甲酸的水溶液,流动相b为含甲酸的乙腈。
[0008]
本发明提供的检测25-羟基胆固醇的方法分析时间短,灵敏度高,可应用于血浆中25-羟基胆固醇的定性或定量检测,为研究25-羟基胆固醇与神经退行性疾病的相关程度奠
定了技术基础。
[0009]
第二方面,本发明提供了一种应用第一方面所述的方法检测25-羟基胆固醇的试剂盒,所述试剂盒包括:25-羟基胆固醇标准品,内标物25-羟基胆固醇-d6标准品,甲醇,含0.1%甲酸的甲醇,乙腈,含0.4%甲酸的水溶液和仪器分析液,其中,所述仪器分析液包括:流动相a:含0.2%甲酸的水溶液,流动相b:含0.2%甲酸的乙腈。
[0010]
本发明提供的试剂盒通过向流动相中加入甲酸,使得25-羟基胆固醇的质谱响应增强。
[0011]
第三方面,本发明提供了一种根据第一方面所述的方法在研究25-羟基胆固醇与神经退行性疾病的相关程度中的应用。
[0012]
第四方面,本发明提供了一种根据第一方面所述的方法在药代动力学研究中的应用。
附图说明
[0013]
图1为25-羟基胆固醇的二级质谱图;
[0014]
图2为25-羟基胆固醇-d6的二级质谱图;
[0015]
图3为本发明实施例1提供的基于lc-ms/ms法检测人血浆中25-羟基胆固醇的特征性色谱图;
[0016]
图4为本发明实施例1提供的基于lc-ms/ms法检测人血浆中25-羟基胆固醇-d6的特征性色谱图;
[0017]
图5为本发明实施例2提供的基于lc-ms/ms法检测大鼠血浆中25-羟基胆固醇的线性代表图;
[0018]
图6为本发明实施例2提供的基于lc-ms/ms法检测双空白血浆样本中25-羟基胆固醇的代表色谱图;
[0019]
图7为本发明实施例2提供的基于lc-ms/ms法检测双空白血浆样本中25-羟基胆固醇-d6的代表色谱图;
[0020]
图8为本发明实施例2提供的基于lc-ms/ms法检测lloq样本中25-羟基胆固醇的代表色谱图;
[0021]
图9为本发明实施例2提供的基于lc-ms/ms法检测lloq样本中25-羟基胆固醇-d6的代表色谱图;
[0022]
图10为本发明对比例1提供的25-羟基胆固醇的一级质谱图;
[0023]
图11为本发明对比例1提供的25-羟基胆固醇的另一种一级质谱图;
[0024]
图12为本发明对比例2提供的基于lc-ms/ms法检测std5标准曲线样本中25-羟基胆固醇的色谱图;
[0025]
图13为本发明对比例3提供的基于lc-ms/ms法检测1.00μg/ml的工作液中25-羟基胆固醇的色谱图。
具体实施方式
[0026]
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释
本发明,并不用于限定本发明。
[0027]
除另有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的实验试剂,如无特殊说明,均为常规生化试剂,均可以通过市场上购买或者按照本领域常规方法合成制备;所述实验试剂用量,如无特殊说明,均为常规实验操作中试剂用量;所述实验方法,如无特殊说明,均为常规方法。
[0028]
第一方面,本发明实施例提供了一种基于lc-ms/ms法检测25-羟基胆固醇的方法,所述方法包括:对待测生物样本进行预处理;对经过预处理的所述待测生物样本进行lc-ms/ms检测,得到所述待测生物样本的图谱,利用同位素内标法,以25-羟基胆固醇-d6为内标物,采用25-羟基胆固醇标准品制作标准曲线定量,计算所述待测生物样本中的25-羟基胆固醇的浓度;液相色谱条件包括:采用梯度洗脱,色谱柱为长度不大于50mm的ec-c18色谱柱,流动相包括流动相a和流动相b,流动相a为含甲酸的水溶液,流动相b为含甲酸的乙腈。
[0029]
25-羟基胆固醇-d6的分子结构如式ⅱ所示:
[0030][0031]
内标的选择对于检测的灵敏度和特异性至关重要,本发明实施例利用同位素内标法测定25-羟基胆固醇,与使用其它的内标相比,可以降低基质效应对其检测的干扰,使得25-羟基胆固醇的定量更加准确。
[0032]
如果将流动相中的乙腈替换为甲醇,会导致柱压很高,缩短色谱柱的寿命。
[0033]
本发明实施例提供的检测25-羟基胆固醇的方法,采用液相色谱-质谱联用法进行检测,既结合了液相色谱仪有效分离不同化合物的分离能力,又结合质谱仪很强的组分鉴别能力,能够有效分离和鉴别待测生物样本中25-羟基胆固醇,血样用量少,分析时间短,灵敏度高;通过采用长度不大于50mm的ec-c18色谱柱,使得25-羟基胆固醇的色谱峰峰形较好,不会出现拖尾和分叉,25-羟基胆固醇的色谱峰和干扰峰可以有效地分离;通过采用含甲酸的溶液作为流动相,可以使得25-羟基胆固醇的质谱响应增强。该检测方法可应用于血浆中25-羟基胆固醇的定性或定量检测,为研究25-羟基胆固醇与神经退行性疾病的相关程度奠定了技术基础。
[0034]
进一步地,所述采用25-羟基胆固醇标准品制作标准曲线定量,包括:以所述25-羟基胆固醇的浓度为横坐标,所述25-羟基胆固醇与内标物的峰面积的比值为纵坐标,以1/x2为权重系数,利用加权最小二乘法进行线性回归,建立标准曲线回归方程;将所述待测生物样本中25-羟基胆固醇和内标物的峰面积的比值代入所述标准曲线回归方程,计算所述待测生物样本中25-羟基胆固醇的浓度。
[0035]
进一步地,所述生物样本包括血液、唾液、尿液、胆汁、脏器、粪便中的至少一种。
[0036]
进一步地,所述血液为全血、血浆或血清,优选为血浆,血浆为人或动物的血浆。
[0037]
进一步地,所述对待测生物样本进行预处理,包括:将待测生物样本与乙腈混合
后,加入内标物工作液,离心,取离心后的上层澄清液体作为待测液,向所述待测液中加入含甲酸的水溶液,混匀后进样。现有技术中多采用步骤繁琐的固相萃取和液液萃取对待测生物样本进行处理,本发明实施例采用乙腈蛋白沉淀法对待测生物样本进行预处理,前处理过程较简单,便于操作,安全且样本用量少,整个实验成本低。如果将乙腈替换为甲醇,离心后的上层液体会有絮状物,无法得到符合规定的澄清液体。
[0038]
进一步地,所述内标物工作液的制备方法包括:将内标物25-羟基胆固醇-d6使用甲醇溶解配制成内标物储备液,然后使用含甲酸的甲醇稀释即得。与使用不含甲酸的甲醇稀释相比,本发明实施例通过使用含甲酸的甲醇稀释,可以增强25-羟基胆固醇-d6的质谱响应。
[0039]
进一步地,所述液相色谱条件还包括:洗针溶液为体积分数为90%的乙腈的水溶液(乙腈和水的体积比为90:10),进样量为1~10μl,色谱柱为poroshell 120ec-c18,2.1
×
50mm,1.9μm或等效色谱柱,柱温为25℃~40℃,流动相流速为0.2~1ml/min。例如,进样量可以为1μl、3μl、5μl、7μl或10μl等,柱温可以为25℃、30℃、35℃或40℃等,流动相流速可以为0.2ml/min、0.4ml/min、0.6ml/min、0.8ml/min或1ml/min等。
[0040]
进一步地,所述梯度洗脱具体为:0~1min,所述流动相a与所述流动相b的体积比为30:70;1~2.5min,所述流动相a与所述流动相b的体积比由30:70匀速变化至5:95;2.5~2.6min,所述流动相a与所述流动相b的体积比由5:95匀速变化至0:100;2.6~3.9min,所述流动相a与所述流动相b的体积比为0:100;3.9~4.0min,所述流动相a与所述流动相b的体积比为由0:100匀速变化至30:70;4.0~6.5min,所述流动相a与所述流动相b的体积比为30:70。申请人发现,当流动相b的体积分数低于95%时,待测物25-羟基胆固醇在色谱图上不出峰;当采用流动相b的体积分数不低于95%时的高有机相等度洗脱时,待测物25-羟基胆固醇的分离效果较差,因此流动相必须采用梯度洗脱的方式。根据本实施例提供的梯度洗脱方式,可以降低采用蛋白沉淀法对待测生物样本进行预处理产生的基质干扰效应,使得乙腈蛋白沉淀法用于25-羟基胆固醇的检测成为了可能。相比固相萃取和液液萃取法的成本高、灵敏度低、分析时间长,乙腈蛋白沉淀法操作简单、成本低,更适合样品量大的样本分析。本发明实施例提供的lc-ms/ms方法灵敏度高、25-羟基胆固醇在5.00~2000ng/ml和20.0~6000ng/ml范围内线性良好、精密度和准确度良好、提取回收率高和基质效应小。
[0041]
进一步地,所述流动相a中甲酸的浓度为0.2%,所述流动相b中甲酸的浓度为0.2%,所述含甲酸的水溶液中甲酸的浓度为0.4%。这里,浓度指体积分数。本发明实施例通过含甲酸的水溶液中甲酸的浓度与流动相(包括流动相a和流动相b)中甲酸的浓度相同,可以降低进样后ph改变对流动相的影响,使得待测物的保留时间更稳定。
[0042]
进一步地,质谱条件包括:离子源:电喷雾esi,扫描方式:多反应监测,离子化方式:正离子;所述离子源的参数设置如下:碰撞气cad:3~6psi,气帘气cur:30~50psi,离子源gas1:50~80psi,离子源gas2:50~80psi,离子喷雾电压is:5000~6000v,离子源温度tem:500~700℃;所述25-羟基胆固醇的参数设置如下:前体离子q1 mass:385.4da,产物离子q3 mass:367.6da,dwell time:200ms,去簇电压dp:50~70v,入口电压ep:5~15v,碰撞能量ce:10~15v,碰撞出口电压cxp:30~40v;所述25-羟基胆固醇-d6的参数设置如下:前体离子q1 mass:391.3da,产物离子q3 mass:373.3da,dwell time:200ms,去簇电压dp:70~90v,入口电压ep:5~15v,碰撞能量ce:10~15v,碰撞出口电压cxp:30~40v。优选为,离
子源参数设置如下:碰撞气cad:4psi,气帘气cur:40psi,离子源gas1:70psi,离子源gas2:70psi,离子喷雾电压is:5500v,离子源温度tem:600℃;25-羟基胆固醇的参数设置如下:前体离子q1 mass:385.4da,产物离子q3 mass:367.6da,dwell time:200ms,去簇电压dp:60v,入口电压ep:10v,碰撞能量ce:13v,碰撞出口电压cxp:35v;内标物25-羟基胆固醇-d6的参数设置如下:前体离子q1 mass:391.3da,产物离子q3 mass:373.3da,dwell time:200ms,去簇电压dp:80v,入口电压ep:10v,碰撞能量ce:13v,碰撞出口电压cxp:35v。
[0043]
进一步地,所述方法还包括:采用定量下限、低、中和高四个水平的质控样本进行质控,即对本发明提供的检测方法进行方法学验证,其中,所述质控样本的定量下限、低、中和高四个水平中25-羟基胆固醇的浓度分别为20ng/ml(定量下限)、60ng/ml(低质控浓度)、400ng/ml(中质控浓度)、3000ng/ml(中质控浓度)和4500ng/ml(高质控浓度)。
[0044]
进一步地,所述方法还包括:配制标准曲线样本,并对所述标准曲线样本进行预处理;所述配制标准曲线样本包括:称取25-羟基胆固醇标准品,经甲醇溶解配制成标准曲线储备液,将标准曲线储备液用含甲酸的甲醇稀释,配制成标准系列的标准曲线工作液,取所述标准系列的标准曲线工作液,分别稀释到空白生物样本中,配制成系列浓度的标准曲线样本;所述对所述标准曲线样本进行预处理,包括:向所述标准曲线样本中加入内标物工作溶液和乙腈,离心后取上清液,然后使用含甲酸的水溶液稀释并进样到lc-ms/ms系统检测。
[0045]
本发明实施例通过使用含甲酸的水溶液稀释,可以增强25-羟基胆固醇的质谱响应。
[0046]
第二方面,本发明实施例提供了一种应用第一方面所述的方法检测25-羟基胆固醇的试剂盒,所述试剂盒包括:25-羟基胆固醇标准品,内标物25-羟基胆固醇-d6标准品,甲醇,含0.1%甲酸的甲醇,乙腈,含0.4%甲酸的水溶液和仪器分析液,其中,所述仪器分析液包括:流动相a:含0.2%甲酸的水溶液,流动相b:含0.2%甲酸的乙腈。
[0047]
所述甲醇用于制备标准曲线储备液和内标储备液;所述含0.1%甲酸的甲醇用于对标准曲线储备液和内标储备液进行稀释,以制备标准曲线工作液和内标物工作液;所述乙腈为蛋白沉淀剂;所述含0.4%甲酸的水溶液用于样本预处理过程中的稀释剂。
[0048]
本发明实施例提供的试剂盒的使用方法可以参照第一方面所述的基于lc-ms/ms法检测25-羟基胆固醇的方法。
[0049]
本发明提供的试剂盒通过向流动相中加入甲酸,使得25-羟基胆固醇的质谱响应增强。
[0050]
进一步地,所述试剂盒还包括:肝素钠和空白生物样本。
[0051]
第三方面,本发明实施例提供了一种根据第一方面所述的基于lc-ms/ms法检测25-羟基胆固醇的方法在研究25-羟基胆固醇与神经退行性疾病的相关程度中的应用。
[0052]
进一步地,该神经退行性疾病包括阿尔茨海默病。
[0053]
第四方面,本发明提供了一种根据第一方面所述的基于lc-ms/ms法检测25-羟基胆固醇的方法在药代动力学研究中的应用。
[0054]
进一步地,所述应用包括:基于检测血浆中25-羟基胆固醇的方法对口服给药的人体药代动力学进行研究。
[0055]
现有技术表明,25-羟基胆固醇通过与细胞蛋白相互作用阻碍病毒复制,表现出广泛的抗病毒活性,目前有报道称25-羟基胆固醇是一种潜在的新冠病毒抑制剂。因此,将第
一方面所述的基于lc-ms/ms法检测25-羟基胆固醇的方法应用到对口服给药的人体药代动力学研究中,具有重要的意义。
[0056]
本发明先后进行过多次试验,现举一部分试验结果作为参考,对发明进行
[0057]
进一步详细描述,下面结合具体实施例进行详细说明。
[0058]
试验材料与方法:
[0059]
1.主要仪器
[0060]
高效液相色谱仪:型号为lc-20adxr,生产厂家为日本岛津制作所;api4000三重四极杆质谱仪,配备电喷雾离子源(esi(+)):型号为api4000,生产厂家为美国sciex公司;分析软件:analyst(version1.6.3)数据处理系统。
[0061]
2.色谱条件
[0062]
进样量:5.00μl,自动进样器温度:4℃,柱温:25℃,色谱柱:poroshell 120ec-c18,2.1
×
50mm,1.9μm,洗针溶液:乙腈-水溶液(90:10,v/v),流动相a:水溶液(含0.2%甲酸),流动相b:乙腈(含0.2%甲酸),流速:0.500ml/min,检测时间:6.50min,洗脱方式:梯度洗脱,梯度洗脱具体为:0~1min,所述流动相a与所述流动相b的体积比为30:70;1~2.5min,所述流动相a与所述流动相b的体积比由30:70匀速变化至5:95;2.5~2.6min,所述流动相a与所述流动相b的体积比由5:95匀速变化至0:100;2.6~3.9min,所述流动相a与所述流动相b的体积比为0:100;3.9~4.0min,所述流动相a与所述流动相b的体积比为由0:100匀速变化至30:70;4.0~6.5min,所述流动相a与所述流动相b的体积比为30:70。
[0063]
3.质谱条件
[0064]
串联三重四极杆质谱配置esi源,采用多反应监测(mrm)方式进行正离子检测,扫描时间为200ms。为降低对质谱系统的污染,1.5min前和3.5min后从色谱柱中流出的洗脱液不进质谱仪,质谱的采集时间段为1.5~3.5min,用于定性分析的离子对分别为m/z385.4
→
367.6(25-羟基胆固醇)、m/z 391.3
→
373.3(25-羟基胆固醇-d6)。
[0065]
离子源参数:碰撞气cad:4psi,气帘气cur(n2):40psi,离子源gas1(n2):70psi,离子源gas2(n2):70psi,离子喷雾电压is:5500v,离子源温度tem:600℃。
[0066]
25-羟基胆固醇的参数设置如下:前体离子q1 mass:385.4da,产物离子q3 mass:367.6da,dwell time:200ms,去簇电压dp:60v,入口电压ep:10v,碰撞能量ce:13v,碰撞出口电压cxp:35v。
[0067]
内标物25-羟基胆固醇-d6的参数设置如下:前体离子q1 mass:391.3da,产物离子q3mass:373.3da,dwell time:200ms,去簇电压dp:80v,入口电压ep:10v,碰撞能量ce:13v,碰撞出口电压cxp:35v。25-羟基胆固醇的二级质谱图如图1所示,25-羟基胆固醇-d6的二级质谱图如图2所示。
[0068]
4.试剂配制
[0069]
流动相a(含0.2%甲酸的水溶液):量取超纯水1000ml,加入甲酸2.00ml,摇匀。
[0070]
流动相b(含0.2%甲酸的乙腈):量取乙腈1000ml,加入甲酸2.00ml,摇匀。
[0071]
稀释剂1(含0.1%甲酸的甲醇):量取甲醇400ml,加入甲酸400μl,摇匀。
[0072]
稀释剂2(含0.4%甲酸的水溶液):量取水400ml,加入甲酸1.60ml,摇匀。
[0073]
由全血制备血浆过程中所用抗凝剂为肝素钠。
[0074]
5.标准曲线工作液的配制
[0075]
精密称取适量25-羟基胆固醇标准品置于棕色玻璃瓶中,加适量甲醇溶解,得浓度为1.00mg/ml储备液stockx;取储备液stockx适量,按表1配制标准曲线工作液wx1_x2,x1=s1~s8,配制好的标准曲线工作液于2~8℃冰箱中储存。
[0076]
表1
[0077][0078]
6.质控工作液的配制
[0079]
取储备液stockx适量,按表2配制质控工作液wx1_x2,x1=lloq qc、lqc、gmqc、mqc、hqc,配制好的质控工作液于2~8℃冰箱中储存。
[0080]
表2
[0081][0082][0083]
7.内标物工作液的配制
[0084]
精密称取适量内标物25-羟基胆固醇-d6标准品(质量校正)置于棕色玻璃瓶中,加适量甲醇溶解,得浓度为1.00mg/ml内标物储备液stockisx,取适量内标物储备液stockisx,按表3配制,先配制内标物中间工作液prestockisx_1,再取内标物中间工作液适量,配制浓度为200ng/ml的内标物工作液wis_x,内标物工作液储存于2~8℃冰箱中。
[0085]
表3
[0086][0087]
8.标准曲线样本的配制
[0088]
分别移取10.0μl的25-羟基胆固醇标准曲线工作液,加入190μl的空白血浆,涡旋混合,混匀,具体配制方法如表4所示,基质为空白血浆。
[0089]
表4
[0090][0091]
9.质控样本的配制:
[0092]
质控样本包含lloq qc、lqc、gmqc、mqc、hqc 5个浓度水平,浓度分别为lloq qc:20.0ng/ml,lqc:60.0ng/ml,gmqc:400ng/ml,mqc:3000ng/ml,hqc:4500ng/ml。按表5配制质控样本,基质为空白血浆。
[0093]
表5
[0094][0095]
10.血浆的制备:
[0096]
取全血样品加入到含有肝素钠抗凝剂的采血管,4℃、8000rpm/min离心10min得到血浆。
[0097]
11.血浆样本预处理方法
[0098]
取50.0μl待测血浆样本于96孔提取板中,加入50.0μl的200ng/ml内标物工作液和400μl乙腈,涡旋振荡5min;将上述样本置于离心机中,4℃、3040
×
g条件下离心10min;取上清200μl,加入200μl的稀释剂2,涡旋振荡5min;进样5.00μl以进行lc-ms/ms分析。
[0099]
实施例1
[0100]
s1、参照“试验材料与方法”第11项血浆样本预处理方法,对待测人血浆样本进行预处理;
[0101]
s2、参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对待测人血浆样本中的25-羟基胆固醇进行检测,得到待测人血浆样本的特征性色谱图,如图3和图4所示;
[0102]
s3、标准曲线工作液的配制:精密称取适量25-羟基胆固醇标准品置于棕色玻璃瓶中,加适量甲醇溶解,得浓度为1.00mg/ml储备液,称取适量储备液并用稀释剂1稀释,得到浓度分别为0.1、0.2、0.5、2、8、24、36、40μg/ml的标准曲线工作液。
[0103]
s4、标准曲线样本的配制:取空白人血浆190μl,加入系列标准曲线工作液10μl,配制成浓度为5.00、10.0、25.0、100、400、1200、1800和2000ng/ml的标准曲线样本。
[0104]
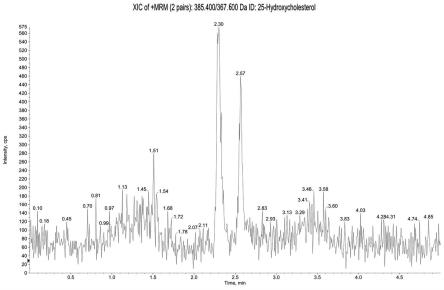
s5、参照“试验材料与方法”第11项血浆样本预处理方法,将待测血浆样本替换为标准曲线样本,对每一浓度的标准曲线样本进行预处理。
[0105]
s6、参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对每一浓度的标准曲线样本中的25-羟基胆固醇进行检测,记录色谱图。以25-羟基胆固醇浓度为横坐标,25-羟基胆固醇与内标物的峰面积比值为纵坐标,用加权(w=1/x2)最小二乘法进行回归分析,考察浓度范围为5.00~2000ng/ml的标准曲线,得到人血浆样品标准曲线方程为y=0.0233x+0.0291(r=0.9991),25-羟基胆固醇浓度在5.00~2000ng/ml范围内线性良好,相关系数大于0.99。
[0106]
s7、将待测人血浆样本中25-羟基胆固醇与内标物的峰面积比值代入人血浆样品标准曲线方程中,得到待测人血浆样本中25-羟基胆固醇的浓度。
[0107]
实施例2方法学验证
[0108]
本发明实施例从分析方法的系统适用性、线性范围和定量下限、系统残留、选择性、基质效应、精密度和准确度、提取回收率和稀释可靠性等方面对建立的25-羟基胆固醇的检测方法进行了充分的验证。
[0109]
本发明实施例所用空白血浆为sd大鼠空白血浆,即基质为sd大鼠空白血浆,待测物为25-羟基胆固醇,内标物为25-羟基胆固醇-d6。
[0110]
2.1系统适用性
[0111]
取25-羟基胆固醇的浓度为60.0ng/ml的lqc质控样本,参照“试验材料与方法”第11项对lqc质控样本进行预处理,参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对lqc质控样本进行检测,重复进样3次;
[0112]
分别记录待测物与内标物的色谱峰面积值及保留时间,并计算待测物与内标物的色谱峰面积比值及色谱峰保留时间的变异系数,结果见表6。
[0113]
表6
[0114][0115]
接受标准为3次重复分析所得待测物与内标物色谱峰面积比值的变异系数应小于10%,3次重复分析所得待测物与内标物色谱峰保留时间的变异系数应小于10%。待测物保留时间变异系数为0.25%~0.5%、内标物保留时间变异系数为0.26%~0.68%、面积比的变异系数为0.90%~5.16%,说明本发明方法对检测肝素钠血浆中25-羟基胆固醇适用。
[0116]
2.2线性范围和定量下限
[0117]
参照“试验材料与方法”第8项配制标准曲线样本,标准曲线样本浓度分别为20.0、40.0、120、360、1080、3600、5400、6000ng/ml,定量范围:20.0~6000ng/ml,定量下限(lloq)为:20.0ng/ml,定量上限(uloq)为:6000ng/ml。参照“试验材料与方法”第11项对标准曲线系列样本进行预处理,参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对标准曲线系列样本进行检测,考察至少2天3个分析批的标准曲线。
[0118]
由标准曲线样本待测物和内标物峰面积的比值作为纵坐标(y),待测物浓度作为横坐标(x),采用加权最小二乘法(权重1/x2),计算各回归方程,得到方程y=ax+b,结果见表7,线性代表图如图5所示。
[0119]
表7
[0120][0121]
由表7可知,在线性范围内线性关系良好。
[0122]
利用标准曲线方程,计算标准曲线系列样本中待测物的浓度,第1批次对应的标准曲线方程为y=0.00575x+0.0277,第2批次对应的标准曲线方程为y=0.0062x+0.0167,第3批次对应的标准曲线方程为y=0.00641x+0.0278,标准曲线的回算浓度结果见表8和表9。
[0123]
表8
第2项色谱条件和第3项质谱条件,对双空白血浆样本进行检测。
[0132]
分别记录双空白血浆样本中待测物和内标物的峰面积以及标准曲线定量下限样本中待测物和内标物的峰面积,残留%=标准曲线定量上限样本后双空白样本中待测物或内标的平均峰面积/该分析批标准曲线有效定量下限样本待测物或内标平均峰面积,结果见表10。
[0133]
表10
[0134][0135]
注:lloq面积为两套标准曲线系列样本中定量下限待测物和内标物的平均峰面积。
[0136]
残留考察的空白样本无明显色谱峰或峰面积不大于相应批次标准曲线lloq样本平均峰面积的20%,且不大于相应内标峰面积均值的5%。待测物残留为6.41~16.18%,内标物残留为0.26~0.62%,说明残留符合接受标准。
[0137]
2.4选择性
[0138]
选择性是指色谱方法测定分析物时,区分生物基质中干扰的能力。方法验证之前,需要至少筛选6个不同批次的空白基质用于方法验证。
[0139]
2.4.1空白基质的选择性
[0140]
考察6个不同来源的空白血浆。每一来源空白血浆配制一份lloq样本。
[0141]
空白血浆干扰=双空白血浆样本(不含待测物和内标物的空白血浆)中待测物或内标物的峰面积/该相应有效定量下限样本待测物或内标峰面积
×
100%。
[0142]
取6个不同来源的大鼠空白血浆,作为双空白血浆样本,参照“2.3系统残留”对双空白血浆样本进行预处理,参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对双空白血浆样本进行检测,双空白血浆样本代表色谱图如图6和图7所示。
[0143]
分别用6个不同来源的大鼠空白血浆,配制25-羟基胆固醇的浓度为20.0ng/ml的lloq样本,参照“试验材料与方法”第11项对lloq样本进行预处理,参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对lloq样本进行检测,lloq样本代表色谱图如图8和图9所示,分别记录各双空白血浆样本和lloq样本的检测结果,结果见表11。
[0144]
表11
[0145]
[0146][0147]
接受标准为至少6份不同来源空白基质样本中的待测物保留时间处色谱峰峰面积低于相对应的不同来源空白基质lloq浓度待测物峰面积的20.0%,且内标物保留时间处内标物峰面积低于相对应的不同来源空白基质lloq浓度内标物峰面积的5.0%。本发明方法针对不同来源空白基质样本中的对待测物的干扰范围为0.69%~7.51%,内标物干扰响应值为0.43%~3.98%。可见,不同的空白血浆对25-羟基胆固醇的检测结果没有造成干扰,该方法可以用于检测不同来源的肝素钠血浆中25-羟基胆固醇,血浆的来源不同对本发明检测方法无影响。
[0148]
由图6~图9可知,待测物和内标物的分离度良好,在相应的保留时间范围内,空白血浆中未存在明显的干扰。
[0149]
2.4.2内标物对待测物测定的干扰
[0150]
取6个不同来源的大鼠空白血浆,分别加入内标工作液,得到6个单空白样本。每一来源空白血浆配制一份lloq样本。
[0151]
取大鼠空白血浆,参照“试验材料与方法”第11项对大鼠空白血浆进行预处理,得到单空白样本,参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对单空白样本进行检测;
[0152]
参照本实施例2.4.1对lloq样本进行检测,分别记录各单空白样本和lloq样本的检测结果,结果见表12。
[0153]
表12
[0154][0155]
接受标准为至少6个样本无明显干扰峰或干扰组分的峰面积不超过相应lloq样本峰面积的20%。本发明方法针对不同来源基质单空白样本中的待测物的干扰范围为7.76%~15.16%。可见,内标物对25-羟基胆固醇的检测结果没有造成干扰。
[0156]
2.4.3待测物对内标物测定的干扰
[0157]
取6个不同来源的大鼠空白血浆,参照“试验材料与方法”第8项配制6份浓度为6000ng/ml的uloq样本和6份浓度为20.0ng/ml的lloq样本。
[0158]
取50.0μl的uloq样本于96孔提取板中,加入50.0μl稀释剂1和400μl乙腈,涡旋振荡5min;将上述样本置于离心机中,4℃、3040
×
g条件下离心10min;取上清200μl,加入200μl的稀释剂2,涡旋振荡5min;进样5.00μl以进行lc-ms/ms分析;参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对uloq样本进行检测。
[0159]
参照本实施例2.4.1对lloq样本进行检测,分别记录各uloq样本和lloq样本的检测结果,结果见表13。
[0160]
表13
[0161][0162]
接受标准为至少6个样本无明显干扰峰或干扰组分的峰面积不超过相应lloq样本峰面积的5%。本发明方法针对不同来源基质uloq样本中待测物对内标物测定的干扰范围为0.19%~1.21%。可见,待测物对内标物的检测结果没有造成干扰。
[0163]
2.5基质效应
[0164]
使用6个不同来源的空白大鼠血浆,考察内标工作液和待测物lqc(60.0ng/ml)、mqc(3000ng/ml)、hqc(4500ng/ml)三个浓度下质控样本的基质效应。每一来源基质,每一浓度配制一份样本。
[0165]
参照“试验材料与方法”第6项配制参比质控工作液,参比质控工作液包括lqc(0.24μg/ml)、mqc(12μg/ml)、hqc(18μg/ml)三个浓度水平。
[0166]
参照“试验材料与方法”第7项配制参比内标工作液,参比内标工作液的浓度为0.8μg/ml。
[0167]
基质存在的血浆样本:取10.0μl稀释剂1分别加到190μl6个不同来源的空白大鼠血浆中,涡旋混合。
[0168]
不含基质的溶液样本:取10μl稀释剂1加到190μl超纯水中,涡旋混合。
[0169]
对基质存在的血浆样本和不含基质的溶液样本分别按下述方法进行预处理:取50.0μl基质存在的血浆样本和不含基质的溶液样本于96孔提取板中,分别加入400μl乙腈和50.0μl的稀释剂1,涡旋振荡5min;将上述样本置于离心机中,4℃、3040
×
g条件下离心10min;取上清190μl,按比例加入5.00μl参比质控工作液、5.00μl参比内标工作液和200μl稀释剂2,混匀,进样5.00μl,以进行lc-ms/ms分析。
[0170]
参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对预处理后的基质存在的血浆样本和不含基质的溶液样本进行检测。
[0171]
计算基质存在的血浆样本和不含基质的溶液样本下待测物的峰面积比值和内标物的峰面积比值,得到待测物和内标物的基质因子;进一步通过待测物的基质因子除以内标物的基质因子,计算经内标归一化的基质效应因子,结果见表14。
[0172]
表14
[0173][0174]
接受标准为每一浓度内标归一化的基质效应因子的变异系数(cv%)≤15%,由表14可知,6个不同来源基质内标归一化的基质效应因子均值为0.893~1.10,变异系数为1.87%~2.72%,在本实施例选择的色谱和质谱条件下,可忽略基质效应对待测物及内标物测定的影响。
[0175]
2.6精密度和准确度
[0176]
使用新鲜配制的质控样本,浓度包含lloq qc、lqc、gmqc、mqc、hqc 5个浓度水平,浓度分别为lloq qc:20.0ng/ml,lqc:60.0ng/ml,gmqc:400ng/ml,mqc:3000ng/ml,hqc:4500ng/ml,每一个浓度平行制备6份,用于批内/批间精密度和准确度的考察。通过至少3个分析批且至少2天完成,来考察批间精密度和准确度。
[0177]
参照“试验材料与方法”第11项对质控样本进行预处理,参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对质控样本进行检测,记录检测结果,见表15和表16。
[0178]
表15
[0179]
[0180]
[0181][0182]
表16
[0183]
[0184]
[0185][0186]
接受标准为除定量下限外,每个浓度测定值要求变异系数(cv%)≤15%;定量下限的质控样本浓度测定值的变异系数(cv%)≤20%;定量下限质控样本浓度测定平均值与理论值的偏差在
±
20%范围内,其他质控样本浓度测定平均值与理论值的偏差在
±
15%范围内;至少2/3定量下限质控样本浓度测定值与理论值偏差在
±
20%范围内,其他浓度至少2/3的质控样本浓度测定值与理论值偏差在
±
15%范围内。由表15和表16可知,本发明方法对肝素钠血浆中的25-羟基胆固醇的检测具有良好的精密度和准确度。
[0187]
2.7提取回收率
[0188]
使用不同来源的大鼠混合空白血浆考察lqc(60.0ng/ml)、mqc(3000ng/ml)、hqc(4500ng/ml)三个浓度的质控样本,每个浓度平行配制6份,用提取的样本与未提取的样本(代表回收率100%)的平均峰面积进行比较,提取的样本同质控样本的制备,未提取的样本同双空白血浆样本制备。
[0189]
参照“试验材料与方法”第11项对提取的样本进行预处理,参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对提取的样本进行检测。
[0190]
参照“2.5基质效应”中“对基质存在的血浆样本和不含基质的溶液样本的预处理方法”对未提取的样本进行预处理,提取过程与提取的样本的提取操作相同,且经预处理后的未提取的样本与提取的样本中待测物和内标物的浓度相同,但是待测物和内标物工作液不参与提取过程。参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对未提取的样本进行检测。
[0191]
待测物提取回收率结果见表17。
[0192]
表17
[0193]
[0194][0195]
接受标准为每一浓度待测物的峰面积的变异系数(cv%)≤15%,总体回收率的变异系数(cv%)≤15%。由表17可知,本发明方法的待测物(25-羟基胆固醇)在高、中、低三个浓度范围内的提取回收率分别为98.10%、92.50%、98.41%,总回收率为96.34%,总体回收率变异系数(cv%)为3.45%。
[0196]
2.8稀释可靠性
[0197]
参照“试验材料与方法”第9项制备浓度为10000ng/ml的稀释质控样本(dqc),用空白大鼠血浆将其稀释5倍后,获得浓度为2000ng/ml血浆样本,平行制备6个样本。参照“试验材料与方法”第11项对样本进行预处理,参照“试验材料与方法”第2项色谱条件和第3项质谱条件,对样本进行检测。结果见表18。
[0198]
表18
[0199][0200]
接受标准为稀释质控样本浓度测定值的变异系数(cv%)≤15%,测定平均值与理论值偏差在
±
15%范围内,且至少2/3的稀释质控样本浓度测定值偏差在
±
15%范围内。由表18可知,10000ng/ml的质控样本采用空白大鼠血浆稀释5倍,检测标示浓度为2000ng/ml,测得浓度与标示浓度准确度偏差为-7.20%,变异系数cv为2.79%,稀释5倍的可靠性符合要求。
[0201]
对比例1
[0202]
含甲酸0.4%的乙腈-水溶液:量取水200ml,乙腈200ml,加入甲酸1.60ml,摇匀。
[0203]
精密称取适量25-羟基胆固醇标准品置于棕色玻璃瓶中,用含甲酸0.4%的乙腈-水溶液进行稀释,配制浓度为50ng/ml的工作液,参照“试验材料与方法”第3项质谱条件,对工作液进行质谱扫描,得到25-羟基胆固醇的一级质谱图,如图10所示;
[0204]
精密称取适量25-羟基胆固醇标准品置于棕色玻璃瓶中,用乙腈-水溶液(体积比为1:1)进行稀释,配制浓度为50ng/ml的工作液,参照“试验材料与方法”第3项质谱条件,对
工作液进行质谱扫描,得到25-羟基胆固醇的另一种一级质谱图,如图11所示;
[0205]
25-羟基胆固醇母离子为385.4,由图10和图11可知,用含甲酸的溶液作为流动相,可以使得25-羟基胆固醇的质谱响应增强。
[0206]
对比例2
[0207]
基质为sd大鼠空白血浆,参照“试验材料与方法”第8项,制备浓度为1080ng/ml的std5标准曲线样本;
[0208]
参照“试验材料与方法”第11项,对std5标准曲线样本进行预处理(不加内标工作液),色谱条件与“试验材料与方法”第2项色谱条件基本相同,不同的是,将“梯度洗脱”修改为“等度洗脱,流动相a与流动相b的体积比为5:95”,质谱条件与“试验材料与方法”第3项质谱条件基本相同,不同的是,从色谱柱中流出的洗脱液全部进质谱仪,对std5标准曲线样本进行检测得到std5标准曲线样本的色谱图,如图12所示。
[0209]
25-羟基胆固醇在1.27min出峰,由图12可知,25-羟基胆固醇的分离效果差。
[0210]
对比例3
[0211]
参照“试验材料与方法”第5项,制备浓度为1.00μg/ml的工作液;
[0212]
色谱条件与“试验材料与方法”第2项色谱条件基本相同,不同的是,梯度洗脱具体为0~0.3min,所述流动相a与所述流动相b的体积比为70:30;0.3~1.0min,所述流动相a与所述流动相b的体积比由70:30匀速变化至10:90,1.0~3.4min,所述流动相a与所述流动相b的体积比为10:90,3.4~3.5min,所述流动相a与所述流动相b的体积比由10:90匀速变化至70:30,3.5min~5min所述流动相a与所述流动相b的体积比为70:30;质谱条件与“试验材料与方法”第3项质谱条件基本相同,不同的是,从色谱柱中流出的洗脱液全部进质谱仪,对1.00μg/ml的工作液进行检测,得到1.00μg/ml的工作液的色谱图,如图13所示。
[0213]
由图13可知,当流动相b的体积分数低于95%时,待测物25-羟基胆固醇在色谱图上不出峰。
[0214]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1