基于Janus铂纳米马达的免疫层析检测方法及应用与流程
基于janus铂纳米马达的免疫层析检测方法及应用
技术领域
1.本发明属于免疫检测技术领域,尤其涉及一种基于janus铂纳米马达的免疫层析检测方法及应用。
背景技术:
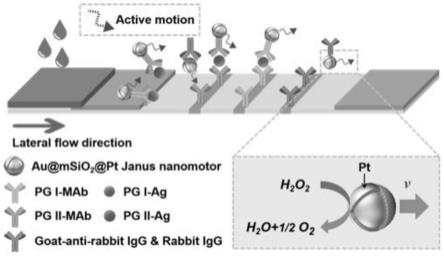
2.目前,免疫层析技术大多基于胶体金探针或荧光探针,其优势在于检测成本较低,且使用方便。然而,检测胶体金探针信号的手段大多通过比色法实现定性检测,即用肉眼来分辨颜色的强弱,因此存在灵敏度低、难以做到精确定量的问题。而荧光探针虽然能够做到定量检测,但其发光类型大多属于下转换荧光,即利用高能态光子激发低能态光子从而发射荧光,该检测方法的缺点是易受到生物内源性的荧光干扰,存在信号稳定性较差的问题。此外,现有微纳探针均以被动模式对免疫标志物进行检测,探针通过毛细作用被动向前扩散,使得抗原抗体间接触时间和接触面积有限,从而影响检测灵敏度。因此,为解决现有技术存在的稳定性低、灵敏度差等问题,需要开发一种基于主动模式的免疫层析检测技术。其中,janus纳米马达作为可进行自主运动的微纳器件,利用化学燃料(如过氧化氢)所引发的氧化还原反应产生气泡,进而实现气泡驱动运动,有望取代传统探针,用于新型主动模式下的免疫层析检测,使得免疫检测的灵敏度和稳定性有明显提升。
技术实现要素:
3.针对现有技术存在的问题,本发明提供了一种基于janus铂纳米马达的免疫层析检测方法及应用。
4.本发明是这样实现的,一种基于janus铂纳米马达的免疫层析检测方法,所述基于janus铂纳米马达的免疫层析检测方法将1mg/ml-5mg/ml的羧基功能化的janus铂纳米马达用1mg/ml-5mg/ml edc和1mg/ml-5mg/mlnhs活化 1-2小时,再用0.1mg-1mg的目标蛋白对其进行偶联4-6小时;偶联结束后用 10%的bsa溶液对其进行封闭1-2小时;然后利用xyz三维划膜喷金仪将其均匀喷于玻纤上,最后利用加入了1-10wt%的过氧化氢的样本溶液对目标抗原进行检测。
5.进一步,所述基于janus铂纳米马达的免疫层析检测方法具体包括以下步骤:
6.第一步,从冰箱取出一定浓度的的已偶联羧基的janus铂纳米马达微球溶液,并用超声细胞破碎机对溶液进行超声,超声功率为180w,超声时超声两秒暂停两秒为一组,共进行三组,总计6秒超声时间;超声完成后取janus铂纳米马达溶液进入离心管,并向其中加入mes溶液,用移液枪抽打混匀,使得配置后的janus铂纳米马达溶液浓度为1mg/ml-5mg/ml,溶液体积1ml;然后用离心机离心,该步骤完成对janus铂纳米马达微球溶液的清洗;
7.第二步,离心期间从冰箱中拿出edc和nhs复温5分钟,然后用电子天平分别称量1mg/ml-5mg/ml edc和1mg/ml-5mg/ml;将称量好的两种药品倒入空离心管,并用移液枪向其中加入mes溶液,抽打混匀,该步骤完成对活化试剂的配置;
8.第三步,离心结束后将离心管取出,对于装有janus铂纳米马达的离心管,用移液
枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入600ul的mes溶液,用细胞破碎超声机进行超声;超声完成后向其中加入第二步配好的400ul混合了edc和nhs的mes溶液,然后将离心管固定在旋转混匀仪进行活化1-2小时,设置转速为15,该步骤完成对janus铂纳米马达微球溶液的活化;
9.第四步,活化完成后用离心机离心,设置离心机转速为12000rpm,工作时长6min,工作温度为4℃;离心结束后将离心管取出,对于装有janus铂纳米马达的离心管,用移液枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入1ml的pbs溶液,用细胞破碎超声机进行超声,该步骤可清洗掉溶液中多余的活化剂;
10.第五步,用移液枪向janus铂纳米马达溶液中加入0.1mg-1mg用于包被的抗体,随后将离心管固定在旋转盘上旋转进行标记4-6小时,该步骤可完成对目标抗体的标记偶联;
11.第六步,标记完成后用离心机离心,离心结束后将离心管取出,对于装有 janus铂纳米马达的离心管,用移液枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入pbs溶液,用细胞破碎超声机进行超声;超声功率为180w,超声2秒暂停2秒为一组,共进行2组,超声时长总计4秒,超声环境为冰浴,该步骤可清洗掉溶液中未偶联上的抗体;
12.第七步,用移液枪向janus铂纳米马达溶液中加入10%bsa溶液,随后将离心管固定在旋转盘上旋转进行封闭1-2小时,该步骤可封闭janus铂纳米马达微球上未偶联上抗体蛋白的羧基位点;
13.第八步,封闭完成后用离心机离心,设置离心机转速为12000rpm,工作时长6min,工作温度为4℃;离心结束后将离心管取出,对于装有janus铂纳米马达,用移液枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入1ml的1%bsa溶液,用细胞破碎超声机进行超声;超声功率为180w,超声2秒暂停2秒为一组,共进行2组,超声时长总计4秒,超声环境为冰浴,超声结束后完成抗体偶联,该步骤可使得偶联后的抗体-微球溶液长期稳定保存;
14.第九步,将已偶联抗体的janus铂纳米马达溶液按照2.0ul/cm的喷量在经过玻纤处理液处理过的玻纤上进行喷金;喷金完成后,将玻纤放置于37℃干燥箱烘干24小时,该步骤可将偶联了抗体的janus铂纳米马达探针固定与玻纤上;
15.第十步,在pvc底卡最上端贴上吸水纸,在中部贴上nc膜;将用于划线的抗体用抗体稀释液稀释至1mg/ml,按照1ul/cm的喷量在nc膜上划检测线,再将二抗用抗体稀释液稀释至1mg/ml,按照1ul/cm的喷量在nc膜上划控制线;划线完成后,将测试卡放入37℃干燥箱烘干24小时,该步骤可将蛋白抗体固定于nc膜上;
16.第十一步,干燥结束后将玻纤贴于pvc底卡最下端,用高速裁切机将其裁切为宽度4mm的试纸条;
17.第十二步,在样本溶液中加入过氧化氢溶液使其质量分数为1-10wt%,取 90ul滴加至试纸条用于抗原检测,该步骤可使得janus铂纳米马达在nc膜上自主运动,达到增强检测灵敏度和稳定性的作用。
18.进一步,所述第一步超声完成后取0.4ml的janus铂纳米马达溶液进入 1.5ml离心管,并向其中加入0.6ml的mes溶液,用移液枪抽打混匀,使得配置后的janus铂纳米马达溶液浓度为1-5mg/ml,溶液体积1ml;然后用离心机离心,设置离心机转速为12000rpm,工作时
长6min,工作温度为4℃。
19.进一步所述第二步将称量好的两种药品倒入1.5ml的空离心管,并用移液枪向其中加入400ul的mes溶液,抽打混匀。
20.进一步,所述第三步超声功率为180w,超声2秒暂停2秒为一组,共进行 2组,超声时长总计4秒。
21.进一步,所述第四步超声功率为180w,超声2秒暂停2秒为一组,共进行 2组,超声时长总计4秒。
22.进一步,所述第五步用移液枪向janus铂纳米马达溶液中加入0.25mg用于包被的抗体,随后将离心管固定在旋转盘上旋转4-6小时进行标记。
23.进一步,所述第六步标记完成后用离心机离心,设置离心机转速为 12000rpm,工作时长6min,工作温度为4℃,离心结束后将离心管取出,对于装有janus铂纳米马达的离心管,用移液枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入1ml的pbs溶液。
24.进一步,所述第七步用移液枪向janus铂纳米马达溶液中加入100ul的10% bsa溶液,随后将离心管固定在旋转盘上旋转1-2小时进行封闭。
25.本发明的另一目的在于提供一种提高免疫层析试纸条对抗原检测能力的方法,所述提高免疫层析试纸条对抗原检测能力的方法包含所述基于janus铂纳米马达的免疫层析检测方法。
26.结合上述的技术方案和解决的技术问题,请从以下几方面分析本发明所要保护的技术方案所具备的优点及积极效果为:
27.第一,针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:利用janus铂纳米马达的自主运动特性,将其作为探针对免疫蛋白(抗原、抗体或适配体)进行偶联,使得免疫蛋白能够稳定附着于janus铂纳米马达探针之上。在检测过程中,通过对样本溶液中添加一定浓度的过氧化氢,利用气泡驱动运动实现janus铂纳米马达探针在nc膜上的自主运动,提高抗原抗体的结合效率,从而完成基于主动模式的免疫层析检测,最终使得检测灵敏度和稳定性均有明显提升。
28.第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:本发明提出将janus纳米马达作为探针于免疫层析技术相结合,形成基于janus铂纳米马达的免疫层析检测方法,以马达可自主运动的特性来增加抗原抗体的结合效率,从而提高免疫层析试纸条对抗原的检测能力。
29.第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
30.本发明的技术方案转化后的预期收益和商业价值为:
31.本发明的技术方案成功转化后有望对现有部分免疫层析技术进行迭代或升级。由于其制备成本低、且具有较高的检测灵敏度和检测稳定性,本发明可广泛应用于药店、诊所和医院等医疗机构,实现对众多用户各类免疫指标的快速、准确以及定量检测。本发明有望提升我国免疫层析试纸产品的市场占有率,降低医疗成本。
附图说明
32.图1是本发明实施例提供的基于janus铂纳米马达的免疫层析检测方法流程图;
33.图2是本发明实施例提供的基于janus铂纳米马达免疫层析方法对胃蛋白酶原ⅰ的线性检测图;
34.图3是本发明实施例提供的基于janus铂纳米马达免疫层析方法对胃蛋白酶原ⅱ的线性检测图;
35.图4是本发明实施例提供的基于janus铂纳米马达免疫层析方法的特异性测试图;图5是本发明实施例提供的基于janus铂纳米马达免疫层析方法的特异性测试。
具体实施方式
36.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
37.一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
38.如图1所示,本发明实施例提供的基于janus铂纳米马达的免疫层析检测方法包括以下步骤:
39.s101:将1mg/ml-5mg/ml的羧基功能化的janus铂纳米马达用1mg/ml-5 mg/ml edc和1mg/ml-5mg/mlnhs活化1-2小时;
40.s102:再用0.1mg-1mg的目标蛋白对其进行偶联4-6小时;偶联结束后用 10%的bsa溶液对其进行封闭1-2小时;
41.s103:然后利用xyz三维划膜喷金仪将其均匀喷于玻纤上;
42.s104:最后利用加入了1-10wt%的过氧化氢的样本溶液对目标抗原进行检测。
43.本发明实施例提供的基于janus铂纳米马达的免疫层析检测方法具体包括以下步骤:
44.第一步,从冰箱取出一定浓度的的已偶联羧基的janus铂纳米马达微球溶液,并用超声细胞破碎机对溶液进行超声,超声功率为180w,超声时超声两秒暂停两秒为一组,共进行三组,总计6秒超声时间;超声完成后取janus铂纳米马达溶液进入离心管,并向其中加入mes溶液,用移液枪抽打混匀,使得配置后的janus铂纳米马达溶液浓度为1mg/ml-5mg/ml,溶液体积1ml;然后用离心机离心,该步骤完成对janus铂纳米马达微球溶液的清洗;
45.第二步,离心期间从冰箱中拿出edc和nhs复温5分钟,然后用电子天平分别称量1mg/ml-5mg/ml edc和1mg/ml-5mg/ml;将称量好的两种药品倒入空离心管,并用移液枪向其中加入mes溶液,抽打混匀,该步骤完成对活化试剂的配置;
46.第三步,离心结束后将离心管取出,对于装有janus铂纳米马达的离心管,用移液枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入600ul的mes溶液,用细胞破碎超声机进行超声;超声完成后向其中加入第二步配好的400ul混合了edc和nhs的mes溶液,然后将离心管固定在旋转混匀仪进行活化1-2小时,设置转速为15,该步骤完成对janus铂纳米马达微球溶液的活化;
47.第四步,活化完成后用离心机离心,设置离心机转速为12000rpm,工作时长6min,
工作温度为4℃;离心结束后将离心管取出,对于装有janus铂纳米马达的离心管,用移液枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入1ml的pbs溶液,用细胞破碎超声机进行超声,该步骤可清洗掉溶液中多余的活化剂;
48.第五步,用移液枪向janus铂纳米马达溶液中加入0.1mg-1mg用于包被的抗体,随后将离心管固定在旋转盘上旋转进行标记4-6小时,该步骤可完成对目标抗体的标记偶联;
49.第六步,标记完成后用离心机离心,离心结束后将离心管取出,对于装有 janus铂纳米马达的离心管,用移液枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入pbs溶液,用细胞破碎超声机进行超声;超声功率为180w,超声2秒暂停2秒为一组,共进行2组,超声时长总计4秒,超声环境为冰浴,该步骤可清洗掉溶液中未偶联上的抗体;
50.第七步,用移液枪向janus铂纳米马达溶液中加入10%bsa溶液,随后将离心管固定在旋转盘上旋转进行封闭1-2小时,该步骤可封闭janus铂纳米马达微球上未偶联上抗体蛋白的羧基位点;
51.第八步,封闭完成后用离心机离心,设置离心机转速为12000rpm,工作时长6min,工作温度为4℃;离心结束后将离心管取出,对于装有janus铂纳米马达,用移液枪吸取离心管中的上清液打入废液缸,待上清液全部取走后向离心管中加入1ml的1%bsa溶液,用细胞破碎超声机进行超声;超声功率为180w,超声2秒暂停2秒为一组,共进行2组,超声时长总计4秒,超声环境为冰浴,超声结束后完成抗体偶联,该步骤可使得偶联后的抗体-微球溶液长期稳定保存;
52.第九步,将已偶联抗体的janus铂纳米马达溶液按照2.0ul/cm的喷量在经过玻纤处理液处理过的玻纤上进行喷金;喷金完成后,将玻纤放置于37℃干燥箱烘干24小时,该步骤可将偶联了抗体的janus铂纳米马达探针固定与玻纤上;
53.第十步,在pvc底卡最上端贴上吸水纸,在中部贴上nc膜;将用于划线的抗体用抗体稀释液稀释至1mg/ml,按照1ul/cm的喷量在nc膜上划检测线,再将二抗用抗体稀释液稀释至1mg/ml,按照1ul/cm的喷量在nc膜上划控制线;划线完成后,将测试卡放入37℃干燥箱烘干24小时,该步骤可将蛋白抗体固定于nc膜上;
54.第十一步,干燥结束后将玻纤贴于pvc底卡最下端,用高速裁切机将其裁切为宽度4mm的试纸条;
55.第十二步,在样本溶液中加入过氧化氢溶液使其质量分数为1-10wt%,取 90ul滴加至试纸条用于抗原检测,该步骤可使得janus铂纳米马达在nc膜上自主运动,达到增强检测灵敏度和稳定性的作用。
56.实施例1
57.如图2所示,本发明检测胃蛋白酶原ⅰ:
58.将0.25毫克的pg
ⅰ‑
mab1用于偶联,0.25mg的pg
ⅰ‑
mab2用于划检测线,1mg/ml的羊抗兔igg用于划质控线,按照上述步骤制备试纸条。用过氧化氢浓度为5wt%的pgⅰ抗原溶液作为样本溶液,配置pgⅰ浓度梯度为:0,50,10,20, 50,100,500ng/ml。每个浓度分别取90ul滴加于试纸条,10分钟后利用图像处理软件imagej测算不同浓度下检测线信号强度。
59.实施例2
60.如图3所示,本发明检测胃蛋白酶原ⅱ:
61.将0.25毫克的pg
ⅱ‑
mab1用于偶联,0.25mg的pg
ⅱ‑
mab2用于划检测线, 1mg/ml的羊抗兔igg用于划质控线,按照上述步骤制备试纸条。用过氧化氢浓度为5wt%的pgⅱ抗原溶液作为样本溶液,配置pgⅱ浓度梯度为:0,50,10, 20,50,100,500ng/ml。每个浓度分别取90ul滴加于试纸条,10分钟后利用图像处理软件imagej测算不同浓度下检测线信号强度。
62.实施例3
63.如图4所示,本发明验证测试胃蛋白酶原的特异性:
64.将0.25毫克的pg
ⅰ‑
mab1和pg
ⅱ‑
mab1用于偶联,0.25mg的pg
ⅰ‑
mab1 用于划检测线1(t1)和pg
ⅱ‑
mab2用于划检测线2(t1),1mg/ml的羊抗兔igg 用于划质控线,按照上述步骤制备试纸条。用过氧化氢浓度为5wt%的pgⅰ和pgⅱ的混合抗原溶液作为样本溶液,配置浓度为20ng/ml。f分别用过氧化氢浓度为 5wt%的crp、saa、pct、myo抗原溶液作为样本溶液,配置浓度均为20ng/ml。分贝取90ul每种抗原溶液滴加于试纸条,10分钟后利用图像处理软件imagej 测算不同抗原样本溶液下检测线信号强度。
65.二、应用实施例。为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
66.利用本发明的技术方案,将janus铂纳米马达探针分别与c反应蛋白(crp) 和血清淀粉样蛋白a(saa)进行偶联。通过上述偶联、喷金及划线步骤后,对人血清中crp抗原及saa抗原进行检测。具体检测方法为在90微升人血清样本中加入5wt%的过氧化氢,将其均匀混合后滴加到试纸条上。同时,以相同条件在已上市的crp和saa试纸条产品上滴加样本溶液,两组均反应15分钟。反应结束后对两组crp试纸和saa试纸的检测限进行计算,发现本发明对crp 检测限为0.05ng/ml,与商用试纸条相比灵敏度提高50%,对saa检测限为0.3 ng/ml,与商用试纸条相比灵敏度提高67%
[0067][0068]
三、实施例相关效果的证据。本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
[0069]
实验1
[0070]
胃蛋白酶原ⅰ线性检测实验:
[0071]
实验时间:2021.2.17
[0072]
实验仪器:image j
[0073]
检测时间:10分钟
[0074]
实验方案:通过测试不同胃蛋白酶原ⅰ浓度下测试线信号强度值,建立胃蛋白酶原
ⅰ
浓度检测线信号强度的线性关系,并计算出线性检测范围与最低检出限。
[0075]
实验结果,如图2所示。
[0076]
实验2
[0077]
胃蛋白酶原ⅱ线性检测实验:
[0078]
实验时间:2021.2.17
[0079]
实验仪器:image j
[0080]
检测时间:10分钟
[0081]
实验方案:通过测试不同胃蛋白酶原ⅱ浓度下测试线信号强度值,建立胃蛋白酶原ⅱ浓度检测线信号强度的线性关系,并计算出线性检测范围与最低检出限。
[0082]
实验结果,如图3所示。
[0083]
实验3
[0084]
胃蛋白酶原检测的特异性实验:
[0085]
实验时间:2021.2.17
[0086]
实验仪器:image j
[0087]
检测时间:10分钟
[0088]
实验方案:通过测试不同抗原样本溶液下检测线信号强度值,验证本发明是否具有良好的特异性。
[0089]
实验结果,如图4所示。
[0090]
综上,本发明可将janus铂纳米马达作为免疫层析探针,提高免疫层析在抗原检测方面的检测灵敏度,在生物探针领域有良好的发展潜力。
[0091]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1