一种缓冲液在PGP9.5检测试剂盒中的应用的制作方法
一种缓冲液在pgp 9.5检测试剂盒中的应用
技术领域
1.本发明属于生物检测技术领域,具体涉及一种缓冲液在脑特异性蛋白产物9.5(pgp 9.5)检测试剂盒中的应用。
背景技术:
2.颅脑创伤(tbi)是由外力引起的大脑损伤,会破坏大脑正常功能,导致人的认知能力或身体机能受损,其发病率高、病情变化快、致死致残率高。尽管目前急诊救治、手术技术和重症监护水平取得了不断的进步,但颅脑创伤患者的预后未见明显改善。因此,在早期对颅脑创伤预后进行更精准判断,及时评估干预措施疗效并依此对患者进行个体化治疗,具有巨大的临床意义和战略意义。
3.颅脑创伤对脑部造成损伤的病理生理学基础为细胞和脑组织缺血缺氧、脑水肿、炎症、神经递质失调和生理性屏障受损等一系列复杂生理生化级联反应引起的神经细胞(包括神经胶质细胞和神经元)变性死亡。生物标志物则是颅脑创伤中由于神经细胞结构破坏、细胞损伤坏死使得一些细胞成分和生化产物直接释放入细胞外液和脑脊液中,并通过损伤的血脑屏障或其他可能途径进入外周血而可被直接检测到的脑特异性蛋白质。通过检测体液中的脑特异性蛋白质浓度,将可准确知晓脑组织损伤和脑保护情况,从而为颅脑创伤伤情判断、预后预测和监测干预措施疗效提供重要依据。
4.uch-l1又称蛋白基因产物9.5(pgp 9.5),是一类由223个氨基酸组成的半胱氨酸水解酶,分子量约24kd,是泛素蛋白酶体系统中一种重要的去泛素化酶,可以将泛素从泛素前体蛋白移除。uch-l1在神经系统中分布广泛,在大脑中的表达量远高于其他组织,其占脑组织总蛋白量的1-5%,尤其在神经元胞体和树突中均有分布,以维持神经元的正常突触结构和功能。当颅脑创伤时,由于神经元发生变性、崩解,该酶进入脑脊液和血液,因而其含量的高低可反映中枢神经系统受损的程度。目前,已有许多研究证明颅脑创伤动物模型和患者的血清uch-l1浓度明显升高,并与脑损伤的严重程度相关。如专利cn201880020489.5公开了一种使用早期生物标记物泛素羧基末端水解酶l1(uch-l1)帮助诊断和评价已遭受或可能已遭受对头部的损伤、诸如轻度或中度至重度创伤性脑损伤(tbi)的人类受试者的方法。专利cn201710396942.x则公开了一种用于轻中度脑损伤的快速诊断试剂及含有该试剂的试剂盒及该试剂盒的制备和检测方法,该试剂和试剂盒包括s100、gfap、uchl1分别制得的单克隆捕获抗体;所述试剂盒还包括检测抗体s100、gfap、uchl1分别制得的多克隆抗体。
5.为了能够快速、简便地检测人外周血中pgp 9.5的含量,通过对缓冲液的不段优化,提供了一种操作简便、能为创伤性脑损伤提供辅助诊断的体外诊断试剂盒及其制备方法和应用。
技术实现要素:
6.针对上述不足,本发明提供了一种缓冲液在脑特异性蛋白产物9.5(pgp 9.5)检测试剂盒中的应用。本发明所述的缓冲液包括4-羟乙基哌嗪乙磺酸、氯化钠、牛igg、酶水解明
胶、蛋白稳定剂、月桂醇聚氧乙烯醚、生物防腐剂等成分,将其应用于脑特异性蛋白产物9.5(pgp 9.5)检测试剂盒中,可快速、简便地检测人外周血中pgp 9.5的含量,从而为颅脑创伤伤情判断、预后预测和监测干预措施疗效提供重要依据,具有巨大的临床意义和战略意义。
7.为了实现上述发明目的,本发明的技术方案如下:
8.一方面,本发明提供了一种缓冲液在脑特异性蛋白产物9.5(pgp 9.5)检测试剂盒中的应用,所述的缓冲液包括4-羟乙基哌嗪乙磺酸、氯化钠、牛igg、六水合氯化镁溶液、氯化锌溶液、酶水解明胶、蛋白稳定剂、月桂醇聚氧乙烯醚、生物防腐剂。
9.具体地,所述的缓冲液包括4-羟乙基哌嗪乙磺酸5.6-9g/l、氯化钠9g/l、牛igg5-30g/l、六水合氯化镁溶液1-10ml/l、氯化锌溶液1-10ml/l、酶水解明胶1-20g/l、蛋白稳定剂30-120ml/l、月桂醇聚氧乙烯醚0.2-5g/l、生物防腐剂1ml/l。
10.进一步具体地,所述的缓冲液包括4-羟乙基哌嗪乙磺酸5.7g/l、氯化钠9g/l、牛igg15g/l、六水合氯化镁溶液3ml/l、氯化锌溶液3ml/l、酶水解明胶15g/l、蛋白稳定剂50ml/l、月桂醇聚氧乙烯醚3g/l、生物防腐剂1ml/l。
11.具体地,所述牛igg、酶水解明胶、月桂醇聚氧乙烯醚的重量比为5-30:1-20:0.2-5。
12.进一步具体地,所述牛igg、酶水解明胶、月桂醇聚氧乙烯醚的重量比为5:5:1。
13.另一方面,本发明还提供了一种pgp 9.5检测试剂盒,所述的试剂盒包括包被板、试剂a、校准品、质控品、清洗浓缩液、显色液、终止液。
14.具体地,所述的试剂a使用上述缓冲液与酶标记pgp9.5抗体偶联物混匀配制而成。
15.进一步具体地,所述清洗浓缩液为缓冲液13,所述缓冲液13包括:三羟甲基氨基甲烷、氯化钠、非离子型表面活性剂。
16.进一步具体地,所述校准品和质控品的制备方法均为:使用缓冲液11将pgp9.5重组蛋白溶解,充分混合后,配制。
17.进一步具体地,所述缓冲液11包括三羟甲基氨基甲烷、牛血清白蛋白、甘氨酸。
18.进一步具体地,所述酶标记pgp9.5抗体偶联物的制备方法包括以下步骤:
19.(1)抗体1活化:将缓冲液6加入至pgp9.5抗体1溶液中进行活化,混匀;
20.(2)hrp活化:将hrp溶解后加入缓冲液2,混匀;再加入缓冲液5,离心,弃去上清液,收集浓缩液,即得hrp溶液;
21.(3)抗体1与hrp连接:向步骤(1)得到的活化后的pgp9.5抗体1溶液中加入步骤(2)得到的hrp溶液,混匀后加入缓冲液6,得到酶标记pgp9.5抗体偶联物溶液;
22.(4)抗体偶联物的终止和纯化:将酶标记pgp9.5抗体偶联物溶液和缓冲液7混合后,混匀反应,再加入缓冲液8,离心,弃去上清后,收集浓缩液,即得pgp9.5抗体偶联物,向抗体偶联物中加入甘油、牛血清白蛋白,充分混匀后,保存。
23.进一步具体地,所述缓冲液6包括碳酸钠、碳酸氢钠,所述缓冲液2包括高碘酸钠,所述缓冲液5包括乙酸,所述缓冲液7包括硼氢化钠;所述缓冲液8包括十二水合磷酸氢二钠、磷酸二氢钠、氯化钠、氯化钾。
24.进一步具体地,所述包被板包括pgp9.5抗体2,所述pgp9.5抗体2包被以及封闭包括以下步骤:
25.s1:pgp9.5抗体2前处理:向pgp9.5抗体2溶液中加入缓冲液8,离心弃去上清后,收
集浓缩液;
26.s2:pgp9.5抗体2的包被和封闭:将步骤s1处理后的pgp9.5抗体2使用缓冲液8稀释,加入至微孔板,反应后弃去各孔反应液,加入缓冲液9,反应;
27.s3:pgp9.5抗体2包被板的清洗和保存:步骤s2的反应结束后,弃去各孔反应液,加入缓冲液10,均匀震荡,弃去反应液,反应后保存。
28.进一步具体地,所述缓冲液9包括三羟甲基氨基甲烷、牛血清白蛋白、甘氨酸、蔗糖、非离子型表面活性剂、生物防腐剂;所述缓冲液10包括:三羟甲基氨基甲烷、氯化钠、非离子型表面活性剂。
29.在某些实施例中,本发明中涉及的缓冲液的配方以及制备方法具体如下所示:
30.①
缓冲液1
31.称取2.0-3.8g的na2hpo4·
12h2o、0.01-0.8g的nah2po4加入到一定量的纯化水中搅拌至完全溶解,调试ph值在6.5-7.6之间并定容至1000ml。用0.22μm的滤膜进行过滤。
32.②
缓冲液2
33.称取10-28g的高碘酸钠加入到一定量的缓冲液1中搅拌至完全溶解,调试ph值在6.5-7.6之间并使用缓冲液1定容至1000ml。用0.22μm的滤膜进行过滤。
34.③
缓冲液3(六水合氯化镁溶液)
35.称取203.3g的mgcl2·
6h2o加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
36.④
缓冲液4(氯化锌溶液)
37.称取136.3g的zncl2加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
38.⑤
缓冲液5
39.称取0.02-0.57g的乙酸加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
40.⑥
缓冲液6
41.称取8.5-52g的na2co3、14-86g的nahco3加入到一定量的纯化水中搅拌至完全溶解,调试ph值在9.0-10.0之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
42.⑦
缓冲液7
43.称取1-5mg的nabh4加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
44.⑧
缓冲液8
45.称取2.0-3.8g的na2hpo4·
12h2o、0.01-0.8g的nah2po4、6-10g的nacl、0.1-0.6g的kcl加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0-7.8之间并定容至1000ml。用0.22μm的滤膜进行过滤。
46.⑨
缓冲液9
47.称取1.0-1.5g的tris、5.0-50g的牛血清白蛋白、5.0-40g的甘氨酸、2-15g的蔗糖、2ml的非离子型表面活性剂、1ml的生物防腐剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.5-8.5之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
48.进一步地,所述非离子型表面活性剂包括吐温系列(吐温20/40/60/80)、曲拉通
x100/114;生物防腐剂为proclin-300。也可替换为其他防腐剂,包括proclin-300、叠氮钠、庆大霉素、硫酸新霉素。除proclin-300外其余均为固体,添加量不超过0.5%(w/v)。
49.⑩
缓冲液10
50.称取1.0-1.5g的tris、9g的nacl、0.2-5ml的非离子型表面活性剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0-7.5之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
51.缓冲液11
52.称取12.0-15.0g的tris、5.0-50g的牛血清白蛋白、1.0-30g甘氨酸加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.6-8.8之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
53.缓冲液12
54.称取2.3-23.8g的hepes、9.0g的nacl、5.0-30g的牛igg、1-10ml的缓冲液3、1-10ml的缓冲液4、1-20g的酶水解明胶、30-120ml的蛋白稳定剂、0.2-5g的月桂醇聚氧乙烯醚、1ml的生物防腐剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0-7.6之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
55.具体地,所述的蛋白稳定剂为商业化产品,厂商:surmodics,货号:sa01。
56.缓冲液13
57.称取10-15g的tris、90g的nacl、2-50ml的非离子型表面活性剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0-7.5之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
58.在一些具体的实施方式中,所述酶标记pgp9.5抗体偶联物的制备方法包括以下步骤:
59.1)辣根过氧化物酶(hrp)的检测
60.使用纯化水将超微量紫外分光光度计调零,检测hrp在275nm波长和403nm波长处的od值。计算rz值,rz=od403nm/od275nm,当rz≥3.0时,hrp可用。
61.2)超滤浓缩离心管的前处理
62.取两支超滤浓缩离心管,其分子截流量≥10kd。使用纯化水将内管、外管浸泡5min以上。在内管中加入500μl纯化水。离心机参数设置为:2-8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。将两支处理好的超滤浓缩离心管排空液体,盖好盖子备用。
63.3)辣根过氧化物酶(hrp)的活化
64.称取5mg hrp,溶于1.2ml纯化水中,加入0.3ml新鲜配制的缓冲液2,室温条件下混匀20min。将hrp溶液转入一支处理好的超滤浓缩离心管内管中,在内管中加入500μl缓冲液5。离心机参数设置为:2-8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液,2-8℃避光保存。
65.4)抗体1的活化
66.按抗体1与缓冲液6体积比1:5-1:20的比例将缓冲液6加入抗体1溶液中进行活化,震荡混匀后,立即测试混合液的ph值,ph值应在9-10之间。
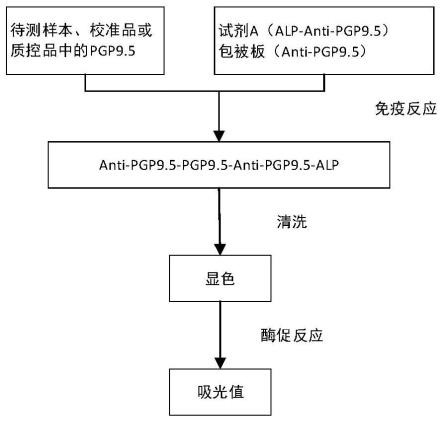
67.5)抗体1和hrp的连接
68.按抗体1与hrp质量比1:2-1:1的比例在抗体1溶液中的加入hrp溶液(即:1.0mg抗体1加入1.0-2.0mg hrp)。震荡混匀后,立即测试混合液的ph值,ph值应在9-10之间,如不符合要求,使用缓冲液6进行调节。将混合物在20-40℃条件下中避光混匀反应1-3.5小时。
69.6)抗体1偶联物的终止和纯化
70.按1mg抗体1加入100μl缓冲液7的比例加入该溶液,在2-8℃条件下混匀反应2小时。将反应液转入另一个处理好的超滤浓缩离心管内管中。在内管中加入500μl缓冲液8。离心机参数设置为:2~8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液。该浓缩液即抗体1偶联物,其浓度应在1-4mg/ml之间,如不在范围,应重新浓缩或使用缓冲液8进行稀释。
71.按1ml抗体1偶联物加入1ml甘油(即体积比1:1)、1ml抗体1偶联物加入5-20μg牛血清白蛋白(即质量体积比200:1-200:4)。充分混匀后,在-20℃环境下保存。
72.进一步地,所述包被板包括抗体2。
73.在某些实施例中,所述抗体2的包被及封闭包括以下步骤:
74.1)超滤浓缩离心管的前处理
75.取一支超滤浓缩离心管,其分子截流量≥10kd。使用纯化水将内管、外管浸泡5min以上。在内管中加入500μl纯化水。离心机参数设置为:2~8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。将处理好的超滤浓缩离心管排空液体,盖好盖子备用。
76.2)抗体2的前处理
77.量取1mg抗体2溶液,将其转入处理好的超滤浓缩离心管内管中,在内管中加入500μl缓冲液8。离心机参数设置为:2-8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液,其浓度应在0.5-2mg/ml之间,如不在范围,应重新浓缩或使用缓冲液8进行稀释。2-8℃保存。
78.3)抗体2的包被和封闭
79.将处理后的抗体2使用缓冲液8进行稀释,稀释浓度在0.1-4μg/ml。在96孔微孔板中加入稀释后的抗体2溶液,每孔的加入量为50-150μl,在2-8℃条件下避光反应12-16小时或在35-42℃条件下避光反应0.5-2小时。之后弃掉各孔反应液,并加入缓冲液9,每孔的加入量为200μl。在35-42℃条件下避光反应0.5-2小时。
80.4)抗体2包被板的清洗和保存
81.反应结束后,弃掉各孔反应液。并在各孔中加入缓冲液10,每孔的加入量为200μl。水平均匀震荡微孔板2min。之后弃掉反应液,并重复该过程,一共重复3-5次。最后弃掉各孔反应液并排干液体,在35-42℃条件下避光反应0.5-2小时。使用避光铝膜袋对处理好的包被板进行抽真空封闭,在2-8℃条件下保存。
82.与现有技术相比,本发明的积极和有益效果在于:
83.1、本发明使用免疫学检测手段对创伤性脑损伤进行血液检测,与影像学检测手段(主要为ct)相比,本专利更能客观的反映样本的真实情况,减少了因主观判断造成的误判和漏判。
84.2、本发明使用的试剂盒可以使检测灵敏度达到皮克级别(10-12
g/ml),而ct依赖像素达到更高的分辨率。由于本发明是对脑损伤特异性标志物进行检测,检测窗口比ct提前
很多。在ct阴性的情况下,即可对正常人和轻度tbi患者进行有效区分。
85.3、本发明使用全自动仪器进行检测,只需加入血清样本,1小时即可得到准确结果。而ct检测时间较长,一般需要等待4小时才可能取得检测结果。
86.4、本发明使用浓度数值进行判断,取得结果即可得知患者是否患病,客观性较强。而ct检测需要医师进行阅片,依医师的业务水平,主观判断性较强,容易造成漏判、误判。
附图说明
87.图1为本发明反应流程图。
88.图2为本发明工艺流程图。
具体实施方式
89.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
90.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本文中使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同意义。
91.值得说明的是,本发明中使用的原料均为普通市售产品,因此对其来源不做具体限定。
92.1检测原理
93.本试剂盒采用双抗体夹心法测定pgp9.5的含量。样本中pgp9.5和试剂a中的酶标抗体1及包被板中的抗体2结合,形成“三明治”夹心结构。经洗涤,加入显色液进行反应。显色液在过氧化物酶的催化下转化为蓝色,并在酸的作用下转化为最终的黄色。颜色的深浅与样本中pgp9.5的浓度成正相关。在450nm波长下测定od值并计算样本浓度。
94.2组分
95.2.1试剂盒组分
96.pgp9.5试剂盒由包被板、试剂a、校准品、质控品、清洗浓缩液(缓冲液13)、显色液、终止液组成。其中包被板为96孔微孔板。试剂a为含一定浓度辣根过氧化物酶标记的pgp9.5抗体溶液;校准品由含有六个浓度的pgp9.5抗原和缓冲液配制而成,用于校准标准曲线;质控品由含有两个浓度的pgp9.5抗原和缓冲液配制而成;清洗浓缩液用于反应过程的清洗,工作液浓度为10倍稀释的浓缩液;显色液为tmb溶液;终止液为2m硫酸。具体如下表1所示。
97.表1.试剂盒主要组分
98.[0099][0100]
3.生产工艺
[0101]
3.1校准品、质控品的生产
[0102]
将pgp9.5重组蛋白作为校准品的原料。以缓冲液11将其溶解,充分混合后配制成6个校准品,浓度为0pg/ml、80pg/ml、160pg/ml、480pg/ml、1280pg/ml、2560pg/ml。
[0103]
将pgp9.5重组蛋白作为质控品的原料。以缓冲液11将其溶解,充分混合配制成质控品。浓度为80pg/ml、480pg/ml。
[0104]
3.2试剂a的生产
[0105]
将酶标记pgp9.5抗体偶联物作为试剂a的原料。以缓冲液12将其充分混匀配制成试剂a。
[0106]
4.应用实施例及对比例
[0107]
实施例1
[0108]
一种试剂盒,包括包被板、试剂a、校准品、质控品、缓冲液13、显色液、终止液。
[0109]
所述的试剂a使用本发明所述的缓冲液(即缓冲液12)与酶标记pgp9.5抗体偶联物混匀配制而成。
[0110]
所述酶标记pgp9.5抗体偶联物的制备方法包括以下步骤:
[0111]
1)辣根过氧化物酶(hrp)的检测
[0112]
使用纯化水将超微量紫外分光光度计调零,检测hrp在275nm波长和403nm波长处的od值。计算rz值,rz=od403nm/od275nm,当rz≥3.0时,hrp可用。
[0113]
2)超滤浓缩离心管的前处理
[0114]
取两支超滤浓缩离心管,其分子截流量≥10kd。使用纯化水将内管、外管浸泡5min以上。在内管中加入500μl纯化水。离心机参数设置为:2-8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。将两支处理好的超滤浓缩离心管排空液体,盖好盖子备用。
[0115]
3)辣根过氧化物酶(hrp)的活化
[0116]
称取5mg hrp,溶于1.2ml纯化水中,加入0.3ml新鲜配制的缓冲液2,室温条件下混匀20min。将hrp溶液转入一支处理好的超滤浓缩离心管内管中,在内管中加入500μl缓冲液5。离心机参数设置为:2-8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液,2-8℃避光保存。
[0117]
4)抗体1的活化
[0118]
按抗体1与缓冲液6体积比1:15的比例将缓冲液6加入抗体1溶液中进行活化,震荡混匀后,立即测试混合液的ph值,ph值应在9-10之间。
[0119]
5)抗体1和hrp的连接
[0120]
按抗体1与hrp质量比1:1.5的比例在抗体1溶液中的加入hrp溶液(即:1.0mg抗体1加入1.5mg hrp)。震荡混匀后,立即测试混合液的ph值,ph值应在9-10之间,如不符合要求,使用缓冲液6进行调节。将混合物在30℃条件下中避光混匀反应2小时。
[0121]
6)抗体1偶联物的终止和纯化
[0122]
按1mg抗体1加入100μl缓冲液7的比例加入该溶液,在4℃条件下混匀反应2小时。将反应液转入另一个处理好的超滤浓缩离心管内管中。在内管中加入500μl缓冲液8。离心机参数设置为:4℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液。该浓缩液即抗体1偶联物,其浓度为2mg/ml,如不在范围1-4mg/ml之间,应重新浓缩或使用缓冲液8进行稀释。
[0123]
按1ml抗体1偶联物加入1ml甘油(即体积比1:1)、1ml抗体1偶联物加入10μg牛血清白蛋白。充分混匀后,在-20℃环境下保存。
[0124]
所述包被板包括抗体2。
[0125]
所述抗体2的包被及封闭包括以下步骤:
[0126]
1)超滤浓缩离心管的前处理
[0127]
取一支超滤浓缩离心管,其分子截流量≥10kd。使用纯化水将内管、外管浸泡5min以上。在内管中加入500μl纯化水。离心机参数设置为:4℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。将处理好的超滤浓缩离心管排空液体,盖好盖子备用。
[0128]
2)抗体2的前处理
[0129]
量取1mg抗体2溶液,将其转入处理好的超滤浓缩离心管内管中,在内管中加入500μl缓冲液8。离心机参数设置为:4℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液,其浓度为1mg/ml,如不在范围0.5-2mg/ml之间,应重新浓缩或使用缓冲液8进行稀释。2-8℃保存。
[0130]
3)抗体2的包被和封闭
[0131]
将处理后的抗体2使用缓冲液8进行稀释,稀释浓度为2μg/ml。在96孔微孔板中加入稀释后的抗体2溶液,每孔的加入量为100μl,在4℃条件下避光反应14小时。之后弃掉各孔反应液,并加入缓冲液9,每孔的加入量为200μl。在40℃条件下避光反应1小时。
[0132]
4)抗体2包被板的清洗和保存
[0133]
反应结束后,弃掉各孔反应液。并在各孔中加入缓冲液10,每孔的加入量为200μl。水平均匀震荡微孔板2min。之后弃掉反应液,并重复该过程,一共重复3-5次。最后弃掉各孔反应液并排干液体,在40℃条件下避光反应1小时。使用避光铝膜袋对处理好的包被板进行抽真空封闭,在2-8℃条件下保存。
[0134]
缓冲液的配方以及制备方法具体如下所示:
[0135]
①
缓冲液1
[0136]
称取3.0g的na2hpo4·
12h2o、0.3g的nah2po4加入到一定量的纯化水中搅拌至完全溶解,调试ph值在6.5-7.6之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0137]
表2.缓冲液1配方
[0138][0139][0140]
②
缓冲液2
[0141]
称取20g的高碘酸钠加入到一定量的缓冲液1中搅拌至完全溶解,调试ph值在6.5-7.6之间并使用缓冲液1定容至1000ml。用0.22μm的滤膜进行过滤。
[0142]
表3.缓冲液2配方
[0143]
原料名称称取量高碘酸钠20gph值6.5-7.6缓冲液1定容至1000ml
[0144]
③
缓冲液3(六水合氯化镁溶液)
[0145]
称取203.3g的mgcl2·
6h2o加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0146]
表4.缓冲液3配方
[0147]
原料名称称取量六水合氯化镁203.3g纯化水定容至1000ml
[0148]
④
缓冲液4(氯化锌溶液)
[0149]
称取136.3g的zncl2加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0150]
表5.缓冲液4配方
[0151]
原料名称称取量氯化锌136.3g纯化水定容至1000ml
[0152]
⑤
缓冲液5
[0153]
称取0.3g的乙酸加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0154]
表6.缓冲液5配方
[0155]
[0156][0157]
⑥
缓冲液6
[0158]
称取22.6g的na2co3、30.2g的nahco3加入到一定量的纯化水中搅拌至完全溶解,调试ph值在9.0-10.0之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
[0159]
表7.缓冲液6配方
[0160]
原料名称称取量碳酸钠22.6g碳酸氢钠30.2gph值9.0-10.0纯化水定容至1000ml
[0161]
⑦
缓冲液7
[0162]
称取2.5mg的nabh4加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0163]
表8.缓冲液7配方
[0164]
原料名称称取量硼氢化钠2.5mg纯化水定容至1000ml
[0165]
⑧
缓冲液8
[0166]
称取3.0g的na2hpo4·
12h2o、0.4g的nah2po4、8g的nacl、0.4g的kcl加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0-7.8之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0167]
表9.缓冲液8配方
[0168][0169][0170]
⑨
缓冲液9
[0171]
称取1.2g的tris、16.6g的牛血清白蛋白、25.7g的甘氨酸、10g的蔗糖、2ml的非离子型表面活性剂、1ml的生物防腐剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.5-8.5之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
[0172]
表10.缓冲液9配方
[0173]
原料名称称取量三羟甲基氨基甲烷1.2g牛血清白蛋白16.6g甘氨酸25.7g蔗糖10g非离子型表面活性剂2ml生物防腐剂1mlph值7.5-8.5纯化水定容至1000ml
[0174]
所述非离子型表面活性剂为吐温20;生物防腐剂为proclin-300。
[0175]
⑩
缓冲液10
[0176]
称取1.2g的tris、9g的nacl、2.2ml的非离子型表面活性剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0-7.5之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
[0177]
表11.缓冲液10配方
[0178]
原料名称称取量三羟甲基氨基甲烷1.2g氯化钠9g非离子型表面活性剂2.2mlph值7.0-7.5纯化水定容至1000ml
[0179]
缓冲液11
[0180]
称取13.6g的tris、35.8g的牛血清白蛋白、12.5g甘氨酸加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.6-8.8之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
[0181]
表12.缓冲液11配方
[0182]
原料名称称取量三羟甲基氨基甲烷13.6g牛血清白蛋白35.8g甘氨酸12.5gph值7.6-8.8纯化水定容至1000ml
[0183]
缓冲液12
[0184]
称取5.7g的hepes、9.0g的nacl、15.0g的牛igg、3ml的缓冲液3、3ml的缓冲液4、15.0g的酶水解明胶、50ml的蛋白稳定剂、3g的月桂醇聚氧乙烯醚、1ml的生物防腐剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0-7.6之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
[0185]
表13.缓冲液12配方
[0186]
原料名称称取量
4-羟乙基哌嗪乙磺酸5.7g氯化钠9.0g牛igg15.0g缓冲液33ml缓冲液43ml酶水解明胶15.0g蛋白稳定剂50ml月桂醇聚氧乙烯醚3g生物防腐剂1mlph值7.0-7.6纯化水定容至1000ml
[0187]
具体地,所述的蛋白稳定剂为商业化产品,厂商:surmodics,货号:sa01。
[0188]
缓冲液13
[0189]
称取12.6g的tris、90g的nacl、23.2ml的非离子型表面活性剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0-7.5之间,并定容至1000ml。用0.22μm的滤膜进行过滤。
[0190]
表14.缓冲液13配方
[0191]
原料名称称取量三羟甲基氨基甲烷12.6g氯化钠90g非离子型表面活性剂23.2mlph值7.0-7.5纯化水定容至1000ml
[0192]
实施例2
[0193]
与实施例1的区别仅在于,缓冲液12具体为:4-羟乙基哌嗪乙磺酸5.6g/l、氯化钠9g/l、牛igg 30g/l、缓冲液3 1.2ml/l、缓冲液4 9.8ml/l、酶水解明胶1.5g/l、蛋白稳定剂110ml/l、月桂醇聚氧乙烯醚0.2g/l、生物防腐剂1ml/l。
[0194]
制备方法同实施例1。
[0195]
实施例3
[0196]
与实施例1的区别仅在于,缓冲液12具体为:4-羟乙基哌嗪乙磺酸9g/l、氯化钠9g/l、牛igg 5.5g/l、缓冲液3 10ml/l、缓冲液4 1ml/l、酶水解明胶20g/l、蛋白稳定剂35ml/l、月桂醇聚氧乙烯醚4.8g/l、生物防腐剂1ml/l。
[0197]
制备方法同实施例1。
[0198]
对比例1
[0199]
与实施例1的区别仅在于,缓冲液12中牛igg、酶水解明胶、月桂醇聚氧乙烯醚的重量比为3.4:29.5:0.1(三者的总重量与实施例1一致)。
[0200]
对比例2
[0201]
与实施例1的区别仅在于,将缓冲液12中的牛igg、缓冲液3和酶水解明胶替换为等量牛血清白蛋白、1m mgso4(将120.37g硫酸镁溶于1l纯化水中,混匀、过滤,即得)和明胶。
[0202]
5.检测方法
[0203]
采用北京美联泰科生物技术有限公司自研的全自动酶联免疫分析仪进行检测。反应所需样本量为100μl,自动检验流程为:
[0204]
(1)免疫反应:将100μl样本、100μl试剂a依次加入微孔板孔位,在37℃条件下反应40min。
[0205]
(2)清洗:通过仪器的自动清洗流程对微孔板进行清洗。
[0206]
(3)读值:在各孔位加入100μl显色液,室温避光反应15min,再在各孔位加入50μl终止液。辣根过氧化物酶催化的显色液显色后在5min内用自研仪器检测450nm波长吸光度(od值)。
[0207]
(4)根据检测的校准品数值可获得一条pgp 9.5浓度-发光值标准曲线。该曲线使用四参数logistic方程拟合。
[0208]
(5)样本的检测值可以和这条曲线上获得唯一的浓度值对应,从而实现对未知样本的浓度检测。
[0209]
5.检测指标
[0210]
5.1准确度
[0211]
将浓度约为3000pg/ml(允许偏差
±
10%)的脑特异性蛋白产物(pgp9.5)液(a)加入到浓度范围0pg/ml-80pg/ml的样本b中,所加入pgp9.5抗原与样本b之间的体积比例为1:9,根据公式(1)计算回收率r,其回收率应在85%-115%范围内。
[0212][0213]
式中:
[0214]
r为回收率;
[0215]
v为样品a液的体积;
[0216]
v0为血清样品b液的体积;
[0217]
c为血清样品b液加入a液后的3次测量平均值;
[0218]
c0为血清样品b液的3次测量平均值;
[0219]
cs为样品a液的浓度。
[0220]
5.2空白限
[0221]
将不含任何分析物的样本重复测试20次,得到20次测试结果的浓度值,计算其平均值和标准差(sd)。平均值即为空白限,结果应≤50pg/ml。
[0222]
5.3线性区间
[0223]
将接近线性区间上限的高值样本与接近线性区间下限的低值样本或零浓度样本混合成不少于5个稀释浓度,其中低值浓度的样本须接近线性区间的下限。对每一浓度的样本各重复测试3次得到发光值,记录各样品的测量结果,并计算各样品3次测量值的平均值(yi)。以稀释浓度(xi)为自变量,以测定结果均值(yi)为因变量求出线性回归方程。按公式(2)计算线性回归的相关系数(r),在80-2560pg/ml的线性区间内,相关系数r应≥0.990。
[0224]
[0225]
式中:
[0226]
r为相关系数;
[0227]
xi为稀释比例;
[0228]
yi为各个样本测定结果均值;
[0229]
为稀释比例的均值;
[0230]
为样本测定结果总均值。
[0231]
5.4重复性
[0232]
同批号试剂盒重复测试质控品10次,计算10次测试结果的平均值和标准差sd。按公式(3)计算变异系数(cv),结果cv≤10%。
[0233][0234]
式中:s为样本测试值的标准差;
[0235]
为样本测试值的平均值。
[0236]
5.5批间差
[0237]
用3个批号的试剂盒分别重复测试质控品10次,计算30次测试结果的平均值和标准差sd,根据公式(3)得出变异系数(cv),结果cv≤15%。
[0238]
5.6特异性
[0239]
在不含任何分析物的样本中加入5000pg/ml的胶质纤维酸性蛋白(gfap),测3次取均值,按公式(4)计算结果,交叉反应率应小于5%。
[0240]rcr
=m/c
×
100%
…………………………………………
(4)
[0241]
式中:
[0242]rcr
为交叉反应率;
[0243]
m为交叉反应物测定结果均值;
[0244]
c为交叉反应物标示值。
[0245]
5.7校准品和质控品瓶间差
[0246]
检测同一批号10瓶校准品(或质控品)各1次,按公式(5)计算,测定结果的均值与标准差(s1)。另取上述10瓶校准品(或质控品)中的1瓶连续测定10次,计算结果的均值和标准差(s2),按照公式(6)、(7)计算瓶间重复性cv%,测量结果cv应<10%。
[0247][0248][0249][0250]
(说明:当s1《s2时,令cv瓶间=0)
[0251]
式中:s为标准差。
[0252]
检测结果:
[0253]
(1)准确度
[0254]
表15
[0255]
实例回收率%实施例1101实施例297实施例395对比例182对比例276
[0256]
(2)空白限
[0257]
表16
[0258][0259]
(3)线性区间
[0260]
表17
[0261]
实例相关系数r实施例10.9993实施例20.9917实施例30.9961对比例10.9754对比例20.9238
[0262]
(4)重复性
[0263]
表18
[0264][0265][0266]
(5)批间差
[0267]
表19
[0268][0269]
(6)特异性
[0270]
表20
[0271]
实例交叉反应率(%)实施例10.001实施例20.002
实施例30.002对比例10.05对比例20.13
[0272]
(7)瓶间差
[0273]
表21
[0274][0275][0276]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1