猪骨桥蛋白IC-ELISA检测的建立方法、试剂盒及应用
猪骨桥蛋白ic-elisa检测的建立方法、试剂盒及应用
技术领域
1.本发明属于免疫学技术领域,具体涉及猪骨桥蛋白ic-elisa检测的建立方法、试剂盒及应用。
背景技术:
2.在集约现代化的养殖场下,人工授精技术已经在广泛的使用,但目前人工授精主要的问题是如何获得优质品质的精液,所以筛选高繁殖性能的公猪对提高母猪受胎率、提高猪场生产效益具有重要意义。
3.近年来随着蛋白质组学的飞速发展,已经在精清中已经鉴别出了数千种蛋白,并且发现了许多与雄性生育能力相关的候选蛋白标记,这将有利于畜牧业在筛选优良种公畜时提供便利,提高生产水平。
4.骨桥蛋白(osteopontin)是在牛骨组织中鉴定的第一个细胞外基质蛋白,属于一种高度磷酸化的糖蛋白,其位于第八条染色体的长臂末端,包含6个外显子以及5个内含子,cds区长为912bp,编码304个氨基酸,其中启动子区域存在7种重复的双核苷酸片段,大约由314个氨基酸组成,经过剪切、翻译后分子量在44到75kda之间,不同物种之间存在着差异。
5.骨桥蛋白属于精液蛋白,并且在大部分哺乳动物生殖器官中均有表达,例如睾丸、附睾、输卵管、子宫等,基本参与了受精、胚胎着床及胎盘形成的生殖全过程。通过免疫组化检测骨桥蛋白在猪睾丸中的定位,发现其表达于初级精母细胞、次级精母细胞和精子细胞,说明其可能参与精子发生的过程。在体外添加骨桥蛋白到冷冻精液和卵母细胞中能够提高牛和猪的受精率、卵裂率及胚胎发育,骨桥蛋白还能通过与整合素结合进而提高子宫内膜容受性,以及充当黏附因子对胚胎着床起着至关重要的因素。
6.对于在大型规模化养殖场的鉴定,通常要求方法准确快速,并且同时要能够处理多个样本,而elisa具有高灵敏度、最小检测限低等优点,能够符合生产中需要同时对大批量进行检测的要求。
技术实现要素:
7.为克服现有技术缺陷,本发明的第一目的在于提供一种猪骨桥蛋白ic-elisa检测的建立方法。
8.本发明的第二目的在于提供一种猪骨桥蛋白ic-elisa检测的试剂盒。
9.本发明的第三目的在于提供一种猪骨桥蛋白ic-elisa检测方法。
10.本发明的第四目的在于提供上述猪骨桥蛋白ic-elisa检测的试剂盒的应用。
11.为了实现上述发明目的,本发明采用以下技术方案:
12.一种猪骨桥蛋白ic-elisa检测的建立方法,包括如下步骤:
13.s1:骨桥蛋白的制备;
14.s2:骨桥蛋白单克隆抗体的制备;
15.s3:酶联免疫检测方法的建立及评估:
16.通过棋盘滴定法,横向梯度包被不同浓度抗原,纵向梯度加入不同浓度的抗体,选择od值在1.0~1.5之间的包被浓度和抗体稀释倍数进行下一步,根据不同组合的amax、ic50、amax/ic50确定最佳包被浓度;
17.在上述最佳条件下,设定不同包被时间,根据不同时间的amax/ic50和ic50确定最佳的包被时间;
18.在上述最佳条件下,选择不同的封闭时间,比对不同封闭时间的amax/ic50和ic50确定最佳封闭时间;
19.在上述最佳条件下,选择不同稀释倍数的一抗进行孵育和选择不同孵育时间,比对不同稀释倍数的一抗和不同孵育时间的amax/ic50和ic50确定最佳一抗稀释倍数及一抗孵育时间;
20.在上述最佳条件下,选择不同稀释倍数的二抗进行孵育和选择不同孵育时间,比对不同稀释倍数的二抗和不同孵育时间的amax/ic50和ic50确定最佳二抗稀释倍数及二抗孵育时间;
21.在上述最佳条件下,选择不同显色时间,比对不同显色时间的amax/ic50和ic50确定最佳显色时间;
22.在上述最佳条件下,采用不同浓度梯度的标准蛋白质溶液绘制标准曲线,根据实验结果剔除数据至出现线性关系,实验结果需满足r2>0.99和cv%<15%才可纳入线性范围。
23.作为本发明的进一步改进,步骤s1中所述的骨桥蛋白的制备的具体步骤如下:
24.p1:以pet-32a(+)质粒为基础,从酶切位点ndel和ecori插入序列如seq id no.1所示的opn基因序列,得到重组质粒opn-pet-32a;
25.p2:将重组质粒opn-pet-32a转化至大肠杆菌bl21(de3)中,培养至od值为0.4-0.6时,加入0.1m iptg进行诱导表达,菌体破碎后收集上清;
26.p3:采用镍柱纯化目的蛋白,洗脱液中氯化钠浓度为300mm,即获得所述的猪骨桥蛋白。
27.作为本发明的进一步改进,步骤s2中所述的骨桥蛋白单克隆抗体的制备的具体步骤,是参考专利cn201911323477.2、采用保藏编号为cctcc no:c2009293的杂交细胞瘤细胞株cy2制备抗体。
28.一种猪骨桥蛋白ic-elisa检测的试剂盒,包括如下组分:上述步骤s1制备的骨桥蛋白、包被液、封闭液、上述步骤s2制备的骨桥蛋白单克隆抗体、二抗、显色液tmb和终止液h2so4。
29.作为本发明的进一步改进,所述的包被液为ph9.6、0.1mol/l碳酸盐缓冲液,每250ml体系按如下方法配制:250ml蒸馏水加入0.375g na2co3和0.732g nahco3。
30.作为本发明的进一步改进,所述的封闭液为1%bsa-pbst,每100ml体系按如下方法配制:1g bsa溶解于100ml pbst。
31.作为本发明的进一步改进,所述的二抗为购于碧云天hrp标记山羊抗小鼠igg。
32.上述猪骨桥蛋白ic-elisa检测的试剂盒的应用,用于非诊断目的的检测待测样本中猪骨桥蛋白opn的含量。
33.作为本发明的进一步改进,所述的待测样本包括但不限于离体猪组织、猪卵母细
胞和/或猪精液。
34.一种猪骨桥蛋白ic-elisa检测方法,包括如下步骤:
35.包被:将骨桥蛋白用包被液按1:20000稀释倍数稀释后,加入至酶标板中,4℃包被12h;
36.封闭:将包被好的酶标板洗板后加入封闭液,37℃恒温封闭2h;将封闭好的板洗板后干燥,备用;
37.竞争反应:将待测样本加入封闭好的酶标板中,震荡混匀;加入稀释倍数为1:100000的骨桥蛋白单克隆抗体,37℃恒温放置45min,待反应结束后洗板;
38.酶标二抗:再接着加入稀释倍数为1:2000的二抗,37℃恒温孵育30min,待反应结束后洗板;
39.显色:加入显色液tmb,37℃恒温孵育10min,加入2m h2so4终止反应;
40.检测:用酶标仪测定od450和od630,通过标准曲线得到待测样品中骨桥蛋白的浓度,从而实现待测样品中骨桥蛋白的定量检测;其中:标准曲线的线性方程为y=-0.3158x+1.294,r2=0.9956,最低检测限为0.027μg/ml。
41.作为本发明的进一步改进,待测样本中猪骨桥蛋白的含量在0.625~32μg/ml范围内。
42.本发明相对于现有技术具有如下的优点及效果:
43.通过本发明提供的骨桥蛋白酶联免疫检测试剂盒,可实现对精液中骨桥蛋白的含量进行检测;特异性好,灵敏度高,检测结果准确性好,重复性好;样品处理简单,检测操作简单,试剂盒均已工作液的形式提供,可对猪场中大规模种公猪群体进行筛选。
附图说明
44.图1为opn基因rt-pcr扩增结果拍照图;
45.图2为pet-32a(+)-opn重组质粒阳性菌液鉴定结果拍照图;
46.图3为pet-32a(+)-opn原核表达蛋白sds-page鉴定结果拍照图;
47.图4为pet-32a(+)-opn原核表达蛋白western blot鉴定结果图;
48.图5为猪源opn蛋白的肽段匹配结果图;
49.图6为ic-elisa实验条件优化研究结果图;其中,a为最佳包被浓度的确定,b为最佳一抗稀释条件确定,c为最佳酶标二抗稀释条件确定,d为最佳包被时间确定,e为最佳封闭时间确定,f为最佳竞争反应时间确定,g为最佳酶标二抗反应时间的确定;
50.图7为ic-elisa检测方法稳定性测试结果图;其中,a为包被抗原酶标板,b为标准抗原,c为单克隆抗体,d为酶标二抗在37℃下保存7天后的活性;
51.图8为ic-elisa抑制竞争曲线图;其中,a为抑制竞争曲线,b为标准曲线。
具体实施方式
52.下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
53.实施例中未注明具体条件的实验方法,通常按照常规条件,例如分子克隆实验指南(第三版,j.萨姆布鲁克等著,黄培堂等译,科学出版社,2002年)中所述的条件,或按照制
造厂商所建议的条件。
54.实施例1:目标抗原的制备
55.1.材料方法
56.1.1菌株、质粒
57.质粒pmd18-t和原核表达质粒pet32a(+)购自takara生物工程有限公司;克隆宿主菌e.coli dh5a、表达宿主菌e.coli bl21(de3)购于擎科生物有限公司。
58.1.2主要试剂
59.动物组织rna抽提试剂盒购于omega公司;反转录试剂盒、高保真酶primerstar max dna polymerase、2
×
taq master mix、dna maker dl2000、氨苄、eb、tae购于鼎国公司;琼脂糖粉购于擎科生物公司;天净沙rnaase、凝胶回收试剂盒、质粒无内毒素抽提试剂盒购于天根生化有限公司。
60.2.实验方法
61.2.1猪骨桥蛋白的原核表达载体构建
62.2.1.1骨桥蛋白opn的密码子优化
63.根据ncbi(genbank登录号:nm_214023.1)提供的基因序列,通过在线软件对在不改变编码氨基酸的前提,采用大肠杆菌偏好表达的密码子,降低gc含量,对编码opn的序列进行优化。优化后的序列由擎科生物合成,并构建于在pmd18-t载体上,得到的重组质粒命名为pmd18-t-opn。
64.2.1.2引物设计
65.为将目的序列opn连接至pet-32a(+)上,选择酶切位点为ndel和ecori,设计出pcr扩增引物,由上海生工合成。
66.opn-ndel-f:5
’‑
ggaattccatatgatgctgcccgtgaagcagaca-3’;
67.opn-ecori-6his-r:5
’‑
ccggaattcttagtggtgatggtggtggtggttgatctcgctgctggcgc-3’;
68.注:下划线部分为酶切位点。
69.2.1.3目的基因opn的亚克隆
70.用构建好的pmd18-t-opn质粒作为模板,用引物opn-ndel-f和opn-ecori-6his-r扩增出带有酶切位点的opn片段,利用高保真酶进行pcr扩增。pcr反应体系为:上游引物1μl,下游引物1μl,2
×
phanta max master mix(dye plus)25μl,质粒模板1μl,ddh2o 21μl。pcr反应程序为:95℃预变性3min,95℃变性15s,65℃退火15s,72℃延伸30s,循环35次,72℃终延伸5min,4℃保存。
71.2.1.4 opn片段和pet-32a(+)质粒的双酶切和连接
72.根据胶回收试剂将pcr产物进行回收后,用ndel和ecori酶对纯化的opn片段和pet-32a(+)质粒进行双酶切。反应条件为:37℃孵育1h。
73.进行凝胶电泳鉴定并再进行切胶回收。将opn片段和载体片段用solution i在16℃下进行连接过夜,构建重组质粒opn-pet-32a。在通过转化、鉴定和抽提质粒得到重组质粒opn-pet-32a。
74.2.1.5猪骨桥蛋白opn原核表达载体诱导表达及鉴定
75.2.1.5.1 opn原核蛋白诱导表达
76.将抽提质粒转化至表达菌bl21(de3)中,将阳性菌落扩大培养,将吸取菌液与la液体培养基1:1000的比例在37℃/220rpm过夜活化。将过夜培养的菌液吸取500μl至50ml液体培养基中,37℃/220rpm培养至od值为0.4-0.6时,加入0.1m iptg进行诱导,12h后进行鉴定。将诱导后的菌液12000rpm/10min,弃去上清,用pbs冲洗3次后,进行超声破碎。破碎程序为(300w,每次10s,间歇10s,循环50次)破碎后的菌液4℃/12000rpm,离心10min,收集上清和沉淀,沉淀用8m的尿素溶解。
77.2.1.5.2 opn表达蛋白的鉴定
78.将诱导表达的蛋白通过sds-page、western blot和飞行质谱进行鉴定,其余蛋白液用bca法测定蛋白的最终浓度,分装后冷冻干燥浓缩备用。
79.2.1.5.3 opn表达蛋白的纯化
80.对鉴定表达正确的菌液,扩大表达,8000rpm离心5min收集菌体沉淀;向菌体沉淀中加入200ml his binding buffer重悬菌体沉淀;用6个50ml离心管均分;超声破碎:功率300w,时间5s,间隙5s,20min,全程冰浴。10000rpm离心15分钟取上清。上清用0.45μm滤器过滤,得到澄清破菌上清。取2根5ml ni excel预装柱,用20倍柱体积his eluting buffer洗脱层析柱;用20倍柱体积his binding buffer平衡层析柱;用5ml/min流速上样,收集穿透液;用10倍柱体积his binding buffer平衡层析柱至a280(uv)和电导趋于平衡为止;收集平衡液;用5%eluting buffer洗脱杂蛋白;收集;用10%eluting buffer洗脱杂蛋白;收集;用15%eluting buffer洗脱杂蛋白;收集;用100%eluting buffer洗脱,收集。将收集液用12%sds-page电泳检测。
81.2.2单克隆抗体的制备
82.参照实验室前期专利cn201911323477.2、采用保藏编号为cctcc no:c2009293的杂交细胞瘤细胞株cy2制备抗体。
83.2.3猪骨桥蛋白ic-elisa方法的建立和应用
84.2.3.1ic
‑‑
elisa基本步骤
85.包被:将包被原用包被液(按如下方法配制:250ml蒸馏水加入0.375g na2co3和0.732g nahco3)稀释至合适浓度后,每孔加入100μl/孔至酶标板中,4℃包被过夜;
86.封闭:将包被好的酶标板洗板3次,加入封闭液(按如下方法配制:1g bsa溶解于100ml pbst)300μl/孔,放入37℃恒温箱中2h;将封闭好的板,洗板后烘干,用真空机抽干,备用;
87.竞争反应:将标准品用稀释液稀释至合适浓度,50μl/孔加入固定好的酶标板中,震荡混匀;再接着向板中加入50μl/孔合适浓度的抗体,放入37℃恒温箱中1h,待反应结束后放入洗板机洗板5次;
88.酶标二抗:酶标二抗(碧云天hrp标记山羊抗小鼠igg)100μl/孔,放入37℃恒温箱30min,反应结束后放入洗板机洗板5次;
89.显色:加入显色液tmb 100μl/孔,放入37℃恒温箱10min,加入100μl/孔2m h2so4终止反应;
90.测定:用酶标仪测定od450和od630。
91.2.3.2最佳包被浓度的确定
92.通过棋盘滴定法,横向梯度包被不同浓度的蛋白,纵向梯度加入不同浓度的抗体,
按照2.3.1步骤测定,选择od值在1.0-1.5之间的包被浓度和抗体稀释倍数进行下一步,根据不同组合的amax、ic50、amax/ic50确定最佳包被浓度。
93.2.3.3最佳包被时间的确定
94.在上述最佳条件下,设定不同包被时间,按步骤2.3.1测定,比对不同时间的amax/ic50和ic50确定最佳的包被时间。
95.2.3.4最佳封闭时间的确定
96.在上述最佳条件下,选择不同的封闭时间,按步骤2.3.1测定,比对不同封闭物及封闭时间的amax/ic50和ic50确定最佳封闭物及封闭时间。
97.2.3.5最佳一抗稀释倍数及孵育时间的确定
98.在上述最佳条件下,选择不同稀释倍数的一抗进行孵育和选择不同孵育时间,按步骤2.3.1测定,比对不同稀释倍数的一抗和不同孵育时间的amax/ic50和ic50确定最佳一抗稀释倍数及一抗孵育时间。
99.2.3.6最佳二抗稀释倍数及孵育时间的确定
100.在上述最佳条件下,选择不同稀释倍数的二抗进行孵育和选择不同孵育时间,按步骤2.3.1测定,比对不同稀释倍数的二抗和不同孵育时间的amax/ic50和ic50确定最佳二抗稀释倍数及二抗孵育时间。
101.2.3.7最佳显色时间的确定
102.在上述最佳条件下,选择不同显色时间,按步骤2.3.1测定,比对不同显色时间的amax/ic50和ic50确定最佳显色时间。
103.2.4猪骨桥蛋白ic-elisa检测方法评价
104.2.4.1 ic-elisa检测方法线性范围及标准曲线的建立
105.线性范围是评估试剂盒有效性的重要依据也是建立标准曲线的基础,实验选取了12个浓度水平,根据实验结果剔除数据至出现线性关系,实验结果需满足r2>0.99和cv%<15%才可纳入线性范围。采用origin9.1软件进行四参数拟合得到抑制曲线。
106.2.4.2 ic-elisa检测方法精密度的确定
107.精密度是衡量检测试剂批内和批间变异的重要指标,通过对同一批次和不同批次准备的试剂盒进行重复4次重复检测,以变异系数来表示批内和批间误差。
108.2.4.3 ic-elisa检测方法的准确性检测
109.利用回收率检测试剂盒的准确性,通过分别将已知浓度的骨桥蛋白稀释成低、中、高三个浓度添加到样品中,添加量控制在线性范围中,每个浓度测定重复3次,计算回收率。
110.2.4.4 ic-elisa检测方法的稳定性测试
111.将各组分进行37℃加速保存实验进行验证,根据《医学检验诊断试剂的制备与应用》,生物试剂37℃一天相当于4-10℃一个半月,观察组装好的试剂盒能保存的时长。
112.2.5猪精液蛋白样品检测
113.选取杜洛克、长白和大白三个品种进行精子和精清蛋白检测。
114.3.实验结果
115.3.1重组质粒pet-opn的构建
116.3.1.1目的基因opn的pcr扩增
117.利用特异性引物opn-ndel-f和opn-ecori-6his-r将opn片段从pmd18-t-opn上扩
增,大小为861bp(图1)。
118.opn片段序列如下所示(seq id no.1):
119.ctgcccgtgaagcagacaaacagcgggagcagcgaggagaagctgctgagcaacaagtacaccgatgccgtggccacactgctgaagcccgatcccagccagaagcagaccttcctggccccccagaacaccattagctccgaggagacagatgatttcaagcaggagaccctgcccagcaagagcaacgagtcccccgagcagaccgacgacgtggatgatgatgatgacgaggaccacgtcgactccagggacaccgacagcgaggaggccgatcacgccgacgatgccgataggtccgacgagagccaccacagcgatgagtccgatgagctggtgacagacttccccacagacacccccgccaccgacgtgacccccgccgtgcccaccggcgaccccaacgatggccggggggatagcgtggtgtacgggctgcggtccaagtccaagaagtttaggcggagcgaggcccagcagctggacgccaccgaggaggacctgaccagccacgtggagagcgaggagaccgacggcacccccaaggccatcctggtggcccagaggctgcacgtggcctccgacctggattcccaggagaaggacagccaggagacatcccagcccgatgataggagcgtggagaccaggagccaggagcagagcaaggagtacacaatcaagacctacgacggcagcaacgagcacagcaacgtgattgagtcccaggagaaccccaaggtgagccaggagttccactcccacgaggataagctggtccccgatagcaagagcgaggaggataagcacctgaagctgagggtgagccacgagctggagagcgccagcagcgagatcaac。
120.3.1.2 opn目的片段与表达质粒pet-32a(+)双酶切、连接及测序鉴定
121.将目的片段纯化回收后与表达质粒pet-32a(+)同时通过ndei和ecori酶切位点进行双酶切,再将产物进行纯化回收、连接;将目的片段连接至pet-32a(+)上,将连接产物转化dh5α,涂板带有氨苄抗性的平板;隔天随机挑选7个菌落进行pcr鉴定(图2),结果表明目的片段opn和pet-32a(+)质粒连接成功。通过测序分析后发现,opn成功插入pet-32a(+)的多克隆位点中,三联密码阅读框正确,并且无碱基突变,表明插入序列正确,重组质粒构建成功。
122.3.2 pet-opn在大肠杆菌的诱导表达及鉴定
123.3.2.1重组质粒pet-opn转化表达菌株bl21(de3)
124.经测序正确的质粒转化表达菌株bl21(de3),涂板过夜;随机挑选4个单克隆菌落进行pcr鉴定,在861bp出均出现条带,表明pet-opn质粒成功转入表达菌株bl21(de3)
125.3.2.2 pet-opn蛋白在大肠杆菌中的可溶性分析鉴定
126.将含重组质粒pet-opn的表达宿主菌bl21(de3)用iptg进行诱导表达后,经超声破碎分离出上清和沉淀,通过sds-page发现了pet-opn在上清中的表达量更高(图3),进一步通过western blot鉴定,确定了pet-opn表达于上清中,而在包涵体中未见有表达(图4),说明pet-opn表达蛋白存在于上清中,同时蛋白可用于后续实验。
127.3.2.3 pet-opn蛋白纯化及浓度测定
128.目的蛋白大量表达,且经过镍柱纯化,目的蛋白可全部结合到层析柱。经过梯度洗脱,目的蛋白和杂蛋白得到了较好的分离。其中,目的蛋白主要在30%(300mm nacl浓度)被洗脱下来。纯化后的蛋白通过bca测定浓度为2.5mg/ml。
129.3.2.4猪源opn蛋白的质谱鉴定
130.质谱结果与ncbi上的猪源氨基酸序列进行比对(图5),结果表达肽段覆盖率为77%,说明表达蛋白可信度高。
131.3.3 ic-elisa实验条件优化
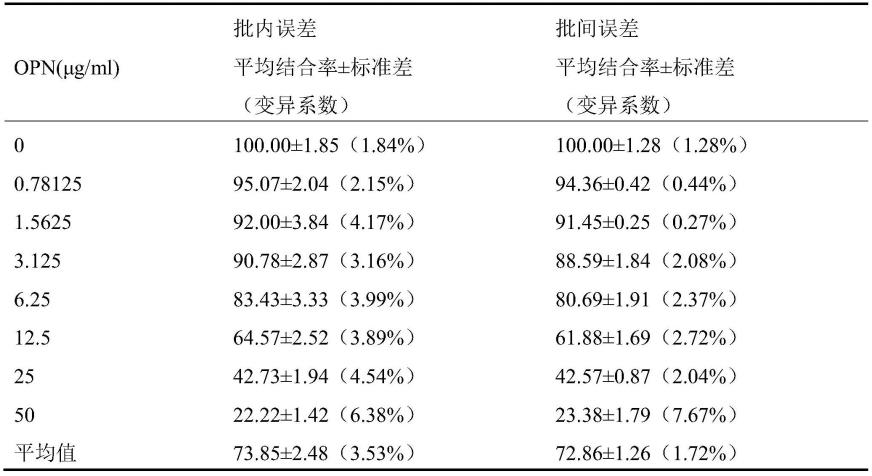
132.3.3.1最佳包被浓度的确定
133.结果如图6中a所示,ic50随着包被浓度的降低而不断降低,而amax/ic50随着包被浓度的降低呈现先上升后下降的趋势。在包被蛋白稀释倍数为1:20000时蛋白浓度为0.125μg/ml,此时amax/ic50最大,因此选择此浓度为最佳包被蛋白浓度。
134.3.3.2最佳一抗稀释条件确定
135.结果如图6中b所示,随着抗体稀释比例的增加,ic50呈现不断下降的趋势后趋于平缓,但amax/ic50为先上升后下降的趋势。在一抗稀释倍数为1:100000抗体浓度为0.05μg/ml时amax/ic50最大,因此选择1:100000为最佳的抗体稀释倍数。
136.3.3.3最佳酶标二抗稀释条件确定
137.如图6中c所示,随着酶标二抗稀释比例的增加,ic50呈现不断下降的趋势后趋于平缓,但amax/ic50为先上升后下降的趋势。在酶标二抗稀释倍数为1:2000时amax/ic50最大,因此选择1:2000为最佳的酶标二抗稀释倍数。
138.3.3.4最佳包被时间确定
139.结果如图6中d所示,在12h 4℃时ic50最小和amax/ic50最大,因此选择12h 4℃作为酶标板的最佳包被条件。
140.3.3.5最佳封闭时间确定
141.结果如图6中e所示,随着时间增加ic50不断的降低在3h达到最低,而amax/ic50为先上升后下降,在2h时达到最大值,因此选择2h时为最佳封闭时间。
142.3.3.6最佳竞争反应时间确定
143.结果如图6中f所示,随着竞争反应时间延长ic50不断上升而amax/ic50不断下降,在竞争反应时间为45min时amax/ic50最大,因此选择45min为最佳竞争反应时间。
144.3.3.7最佳酶标二抗反应时间的确定
145.结果如图6中g所示,随着酶标二抗反应时间的延长,ic50不断上升而amax/ic50不断下降,在二抗反应时间为30min时amax/ic50最大,因此选择30min为最佳酶标二抗反应时间。
146.3.4猪骨桥蛋白ic-elisa检测方法评价
147.3.4.1 ic-elisa检测方法稳定性测试
148.实验结果如图7所示,含有标准品、一抗、二抗和酶标板的试剂在37℃下保存7天后,发现性能还未发生变化,说明试剂盒稳定性较好。
149.3.4.2 ic-elisa检测方法线性范围及标准曲线的确定
150.建立opn蛋白的ic-elisa抑制竞争曲线。如图8所示,在0.625-32μg/ml范围内,曲线呈现良好的线性关系,其线性方程为y=-0.3158x+1.294,r2=0.9956,ic50为3.14μg/ml,最低检测限为0.027μg/ml。在线性范围内选择0μg/ml、0.625μg/ml、1.25μg/ml、2.5μg/ml、5μg/ml、10μg/ml、20μg/ml、30μg/ml作为标准曲线检测范围。
151.3.4.3 ic-elisa检测方法精密度的确定
152.精密度是衡量检测试剂批内和批间变异的重要指标,在优化好的检测试剂中各浓度的批内变异系数在1.84%-6.38%之间,平均值3.53%,各浓度的批间变异系数在0.44%-7.67%之间,平均值1.72%(表1)。批内和批间变异系数均小于15%,说明建立的ic-elisa检测方法重复性好。
153.表1.ic-elisa标准曲线的批间和批内误差
[0154][0155]
3.4.4准确性检测
[0156]
将骨桥蛋白稀释成低、中、高三个浓度添加到样品中,添加量控制在ic-elisa的线性范围中,每个浓度测定3次,回收率在92.13-102.5%,变异系数为7.52-11.21%(表2)。
[0157]
表2.ic-elisa在精清中添加骨桥蛋白回收率检测
[0158][0159]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述的实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1