抗前列腺特异性蛋白抗体检测试剂盒及其应用
1.本发明涉及生物技术领域,尤其是涉及一种抗前列腺特异性蛋白抗体检测试剂盒及其应用。
背景技术:
2.前列腺癌是男性最常见的肿瘤之一,2018年的国际癌症研究中心数据库数据显示,前列腺癌的发病率在所有肿瘤中占第4位,为7.1%,在男性中发病率达13.5%,病死率达6.7%,是男性死亡率最高的八大肿瘤之一。
3.近年来,研究证实癌症患者产生抗肿瘤相关抗原的血清抗体,肿瘤自身抗体可以间接反应肿瘤细胞表达的特异性抗原,相较肿瘤相关抗原来说,自身抗体的半衰期更长,它在癌症早期阶段即可从微量血清中检测到,在癌症发生转移时也会出现,因此,自身抗体有望用于肿瘤的早期诊断和预测患者预后。前列腺特异性蛋白(prostein),是包含跨膜结构域的一种蛋白,在恶性和良性前列腺分泌细胞中呈点状膜染色或颗粒状染色,并且不受分级的影响,仅使用前列腺特异性蛋白在前列腺来源方面一直非常有效,具有良好的灵敏度和特异性。
4.目前已有研究使用前列腺特异性蛋白检测血样中存在的抗前列腺特异性蛋白抗体,从而辅助诊断前列腺癌,包括前列腺癌的tnm分期和gleason分级。然而现有的前列腺特异性蛋白多为市售或自制蛋白,其制备工艺复杂,难以控制,制备出的前列腺特异性蛋白的灵敏度、特异性较低,无法满足现阶段抗前列腺特异性蛋白抗体的检测需要。
5.有鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种抗前列腺特异性蛋白抗体检测试剂盒及其应用,以解决现有技术存在的抗前列腺特异性蛋白抗体体外检测试剂灵敏度、特异性低的问题。本发明试剂盒采用了由氨基酸序列为seq id no.1的前列腺特异性蛋白多肽1偶联磁珠、氨基酸序列为seq id no.2的前列腺特异性蛋白多肽2偶联磁珠、氨基酸序列为seq id no.3的前列腺特异性蛋白多肽3偶联磁珠混合制得的前列腺特异性蛋白偶联磁珠,进一步提高了检测结果的灵敏度、特异性。
7.为了实现上述目的,本发明采取以下技术方案:
8.在一个方面,本发明提供了一种抗前列腺特异性蛋白抗体检测试剂盒,包括:前列腺特异性蛋白偶联磁珠工作液,其由前列腺特异性蛋白偶联磁珠和缓冲液组成;示踪物标记的抗体工作液,其由示踪物标记的抗人igg抗体和稀释液组成;其中,所述前列腺特异性蛋白偶联磁珠由前列腺特异性蛋白多肽1偶联磁珠、前列腺特异性蛋白多肽2偶联磁珠、前列腺特异性蛋白多肽3偶联磁珠混合制得;所述前列腺特异性蛋白多肽1偶联磁珠中前列腺特异性蛋白多肽1与磁珠的终投料比为1ng/(1g
×
1ml),所述前列腺特异性蛋白多肽1具有如seq id no.1所示的氨基酸序列;所述前列腺特异性蛋白多肽2偶联磁珠中前列腺特异性
蛋白多肽2与所述磁珠的终投料比为0.8ng/(1g
×
1ml),所述前列腺特异性蛋白多肽2具有如seq id no.2所示的氨基酸序列;所述前列腺特异性蛋白多肽3偶联磁珠中前列腺特异性蛋白多肽3与所述磁珠的终投料比为0.7ng/(1g
×
1ml),所述前列腺特异性蛋白多肽3具有如seq id no.3所示的氨基酸序列。
9.与常用的市售前列腺特异性蛋白抗原不同,本发明试剂盒采用由终投料比1ng/(1g
×
1ml)前列腺特异性蛋白多肽1偶联磁珠、0.8ng/(1g
×
1ml)前列腺特异性蛋白多肽2偶联磁珠、0.7ng/(1g
×
1ml)前列腺特异性蛋白多肽3偶联磁珠和缓冲液混合,使得前列腺特异性蛋白上的不同抗原位点暴露更加充分,并且优化了前列腺特异性蛋白多肽1偶联磁珠、前列腺特异性蛋白多肽2偶联磁珠、前列腺特异性蛋白多肽3偶联磁珠在制备过程中的终投料比,经灵敏度、特异性验证,与使用现有的市售前列腺特异性蛋白抗原制备出的试剂盒相比,其抗前列腺特异性蛋白抗体检测的灵敏度、特异性更强。
10.在一个优选的实施方案中,所述前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3的c末端上均修饰有生物素,所述磁珠上修饰有链霉亲和素。
11.因本发明申请中所使用的所述前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3的氨基酸长度均为15或16个氨基酸,在采用生物素修饰后,生物素的空间结构较小,不会影响多肽上抗原位点的暴露,也更利于多肽与磁珠的连接,提升了多肽、磁珠的利用率。若使用其他方式将多肽与磁珠连接,则会出现影响抗原表位暴露、多肽无法连接在磁珠上、多肽利用率低或磁珠利用率低的情况,进而严重影响试剂盒对抗前列腺特异性蛋白抗体检测的灵敏度、特异性。
12.在一个实施方案中,所述前列腺特异性蛋白多肽1偶联磁珠的结构为前列腺特异性蛋白多肽1-生物素-链霉亲和素-磁珠;所述前列腺特异性蛋白多肽2偶联磁珠的结构为前列腺特异性蛋白多肽2-生物素-链霉亲和素-磁珠;所述前列腺特异性蛋白多肽3偶联磁珠的结构为前列腺特异性蛋白多肽3-生物素-链霉亲和素-磁珠。
13.在一个优选实施方案中,所述前列腺特异性蛋白偶联磁珠工作液中所述前列腺特异性蛋白多肽1偶联磁珠:所述前列腺特异性蛋白多肽2偶联磁珠:所述前列腺特异性蛋白多肽3偶联磁珠的质量比例为1:1:1(g:g:g)。
14.本技术中采用了先将不同的前列腺特异性蛋白多肽分别与不同的磁珠偶联,形成不同的前列腺特异性蛋白偶联磁珠,再将不同的前列腺特异性蛋白偶联磁珠以特定终投料比混合形式。较同时将不同的前列腺特异性蛋白多肽在同一液体内与磁珠偶联,磁珠上偶联的前列腺特异性蛋白多肽更加均匀,避免了在同一磁珠上偶联多种前列腺特异性蛋白多肽时出现空间位阻较大、均匀性较差的情况,进一步提升了试剂盒检测结果的灵敏度、特异性。
15.在一个优选实施方案中,所述前列腺特异性蛋白偶联磁珠工作液中所述前列腺特异性蛋白抗偶联磁珠与所述缓冲液比例为1g磁珠/ml缓冲液。
16.在一个优选实施方案中,所述缓冲液为1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.05mg/ml吐温20、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液。
17.在一个实施方案中,所述示踪物为藻红蛋白,所述稀释液为1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.2mg/ml蔗糖、0.08mg/ml proclin300、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液。
no.2所述的前列腺特异性蛋白多肽2偶联至磁珠上。
28.本技术中所述“前列腺特异性蛋白多肽3偶联磁珠”指将氨基酸序列如seq id no.3所述的前列腺特异性蛋白多肽3偶联至磁珠上。
29.本技术中所述“终投料比”指前列腺特异性蛋白多肽与磁珠偶联制备过程中形成的投料比。例如,前列腺特异性蛋白多肽1与磁珠的终投料比为1ng/(1g
×
1ml)表示在单独制备前列腺特异性蛋白多肽1偶联磁珠时,磁珠与前列腺特异性蛋白多肽1的投料后两者真实反应的比例为1ml液体中含有1ng前列腺特异性蛋白多肽与1g磁珠,在将前列腺特异性蛋白多肽1偶联磁珠、前列腺特异性蛋白多肽2偶联磁珠、前列腺特异性蛋白多肽3偶联磁珠混合后,根据比例调节单独制备前列腺特异性蛋白多肽1偶联磁珠的投料比、磁珠加入量、缓冲液量,使得在进行前列腺特异性蛋白多肽1偶联磁珠、前列腺特异性蛋白多肽2偶联磁珠、前列腺特异性蛋白多肽3偶联磁珠混合后,前列腺特异性蛋白偶联磁珠工作液中前列腺特异性蛋白多肽1偶联磁珠的投料比仍保持1ng/(1g
×
1ml)。
30.本技术中“前列腺特异性蛋白多肽1-生物素-链霉亲和素-磁珠”指修饰有生物素的前列腺特异性蛋白多肽1与修饰有链霉亲和素的磁珠反应,生物素与链霉亲和素连接而形成的复合物。
31.本技术中“前列腺特异性蛋白多肽2-生物素-链霉亲和素-磁珠”指修饰有生物素的前列腺特异性蛋白多肽2与修饰有链霉亲和素的磁珠反应,生物素与链霉亲和素连接而形成的复合物。
32.本技术中“前列腺特异性蛋白多肽3-生物素-链霉亲和素-磁珠”指修饰有生物素的前列腺特异性蛋白多肽3与修饰有链霉亲和素的磁珠反应,生物素与链霉亲和素连接而形成的复合物。
33.1.原料:生物素化前列腺特异性蛋白多肽。
34.本发明采用的前列腺特异性蛋白抗原为前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3。前列腺特异性蛋白多肽1的氨基酸序列为seq id no.1,前列腺特异性蛋白多肽2的氨基酸序列为seq id no.2,前列腺特异性蛋白多肽3的氨基酸序列为seq id no.3。前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3的c末端上均修饰有生物素。
35.sflpgpkpgapfpng(seq id no.1)。
36.vgaggsgllppppal(seq id no.2)。
37.gasacdvsvrvvvgep(seq id no.3)。
38.2.制备链霉亲和素磁珠工作液:
39.本实施例中所用磁珠为偶联有链霉亲和素的磁珠。用ph为7.0、浓度为0.05mol/l的磷酸盐缓冲液将磁珠重悬至浓度为1g/ml的磁珠溶液。使用ph为7.0、浓度为0.05mol/l的磷酸盐缓冲液清洗3次,重悬至1g/ml的磁珠溶液。
40.3.制备前列腺特异性蛋白偶联磁珠:
41.将生物素化前列腺特异性蛋白多肽1、生物素化前列腺特异性蛋白多肽2、生物素化前列腺特异性蛋白多肽3与链霉亲和素磁珠工作液均分别按照1.2ng/(1g
×
1ml)、1.1ng/(1g
×
1ml)、1ng/(1g
×
1ml)、0.9ng/(1g
×
1ml)、0.8ng/(1g
×
1ml)、0.7ng/(1g
×
1ml)、0.6ng/(1g
×
1ml)终投料比包被,室温震荡2h后,磁分离吸附去上清,使用相同体积的上述
ph为7.0、浓度为0.05mol/l的磷酸盐缓冲液清洗3次,制得前列腺特异性蛋白偶联磁珠。
42.其中,1ng/(1g
×
1ml)表示平均1ml液中含有1ng生物素化前列腺特异性蛋白多肽与1g链霉亲和素的磁珠,或平均1ml液中含有1g磁珠,磁珠上通过链霉亲和素偶联有1ng生物素化前列腺特异性蛋白多肽。
43.使用含有2mg/ml的牛血清白蛋白、0.005mg/ml proclin 300、ph为0.7,浓度为0.05mol/l的磷酸盐缓冲液将制备的前列腺特异性蛋白偶联磁珠重悬封闭1h。
44.封闭完成后,使用ph为0.7,浓度为0.05mol/l的磷酸盐缓冲液重悬前列腺特异性蛋白偶联磁珠至1g磁珠/ml。
45.按照每个测试使用1g磁珠/ml缓冲液比例配置工作液,所述缓冲液为包含1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.05mg/ml吐温20、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液。
46.4.制备藻红蛋白标记的抗人igg抗体工作液:
47.用含有1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.2mg/ml蔗糖、0.08mg/ml proclin300、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液将藻红蛋白标记的抗人igg抗体稀释到300ng/ml。
48.5.制备样本稀释液:
49.所述0值对照液、样本稀释液为含有1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.05mg/ml吐温20、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液。
50.6.制备空白对照液:
51.所述0值对照液、样本稀释液为含有1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.05mg/ml吐温20、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液。
52.7.抗前列腺特异性蛋白抗体检测试剂盒配制。
53.抗前列腺特异性蛋白抗体检测试剂盒包括:前列腺特异性蛋白偶联磁珠6.5ml/瓶、藻红蛋白标记的抗人igg抗体3.5ml/瓶、空白对照工作液1.0ml/支分装后,组装在一起,保存于2-8℃。
54.在一个实施方案中,可以将待测样品、前列腺特异性蛋白偶联磁珠混合孵育,再加入藻红蛋白标记的抗人igg抗体工作液孵育。当样本中存在抗前列腺特异性蛋白抗体时,则形成磁珠-链霉亲和素-生物素-前列腺特异性蛋白多肽-抗前列腺特异性蛋白抗体-抗人igg抗体复合物,通过抗人igg抗体上藻红蛋白、磁珠上的条码检测样本中的抗前列腺特异性蛋白抗体进行定性或定量分析。
55.一、前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3包被磁珠投料比检测:
56.实验例1.1
57.本实施例采用的前列腺特异性蛋白抗原为前列腺特异性蛋白多肽1。前列腺特异性蛋白多肽1的氨基酸序列为seq id no.1。前列腺特异性蛋白多肽1上修饰有生物素。
58.用ph为7.0、浓度为0.05mol/l的磷酸盐缓冲液将磁珠重悬至浓度为1g/ml的磁珠溶液。使用ph为7.0、浓度为0.05mol/l的磷酸盐缓冲液清洗3次,重悬至1g/ml的磁珠溶液。
59.将生物素化前列腺特异性蛋白多肽1与链霉亲和素磁珠工作液均分别按照1.2ng/(1g
×
1ml)、1.1ng/(1g
×
1ml)、1ng/(1g
×
1ml)、0.9ng/(1g
×
1ml)、0.8ng/(1g
×
1ml)、
0.7ng/(1g
×
1ml)、0.6ng/(1g
×
1ml)终投料比包被,室温震荡2h后,磁分离吸附去上清,使用相同体积的上述ph为7.0、浓度为0.05mol/l的磷酸盐缓冲液清洗3次,制得前列腺特异性蛋白多肽1偶联磁珠。
60.使用含有2mg/ml的牛血清白蛋白、0.005mg/mlproclin 300、ph为0.7,浓度为0.05mol/l的磷酸盐缓冲液将制备的前列腺特异性蛋白偶联磁珠重悬封闭1h。
61.封闭完成后,使用ph为0.7,浓度为0.05mol/l的磷酸盐缓冲液重悬前列腺特异性蛋白偶联磁珠至1g磁珠/ml。
62.按照每个测试使用1g磁珠/ml缓冲液比例配置工作液,所述缓冲液为包含1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.05mg/ml吐温20、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液。
63.用含有1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.2mg/ml蔗糖、0.08mg/ml proclin300、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液将藻红蛋白标记的抗人igg抗体稀释到300ng/ml。
64.所述空白对照液、样本稀释液为含有1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.05mg/ml吐温20、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液。
65.所述空白对照液、样本稀释液为含有1.2mg/ml牛血清白蛋白、0.1mg/ml氯化钠、0.05mg/ml吐温20、ph为7.0、浓度为0.06mol/l的磷酸盐缓冲液。
66.抗前列腺特异性蛋白抗体检测试剂盒包括:前列腺特异性蛋白偶联磁珠6.5ml/瓶、藻红蛋白标记的抗人igg抗体3.5ml/瓶、空白对照工作液1.0ml/支分装后,组装在一起,保存于2-8℃。
67.使用上述制备的抗前列腺特异性蛋白抗体检测试剂盒检测空白、10例患有前列腺癌并血液中含有抗前列腺特异性蛋白抗体的阳性样本、10例未患有前列腺癌的阴性样本,通过化学发光分析系统进行检测。检测过程如下:
68.第一步:化学发光分析系统吸取样本15μl后自动稀释13倍。
69.第二步:取稀释后的样本50μl,加入100μl前列腺特异性蛋白偶联磁珠,37℃孵育15min,孵育后磁分离,清洗3次。
70.第三步:加入50μl藻红蛋白标记的抗人igg抗体,37℃孵育15min,孵育后磁分离,清洗3次。
71.第四步:读取信号值,计算信噪比,抗前列腺特异性蛋白抗体测试结果如表1所示。
72.实验例1.2
73.前列腺特异性蛋白抗原为前列腺特异性蛋白多肽2。前列腺特异性蛋白多肽2的氨基酸序列为seq id no.2。其余条件与实验例1.1相同,抗前列腺特异性蛋白抗体测试结果如表2所示。
74.实验例1.3
75.前列腺特异性蛋白抗原为前列腺特异性蛋白多肽3。前列腺特异性蛋白多肽3的氨基酸序列为seq id no.3。其余条件与实验例1.1相同,抗前列腺特异性蛋白抗体测试结果如表3所示。
76.对比例1
77.前列腺特异性蛋白抗原为市售前列腺特异性蛋白。其余条件与实验例1相同,抗前
列腺特异性蛋白抗体测试结果如表4所示。
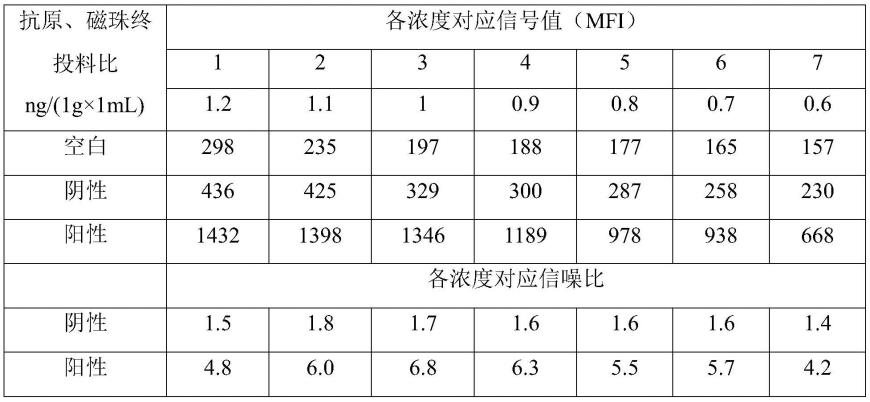
78.表1.实验例1.1前列腺特异性蛋白多肽1包被磁珠终投料比检测
[0079][0080]
表2.实验例1.2前列腺特异性蛋白多肽2包被磁珠终投料比检测
[0081][0082]
表3.实验例1.3前列腺特异性蛋白多肽3包被磁珠终投料比检测
[0083][0084][0085]
表4.对比例1市售前列腺特异性蛋白包被磁珠投料比检测
[0086][0087]
结果分析:
[0088]
因生物素修饰的前列腺特异性蛋白多肽与链霉亲和素修饰的磁珠之间存在解离平衡,且因为磁珠与前列腺特异性蛋白多肽之间不能始终保持充分接触,因此会出现磁珠上偶联前列腺特异性蛋白多肽不均匀、数目差别较大的情况,因此只能在偶联过程解离后计算偶联时的缓冲液中存在的氨基酸量,从而计算出结合在磁珠上的前列腺特异性蛋白多肽量,在忽略少数磁珠上偶联前列腺特异性蛋白多肽较少的情况,计算出的平均前列腺特异性蛋白多肽、磁珠、缓冲液的比例,是表示前列腺特异性蛋白多肽偶联磁珠上抗原偶联量的唯一标准。
[0089]
根据信噪比、信号值综合判断,阳性样本信噪比越高且阴性样本信噪比越低,效果越好。
[0090]
由表1可知前列腺特异性蛋白多肽1包被磁珠的最佳抗原、磁珠投料比为1ng/(1g
×
1ml),阳性样本的信噪比为6.8,阴性样本的信噪比为1.7。使用抗原、磁珠投料比上限为1.1ng/(1g
×
1ml),下限为0.9ng/(1g
×
1ml)。
[0091]
由表2可知前列腺特异性蛋白多肽2包被磁珠的最佳抗原、磁珠投料比为0.8ng/(1g
×
1ml),阳性样本的信噪比为7.0,阴性样本的信噪比为1.7。使用抗原、磁珠投料比上限为0.9ng/(1g
×
1ml),下限为0.7ng/(1g
×
1ml)。
[0092]
由表3可知前列腺特异性蛋白多肽3包被磁珠的最佳抗原、磁珠投料比为0.7ng/(1g
×
1ml),阳性样本的信噪比为6.9,阴性样本的信噪比为1.7。使用抗原、磁珠投料比上限为0.9ng/(1g
×
1ml),下限为0.7ng/(1g
×
1ml)。
[0093]
由表4可知市售前列腺特异性蛋白包被磁珠的最佳抗原、磁珠投料比为0.9ng/(1g
×
1ml),阳性样本的信噪比为4.2,阴性样本的信噪比为1.9。使用抗原、磁珠投料比上限为0.9ng/(1g
×
1ml),下限为0.7ng/(1g
×
1ml)。市售前列腺特异性蛋白的最佳阳性样本的信噪比低于前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3的最差阳性样本的信噪比,表明市售前列腺特异性蛋白的对抗前列腺特异性蛋白抗体的检测性能低于前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2或前列腺特异性蛋白多肽3。
[0094]
二、前列腺特异性蛋白多肽偶联磁珠混合投料比例检测
[0095]
实验例2.1
[0096]
将实验例1.1中的制备的前列腺特异性蛋白多肽1偶联磁珠以投料比为1ng/(1g
×
1ml)用于制备抗前列腺特异性蛋白抗体检测试剂盒。其余条件与实验例1.1相同,使用制备的抗前列腺特异性蛋白抗体试剂盒检测30例阳性样本、30例阴性样本,并根据检测结果计算灵敏度、特异性,测试结果如表5所示。
[0097]
实验例2.2
[0098]
将实验例1.2中的制备的前列腺特异性蛋白多肽2偶联磁珠以投料比为0.8ng/(1g
×
1ml)用于制备抗前列腺特异性蛋白抗体检测试剂盒。其余条件与实验例1.1相同,使用制备的抗前列腺特异性蛋白抗体试剂盒检测30例阳性样本、30例阴性样本,并根据检测结果计算灵敏度、特异性,测试结果如表6所示。
[0099]
实验例2.3
[0100]
将实验例1.3中的制备的前列腺特异性蛋白多肽3偶联磁珠以投料比为0.7ng/(1g
×
1ml)用于制备抗前列腺特异性蛋白抗体检测试剂盒。其余条件与实验例1.1相同,使用制备的抗前列腺特异性蛋白抗体试剂盒检测30例阳性样本、30例阴性样本,并根据检测结果计算灵敏度、特异性,测试结果如表7所示。
[0101]
实验例2.4
[0102]
将实验例1.1中的制备的前列腺特异性蛋白多肽1偶联磁珠以终投料比为1ng/(1g
×
1ml)、实验例1.2中制备的前列腺特异性蛋白多肽2偶联磁珠以终投料比为0.8ng/(1g
×
1ml)混合,制备抗前列腺特异性蛋白抗体检测试剂盒。其余条件与实验例1.1相同,使用制备的抗前列腺特异性蛋白抗体检测试剂盒检测30例阳性样本、30例阴性样本,并根据检测结果计算灵敏度、特异性,测试结果如表8所示。
[0103]
实验例2.5
[0104]
将实验例1.1中的制备的前列腺特异性蛋白多肽1偶联磁珠以终投料比为1ng/(1g
×
1ml)、实验例1.3中制备的前列腺特异性蛋白多肽3偶联磁珠以终投料比为0.7ng/(1g
×
1ml)混合,制备抗前列腺特异性蛋白抗体检测试剂盒。其余条件与实验例1.1相同,使用制备的抗前列腺特异性蛋白抗体检测试剂盒检测30例阳性样本、30例阴性样本,并根据检测结果计算灵敏度、特异性,测试结果如表9所示。
[0105]
实验例2.6
[0106]
将实验例1.2中制备的前列腺特异性蛋白多肽2偶联磁珠以终投料比为0.8ng/(1g
×
1ml)、实验例1.3中制备的前列腺特异性蛋白多肽3偶联磁珠以终投料比为0.7ng/(1g
×
1ml)混合,制备抗前列腺特异性蛋白抗体检测试剂盒。其余条件与实验例1.1相同,使用制备的抗前列腺特异性蛋白抗体检测试剂盒检测30例阳性样本、30例阴性样本,并根据检测结果计算灵敏度、特异性,测试结果如表10所示。
[0107]
实施例1
[0108]
将实验例1.1中的制备的前列腺特异性蛋白多肽1偶联磁珠以终投料比为1ng/(1g
×
1ml)、实验例1.2中制备的前列腺特异性蛋白多肽2偶联磁珠以终投料比为0.8ng/(1g
×
1ml)、实验例1.3中制备的前列腺特异性蛋白多肽3偶联磁珠以终投料比为0.7ng/(1g
×
1ml)混合,制备抗前列腺特异性蛋白抗体检测试剂盒。其余条件与实验例1.1相同,使用制备的抗前列腺特异性蛋白抗体检测试剂盒检测30例阳性样本、30例阴性样本,并根据检测结果计算灵敏度、特异性,测试结果如表11所示。
[0109]
对比例2
[0110]
将实验例1.4中的制备的市售前列腺特异性蛋白偶联磁珠以投料比为0.9ng/(1g
×
1ml)用于制备抗前列腺特异性蛋白抗体检测试剂盒。其余条件与实验例1.1相同,使用制备的抗前列腺特异性蛋白抗体试剂盒检测30例阳性样本、30例阴性样本,并根据检测结果计算灵敏度、特异性,测试结果如表12所示。
[0111]
其中,八种试剂盒对30例阳性样本的检测结果如表13所示,八种试剂盒对30例阴性样本的检测结果如表14所示,各试剂盒的灵敏度、特异性、假阳性、假阴性结果如表15所示。其中“+”表示样本检测结果为阳性,
“‑”
表示样本检测结果为阴性。
[0112]
表5.前列腺特异性蛋白多肽1灵敏度、特异性测试
[0113][0114]
表6.前列腺特异性蛋白多肽2灵敏度、特异性测试
[0115][0116]
表7.前列腺特异性蛋白多肽3灵敏度、特异性测试
[0117][0118]
表8.前列腺特异性蛋白多肽1+多肽2灵敏度、特异性测试
[0119][0120]
表9.前列腺特异性蛋白多肽1+多肽3灵敏度、特异性测试
[0121][0122]
表10.前列腺特异性蛋白多肽2+多肽3灵敏度、特异性测试
[0123][0124]
表11.前列腺特异性蛋白多肽1+多肽2+多肽3灵敏度、特异性测试
[0125][0126]
表12.前列腺特异性蛋白灵敏度、特异性测试
[0127][0128]
表13.八个试剂盒阳性测试结果
[0129]
[0130][0131]
表14.八个试剂盒阴性测试结果
[0132]
[0133][0134]
表15.八个试剂盒灵敏度、特异性、假阳性、假阴性测试结果
[0135][0136]
结果分析:
[0137]
由表15内数据可得,前列腺特异性蛋白多肽1偶联磁珠以终投料比1ng/(1g
×
1ml)、前列腺特异性蛋白多肽2偶联磁珠以终投料比0.8ng/(1g
×
1ml)、前列腺特异性蛋白多肽3偶联磁珠以终投料比0.7ng/(1g
×
1ml)混合制备的抗前列腺特异性蛋白抗体检测试剂盒的灵敏度和特异性均优于市售前列腺特异性蛋白偶联磁珠以投料比为0.9ng/(1g
×
1ml)用于制备抗前列腺特异性蛋白抗体检测试剂盒,假阴性由33.00%降至10.00%,降低了70.0%;假阳性由33.3%降至6.7%,降低了79.9%,灵敏度与特异性有较大提升。
[0138]
发明人推测:前列腺癌患者血液中产生的前列腺特异性蛋白为具有针对于不同抗原表位的抗体混合物(多克隆抗体)。不同个体产生的抗体种类及抗体占比不同。人工合成的前列腺特异性蛋白抗原/基因工程表达的抗原,仅有部分抗原决定簇充分暴露,使用单一抗原进行免疫学检验时极易造成漏检,导致灵敏度低。通过前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3联合使用,尽可能多的涵盖了特异有效的抗原表位。
[0139]
联合使用前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3的灵敏度最高、特异性最强,且保持特异性在90%以上,此时三种抗原的终投料比分别是前列腺特异性蛋白多肽1与磁珠为1ng/(1g
×
1ml)、前列腺特异性蛋白多肽2与磁珠为0.8ng/(1g
×
1ml)、前列腺特异性蛋白多肽3与磁珠为0.7ng/(1g
×
1ml)。
[0140]
因本发明申请中所使用的所述前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3的氨基酸长度均为15或16个氨基酸,在采用生物素修饰后,生物素的空间结构较小,不会影响多肽上抗原位点的暴露,也更利于多肽与磁珠的连接,提升了多肽、磁珠的利用率。若使用其他方式将多肽与磁珠连接,则会出现影响抗原表位暴露、多肽无法连接在磁珠上、多肽利用率低或磁珠利用率低的情况,进而严重影响试剂盒对抗前列腺特异性蛋白抗体检测的灵敏度、特异性。
[0141]
本技术中采用了先将不同的前列腺特异性蛋白多肽分别与不同的磁珠偶联,形成不同的前列腺特异性蛋白偶联磁珠,再将不同的前列腺特异性蛋白偶联磁珠以特定终投料比混合形式。较同时将不同的前列腺特异性蛋白多肽在同一液体内与磁珠偶联,磁珠上偶联的前列腺特异性蛋白多肽更加均匀,避免了在同一磁珠上偶联多种前列腺特异性蛋白多肽时出现空间位阻较大、均匀性较差的情况,进一步提升了试剂盒检测结果的灵敏度、特异性。
[0142]
三、前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3与磁珠终投料比筛选
[0143]
对比例3
[0144]
将前列腺特异性蛋白多肽1与磁珠终投料比、前列腺特异性蛋白多肽2与磁珠终投料比、前列腺特异性蛋白多肽3与磁珠终投料比按照表16中所表述的序号1-9组合进行正交实验,其余过程与实施例1相同。序号1-9组合对应的灵敏度、特异性检测结果如表17-26所示。
[0145]
表16.前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3与磁珠终投料比实验表
[0146][0147][0148]
表17.对比例3组1灵敏度、特异性测试
[0149][0150]
表18.对比例3组2灵敏度、特异性测试
[0151][0152]
表19.对比例3组3灵敏度、特异性测试
[0153][0154]
表20.对比例3组4灵敏度、特异性测试
[0155][0156]
表21.实施例1灵敏度、特异性测试
[0157][0158]
表22.对比例3组6灵敏度、特异性测试
[0159][0160]
表23.对比例3组7灵敏度、特异性测试
[0161][0162]
表24.对比例3组8灵敏度、特异性测试
[0163][0164]
表25.对比例3组9灵敏度、特异性测试
[0165][0166]
表26.前列腺特异性蛋白多肽1+前列腺特异性蛋白多肽2+前列腺特异性蛋白多肽3混合抗原不同终投料比灵敏度、特异性测试结果
[0167][0168][0169]
结果分析:
[0170]
本技术选用的前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3均含有不同的抗原决定簇,三个抗原的抗原决定簇与其对应抗体的结合速率常数恒定且各不相同,单个抗原的浓度水平信号值与信号值水平呈正相关,免疫检测方法学通过信号值与预先设定的临界值的比对来判断检测结果的阴阳性。三个抗原对在人群中抗体的检测存在互补关系。三个抗原在同时混合使用时的终投料比尤为重要。只有在将混合后的抗原检测结果调至信号值水平接近时,三个抗原阳性判定值接近,此时灵敏度、特异性最高。某个抗原浓度相对较低时,会导致仅有该抗原能检出的样本信号值低于临界点,误判为阴性,导致漏检,灵敏度下降。同理当某个抗原浓度相对较高,导致整体样本整体信号值拉高,临界点上移,误判为阳性,结果是错检,特异性下降。
[0171]
因前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3中因一种或多种多肽的投料比过高而出现了假阳性结果的叠加,导致最终检测结果的特异性降低。
[0172]
因前列腺特异性蛋白多肽1、前列腺特异性蛋白多肽2、前列腺特异性蛋白多肽3中因一种或多种多肽的投料比过低而出现了假阴性结果的叠加,导致最终检测结果的灵敏度降低,假阴性出现了不同程度的提升。
[0173]
综合表15与表26可知以前列腺特异性蛋白多肽1与磁珠终投料比1ng/(1g
×
1ml)、前列腺特异性蛋白多肽2与磁珠终投料比0.8ng/(1g
×
1ml)、前列腺特异性蛋白多肽3与磁珠终投料比0.7ng/(1g
×
1ml)为最优组合,此时对抗前列腺特异性蛋白抗体检测的灵敏度和特异性最高,灵敏度为93.3%,特异性为90.0%,假阳性为10.0%,假阴性为6.7%;较市
售前列腺特异性蛋白偶联磁珠以终投料比0.9ng/(1g
×
1ml),假阳性33.3%,假阴性为33.3%,假阳性降低了70.0%、假阴性降低了79.9%,效果显著。
[0174]
本发明利用以前列腺特异性蛋白多肽1与磁珠终投料比1ng/(1g
×
1ml)、前列腺特异性蛋白多肽2与磁珠终投料比0.8ng/(1g
×
1ml)、前列腺特异性蛋白多肽3与磁珠终投料比0.7ng/(1g
×
1ml)替代市售前列腺特异性蛋白偶联磁珠,进一步提高了对不同患者血清的抗前列腺特异性蛋白抗体检测的灵敏度和特异性。
[0175]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1