一种芯片卡、基于该芯片卡的分子互作分析系统及分析方法与流程
1.本发明属于检测技术领域,具体地,涉及一种芯片卡、基于该芯片卡的分子互作分析系统及分析方法;更具体地,涉及一种芯片卡、基于该芯片卡的纳米等离子体共振桌面分子互作分析系统及分析方法。
背景技术:
2.分子相互作用动力学的测量在药物发现、遗传筛查和临床诊断中越来越重要,因为动态结合信息可以提高对疾病的认识从而为治疗提供新思路。
3.表面等离子体共振(spr)传感器,如商业biacore spr生物传感器系统,能够实时监测动力学生物分子相互作用,无需标记,不受大量背景的影响。由于商业biacore spr生物传感器系统属于传统spr设备,所以其需要特制的设备,专人的操作,使得购买或使用该生物传感器系统成本较高。
4.专利文献cn111781370a公开了利用酶标仪及纳米柱状阵列的spr传感器来测定分子结合量的方法,将特异性spr检测芯片置于无底孔板中对标记纳米金颗粒的待测样品进行检测,该方法虽然能够最大限度降低商业化生物传感器复杂的系统和设备要求,然而由于spr芯片置于孔板中,待测样品需加入孔板后进行反应,再使用酶标仪进行检测,使得该检测方法存在如下缺陷:(1)检测时将待测样品加入包被有蛋白的孔板之后再采用酶标仪进行检测,分子间反应很快,待检测时反应已经基本完成,导致不能获取到反应起点的互作信息;(2)采用酶标仪进行检测获取的结果为数值,需要手动处理获取动力学的图谱曲线;(3)该文献使用酶标仪检测时仅测试了分子结合部分,没有测试分子解离部分,其获得的平衡解离常数kd不够准确;同时,如果分子结合和解离部分均测试,分子结合和解离步骤需要分开进行,不能连续进行;(4)采用酶标仪检测时包被蛋白的芯片与含有待测样品的缓冲液混合后静置条件下进行检测,反应速度降低,灵敏度较小。
技术实现要素:
5.针对现有技术的缺陷,本发明的目的在于提供一种用于分子互作分析的芯片卡、该芯片卡的纳米等离子体共振桌面分子互作分析系统及分析方法,以解决现有技术利用酶标仪及纳米柱状阵列的spr传感器来测定分子结合量时存在的分子作用太快不能检测作用起点、结合和解离需要分别测试、操作和数据分析步骤繁琐等的技术问题。
6.为实现上述目的,本发明提供了一种用于分子互作分析的芯片卡,其包含卡片本体、在所述卡片本体表面开设的第一槽体以及在所述第一槽体底部开设的第二槽体;
7.所述第二槽体内沿轴向设置有流体第一传输孔、检测芯片和流体第二传输孔;所述流体第一传输孔和流体第二传输孔为均为穿过所述卡片本体的通孔,且所述流体第一传输孔和流体第二传输孔的孔表面与所述第二槽体底部表面平齐;
8.所述第一槽体内嵌设有透明盖体,且所述透明盖体覆盖在所述第二槽体的表面,使所述第二槽体成为封闭槽体。
9.优选地,所述透明盖体为玻璃、pet膜或亚克力板。
10.优选地,所述卡片本体厚度为5mm-15mm,所述第一槽体开槽深度为1mm-5mm,所述第二槽体开槽深度为0.5mm-1.5mm,所述检测芯片的宽度为35mm-45mm。
11.优选地,所述检测芯片和流体第二传输孔的延长线上还设置有流体第三传输孔,所述流体第三传输孔和所述流体第二传输孔之间还设置有参比芯片,所述流体第三传输孔为穿过所述卡片本体的通孔,且所述流体第三传输孔的孔表面与所述第二槽体底部表面平齐。
12.优选地,所述第二槽体内开设有第一芯片槽和第二芯片槽,所述第一芯片槽用于容纳并固定所述检测芯片,所述第二芯片槽用于容纳并固定所述参比芯片,使得所述检测芯片和参比芯片的表面均与所述第二槽体的底部表面平齐或基本平齐。
13.进一步优选地,所述流体第二传输孔面向所述流体第三传输孔的一侧设置有相对于第二槽体底面突出的凸台,且所述第二槽体侧壁相对于所述凸台位置形成半环状膨出,以使得所述第二槽体形成几字形流体通道。
14.按照本发明的另一个方面,提供了一种基于所述芯片卡的分子互作分析系统,包括光路单元、液路单元、所述的芯片卡以及控制单元;其中:
15.所述光路单元用于为所述芯片卡提供分子互作分析所需的光照,其包括光源、光纤和检测仪;
16.所述液路单元用于为所述芯片卡提供分子互作分析所需的流体通路,在所述流体通路上设置有流体流动动力装置、液体管道和废液收集装置;样品通过流体流动动力装置被输送至液体管道,流经所述芯片卡上的芯片,在所述光路单元提供的光照下,实现分子互作分析检测,废液流入废液收集装置进行收集;所述芯片卡上的芯片为纳米柱状阵列的等离子体共振芯片传感器;
17.所述控制单元为计算机,其通过数据传输线控制所述检测仪和所述光纤,光源发出的光经过所述光纤进入所述芯片卡中的芯片,在芯片处发生等离子共振,所获得的反馈信号经所述检测仪采集信号后传输至所述计算机,由所述计算机对所采集的信号进行分析处理。
18.优选地,所述芯片卡其第二槽体内沿轴向设置有流体第一传输孔、检测芯片和流体第二传输孔;其中所述流体第一传输孔为样品进液孔,所述流体第二传输孔为废液出液孔,在所述流体通路上依次设置有缓冲液储存装置、定量组件、第一多通道阀门、所述芯片卡、流体流动动力装置和废液收集装置;其中所述第一多通道阀门与所述样品进液孔相连接,所述废液出液孔与所述流体流动动力装置相连接。
19.优选地,所述芯片卡其第二槽体内沿着轴向设置有流体第一传输孔、检测芯片、流体第二传输孔、参比芯片和流体第三传输孔;所述流体第一传输孔为样品进液孔,所述流体第二传输孔为废液出液孔,所述流体第三传输孔为第二出液孔,在所述流体通路上依次设置有缓冲液储存装置、定量组件、第一多通道阀门、所述芯片卡、第二多通道阀门、流体流动动力装置和废液收集装置;其中所述第一多通道阀门与所述样品进液孔相连接,所述废液出液孔与所述第二出液孔均与所述第二多通道阀门相连接;使用时,通过切换所述第二多通道阀门的开口方向,利用所述流体流动动力装置提供的动力使废液从所述废液出液孔或所述第二出液孔流出。
20.进一步优选地,所述芯片卡其第二槽体内沿着轴向设置有流体第一传输孔、检测芯片、流体第二传输孔、参比芯片和流体第三传输孔;所述流体第二传输孔为第一样品进液孔,所述流体第三传输孔为第二样品进液孔,所述流体第一传输孔为废液出液孔,在所述流体通路上依次设置有缓冲液储存装置、定量组件、第一多通道阀门、第二多通道阀门、所述芯片卡、流体流动动力装置和废液收集装置;其中所述第一多通道阀门与所述废液出液孔相连接,所述第一样品进液孔与所述第二样品进液孔均与所述第二多通道阀门相连接;使用时,通过切换所述第二多通道阀门的开口方向,利用所述流体流动动力装置提供的动力使样品从所述第一样品进液孔或所述第二样品进液孔进入。
21.按照本发明的另一个方面,提供了一种利用所述的分析系统进行分子互作分析的方法,包括如下步骤:
22.(1)通过所述第一多通道阀门的注射口将用于活化羧基化芯片的活化液注射至所述定量组件内,切换所述第一多通道阀门的开口方向,使所述活化液随缓冲液从所述流体第一传输孔进入所述芯片卡并流经所述检测芯片,所述检测芯片为羧基化检测芯片,以实现对所述羧基化检测芯片的活化;利用所述流体流动动力装置提供的动力使活化过程产生的废液从所述废液出液孔流出至废液收集装置,得到活化的羧基化检测芯片;
23.(2)通过所述第一多通道阀门的进样口将第一分子样品注射至所述定量组件内,切换所述第一多通道阀门的开口方向,使第一分子随所述缓冲液从所述流体第一传输孔进入所述芯片卡并流经所述活化的羧基化检测芯片,实现所述第一分子在所述检测芯片上的固定;利用所述流体流动动力装置提供的动力使固定过程产生的废液从所述流体第二传输孔流出至废液收集装置;得到固定有第一分子的检测芯片;
24.(3)通过所述第一多通道阀门的进样口将第二分子样品注射至所述定量组件内,切换所述第一多通道阀门的开口方向,使第二分子随所述缓冲液从所述流体第一传输孔进入所述芯片卡并流经所述固定有第一分子的检测芯片,在所述光路单元提供的光照下使所述第二分子与固定在所述检测芯片上的第一分子相互作用;利用所述流体流动动力装置提供的动力使检测废液从所述流体第二传输孔流出至所述废液收集装置。
25.按照本发明的另一个方面,提供了一种利用所述的分析系统进行分子互作分析的方法,包括如下步骤:
26.(1)通过所述第一多通道阀门的注射口将用于活化羧基化芯片的活化液注射至所述定量组件内,切换所述第一多通道阀门的开口方向,使所述活化液随所述缓冲液从所述流体第一传输孔进入所述芯片卡并依次流经羧基化检测芯片和羧基化参比芯片,以实现对所述羧基化检测芯片和羧基化参比芯片的活化;切换所述第二多通道阀门的开口方向,利用所述流体流动动力装置提供的动力使活化过程产生的废液从所述流体第三传输孔流出至废液收集装置,得到活化的羧基化检测芯片和活化的羧基化参比芯片;
27.(2)通过所述第一多通道阀门的注射口将第一分子样品注射至所述定量组件内,切换所述第一多通道阀门的开口方向,使第一分子随所述缓冲液从所述流体第一传输孔进入所述芯片卡并流经所述活化的羧基化检测芯片,实现所述第一分子在所述检测芯片上的固定;利用所述流体流动动力装置提供的动力使固定过程产生的废液从所述流体第二传输孔流出至废液收集装置;
28.(3)通过所述第一多通道阀门的注射口将第二分子样品注射至所述定量组件内,
切换所述第一多通道阀门的开口方向,使第二分子随所述缓冲液从所述流体第一传输孔进入所述芯片卡并依次流经所述固定有第一分子的检测芯片和所述活化的羧基化参比芯片,在所述光路单元提供的光照下使所述第二分子与固定在所述检测芯片上的第一分子相互作用;切换所述第二多通道阀门的开口方向,利用所述流体流动动力装置提供的动力使检测废液从所述流体第三传输孔流出至废液收集装置。
29.按照本发明的另一个方面,提供了一种利用所述的分析系统进行分子互作分析的方法,包括如下步骤:
30.(1)通过所述第一多通道阀门的注射口将用于活化羧基化芯片的活化液注射至所述定量组件内,切换所述第一多通道阀门的开口方向,使所述活化液随所述缓冲液从所述流体第三传输孔进入所述芯片卡并依次流经羧基化参比芯片和羧基化检测芯片,以实现对所述羧基化参比芯片和羧基化检测芯片的活化;切换所述第二多通道阀门的开口方向,利用所述流体流动动力装置提供的动力使活化废液从所述流体第一传输孔流出至废液收集装置,得到活化的羧基化检测芯片和活化的羧基化参比芯片;
31.(2)通过所述第一多通道阀门的注射口将第一分子样品注射至所述定量组件内,切换所述第一多通道阀门的开口方向,使第一分子随所述缓冲液从所述流体第二传输孔进入所述芯片卡并流经所述活化的羧基化检测芯片,实现所述第一分子在所述检测芯片上的固定;利用所述流体流动动力装置提供的动力使固定过程产生的废液从所述流体第一传输孔流出至废液收集装置;
32.(3)通过所述第一多通道阀门的进样口将第二分子样品注射至所述定量组件内,切换所述第一多通道阀门的开口方向,使第二分子随所述缓冲液从所述流体第三传输孔进入所述芯片卡并依次流经所述活化的羧基化参比芯片和所述固定有第一分子的检测芯片;在所述光路单元提供的光照下使所述第二分子与固定在所述检测芯片上的第一分子相互作用;利用所述流体流动动力装置提供的动力使检测废液从所述第一流体传输孔流出至废液收集装置。
33.总体而言,通过本发明所构思的以上技术方案与现有技术相比,具有以下有益效果:
34.(1)本发明提供的一种用于纳米等离子体共振桌面分子互作分析的芯片卡,包含卡片本体、在所述卡片本体表面开设的第一槽体以及在所述第一槽体底部开设的第二槽体;所述第二槽体内沿轴向设置有样品进液孔、检测芯片和废液出液孔。第一槽体内嵌设有透明盖体,且所述透明盖体覆盖在所述第二槽体的表面,使得所述第二槽体成为封闭槽体。本发明芯片卡的设计能够避免检测液体样品在芯片卡中流动时漏液,稳定性较好。
35.(2)本发明优选实施例中提供的用于纳米等离子体共振桌面分子互作分析的芯片卡,其可以为单通道检测芯片卡,也可以为在单通道检测基础上增设参比芯片的双通道检测芯片卡,通过增设参比芯片,可以扣除分子互作分析检测过程中的背景噪音,降低芯片的非特异性吸附。本发明还可以根据需要在上述单通道、双通道检测芯片卡的基础上,重复设置多个,以获得多个检测通道,以满足不同浓度样品的同步检测需求。
36.(3)本发明优选实施例中提供的双通道芯片卡,其在芯片卡的废液出液孔面向第二出液孔的一侧设置有相对于第二槽体底面突出的凸台,且所述第二槽体侧壁相对于所述凸台位置形成半环状膨出,以使得所述第二槽体形成几字形流体通道,如此特别的设计能
够很好地避免第一步在检测芯片上包被第一分子比如固定蛋白分子时,样品溶液扩散至参比芯片表面而污染参比芯片,确保双通道检测过程中参比芯片正常发挥作用。
37.(4)本发明提出的基于上述芯片卡的纳米等离子体共振桌面分子互作分析系统包括光路单元、液路单元、控制单元和本发明提出的芯片卡,只需要按照特定的连接方式将各组件有序连接好,按照既定的分析步骤,先后通过六通阀定量环注入样品,在泵压下有序进行第一分子的固定和第一、第二分子的互作分析,可以实时、准确、完整地检测第一分子和第二分子的相互作用动力学过程,且整个系统结构简单,搭建容易,便携且成本较低。
38.(5)本发明较佳实施例中,对于采用包含双通道芯片卡的分析系统,通过优化进样方式进一步提高检测精度。比如通过从双通道芯片卡的中央流体传输孔输送用于固定的配体溶液,在检测芯片上固定配体分子,从最左侧的流体传输孔排出固定废液;然后再从最右侧的流体传输孔中输送第二分子样品溶液,从最左侧的流体传输孔排出废液,就可以完全避免第一步固定配体分子过程中残留的配体溶液污染参比芯片,提高检测结果准确度。
39.(6)本发明基于特定结构的芯片卡设计,并搭建包含光路单元、液路单元和控制单元的分析系统,光源发出的光经过光纤传输至芯片卡中的芯片表面,在芯片处发生等离子共振,所获得的反馈信号经过光纤传入检测仪,由检测仪采集信号后经过处理后传输至计算机,由计算机对所采集的信号进行分析处理并显示,相对于酶标仪及纳米柱状阵列的spr传感器来测定分子结合量的方法,能够实时获取完整的分子互作信息,包括平衡、结合、解离和再生的完整动力学结合解离检测和模拟过程,结果可靠、准确、灵敏度高。
附图说明
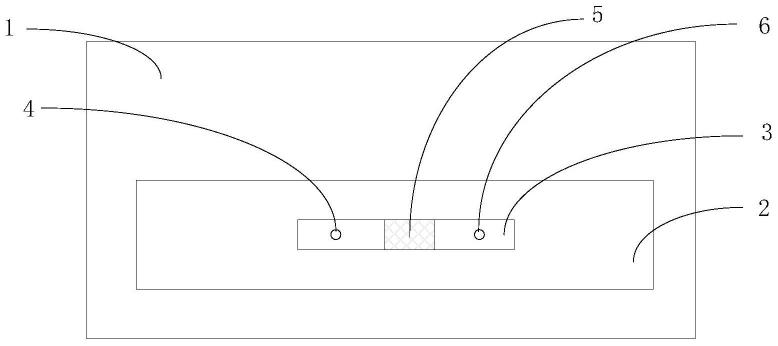
40.图1为本发明一些实施例中单通道芯片卡的主视图;
41.图2为图1中单通道芯片卡的侧视图;
42.图3为本发明一些实施例中双通道芯片卡的主视图;
43.图4为图3中双通道芯片卡的侧视图;
44.图5为本发明另一些实施例中双通道芯片卡的主视图;
45.图6为图5中双通道芯片卡的侧视图;
46.图7为本发明一些实施例中基于单通道芯片卡的纳米等离子体共振桌面分子互作分析系统;
47.图8为本发明一些实施例中基于双通道芯片卡的纳米等离子体共振桌面分子互作分析系统;
48.图9为本发明另一些实施例中基于双通道芯片卡的纳米等离子体共振桌面分子互作分析系统;
49.图10为实施例1窄光谱检测不同蔗糖浓度的全光谱图;
50.图11为实施例1宽光谱检测不同蔗糖浓度的全光谱图;
51.图12为实施例1窄光谱在660nm与600nm光强的差值与宽光谱在620nm与610nm光强的差值的对比;
52.图13为实施例2检测protein a与igg的动力学相互作用,其检测过程典型图谱;
53.图14为实施例2检测protein a与igg的动力学相互作用,两者的动力学结合解离检测及模拟过程;
54.图15为实施例2采用protein a芯片对igg的检测线性r2拟合结果;
55.图16为实施例3检测fcrn与igg的动力学相互作用,两者的动力学结合解离模拟过程;
56.在所有附图中,相同的附图标记用来表示相同的元件或结构,其中:
57.1-卡片本体;2-第一槽体;3-第二槽体;4-流体第一传输孔;5-检测芯片;6-流体第二传输孔;7-流体第三传输孔;8-参比芯片;9-凸台;10-半环状膨出;11-缓冲液储存装置;12-定量组件;13-第一多通道阀门;14-流体流动动力装置;15-废液收集装置;16-第二多通道阀门;17-光源;18-光纤;19-检测仪;20-计算机;21-光纤探头;22-光波。
具体实施方式
58.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
59.针对利用酶标仪及纳米柱状阵列的spr传感器来测定分子结合量的方法存在的不能检测起点、结合和解离需要分开检测、不能直接获取动力学曲线图谱。的技术缺陷,本发明提出利用检测仪比如光谱仪及纳米柱状阵列的spr传感器(以下缩写为nanospr)来测定分子结合量,然而,在具体实验过程中,如何将光谱仪与nanospr传感器进行连接以实现实时检测,如何将芯片固定在流道中以及如何确保流体流动过程中不漏液,双通道检测时固定蛋白分子过程中如何避免含有蛋白的溶液扩散污染参比芯片等,都是需要克服的技术难题。比如商用openspr传感器通过玻璃片芯片加速pdms压合密封方法,稳定性不好且也容易漏液。
60.针对上述缺陷,本发明提出了一种用于分子互作分析的芯片卡及基于该芯片卡的纳米等离子体共振桌面分子互作分析系统。如图1和图2所示,一些实施例中,一种用于分子互作分析的芯片卡,其包含卡片本体1、在所述卡片本体1表面开设的第一槽体2以及在所述第一槽体2底部开设的第二槽体3;所述第一槽体2可以为各种形状,包括但不限于为矩形槽体。所述第二槽体3实际上是用来供样品溶液流动的通道,可以根据需要开设为各种形状的槽体,包括但不限于为长条状矩形体。
61.所述第二槽体3内沿着轴向设置有流体第一传输孔4、检测芯片5和流体第二传输孔6;所述流体第一传输孔4和流体第二传输孔6为均为穿过所述卡片本体1的通孔,且所述流体第一传输孔4和流体第二传输孔6的孔外围表面与所述第二槽体3底部表面平齐。
62.所述第一槽体2内嵌设有透明盖体(图中未示意出),且所述透明盖体覆盖在所述第二槽体3的表面,使得所述第二槽体3成为封闭槽体,以防止流体流出,一些实施例中,所述透明盖体为玻璃、pet膜或亚克力板;所述透明盖体面向所述第二槽体的表面本身具有亲水性或经亲水处理使之面向所述第二槽体的表面具有亲水性,具有亲水性的透明盖体其亲水性能够促进流体扩散,以确保样品溶液自流体第一传输孔4进入所述第二槽体3后能够迅速在该第二槽体3内均匀平铺,确保检测芯片5表面溶液覆盖均匀,确保芯片表面物质均匀作用。
63.一些实施例中,第一槽体2内嵌设的透明盖体的大小与第一槽体开槽面积的大小相同,且大于第二槽体的开槽面积,覆盖在所述第二槽体3的表面,使得所述第二槽体3成为
封闭槽体,能够较好地防止流体流出。较佳地,透明盖体的厚度与第一槽体的开槽深度相同,这样芯片卡整体表面为一个平面。
64.为了确保分子互作分析反应的顺利进行,一些较佳实施例中,所述卡片本体厚度为5mm-15mm,所述第一槽体开槽深度为1mm-5mm,所述第二槽体开槽深度为0.5mm-1.5mm,检测芯片的宽度(垂直于轴向方向上的宽度)为35mm-45mm。
65.另一些实施例中,如图3和图4所示,第二槽体3内所述检测芯片5和流体第二传输孔6的延长线上还设置有流体第三传输孔7,所述流体第三传输孔7和所述流体第二传输孔之间还设置有参比芯片8,所述流体第三传输孔7为穿过所述卡片本体1的通孔,且所述流体第三传输孔7的孔外围表面与所述第二槽体3底部表面平齐。所述参比芯片8的设置用于为分子互作分析检测提供参比数据或曲线扣除背景噪音以降低芯片的非特异性吸附。同时设置检测芯片和参比芯片的芯片卡,本发明中称之为双通道检测芯片卡,仅设置检测芯片的芯片卡称之为单通道芯片卡。
66.为了避免样品溶液从流体第一传输孔4进入第二槽体后,溶液流经至检测芯片5以及参比芯片8有阻力,一些实施例中,在所述第二槽体内开设有第一芯片槽和第二芯片槽(图中未示意出),所述第一芯片槽用于容纳并固定所述检测芯片5,所述第二芯片槽用于容纳并固定所述参比芯片8,使得所述检测芯片5和参比芯片8的表面均与所述第二槽体3的底部表面平齐或基本平齐。
67.进一步地,由于采用双通道检测即本发明芯片卡中同时设置检测芯片和参比芯片时,在第一步固定第一分子比如固定配体分子步骤中,只有检测芯片需要固定配体分子,参比芯片不需要固定配体分子,为了避免样品溶液扩散至参比芯片上,一些优选实施例中,所述流体第二传输孔6面向流体第三传输孔7的一侧设置有相对于第二槽体3底面突出的凸台9,且所述第二槽体3侧壁相对于所述凸台9位置形成半环状膨出10,以使得所述第二槽体3形成几字形流体通道。这样当用于为检测芯片5固定配体分子的溶液自流体第一传输孔4进入后,逐步流经至检测芯片5然后至流体第二传输孔6时,由于凸台9的阻挡作用,实验证明能够很好地阻挡样品溶液进一步扩散至参比芯片8一侧,导致参比芯片8被污染。
68.图2、图4和图6分别为图1、图3和图5三种芯片卡的侧视图,图中示意出流体第一传输孔4、流体第二传输孔6和流体第三传输孔7均为相对于卡片本体1底部凸出设置,便于连接液体管路。
69.本发明还提供了一种基于所述芯片卡的分子互作分析系统,包括光路单元、液路单元、所述的芯片卡以及控制单元;如图7、图8和图9所示,其中:
70.所述光路单元用于为所述芯片卡提供分子互作分析所需的光照,其包括光源17、光纤18和检测仪19;本发明利用纳米等离子体共振芯片对分子的相互作用进行测试,其采用的光源只要能够提供光波均可,包括但不限于为钨灯光源或led灯;光纤可以为反射光纤或透射光纤;所述检测仪用于对芯片表面分子互作进行检测,包括但不限于为光谱仪或光电检测仪(比如pd检测器)等。
71.所述液路单元用于为所述芯片卡提供分子互作分析所需的流体通路,其包括流体流动动力装置、液体管道和废液收集装置;样品通过流体流动动力装置传送至液体管道,流经所述芯片卡上的芯片,在所述光路单元提供的光照下,实现分子互作分析检测,废液流入废液收集装置进行收集;所述芯片卡上的芯片为纳米柱状阵列的等离子体共振芯片传感
器。
72.所述控制单元为计算机20,光源17和光纤18相连接,光纤与18与检测仪19相连接,检测仪19与计算机20相连接。计算机20通过数据传输线控制所述检测仪19,光源17发出的光经过光纤18(经光纤探头21发出的光波22)传输至所述芯片卡中的芯片表面,在芯片处发生等离子共振,所获得的反馈信号经过光纤17传入检测仪19,由所述检测仪19采集信号后经过处理后传输至所述计算机20,由所述计算机对所采集的信号进行分析处理并显示。
73.本发明提供的芯片卡设计不仅可以满足单通道分子互作分析要求,也能够满足双通道分子互作分析要求。双通道分子互作分析相对于单通道分子互作分析,在芯片卡上增设了参比芯片,通过设置参比芯片,在检测芯片的基础上可以扣除参比芯片背景噪音以降低芯片的非特异性吸附。
74.一些实施例中,如图7所述,采用单通道芯片卡,芯片卡的结构示意图如图1和图2所示,所述芯片卡其第二槽体内沿轴向设置有流体第一传输孔4、检测芯片5和流体第二传输孔6;其中所述流体第一传输孔4为样品进液孔,所述流体第二传输孔6为废液出液孔,在所述流体通路上依次设置有缓冲液储存装置11、定量组件12、第一多通道阀门13、所述芯片卡、流体流动动力装置14和废液收集装置15;其中所述第一多通道阀门13与所述样品进液孔(流体第一传输孔4)相连接,所述废液出液孔(流体第二传输孔6)与所述流体流动动力装置14相连接。
75.另一些实施例中,所述芯片卡增设了参比芯片,本发明称之为双通道芯片卡,以图3、图4、图5和图6所示的双通道芯片卡为例,包含该芯片卡的分析系统中,所述芯片卡其第二槽体内沿着轴向设置有流体第一传输孔4、检测芯片5、流体第二传输孔6、参比芯片8和流体第三传输孔7;所述流体第一传输孔4为样品进液孔,所述流体第二传输孔6为废液出液孔,所述流体第三传输孔7为第二出液孔,如图8所示,在所述流体通路上依次设置有缓冲液储存装置11、定量组件12、第一多通道阀门13、所述芯片卡、第二多通道阀门16、流体流动动力装置14和废液收集装置15;其中所述第一多通道阀门13与所述样品进液孔相连接,所述废液出液孔与所述第二出液孔均与所述第二多通道阀门16相连接,使用时,通过切换所述第二多通道阀门的开口方向,利用所述流体流动动力装置14提供的动力使废液从所述废液出液孔或所述第二出液孔流出。
76.采用上述基于双通道芯片卡的分子互作分析系统,可以通过选择设置废液出口通道,来根据需要实现单通道或双通道的分子互作分析需求。
77.采用本发明分析系统进行分子互作时,与通常采用nanospr芯片进行分子互作分析流程类似,一般先将芯片进行羧基化处理,然后采用活化液对羧基化芯片进行活化,再在活化后的羧基化芯片上固定第一分子(比如配体),然后在使第二分子与第一分子在光照条件下相互作用,借助于该分析系统获取分析结果。
78.一些实施例中,将nanospr芯片浸入50mm 3-mpa中于4℃过夜,使芯片表面羧基化,然后将羧基化芯片储存在pbs缓冲液中于4℃条件下备用。将羧基化芯片粘贴在芯片卡上并组装至检测系统中进行检测。通过第一多通道阀门的进样口注射活化液edc/nhs(400mm/100mm)混合物至定量组件内,切换所述第一多通道阀门的开口方向,使该混合物从流体第一传输孔流入并流经检测芯片和参比芯片使芯片羧基活化,然后从流体第三传输孔流出至废液收集装置,流速为10μl/min。
79.具体地,利用如图7所示的单通道芯片卡搭建分析系统,进行第一分子和第二分子的互作分析方法,包括如下步骤:
80.(1)通过所述第一多通道阀门13的注射口将用于活化羧基化芯片的活化液注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使所述活化液随缓冲液从所述流体第一传输孔4进入所述芯片卡并流经所述检测芯片5,所述检测芯片5为羧基化检测芯片,以实现所述羧基化检测芯片的活化;利用所述流体流动动力装置14提供的动力使活化过程产生的废液从所述废液出液孔即流体第二传输孔流出至废液收集装置15,得到活化的羧基化检测芯片;
81.(2)通过所述第一多通道阀门13的进样口将第一分子样品注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使第一分子随所述缓冲液从所述流体第一传输孔4进入所述芯片卡并流经所述活化的羧基化检测芯片,实现所述第一分子在所述检测芯片5上的固定;利用所述流体流动动力装置14提供的动力使固定过程产生的废液从所述流体第二传输孔6流出至废液收集装置15,得到固定有第一分子的检测芯片;
82.(3)通过所述第一多通道阀门13的进样口将第二分子样品注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使第二分子随所述缓冲液从所述流体第一传输孔4进入所述芯片卡并流经所述固定有第一分子的检测芯片,使所述第二分子与固定在所述检测芯片上的第一分子相互作用;利用所述流体流动动力装置14提供的动力使检测废液从所述流体第二传输孔流出至所述废液收集装置。
83.一些实施例中,上述步骤(2)和步骤(3)之间还包括步骤:
84.(2.5)通过所述第一多通道阀门13的进样口将用于封闭芯片的封闭溶液注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使所述封闭溶液随所述缓冲液从所述流体第一传输孔4进入所述芯片卡并流经所述固定有第一分子的检测芯片,以封闭所述检测芯片;利用所述流体流动动力装置14提供的动力使封闭废液从所述流体第二传输孔流出至所述废液收集装置。
85.利用上述双通道芯片卡搭建如图8所示的分析系统,进行第一分子和第二分子的互作分析方法,包括如下步骤:
86.(1)通过所述第一多通道阀门13的注射口将用于活化羧基化芯片的活化液注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使所述活化液随所述缓冲液从所述流体第一传输孔4进入所述芯片卡并依次流经羧基化检测芯片5和羧基化参比芯片8,以实现所述羧基化检测芯片和羧基化参比芯片的活化;切换所述第二多通道阀门16的开口方向,利用所述流体流动动力装置14提供的动力使活化过程产生的废液从所述流体第三传输孔7流出至废液收集装置15,得到活化的羧基化检测芯片和活化的羧基化参比芯片;
87.(2)通过所述第一多通道阀门13的注射口将第一分子样品注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使第一分子随所述缓冲液从所述流体第一传输孔4进入所述芯片卡并流经所述活化的羧基化检测芯片,实现所述第一分子在所述检测芯片上的固定;利用所述流体流动动力装置14提供的动力使固定过程产生的废液从所述流体第二传输孔6流出至废液收集装置15;
88.(3)通过所述第一多通道阀门13的注射口将第二分子样品注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使第二分子随所述缓冲液从所述流体第一传
输孔4进入所述芯片卡并依次流经所述固定有第一分子的检测芯片5和所述活化的羧基化参比芯片8,使所述第二分子与固定在所述检测芯片上的第一分子相互作用;切换所述第二多通道阀门16的开口方向,利用所述流体流动动力装置14提供的动力使检测废液从所述流体第三传输孔7流出至废液收集装置。
89.一些实施例中,上述步骤(2)和步骤(3)之间还包括步骤:
90.(2.5)通过所述第一多通道阀门13的注射口将用于封闭芯片的封闭溶液注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使所述封闭溶液随所述缓冲液从所述流体第一传输孔4进入所述芯片卡并依次流经所述固定有第一分子的检测芯片5和所述活化的羧基化参比芯片8,以封闭所述检测芯片和参比芯片;切换所述第二多通道阀门16的开口方向,利用所述流体流动动力装置14提供的动力使封闭废液从所述流体第三传输孔7流出至废液收集装置。
91.为了尽可能避免固定配体分子过程中残留的配体溶液污染参比芯片,更优选实施例中,仍然以采用图5和图6所示的双通道芯片卡为例,其对应的分析系统要求从流体第二传输孔输送配体溶液,从流体第一传输孔排出废液,具体地,所述芯片卡其第二槽体内沿着轴向设置有流体第一传输孔、检测芯片、流体第二传输孔、参比芯片和流体第三传输孔;所述流体第二传输孔为第一样品进液孔,所述流体第三传输孔为第二样品进液孔,所述流体第一传输孔为废液出液孔,如图9所示,在所述流体通路上依次设置有缓冲液储存装置11、定量组件12、第一多通道阀门13、第二多通道阀门16、所述芯片卡、流体流动动力装置15和废液收集装置15;其中所述第一多通道阀门13与第二多通道阀门16相连接,第二多通道阀门16与所述第一样品进液孔和所述第二样品进液孔相连接,使用时,通过切换所述第二多通道阀门16的开口方向,利用所述流体流动动力装置14提供的动力使样品从所述第一样品进液孔或所述第二样品进液孔进入。
92.采用如图9所示的分析系统进行分子互作分析时,包括如下步骤:
93.(1)通过所述第一多通道阀门13的注射口将用于活化羧基化芯片的活化液注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使所述活化液随所述缓冲液从所述流体第三传输孔7进入所述芯片卡并依次流经羧基化参比芯片8和羧基化检测芯片5,以实现所述羧基化参比芯片和羧基化检测芯片的活化;切换所述第二多通道阀门16的开口方向,利用所述流体流动动力装置15提供的动力使活化废液从所述流体第一传输孔4流出至废液收集装置,得到活化的羧基化检测芯片和活化的羧基化参比芯片;
94.(2)通过所述第一多通道阀门13的注射口将第一分子样品注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使第一分子随所述缓冲液从所述流体第二传输孔6进入所述芯片卡并流经所述活化的羧基化检测芯片,实现所述第一分子在所述检测芯片上的固定;利用所述流体流动动力装置14提供的动力使固定过程产生的废液从所述流体第一传输孔4流出至废液收集装置15;
95.(3)通过所述第一多通道阀门13的进样口将第二分子样品注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使第二分子随所述缓冲液从所述流体第三传输孔7依次流经所述活化的羧基化参比芯片和所述固定有第一分子的检测芯片;在所述光路单元提供的光照下使所述第二分子与固定在所述检测芯片上的第一分子相互作用;利用所述流体流动动力装置14提供的动力使检测废液从所述第一流体传输孔4流出至废液收集
装置15。
96.一些实施例中,上述步骤(2)和步骤(3)之间还包括步骤:
97.(2.5)通过所述第一多通道阀门13的进样口将用于封闭芯片的封闭溶液注射至所述定量组件12内,切换所述第一多通道阀门13的开口方向,使所述封闭溶液随所述缓冲液从所述流体第三传输孔7依次流经所述活化的羧基化参比芯片和所述固定有第一分子的检测芯片,以封闭所述参比芯片和检测芯片;利用所述流体流动动力装置14提供的动力使封闭废液从所述第一流体传输孔4流出至废液收集装置15。
98.本发明一些实施例中,所述缓冲液储存装置11为缓冲液瓶,用于盛放缓冲液;所述定量组件12可以为各种定量注入样品的组件,包括但不限于为定量环;所述第一多通道阀门13能够通过切换多通道开口,调控流体流通路径,可以为三通阀、六通阀等;所述流体流动动力装置14用于为流体流动提供动力,包括但不限于为蠕动泵、注射泵或高压泵等;通过对泵的弹性输送软管交替进行挤压和释放来泵送流体,通过控制泵送过程中合适的交替挤压释放速度来控制流体的流量。所述废液收集装置15用于收集废液。
99.一些实施例中,本发明分析系统在检测芯片上固定第一分子后,在通入第二分子进行检测之前,还对检测芯片和参比芯片进行封闭,以降低芯片的非特异性吸附,一些实施例中,用于封闭芯片的封闭溶液为酪蛋白的pbs溶液。
100.根据本发明芯片卡及分析系统设计思路,可根据需要设置单通道、双通道或其它任意多通道芯片卡,比如可在芯片卡上开设多条第二槽体,复制第二槽体的结构,配合设置液体流路,可以同时实现多种不同浓度的分子互作分析。
101.本发明采用的检测芯片和参比芯片为纳米柱状阵列的等离子体共振(nano-spr)芯片传感器,该芯片传感器可采用复制成形工艺制作,其中,利用激光干涉光刻在石英基板上制作纳米柱状阵列图案,然后将紫外光固化聚合物(例如noa-61)均匀散布在模具上,顶部以聚对苯二甲酸乙二醇酯支撑;用紫外光进行固化处理,然后将聚对苯二甲酸乙二醇酯基板连同周期性纳米孔道图案从模具上剥除;通过电子束蒸发沉积形成一个钛粘附层、一个银层和一个黄金层,以实现等离激元器件成形。本发明实施例中具体芯片结构和制备可参考专利文献cn111781370a。以下实施例中检测芯片和参比芯片中钛黏附层、黄金层和二氧化钛谐振腔层的厚度分别是16nm、220nm和180nm,固化处理的时间为3分钟。
102.本发明提供的芯片卡、基于该芯片卡的纳米等离子体共振桌面分子互作分析系统及分析方法可用于实时监测动力学生物分子相互作用,包括但不限于蛋白质与蛋白质,蛋白质与核酸,蛋白与小分子,核酸与小分子,核酸与核酸等相互作用的分析。本发明以下实施例中通过检测protein a与igg的亲和力并对igg进行线性检测来验证本发明提出的芯片卡以及基于该芯片卡的纳米等离子体共振分子互作分析系统的可行性。
103.实施例1
104.采用不同浓度的蔗糖对比窄光谱与宽光谱
105.1、实验过程
106.用超纯水将蔗糖稀释成不同的浓度(0~60%),分别注射入如图7所示的检测系统中,其中芯片卡结构示意图如图1和图2所示,缓冲液采用蠕动泵动力装置,切换第一多通道阀门即六通阀的开口方向,利用泵压使不同浓度蔗糖溶液随缓冲液从流体第一传输孔进入芯片卡,流经芯片,废液从流体第二传输孔流出至废液瓶;并分别用窄光谱(波长范围
400nm-800nm)与宽光谱(波长范围200nm-1100nm)进行检测。
107.2、检测结果
108.图10为窄光谱检测不同蔗糖浓度的全光谱图,结果显示,该芯片的灵敏度很高。图11为宽光谱检测不同蔗糖浓度的全光谱图,结果显示,该芯片的灵敏度很高。图12为窄光谱在660nm与600nm光强的差值与宽光谱在620nm与610nm光强的差值的对比,结果显示窄光谱效果更好,因此选择窄光谱检测仪进行检测。
109.实施例2
110.蛋白a(protein a)与免疫球蛋白g(igg)的平衡亲和力常数kd111.实验材料:
112.鼠抗人igg:北京索莱宝科技有限公司
113.protein a:北京义翘神州科技股份有限公司
114.nanospr one组件包括钨灯光源(杭州赛曼科技有限公司,220609w132),光谱仪(广州常晖电子科技有限公司,chs-3000),光纤(广州常晖电子科技有限公司,ch-ir-05m),六通阀,三通阀,塑料管,纳米等离子体芯片,蠕动泵。
115.采用如图5和图6所示的芯片卡,其中卡片本体厚度为8mm,所述第一槽体开槽深度为2mm,所述第二槽体开槽深度为1mm,检测芯片的宽度(垂直于轴向方向上的宽度)为40mm,透明盖体为具有亲水性的亚克力板,厚度与第一槽体开槽深度相同,大小与第一槽体内部截面大小相同,嵌设在第一槽体内,覆盖在第二槽体表面使第二槽体封闭。流体第二传输孔6面向流体第三传输孔7的一侧设置有相对于第二槽体3底面突出的凸台9,且第二槽体3侧壁相对于所述凸台9位置形成半环状膨出10,以使得所述第二槽体3形成几字形流体通道。这样当用于为检测芯片5固定配体分子的溶液自流体第一传输孔4进入后,逐步流经至检测芯片5然后至流体第二传输孔6时,由于凸台9的阻挡作用,实验证明能够很好地阻挡样品溶液进一步扩散至参比芯片8一侧,导致参比芯片8被污染。
116.采用该芯片卡搭建如图8所示的分析系统进行蛋白a(protein a)与免疫球蛋白g(igg)的平衡亲和力常数测试,具体包括如下步骤:
117.1、实验过程
118.(1)将nanospr芯片在4℃下浸入50mm 3-mpa中过夜,使芯片表面羧基化,然后将羧基化芯片储存在4℃的pbs中用于后续分子相互作用研究,将芯片裁剪至1cm
×
0.3cm用双面胶粘贴至图5和图6所示的芯片卡中的检测芯片区的第一芯片槽和第二芯片槽,然后用亚克力板将传感器表面封闭。将edc/nhs(400mm/100mm)混合物通过六通阀注射至定量环中,切换三通阀阀门使该混合物从第一流体传输孔进入,依次流经检测芯片和参比芯片,使芯片羧基活化,活化废液从流体第三传输孔流出至废液收集瓶中。然后注射100μl20μg/ml蛋白a使其从流体第一传输孔进入并流经检测芯片,从流体第二传输孔流出至废液收集瓶,进行配体蛋白a的固定。然后将100μl1%酪蛋白pbs溶液注射至定量环中,切换三通阀阀门使该混合物从流体第一传输孔进入,流经检测芯片和参比芯片,废液从流体第三传输孔流出,用于封闭检测芯片和参比芯片,降低芯片的非特异性吸附,最终获得protein a芯片,将其储存在4℃冰箱备用。
119.(2)采用如图8所示的分析系统进行检测,采用pbst缓冲液稀释igg至5个不同浓度(0、1、3.5、7、14、28、56nm),采用波长为600nm和660nm的双波长对芯片进行反射光谱检测,
平衡基线30s,将不同浓度igg(0-56nm)由低浓度至高浓度分别注射至检测系统,切换三通阀方向,使样品从流体第一传输孔进入,分别流经检测芯片和参比芯片,从流体第三传输孔流出至废液收集瓶,每组检测时间为10min,流速为68μl/min。每组之间的再生条件即将100μl甘氨酸溶液(ph=1.5)注射至检测体系,切换三通阀方向,按照相同的流路设置,使样品分别流经参比芯片和测试芯片,流速为150μl/min,基线稳定后将流速设为68μl/min,然后进行下一组浓度检测。
120.(3)采用origin 8.0软件对原始数据进行拟合得到结合速率常数k
on
和解离速率常数k
off
的拟合方程,分别为
121.和
122.然后按公式拟合得到待测分析物的平衡亲和力常数kd的拟合方程;其中,[b]为待测蛋白的浓度,a为渐近线。
[0123]
2、检测结果
[0124]
本实验将protein a直接固定在芯片表面,首先通过定向结合igg的fc区检测亲和力。本实验采用反射光纤检测protein a与igg的动力学相互作用,其检测过程典型图谱如图13所示,包括平衡,结合,解离,再生。且两者的动力学结合解离检测及模拟过程如图14所示,kd值为0.25nm,该实验结果与之前文献报道一致(yang d,singh a,wu h,et al.comparison of biosensor platforms in the evaluation of high affinity antibody-antigen binding kinetics[j].analytical biochemistry,2016,508:78-96.)。说明本发明的纳米等离子体共振谱仪可应用于proteina通用型芯片,结果可靠、准确、可用。图15为采用protein a芯片对igg的线性检测,其r2为0.99,说明线性好。
[0125]
实施例3
[0126]
测试fcrn和igg的平衡亲和力常数kd[0127]
实验材料:
[0128]
鼠抗人igg:北京索莱宝科技有限公司;
[0129]
fcrn北京百普赛斯生物科技股份有限公司;nanospr one组件包括钨灯光源(杭州赛曼科技有限公司,220609w132),光谱仪(广州常晖电子科技有限公司,chs-3000),光纤(广州常晖电子科技有限公司,ch-ir-05m),六通阀,三通阀,塑料管,纳米等离子体芯片,蠕动泵。
[0130]
采用的芯片卡与实施例2相同,利用该芯片卡搭建如图9所示的分析系统,具体分析过程包括如下步骤:
[0131]
1、实验过程
[0132]
(1)将nanospr芯片在4℃下浸入50mm 3-mpa中过夜,使芯片表面羧基化,然后将羧基化芯片储存在4℃的pbs中用于后续分子相互作用研究或将芯片粘贴在裁剪至1cm
×
0.3cm用双面胶贴至图6所示的芯片卡中的检测芯片区,然后用亚克力板子将传感器表面封闭。将edc/nhs(400mm/100mm)混合物注射至六通阀定量环中,切换三通阀阀门使该混合物从流体第三传输孔进入并依次流经参比芯片和检测芯片,使芯片羧基活化,活化废液从流体第一传输孔流出至废液收集瓶;然后注射100μl 20μg/mlfcrn从流体第二传输孔进入使其流经检测芯片,进行配体fcrn的固定,固定废液从流体第一传输孔流出。然后将100μl1%
酪蛋白pbs溶液注射至定量环中,切换三通阀阀门使该混合物从流体第三传输孔进入,依次流经参比芯片和检测芯片,废液从流体第一传输孔流出,用于封闭检测芯片和参比芯片,降低芯片的非特异性吸附,最终获得protein a芯片,将其储存在4℃冰箱备用。
[0133]
(2)采用如图9所示的分析系统进行检测,采用pbst缓冲液稀释igg至不同浓度(0、47、94、188、376、752nm),采用波长为600nm和660nm的双波长对芯片进行反射光谱检测,平衡基线30s,将不同浓度igg(0-752nm)由低浓度至高浓度分别注射至检测系统,切换三通阀方向,使样品从流体第三传输孔进入,然后依次流经参比芯片和测试芯片,每组检测时间为10min,流速为68μl/min。每组之间的再生条件即将100μl pbs溶液(ph=8)注射至检测体系,切换三通阀方向,使样品分别流经参比芯片和测试芯片,流速为150μl/min,基线稳定后将流速设为68μl/min,然后进行下一组浓度检测。
[0134]
(3)采用origin 8.0软件对原始数据进行拟合并获得亲和常数(ka)及解离常数(kd)的拟合方程,分别为
[0135][0136]
然后按公式拟合得到待测蛋白的平衡亲和力常数kd的拟合方程;
[0137]
其中,k
on
为结合速率常数,k
off
为解离速率常数;[b]为待测蛋白的浓度;a为渐近线。
[0138]
2、检测结果
[0139]
fcrn与igg的动力学结合过程如图16所示,kd值为68.4nm,该实验结果商家给的结果一致。说明本发明的纳米等离子体共振谱仪可应用于类似于fcrn和herceptin的快速结合解离检测,结果可靠、准确、可用。
[0140]
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1