新型冠状病毒N蛋白在制备用于诊断新型冠状病毒的产品中的应用
新型冠状病毒n蛋白在制备用于诊断新型冠状病毒的产品中的应用
技术领域
1.本发明涉及生物技术领域,具体涉及新型冠状病毒n蛋白在制备用于诊断新型冠状病毒的产品中的应用。
背景技术:
2.抗体(antibody)是指机体在抗原的刺激下,由b细胞分化成的浆细胞所产生的、可与相应抗原发生特异性结合反应的免疫球蛋白。多克隆抗体 (polyclonal antibody)是用一种包含多种抗原决定簇的抗原免疫动物,刺激动物机体多个b细胞克隆产生针对多种抗原表位的不同抗体,所获得的免疫血清是含有不同抗原表位的多种抗体的混合物。多克隆抗体的应用十分广泛,它可以用于疾病的诊断与治疗以及科学研究等领域。免疫佐剂简称佐剂,即非特异性免疫增生剂,指与抗原一起或预先注入机体内能增强机体对抗原的免疫应答能力或改变免疫应答类型的辅助物质,应用最多的是弗氏佐剂(freund adjuvant)。佐剂的作用机制尚未完全明了,不同佐剂作用的机制也不尽相同。
3.新型冠状病毒疫情的爆发使检疫检测显得尤为重要,通过胶体金免疫层析法(colloidal gold immunochromatography assay,gica)制备的胶体金试纸条进行抗原或抗体的检测是检测方法之一。该技术以抗原抗体特异性免疫反应为基础,利用胶体金颗粒作为示踪物标记其中之一,标记物在溶剂层析作用带动下,于对照线(control,c线)/检测线(test,t线)上发生免疫反应,根据t线颜色即可得到检测结果,其具有使用方便快速,成本低、稳定性好等优点,但是目前用于检测新型冠状病毒的试剂盒检测效率还有待提高。
技术实现要素:
4.为解决上述技术问题,本发明提供了一种新型冠状病毒n蛋白在制备用于诊断新型冠状病毒的产品中的应用。
5.进一步的,所述产品为胶体金试剂盒。
6.更进一步的,所述胶体金试剂盒包括:
7.pvc板、样品垫、金标垫、硝酸纤维素膜及吸水垫;所述样品垫、金标垫、硝酸纤维素膜及吸水垫依次贴敷于所述pvc板上,并采用搭接的方式连接;所述硝酸纤维素膜上从所述金标垫至所述吸水垫方向依次设有相互平行的检测线和质控线;
8.所述金标垫有免疫金,金颗粒结合的抗体为protein a;
9.所述质控线处标记三抗,所述三抗为抗protein a小鼠单克隆抗体;
10.所述检测线处标所述的新型冠状病毒n蛋白。
11.更进一步的,所述三抗与新型冠状病毒n蛋白的浓度均为0.5-0.15mg/ml。
12.更进一步的,所述三抗与新型冠状病毒n蛋白的划量均为0.5-0.15μl/cm。
13.本发明具有如下有益效果:
14.本发明提供了一种新型冠状病毒n蛋白在制备用于诊断新型冠状病毒的的产品中
的应用,制备的胶体金试剂盒能够检测出新冠病毒多克隆抗体,10分钟内就能检测出抗体,故特异性高,灵敏度强,具有较强的应用前景。
附图说明
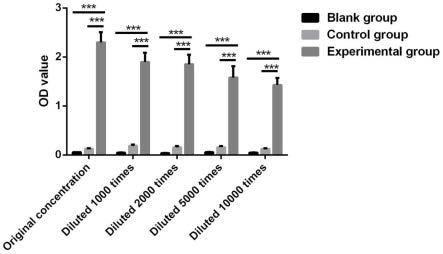
15.图1为稀释不同浓度抗体od值之间的比较,***:p﹤0.001:表示有极显著性差异。
16.图2为bsa标准曲线。
17.图3为胶体金试剂盒对新型冠状病毒n蛋白抗体的检测结果。
具体实施方式
18.下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明的限制。如未特殊说明,下述实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
19.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
20.实验动物:spf级sd雌性大鼠12只,体重平均120g左右(购自西安交通大学医学部,批号:1465)。
21.主要试剂及药品:新型冠状病毒n蛋白(dra31,上海近岸),弗氏完全佐剂与弗氏不完全佐剂,0.01%氯金酸,1%柠檬酸三钠,proteina(2.5mg/ml),protein a mouse monoclonal antibody,bca 蛋白定量试剂盒,rprotein a beads(购自北京索莱宝科技有限公司)、样品垫、金标结合垫、吸水垫、硝酸纤维膜(nc膜)均有杭州峰航科技有限公司提供,塑料盒(杭州峰航科技有限公司)
22.实施例1:鼠抗新型冠状病毒n蛋白多克隆抗体的制备
23.1、实验方法
24.1.1抗体的制备
25.取新冠病毒n蛋白20μl用0.01m pbs稀释10倍,在生物安全柜中使用 0.22um的滤膜对其进行过滤除菌;按实验要求使用注射器吸取新冠病毒n蛋白溶液和弗式完全佐剂/弗式不完全佐剂,二者等体积混合乳化(现配现用)。
26.1.2免疫程序
27.将12只sd大鼠,随机分为三组,每组4只,第一组为实验组,注射抗原(弗氏佐剂/弗氏不完全佐剂+新冠n蛋白)0.4ml/只;第二组为弗氏佐剂对照组,注射弗氏完全佐剂/弗氏不完全佐剂0.4ml/只;第三组为空白对照组,不做注射。每只共免疫3次,每次间隔7天。
28.1.3采集血清
29.在最后一次注射4天后采用心脏血法获得血液,经3000转/min离心5min,取上清液分装冷冻保存至80℃。
30.1.4酶联免疫吸附实验
31.抗原用pbs稀释为2.2μg/ml后,在酶标板中每孔100μl,37℃恒温箱1h;在每孔加200μl 1%bsa,封板并37℃恒温箱1h;用pbs将各组血清分别稀释 1000、2000、5000、10000倍,在每孔加入50μl的二抗,37℃恒温箱1h;用 tmb显色反应终止反应,450nm读取各孔吸光度值。
32.1.5亲和层析分离纯化
33.使用rprotein a beads的方法纯化抗体,方法参照说明书。
34.1.6测定bsa标准曲线
35.取bsa标准品1号-8号和纯化后的抗体各取20μl加到96孔板中,各孔加入200μl显色工作液,充分混匀,37℃孵育30min。酶标仪562nm测定各孔吸光度值并绘制标准曲线。
36.2、结果
37.2.1实验过程中,大鼠活动正常,未出现明显不良反应,对收集到的血液经离心后获得0.50ml血清。
38.2.2酶联免疫吸附试验(elisa)检测结果如图1所示,在450nm波长下,测定空白对照组、对照组和实验组的od值。
39.根据单因素分析,原浓度、稀释1000、2000、5000、10000倍血清浓度的结果显示实验组明显高于空白对照组和对照组(p《0.001)。
40.2.3亲和层析分离纯化结果,经洗脱液洗脱共收集洗脱液10ml,即目的蛋白10ml。
41.2.4bsa标准曲线测定及绘制,计算得实验组抗体的平均吸光度值:2.413。
42.bsa的标准曲线方程为y=0.0005x+0.0485,y为平均吸光度值,x为浓度,如图2所示,相关性系数为r2=0.9885,将2.413代入公式中可得纯化后实验组抗体的浓度为4729ug/ml,即原液浓度为4.729mg/ml。
43.实施例2:胶体金试剂盒的制备
44.1、实验方法
45.1.1胶体金的制备
46.取50ml 0.01%氯金酸,0.3ml 1%柠檬酸三纳为第一组(100:0.6);取50ml 0.01%氯金酸、0.4ml 1%柠檬酸三纳为第二组(100:0.8);取50ml 0.01%氯金酸、 0.5ml 1%柠檬酸三纳为第三组(100:1)。分别加入三组的50ml 0.01%氯金酸加热至有气泡产生并脱落后,按照上述分组一次性加入相应体积的1%柠檬酸三纳,继续加热10min,待液体颜色变为酒红色后室温下冷却,并用离心管4℃密封保存。
47.1.2免疫金的制备
48.使用protein a与胶体金结合,具体过程参见文献(黄池宝,杨斌,康帅,杨丽,吕国岭,余福勋.用于新型冠状病毒快速诊断的荧光免疫层析试纸条的制备及其细胞成像[j/ol].精细化工:1-9[2021-05-15].https://doi.org/10.13550/j.jxhg.2 0210211)。
[0049]
1.3金标垫(结合垫)预处理
[0050]
将玻璃纤维垫裁成与试纸条规格一致,玻璃纤维垫用金标稀释液(0.01%硼酸缓冲液+0.1%pva+1%tween 20+0.5%海藻糖,ph=9.0)浸泡20min,37℃干燥后,室温密封保存备用。
[0051]
1.4金标二抗的处理
[0052]
选喷金程序,将免疫金固定在预处理好的金标垫上,喷量为10ul/cm,根据结合垫的宽窄设置喷量,放37℃干燥箱烘干,4℃密封保存。
[0053]
1.5划膜
[0054]
将硝酸纤维素膜(nc膜)黏在pvc板上,用划膜程序,在t线上标记实施例1的新型冠状病毒n蛋白,浓度为1mg/ml,在c线上标记三抗,所述三抗为抗protein a小鼠单克隆抗体(protein a mouse monoclonal antibody),浓度为1mg/ml,划量为0.7ul/cm。
[0055]
1.6组装
[0056]
胶体金免疫层析试纸条最底层为保护层(pvc),分为三部分:pvc短端放置吸水垫;中间为硝酸纤维素膜(nc膜)、nc膜上固定检测蛋白(抗原t线)、三抗(c线);pvc长端粘贴样品垫、金标垫。
[0057]
2、结果
[0058]
2.1胶体金的制备
[0059]
50ml 0.01%氯金酸溶液加热沸腾后,一次性加入0.3ml1%柠檬酸三钠水溶液,淡黄色的氯金酸水溶液在50s内变为淡蓝色,再过2min后蓝色转为淡粉红色,在1min后变为粉色,再5min后变为亮红色,置于室温下为酒红色。
[0060]
2.2免疫金的制备
[0061]
2.2.1最适蛋白量
[0062]
在胶体金中,分别加入二抗protein a使其终浓度为50ug/ml、100ug/ml、 150ug/ml,加入10%nacl后液体颜色分别为红色,酒红色,紫红色;静止2h 后,加入protein a终浓度分别为50ug/ml、100ug/ml、150ug/ml的胶体金颜色变深且接近本体颜色无沉淀,因而标记蛋白最小量为终浓度为50ug/ml。
[0063]
2.2.2划膜
[0064]
结果显示,划量为0.7ug/cm时,沉淀线显色明显;划量为0.5ug/cm时,沉淀线过于细,显色结果不明显;划量为1.0ug/cm时,划在nc膜上时,直接印开;因而,选0.7ug/cm为本次实验的划膜划量。
[0065]
2.2.3喷金
[0066]
去上清后,沉淀用金标保存液重悬,二抗浓度为100ug/ml;金标结合垫的宽度为0.7mm,喷量为10ul/cm;喷金后,金标结合垫上显示为红色,干燥后为黑紫红色。
[0067]
2.2.4组装与切片及检测结果
[0068]
将nc膜贴到pvc板上并固定到划膜机上,划膜后,将金标垫贴到pvc板上,金标垫上覆盖样品垫,在另一端贴上吸水垫。将组装好的pvc板放到裁切机上裁成宽4mm,金标测试试纸完成。
[0069]
2.2.5试剂盒的组装
[0070]
将试纸条与塑料盒组装成测试卡,由测试卡、滴瓶(内含0.1%pbs的样本稀释液)和滴管组成。
[0071]
实施例3:胶体金试剂盒的鉴定
[0072]
本实施例用水样与新型冠状病毒n蛋白抗体进行测试,水样检测出来的结果为仅c线显色(图3),抗体检测c、t线均显色,且10分钟内即可检测出结果。
[0073]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0074]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1