一种头孢呋辛钠中基因毒性杂质的检测方法与流程
一种头孢呋辛钠中基因毒性杂质的检测方法
发明领域
1.本发明属于药物检测技术领域,具体涉及一种同时测定头孢呋辛钠中5种基因毒性杂质的检测方法。
2.发明背景
3.头孢呋辛属于第二代广谱头孢菌素类药物,原研厂家为葛兰素史克公司,1978年分别在英国、爱尔兰、德国和意大利相继上市,随后在全球多个国家和地区推广销售。随着头孢呋辛在世界头孢菌素类临床市场的良好表现,由意大利esseti farmaceutici s.r.l生产的高标准高质量且疗效好的仿制药产品注射用头孢类,于1986年首次在意大利上市,并于1997年开始进入中国市场。
4.头孢呋辛钠化学名称为(6r,7r)-7-[2-呋喃基(甲氧亚氨基)乙酰氨基]3-氨基甲酰氧甲基-8-氧代-5-硫杂-1-氮杂二环[4.2.0]辛-2-烯-2-甲酸钠盐,其结构式为
[0005][0006]
头孢呋辛钠适用于治疗特定微生物敏感菌株引起的感染。临床应用广泛,如呼吸道感染、耳鼻喉感染及泌尿系统感染等,安全性方面,头孢呋辛钠具有致敏性。
[0007]
其合成工艺可能引入酰胺类及磺酰胺类基因毒警示结构杂质,如中间体pm2在碱性条件下水解得到氨基甲酸,再与甲醇/乙醇/异丙醇反应生成氨基甲酸甲酯/乙酯/异丙酯。而起始物料sm2经过水解得到氨基磺酰氯,再与乙醇/异丙醇生成氨基磺酸乙酯/异丙酯。参考ich m7《评估和控制药物中dna反应的(诱变的)杂质以限制潜在的致癌风险》中抗感染药物以治疗时长为1~12个月,可接受摄入量为20μg/天,根据“注射用头孢呋辛钠说明书”相关规定,本品最大日服用量9g,基因毒性杂质总量限度应为20μg/天
÷
9g/天=0.00022%(即2.2ppm)
[0008]
通过检索国内外文献及专利,仅检索到:
[0009]
文献1:“邓贵福.注射用头孢呋辛钠杂质谱研究,中国抗生素杂质,2019,44(2):228”,其中,对不同来源产品中检出3个较大杂质,分别为:杂质a(去氨甲酰头孢呋辛)、杂质e(头孢呋辛反式异构体)和杂质h(头孢呋辛内酯),上述几种杂质均属于头孢呋辛产品强制降解的杂质。
[0010]
文献2:“钱建钦,胡昌勤.高效液相色谱-单四级杆质谱仪结合同位素峰形校正检索技术快速确定头孢呋辛水溶液降解杂质,药物分析杂志,2012,32(9):1589”,其中液相条件中采用依利特ods-bp(4.6mm
×
250mm,5μm)色谱柱,流动相为4mmol
·
l-1
醋酸铵(用醋酸调ph至3.3)-乙腈(77:23);质谱条件中,采用正离子全扫描方式。采用上述条件对位于头孢呋辛主峰前的头孢呋辛钠降解杂质进行分析检测。
[0011]
文献3:“jerry zweigenbaum,michael flanagan,peter stone,thomas glauner,limian zhao;使用三重串联四极杆液质联用仪和动态多反应监测功能(dmrm)进行复杂样品中农药多残留的快速定性定量分析”,其利用三重串联四极杆液质的分析方法对农残测试标样、农药组分进行了分析,但该方法并不适用与本技术中的头孢呋辛钠中基因毒性杂质的检测。
[0012]
以上文献1和2,其文章中介绍了采用lc-ms法对头孢呋辛降解杂质的定性、定量研究,未涉及基因毒性杂质(工艺杂质),未发现基因毒性杂质的相关检测方法与定量研究的内容。而文献3中的测试条件和过程并不适用于头孢呋辛钠中5中基因毒性杂质的同时检出和测定。
技术实现要素:
[0013]
针对现有技术中存在的缺陷和不足,本发明提供了一种同时测定头孢呋辛钠中5种基因毒的检测方法。
[0014]
本发明同时测定氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯和氨基磺酸异丙酯5种基因毒警示结构杂质,所述方法具有显著的灵敏度,上述5中杂质的最低定量限为0.32ng/ml,最低检出限为0.16ng/ml,满足ichm7指导原则的相关要求(限度不超过2.2ppm)。
[0015]
具体来说,本发明提供了如下技术方案:
[0016]
一种头孢呋辛钠基因毒性杂质的检测方法,所述检测方法包括如下步骤:
[0017]
1)供试品溶液的配制:称取头孢呋辛钠,加入稀释剂配制成供试品溶液;
[0018]
所述稀释剂包括甲酸水溶液和甲醇;
[0019]
2)取上述供试品溶液,注入液相色谱和质谱联用仪中,采用如下条件进行检测;
[0020]
液相条件包括:
[0021]
色谱柱,zorbax eclipse plusc18;
[0022]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0023]
质谱条件包括:
[0024]
离子源:esi正离子模式;
[0025]
采集方式为:mrm多反应检测扫描;
[0026]
在步骤2)中,所述杂质的定量信息为下表中的一种或多种:
[0027]
名称q1massq3massfrag(v)ce(v)氨基甲酸甲酯77.9~78.358.9~59.355~6525~35氨基甲酸乙酯89.9~90.361.9~62.355~6525~35氨基甲酸异丙酯103.9~104.344.0~44.455~6525~35氨基磺酸乙酯123.6~124.077.9~78.355~6525~35氨基磺酸异丙酯137.7~138.177.7~78.155~6525~35。
[0028]
其中,q1mass,表示母离子(m/z);q3mass,表示子离子(m/z)frag(v)表示碎裂电压(v);ce(v)表示碰撞能量(v)。
[0029]
在一些优选的实施方案中,在步骤2)中,所述杂质的定量信息为下表中的一种或
多种:
[0030][0031][0032]
在一些优选的实施方案中,其中,所述头孢呋辛钠基因毒性杂质为氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯中的一种或多种。
[0033]
在一些实施方案中,其中,甲酸水溶液和甲醇二者体积比为0.05%的甲酸水溶液:甲醇=1~2:1。
[0034]
在一些优选的实施方案中,0.05%的甲酸水溶液:甲醇=1:1。
[0035]
在一些优选的实施方案中,其中,甲酸水溶液浓度为0.05%。
[0036]
在一些优选的实施方案中,其中,所述流动相为梯度洗脱,运行时间为25min。
[0037]
在一些优选的实施方案中,其中,所述液相条件中,流动相的洗脱梯度为:
[0038]
时间(min)流动相a(%)流动相b(%)0.088~928~125.0901010.0752515.0752520.0901025.09010。
[0039]
在一些优选的实施方案中,其中,所述液相条件中,流动相的洗脱梯度为:
[0040]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.0901025.09010。
[0041]
在一些优选的实施方案中,其中,所述液相色谱和质谱联用仪为液相色谱和质谱联用仪(hplc-ms/ms),质谱质量分析器为三重四级杆(ms/ms),质谱检测器为esi检测器。
[0042]
在一些优选的实施方案中,其中,所述液相条件中,柱温35℃;
[0043]
流速0.2ml/min;
[0044]
进样量5μl。
[0045]
在一些优选的实施方案中,其中,所述质谱条件进一步包括以下:
[0046]
极性positive毛细管电压capillary(v)2500气体温度gas temp(℃)300气体流速gas flow(l/min)4雾化器nebulizer(psi)40鞘气温度sheath gas heater(℃)280鞘气流速sheath gas flow(l/min)10。
[0047]
其中,positive表示正离子模式。
[0048]
一种基因毒性杂质的检测方法,所述检测方法包括如下步骤:
[0049]
1)供试品溶液的配制:取基因毒性杂质或者可能含有该基因毒性杂质的供试品,加入稀释剂配制成待测溶液;
[0050]
所述基因毒性杂质为氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯中的一种或多种;
[0051]
所述稀释剂包括甲酸水溶液和甲醇;
[0052]
2)取上述待测溶液,注入液相色谱和质谱联用仪中,采用如下条件进行检测;
[0053]
液相条件包括:
[0054]
色谱柱,zorbax eclipse plusc18;
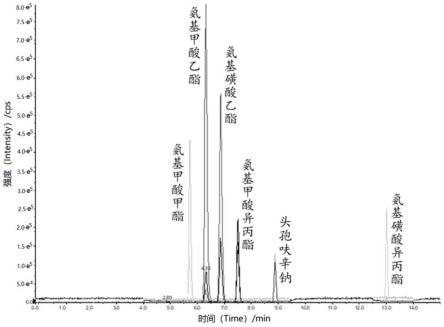
[0055]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0056]
质谱条件包括:
[0057]
离子源:esi正离子模式;
[0058]
采集方式为:mrm多反应检测扫描;
[0059]
在步骤2)中,所述杂质的定量信息为下表中的一种或多种:
[0060]
名称q1massq3massfrag(v)ce(v)氨基甲酸甲酯77.9~78.358.9~59.355~6525~35氨基甲酸乙酯89.9~90.361.9~62.355~6525~35氨基甲酸异丙酯103.9~104.344.0~44.455~6525~35氨基磺酸乙酯123.6~124.077.9~78.355~6525~35氨基磺酸异丙酯137.7~138.177.7~78.155~6525~35。
[0061]
在一些优选的实施方案中,在步骤2)中,所述杂质的定量信息为下表中的一种或多种:
[0062]
名称q1massq3massfrag(v)ce(v)氨基甲酸甲酯78.159.16030氨基甲酸乙酯90.162.16030氨基甲酸异丙酯104.144.26030
氨基磺酸乙酯123.878.16030氨基磺酸异丙酯137.977.96030。
[0063]
在一些优选的实施方案中,其中,所述头孢呋辛钠基因毒性杂质为氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯和氨基磺酸异丙酯中的一种或多种。
[0064]
在一些优选的实施方案中,其中,甲酸水溶液和甲醇二者体积比为0.05%的甲酸水溶液:甲醇=1~2:1;优选的,0.05%的甲酸水溶液:甲醇=1:1。
[0065]
在一些优选的实施方案中,其中,甲酸水溶液浓度为0.05%。
[0066]
在一些优选的实施方案中,其中,所述流动相为梯度洗脱,运行时间为25min。
[0067]
在一些优选的实施方案中,其中,所述液相条件中,流动相的洗脱梯度为:
[0068][0069][0070]
在一些优选的实施方案中,其中,所述液相条件中,流动相的洗脱梯度为:
[0071]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.0901025.09010。
[0072]
在一些优选的实施方案中,其中,所述液相色谱和质谱联用仪为液相色谱和质谱联用仪(hplc-ms/ms),质谱质量分析器为三重四级杆(ms/ms),质谱检测器为esi检测器。
[0073]
在一些优选的实施方案中,其中,所述液相条件中,柱温35℃,流速0.2ml/min,进样量5μl。
[0074]
在一些优选的实施方案中,其中,所述质谱条件进一步包括以下:
[0075]
极性positive毛细管电压capillary(v)2500气体温度gas temp(℃)300气体流速gas flow(l/min)4
雾化器nebulizer(psi)40鞘气温度sheath gas heater(℃)280鞘气流速sheath gas flow(l/min)10。
[0076]
本发明的有益效果如下:
[0077]
本发明提供了一种同时测定头孢呋辛钠中5种基因毒的检测方法,能实现同时测定氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯和氨基磺酸异丙酯5种基因毒警示结构杂质,上述5中杂质的最低定量限为0.32ng/ml,最低检出限为0.16ng/ml。
[0078]
本发明首次公开的同时检测头孢呋辛钠中5种基因毒的方法,
①
灵敏度高,(各聚合物灵敏度以头孢呋辛钠计)最低定量限为0.32ng/ml,最低检出限为0.16ng/ml;
②
稳定性优异,各杂质24h内稳定性良好,变化值均小于2.0%;
③
重复性良好,rsd%均小于2.0%;
④
并且专属性良好,各杂质之间的分离度均大于1.5,表现出显著的分离效果优势。
附图说明
[0079]
图1a和图1b为实施例1中采用方法1zorbax eclipse plusc18(1.8μm,50*2.1mm)色谱柱得到的色谱图;
[0080]
图2为实施例1中采用方法2welch ultimate xb-c18(1.8μm,50*2.1mm)色谱柱得到的色谱图;
[0081]
图3为实施例3中方法2质谱条件采用apci离子源得到的色谱图;
[0082]
图4为实施例4中方法1的mrm模式下得到的色谱图;
[0083]
图5为实施例4中方法2的sim模式下得到的色谱图;
[0084]
图6为对比例1检测头孢呋辛钠降解杂质的色谱图;
[0085]
图7为对比例2检测头孢呋辛钠降解杂质的色谱图。
具体实施方式
[0086]
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
[0087]
实施例1:色谱柱的选择
[0088]
1-1.溶液配制
[0089]
稀释剂:选用甲酸水溶液和甲醇,二者体积比为1:1,其中,甲酸水溶液浓度为0.05%。
[0090]
供试品溶液:取头孢呋辛钠,精密称重,加水溶解并定量稀释制成每1ml中约含主成分1mg的溶液,作为供试品溶液。
[0091]
混合溶液:取氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯适量,精密称重,至容量瓶中,采用稀释剂稀释,定容至浓度为0.05μg/ml。
[0092]
1-2.测试条件
[0093]
仪器,液相色谱-三重四级杆质谱联用仪;
[0094]
方法1:
[0095]
液相条件:
[0096]
色谱柱,zorbax eclipse plusc18,1.8μm,50*2.1mm;
[0097]
柱温35℃;
[0098]
流速0.2ml/min;
[0099]
进样量5μl;进样顺序:稀释剂1针——供试品溶液1针——混合溶液1针;
[0100]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0101]
洗脱梯度
[0102]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.0901025.09010
[0103]
质谱条件:
[0104]
离子源esi采集方式mrm极性positive毛细管电压capillary(v)2500气体温度gas temp(℃)300气体流速gas flow(l/min)4雾化器nebulizer(psi)40鞘气温度sheath gas heater(℃)280鞘气流速sheath gas flow(l/min)10
[0105]
方法2:
[0106]
改变液相条件中色谱柱类型,
[0107]
welch ultimate xb-c18,1.8μm,50*2.1mm;
[0108]
其他参数和步骤与方法1相同。
[0109]
1-3.实验步骤及结论:
[0110]
[0111]
结论:采用方法1中zorbax eclipse plusc18(1.8μm,50*2.1mm)色谱柱,图1a为基于全扫模式(即,scan模式,m/z=50~800范围内)扫描得到的质谱图,其中5个基因毒性杂质峰和头孢呋辛钠的特征峰均显示出良好的分离度(其中,在6~7min内的微小特征峰为定性碎片离子,不影响杂质检测);图1b为mrm模式(m/z=50~150范围内)扫描得到的质谱图,其中5个基因毒性杂质峰(以下谱图中,为节省扫描检测时间,均只展示5个杂质特征峰的分离程度),各杂质的分离度大于1.5;而采用方法2中welch ultimate xb-c18(1.8μm,50*2.1mm)色谱柱得到的色谱图,分离度差,并且氨基甲酸异丙酯和氨基磺酸乙酯的峰未分开(见图2);由上述分离度对比可知,与方法2相比,方法1的分离效果具有显著性。
[0112]
实施例2:稀释剂的选择
[0113]
2-1.溶液配制
[0114]
供试品溶液:取头孢呋辛钠,精密称重,加水溶解并定量稀释制成每1ml中约含主成分0.5mg的溶液,作为供试品溶液。
[0115]
灵敏度溶液:取氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯适量,精密称重,至容量瓶中,采用稀释剂稀释并定容至浓度为0.45ng/ml。
[0116]
方法1:
[0117]
稀释剂选用甲酸水溶液和甲醇,二者体积比为1:1,其中,甲酸水溶液浓度为0.05%。
[0118]
方法2:
[0119]
稀释剂选用甲酸水溶液和乙腈,二者体积比为1:1,其中,甲酸水溶液浓度为0.05%。
[0120]
方法3:稀释剂选用甲酸水溶液和甲醇,二者体积比为2:1,其中,甲酸水溶液浓度为0.05%。
[0121]
方法4:稀释剂选用甲酸水溶液和甲醇,二者体积比为1:2,其中,甲酸水溶液浓度为0.05%。
[0122]
2-2.测试条件
[0123]
仪器,液相色谱-三重四级杆质谱联用仪;
[0124]
液相条件:
[0125]
色谱柱,zorbax eclipse plusc18,1.8μm,50*2.1mm;
[0126]
柱温35℃;
[0127]
流速0.2ml/min;
[0128]
进样量5μl;进样顺序:稀释剂1针——供试品溶液1针——灵敏度溶液1针;
[0129]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0130]
洗脱梯度
[0131]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.09010
25.09010
[0132]
质谱参数:
[0133][0134][0135]
2-3.实验步骤及结论:
[0136][0137]
结论:采用方法1的稀释剂(0.05%的甲酸水溶液:甲醇(1:1,v/v)),得到的谱图中全部杂质(5种基因毒性杂质)均有出峰响应。而采用方法2的稀释剂(0.05%的甲酸水溶液:乙腈(1:1,v/v)),仅能检测出氨基甲酸乙酯1种杂质吸收峰。由上述检测分离出的吸收峰的个数对比可知,采用方法1的稀释剂(0.05%的甲酸水溶液:甲醇(1:1,v/v)),其灵敏度优于方法2的稀释剂(0.05%的甲酸水溶液:乙腈(1:1,v/v))。
[0138]
[0139][0140]
结论:采用稀释剂0.05%的甲酸水溶液和甲醇作为稀释剂,控制二者体积比为1:1(方法1)或2:1(方法3)时,得到的谱图中全部杂质均有出峰响应;而采用方法4体积比的稀释剂(0.05%的甲酸水溶液:甲醇(1:2,v/v)),得到的谱图中,氨基磺酸异丙酯杂质的峰型出现拖尾,并且usp拖尾(usp tailor)因子》2.0,分离效果不显著。
[0141]
上述实验证明,采用稀释剂0.05%的甲酸水溶液和甲醇作为稀释剂时,体积比保持0.05%的甲酸水溶液:甲醇=(1~2):1能实现头孢呋辛钠中5种基因毒性杂质的分离检测,并且分离效果显著。
[0142]
实施例3:质谱条件中离子源的确定
[0143]
3-1.溶液配制
[0144]
供试品溶液:取头孢呋辛钠,精密称重,加水溶解并定量稀释制成每1ml中约含主成分0.5mg的溶液,作为供试品溶液。
[0145]
混合溶液的配制:取氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯适量,精密称重,至容量瓶中,采用稀释剂稀释,定容至浓度为0.05μg/ml。
[0146]
稀释剂选用甲酸水溶液和甲醇,二者体积比为1:1,其中,甲酸水溶液浓度为0.05%。
[0147]
3-2.测试条件
[0148]
仪器,液相色谱-三重四级杆质谱联用仪;
[0149]
液相条件:
[0150]
色谱柱,zorbax eclipse plusc18,1.8μm,50*2.1mm;
[0151]
柱温35℃;
[0152]
流速0.2ml/min;
[0153]
进样量5μl;进样顺序:供试品溶液1针——混合溶液1针;
[0154]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0155]
洗脱梯度
[0156]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.0901025.09010
[0157]
质谱参数:
[0158][0159]
3-3.实验步骤及结论:
[0160][0161]
结论:方法2中采用apci离子源,未检测出杂质的信号响应(采用方法2apci离子源得到的色谱图见图3);相比之下,本发明方法1中采用esi离子源,使氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯和氨基磺酸异丙酯5种杂质均可有效检出,分离效果显著。
[0162]
实施例4:质谱条件中采集方式的确定
[0163]
4-1.溶液配制
[0164]
供试品溶液:取头孢呋辛钠,精密称重,加水溶解并定量稀释制成每1ml中约含主成分0.5mg的溶液,作为供试品溶液。
[0165]
混合溶液的配制:取氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯适量,精密称重,至容量瓶中,采用稀释剂稀释,定容至浓度为0.05μg/ml,稀释剂选用甲酸水溶液和甲醇,二者体积比为1:1,其中,甲酸水溶液浓度为0.05%。
[0166]
4-2.测试条件
[0167]
仪器,液相色谱-三重四级杆质谱联用仪;
[0168]
液相条件:
[0169]
色谱柱,zorbax eclipse plusc18,1.8μm,50*2.1mm;
[0170]
柱温35℃;
[0171]
流速0.2ml/min;
[0172]
进样量5μl;进样顺序:供试品溶液1针——混合溶液1针;
[0173]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0174]
洗脱梯度
[0175]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.0901025.09010
[0176]
质谱条件:
[0177][0178][0179]
4-3.实验步骤及结论
[0180][0181]
结论:质谱条件中,采用方法1的mrm模式,对5种杂质氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯的检测过程中,基线噪音小导致检测的灵敏度更高;而采用方法2的sim采集方式,其测定的基线噪声大导致检测的灵敏度较低,影响对杂质的定性分离检出以及定量检测。图4为方法1的mrm模式下得到的色谱图,其中显示出明显的氨基甲酸甲酯杂质特征峰信号;图5为方法2的sim模式下得到的色谱图,其中基线噪声大,无法直观显示出氨基甲酸甲酯杂质的特征峰信号。
[0182]
实施例5:专属性测试
[0183]
5-1.溶液配制
[0184]
空白溶剂:流动相a:流动相b=(90:10,v/v);流动相a,0.05%的甲酸水溶液;流动
相b,甲醇。
[0185]
系统适用性溶液:取头孢呋辛钠及各基因毒性杂质适量,精密称重,配制成限度浓度供试品溶液(头孢呋辛钠浓度1mg/ml,各杂质浓度为45ng/ml,即45ppm),作为系统适用性溶液。
[0186]
5-2.测试条件
[0187]
仪器,液相色谱-三重四级杆质谱联用仪;
[0188]
液相条件:
[0189]
色谱柱,zorbax eclipse plusc18,1.8μm,50*2.1mm;
[0190]
柱温35℃;
[0191]
流速0.2ml/min;
[0192]
进样量5μl;
[0193]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0194]
洗脱梯度
[0195]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.0901025.09010
[0196]
质谱条件:
[0197]
离子源esi采集方式mrm极性positive毛细管电压capillary(v)2500气体温度gas temp(℃)300气体流速gas flow(l/min)4雾化器nebulizer(psi)40鞘气温度sheath gas heater(℃)280鞘气流速sheath gas flow(l/min)10
[0198]
5-3.实验步骤及结论
[0199][0200]
结论:采用空白溶剂对样品进行分离检测时,没有产生多余的特征峰,说明空白溶剂对测定不产生干扰;采用系统适用性溶液进行测定,谱图显示各杂质与临近峰的分离度
良好,分离度>1.5。
[0201]
实施例6:灵敏度测试
[0202]
6-1.溶液配制
[0203]
空白溶剂:流动相a:流动相b=(90:10,v/v);流动相a,0.05%的甲酸水溶液;流动相b,甲醇。
[0204]
灵敏度测试溶液:取氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯适量,精密称量,采用稀释剂稀释至信/噪比(s/n)=10:1及信/噪比(s/n)=3:1,即为方法的定量限及检测限。稀释剂选用甲酸水溶液和甲醇,二者体积比为1:1,其中,甲酸水溶液浓度为0.05%。
[0205]
6-2.测试条件
[0206]
仪器,液相色谱-三重四级杆质谱联用仪;
[0207]
液相条件:
[0208]
色谱柱,zorbax eclipse plusc18,1.8μm,50*2.1mm;
[0209]
柱温35℃;
[0210]
流速0.2ml/min;
[0211]
进样量5μl;进样顺序:空白溶剂1针——灵敏度测试溶液1针;
[0212]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0213]
洗脱梯度
[0214]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.0901025.09010
[0215]
质谱参数:
[0216][0217]
[0218]
6-3.实验结论
[0219]
名称定量限(ng/ml)检测限(ng/ml)氨基甲酸甲酯0.320.16氨基甲酸乙酯0.350.17氨基甲酸异丙酯0.330.19氨基磺酸乙酯0.340.22氨基磺酸异丙酯0.380.21
[0220]
结论:采用上述分离检测条件,对头孢呋辛钠中5种基因毒性杂质进行检测,定量限低至0.32ng/ml,检出限低至0.16ng/ml,可以满足氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯和氨基磺酸异丙酯5种基因毒性杂质的同时检测分离以及控制要求。
[0221]
实施例7:重复性测试
[0222]
7-1.溶液配制
[0223]
空白溶剂:流动相a:流动相b=(90:10,v/v);流动相a,0.05%的甲酸水溶液;流动相b,甲醇。
[0224]
重复性测试溶液:取头孢呋辛钠原料适量,分别加入限度浓度各杂质,精密称重,加稀释剂溶解并定量稀释制成每1ml中约含主成分1mg的溶液,作为供试品溶液,平行配制六份。
[0225]
稀释剂选用甲酸水溶液和甲醇,二者体积比为1:1,其中,甲酸水溶液浓度为0.05%。
[0226]
7-2.测试条件
[0227]
仪器,液相色谱-三重四级杆质谱联用仪;
[0228]
液相条件:
[0229]
色谱柱,zorbax eclipse plusc18,1.8μm,50*2.1mm;
[0230]
柱温35℃;
[0231]
流速0.2ml/min;
[0232]
进样量5μl;进样顺序:空白溶剂1针——重复性测试溶液1针;
[0233]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0234]
洗脱梯度
[0235]
时间(min)流动相a(%)流动相b(%)0.090105.0901010.0752515.0752520.0901025.09010
[0236]
质谱参数:
[0237]
离子源esi
采集方式mrm极性positive毛细管电压capillary(v)2500气体温度gas temp(℃)300气体流速gas flow(l/min)4雾化器nebulizer(psi)40鞘气温度sheath gas heater(℃)280鞘气流速sheath gas flow(l/min)10
[0238]
7-3.实验结论
[0239][0240][0241][0242]
结论:本发明实施例7的方法重复性良好,其中,氨基甲酸甲酯的rsd%为1.2%、氨基甲酸乙酯的rsd%为0.9%、氨基甲酸异丙酯的rsd%为0.8%、氨基磺酸乙酯的rsd%为1.1%、氨基磺酸异丙酯的rsd%为1.3%,由上述可知,5种杂质的rsd%均小于2.0%,其中氨基甲酸异丙酯的rsd%最低为0.8%,说明上述分离检测方法的稳定性良好,重复性能显著。
[0243]
实施例8:稳定性测试
[0244]
8-1.溶液配制
[0245]
空白溶剂:稀释剂,稀释剂选用甲酸水溶液和甲醇,二者体积比为1:1,其中,甲酸水溶液浓度为0.05%。
[0246]
稳定性测试溶液:取头孢呋辛钠原料适量,分别加入限度浓度各杂质,精密称重,加水溶解并定量稀释制成每1ml中约含主成分1mg的溶液,作为稳定性测试溶液。
[0247]
8-2.测试条件
[0248]
仪器,液相色谱-三重四级杆质谱联用仪;
[0249]
液相条件:
[0250]
色谱柱,zorbax eclipse plusc18,1.8μm,50*2.1mm;
[0251]
柱温35℃;
[0252]
流速0.2ml/min;
[0253]
进样量5μl;
[0254]
流动相a,0.05%的甲酸水溶液;流动相b,甲醇;
[0255]
洗脱梯度
[0256][0257][0258]
质谱条件:
[0259]
离子源esi采集方式mrm极性positive毛细管电压capillary(v)2500气体温度gas temp(℃)300气体流速gas flow(l/min)4雾化器nebulizer(psi)40鞘气温度sheath gas heater(℃)280鞘气流速sheath gas flow(l/min)10
[0260]
8-3.实验结论
[0261][0262]
结论:分别在0h和24h条件下进行检测,比较上述5种基因毒的峰面积大小,结果显示:5种杂质24h后测定的峰面积较0h时,变化值均小于2.0%,不同时间内测定的峰面积和杂质含量相差较小,说明本发明测试条件下测试结果的稳定性良好。
[0263]
对比例1-2:
[0264]
对比例1:“邓贵福.注射用头孢呋辛钠杂质谱研究,中国抗生素杂质,2019,44(2):228”,其中,对不同来源产品中检出3个较大杂质,分别为:杂质a(去氨甲酰头孢呋辛)、杂质
e(头孢呋辛反式异构体)和杂质h(头孢呋辛内酯),上述几种杂质均属于头孢呋辛产品强制降解的杂质(具体测试条件参见对比例1第229~230页,第1.1和2.5部分)。
[0265]
对比例2:“钱建钦,胡昌勤.高效液相色谱-单四级杆质谱仪结合同位素峰形校正检索技术快速确定头孢呋辛水溶液降解杂质,药物分析杂志,2012,32(9):1589”,其中液相条件中采用依利特ods-bp(4.6mm
×
250mm,5μm)色谱柱,流动相为4mmol
·
l-1
醋酸铵(用醋酸调ph至3.3)-乙腈(77:23);质谱条件中,采用正离子全扫描方式。采用上述条件对位于头孢呋辛主峰前的头孢呋辛钠降解杂质进行分析检测(参见对比例2第1590页,第1和2部分)。
[0266]
表1本技术与对比例1和2的杂质对比
[0267]
[0268][0269]
表2本技术与对比例1和2的液相条件对比
[0270][0271]
表3本技术与对比例1和2的质谱条件对比
[0272][0273]
对比实验:
[0274]
混合溶液的配制:取氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸异丙酯、氨基磺酸乙酯、氨基磺酸异丙酯适量,精密称重,至容量瓶中,采用稀释剂稀释,定容至浓度为0.05mg/ml。
[0275]
分别采用上述对比例1和对比例2的液相条件和质谱条件对混合溶液进行检测分离,结果如下:
[0276][0277][0278]
结论:
[0279]
由上述结果可知,本技术分离检测条件得到的5种基因毒性杂质得到的峰型好,分离度高,各杂质之间的分离度均大于1.5,灵敏度高,(各聚合物灵敏度以头孢呋辛钠计)最
低定量限为0.32ng/ml,最低检出限为0.16ng/ml;稳定性优异,各杂质24h内稳定性良好,变化值均小于2.0%;重复性能良好,rsd%均小于2.0%;并且专属性良好,各杂质之间的分离度均大于1.5。而图6和图7显示的对比例1和对比例2的峰形差并且灵敏度差,本技术的分离效果具有显著提高,相较于对比例1和对比例2表现出显著的优势。
[0280]
对比例3:
[0281]
对比例3:“jerry zweigenbaum,michael flanagan,peter stone,thomas glauner,limian zhao;使用三重串联四极杆液质联用仪和动态多反应监测功能(dmrm)进行复杂样品中农药多残留的快速定性定量分析”(参见对比例3第18~25页,附录i~viii)。
[0282]
表4本技术与对比例3的杂质对比
[0283][0284]
表5本技术与对比例3的液相条件对比
[0285][0286][0287]
表6本技术与对比例3的质谱条件对比
[0288]
本技术对比例3离子源:esi+离子化方式:esi+采集方式:mrm多反应检测扫描采集方式:mrm多反应检测扫描
[0289]
对比例3中利用三重串联四极杆液质的分析方法对农残测试标样、农药组分进行了分析,但经过测试对比实验可知,采用对比例3中6种不同流动相的测试条件,并不能将头孢呋辛钠中5中基因毒性杂质的特征峰实现良好的检出和分离,对比例3所述色谱条件中的流动相并不适用与本技术中的头孢呋辛钠中基因毒性杂质的检测。因此对比例3的测定条件和方法并不适用与本技术的检测内容。
[0290]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对其作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1