一种基于SERS和CRISPR/Cas联免疫吸附检测蛋白的方法及应用
一种基于sers和crispr/cas联免疫吸附检测蛋白的方法及应用
技术领域
1.本发明属于医学检测技术领域,主要涉及一种基于sers和crispr/cas联免疫吸附检测蛋白的方法及应用。
背景技术:
2.elisa是目前最为常用的免疫学检测技术之一,在全世界范围内被广泛应用于疾病诊断、食品安全和环境监控领域,它的操作比较简单,显色原理明确,容易控制生产工艺,稳定性良好。但是,对于一些检出限低的物质来说,elisa的灵敏度是远远达不到要求的。
3.crispr/cas是近些年兴起的一种用于核酸检测的酶,crispr/cas蛋白与crispr rna(crrna)结合,crrna能够识别特异性的核酸序列,cas蛋白发挥核酸内切酶功能,对靶标核酸分子进行剪切。除了特异性核酸内切酶活性(靶向切割)外,crispr类型中的iii、v和vi rna引导的核酸酶(cas12、cas13和cas14)还具有侧链靶向激活的非特异性单链核酸水解酶活性(侧链切割),其中,cas12a可在crrna引导下特异性识别并剪切单链或双链dna,一旦对靶dna进行识别并剪切,cas12a自身的非特异性dna酶活性被激活,可高效剪切其他单链dna。cas12a的这种扩增特性,可用于构建高灵敏的检测方法。与本发明最相近似的实现方案是nano-clisa,首先,抗原在96孔板中被包被抗体捕获,加入被抗原适配体和激活序列修饰金纳米(aunps)后,适配体与抗原结合,使得aunps被捕获;然后加入cas12a-crrna以及荧光淬灭探针(fq-reporter),cas12a-crrna识别aunps表面的激活序列并剪切,cas12a自身的非特异性dna酶活性被激活,剪切fq-reporter,fq-reporter被剪断后荧光基团被释放,从而产生荧光信号实现检测。
技术实现要素:
4.本发明的首要目的在于提供一种基于sers和crispr/cas联(clisa)免疫吸附检测蛋白的方法,解决传统的酶联免疫吸附试验(elisa)在蛋白标志物检测中的灵敏度不足的技术问题。
5.本发明的另一目的在于提供上述基于sers和crispr/cas联免疫吸附检测蛋白的方法的应用。
6.本发明的目的通过下述技术方案实现:
7.一种基于sers和crispr/cas联(clisa)免疫吸附检测蛋白的方法,包括以下步骤:
8.(1)将靶激活dna连接到待测蛋白的检测抗体上;
9.(2)将待测蛋白的捕获抗体进行固定,清洗;
10.(3)在步骤(2)中固定的捕获抗体中加入待测样本,孵育;
11.(4)在步骤(3)得到的体系中加入步骤(1)中连接了靶激活dna的检测抗体,孵育后清洗;
12.(5)在步骤(4)得到的体系中加入cas12a蛋白、crrna和拉曼探针,孵育后检测拉曼
信号,根据拉曼信号强度检测待测蛋白。
13.步骤(1)所述的靶激活dna是一段核苷酸序列,能够与步骤(5)所述的crrna互补结合,激活cas12a的酶活性。
14.步骤(1)所述的待测蛋白包括至少有两个抗原决定簇的抗原蛋白,优选为前列腺特异抗原(psa)、sars-cov-2n蛋白、γ干扰素(ifn-γ)、癌胚抗原(cea)、鳞状上皮细胞癌抗原(scca)、甲胎蛋白(afp)中的至少一种。
15.步骤(1)所述的连接为生物素-链霉亲和素连接。
16.步骤(1)的具体步骤为:
17.将生物素修饰的靶激活dna与链霉亲和素修饰的检测抗体共同孵育,得到连接了靶激活dna的检测抗体。
18.步骤(2)所述的固定为固定在孔板中;优选固定后使用bsa进行封闭。
19.步骤(2)所述的捕获抗体的加入量为至少0.01mg;优选为至少0.1mg。
20.步骤(2)所述的清洗为使用pbst缓冲液清洗;优选为用pbst缓冲液清洗3次。
21.步骤(3)所述的孵育的条件为35~40℃,至少30min;优选为37℃,孵育1h。
22.步骤(4)所述的靶激活dna的检测抗体的加入量为至少0.05μm,优选为至少0.5μm。
23.步骤(4)所述的孵育的条件为35~40℃,至少20min;优选为37℃,孵育30min。
24.步骤(4)所述的清洗为使用pbst缓冲液清洗;优选为用pbst缓冲液清洗3次。
25.步骤(5)所述的孵育的条件为35~40℃,至少10min;优选为37℃,孵育20min。
26.步骤(5)所述的拉曼探针由表面偶联4-氨基苯硫酚(4atp)的银纳米颗粒(agnps@4atp)和表面修饰链霉亲和素的磁珠(sa-mbs)构成,两部分之间用生物素修饰的单链dna(ssdna)连接。
27.步骤(5)所述的crrna是一段核苷酸序列,能够与步骤(1)所述的靶激活dna互补结合;所述crrna可以作为cas12a蛋白的引导rna,帮助激活cas12a蛋白的酶活性;所述crrna特异性识别靶激活dna序列后激活cas12a的酶活性。
28.步骤(5)所述的检测拉曼信号为785nm激发激光下检测拉曼信号。
29.上述的检测拉曼信号为识别拉曼特征峰强度,依据标准曲线计算样品中的标志蛋白浓度;优选为识别4atp的拉曼特征峰(1074cm-1
)。
30.上述基于sers和crispr/cas联免疫吸附检测蛋白的方法在制备检测试剂盒中的应用。
31.上述的cas12a蛋白,通过crispr rna(crrna)识别特异性的核酸序列,激活其非特异性核酸内切酶活性,对样品中的ssdna进行随意剪切,操作更加稳定、简单。
32.步骤(1)所述的待测蛋白捕获抗体ab1为针对待测蛋白上特定抗原表位的抗体,待测蛋白检测抗体ab2为针对待测蛋白上特定抗原表位的抗体,但与ab1针对的表位不同。当体系中同时含有待测蛋白、ab1、ab2时,三者会形成三明治状的双抗体夹心结构。
33.上述的ab2通过生物素和链霉亲和素与靶激活dna偶联,当样品中含有待测蛋白时,形成ab
1-待测蛋白-ab2的双抗体夹心结构,被吸附在孔板中,与ab2相连的靶激活dna会被crrna识别,激活cas12a蛋白的非特异性核酸内切酶活性,对体系中的核酸分子进行剪切。
34.现有技术的缺点在于:从原理上就可看出,nano-clisa的缺点是操作复杂,检测时
间长(4h)。造成上述缺点的原因是其使用适配体形成夹心结构,适配体的特异性和敏感度不足,需要用金纳米的大比表面积实现核酸数量的放大;其次,信号探针用的是荧光探针,荧光探针的灵敏度不足,导致需要长时间孵育来弥补。
35.本发明相对于现有技术具有如下的优点及效果:
36.本发明提供了一种基于sers和crispr/cas联免疫吸附检测蛋白的方法,使用双抗体夹心法进行免疫吸附试验,取代适配体,提高灵敏度,此外使用比荧光信号更灵敏的表面增强拉曼信号作为传感信号,这样就可以不需要核酸数量的放大,反应时间也大大缩短了;此外,本发明可直接把激活序列与抗体通过生物素-链霉亲和素系统连接,提高了试剂的稳定性,减少了操作步骤。
附图说明
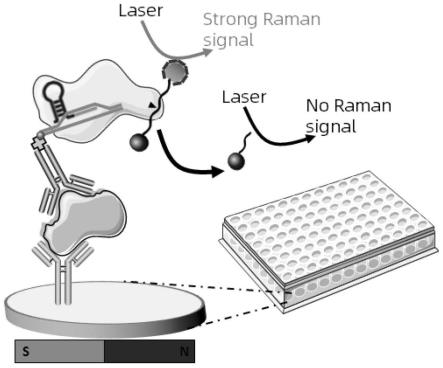
37.图1是sers和crispr/cas联免疫吸附检测蛋白的原理图。
38.图2是psa浓度与拉曼信号强度的检测曲线图。
39.图3是sars-cov-2n蛋白浓度与拉曼信号强度的检测曲线图。
40.图4是ifn-γ浓度与拉曼信号强度的检测曲线图。
41.图5是对比例中elisa法测试psa的检测结果图。
具体实施方式
42.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
43.下面实施方案中若未注明具体试验条件,则通常按照常规试验条件或按照试剂公司所建议的试验条件。所使用的材料、试剂等,若无特殊说明,均为从商业途径得到的试剂和材料。
44.实施例中使用的抗体和抗原均购自abcam公司,所使用的合成序列均由南京金斯瑞生物科技有限公司合成。
45.实施例1
46.本实施例中,以前列腺特异抗原(psa)作为分析物,对其进行定量分析。
47.1.拉曼探针的制备
48.取锥形瓶,称量90mg硝酸银,将90mg硝酸银溶解在500ml超纯水中,并将溶液加热至沸腾。将10ml 1%柠檬酸三钠水溶液逐滴滴加到沸腾的硝酸银溶液中,并用磁力搅拌器进行剧烈搅拌,将混合溶液再煮沸30分钟,产生稳定的灰绿色胶体银。将6μl的10mm 4atp(4-氨基苯硫酚)与1ml银纳米(即灰绿色胶体银)混合;将溶液在室温下持续搅拌1小时,并在4℃下以6000rpm离心10分钟,弃去上清液。将所得颗粒(agnps@4atp)重悬在1ml超纯水中。
49.将100μl链霉亲和素磁珠(mbs-sa,cat.#22307,购于苏州海狸生物医学工程有限公司)用磁力架洗涤3次,并用500μl buffer1重悬。将30μl 4mmsh-ssdna-biotin添加到mbs-sa中并孵育30分钟获得mbs-sa-biotin-ssdna-sh。
50.将mbs-sa-biotin-ssdna-sh与agnps@4atp室温孵育30分钟获得拉曼探针。将拉曼探针用磁力架清洗3次,4℃保存备用。
51.ssdna的序列为:
52.biotin-tttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttt-sh
53.2.caslisa的构建
54.ab
2-sa-biotin-靶激活dna的制备:将2μm生物素修饰的靶激活dna(用pbs缓冲液稀释)与0.5μm检测抗体ab
2-sa(ab2抗体使用链霉亲和素标记试剂盒合成后得到,试剂盒购自abcam公司,按试剂盒说明书进行制备)在室温下孵育30分钟,4℃备用。
55.捕获抗体ab1为:抗psa的鼠源单克隆抗体;
56.检测抗体ab2为:抗psa的鼠源单克隆抗体(与ab1针对的表位不一样);
57.生物素修饰的靶激活dna序列为:
58.biotin-gcttgtggccgtttacgtcgccgtccagctcgaccaggatgggcaccaccccggc;
59.3.激活cas12a的非特异ssdna酶活性并剪切拉曼探针
60.将100μl 1mg/ml捕获抗体ab1(用cbs缓冲液稀释)加入孔板中,在4℃下孵育过夜,用pbst清洗3次,加入100μl 10%bsa溶液,37℃封闭4小时,用pbst清洗3次,甩干,4℃备用。
61.将不同浓度的psa样品加入包被了ab1的孔板中,终浓度为0.1~10000pg/ml,37℃孵育1小时后,加入0.5μm的ab
2-sa-biotin-靶激活dna,37℃孵育30分钟后,用pbst缓冲液清洗3次,加入50nm lbcas12a、62.5nmcrrna、40 u rnase inhibitor和拉曼探针在37℃下孵育20分钟。将孔板用磁力架清洗3次,然后用100μl超纯水重悬。将孔板放置在便携式拉曼读板器中,使用便携式拉曼光谱仪在785nm激发激光下,功率为300mw,累积时间为10秒,对拉曼信号进行一一测量。明显识别出4atp的拉曼特征峰(1074cm-1
)并用于分析。
62.crrna序列为:
63.uaauuucuacuaaguguagaucgucgccguccagcucgacc;
64.上述lbcas12a、crrna、1
×
nebuffer 2.1均购买自new england biolabs(neb)公司。
65.3.实验结果
66.检测原理如图1所示,图2显示了psa的检测曲线图,由图可知,检测体系的信号随着psa分析物的增加而增强,检测灵敏度为10pg/ml。
67.实施例2
68.本实施例,以sars-cov-2n蛋白作为分析物,对其进行定量分析。
69.与实施例1的区别在于,用sars-cov-2n特异的捕获抗体ab1代替psa特异的捕获抗体ab1,用sars-cov-2n特异的检测抗体ab2代替psa特异的检测抗体ab2。
70.sars-cov-2n特异的捕获抗体ab1为:抗sars-cov-2n的鼠源单克隆抗体;
71.sars-cov-2n特异的检测抗体ab2为:抗sars-cov-2n的鼠源单克隆抗体(与ab1针对的表位不一样);
72.图3显示了sars-cov-2n蛋白的检测曲线图,由图可知,检测体系的信号随着sars-cov-2n蛋白分析物的增加而增强,检测灵敏度为10pg/ml。
73.实施例3
74.本实施例,以ifn-γ(γ干扰素)作为分析物,对其进行定量分析。
75.用ifn-γ特异的捕获抗体ab1代替psa特异的捕获抗体ab1,用ifn-γ特异的检测抗
体ab2代替psa特异的检测抗体ab2。
76.ifn-γ特异的捕获抗体ab1为:抗ifn-γ的鼠源单克隆抗体;
77.ifn-γ特异的检测抗体ab2为:抗ifn-γ的鼠源单克隆抗体(与ab1针对的表位不一样);
78.图4显示了ifn-γ的检测曲线图,由图可知,检测体系的信号随着ifn-γ分析物的增加而增强,检测灵敏度为10pg/ml。
79.对比例
80.该对比例中,以前列腺特异抗原(psa)作为分析物,使用psa elisa试剂盒,对其进行定量分析。
81.psa elisa试剂盒购自abcam抗体公司。
82.图5显示了psa的elisa检测曲线图,由图可知,检测体系的信号随着psa分析物的增加而增强,检测灵敏度为3.125ng/ml。结果表明,我们基于crispr的检测的灵敏度高于基于hrp的elisa。
83.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1