基于显微放大图像的血液目标细胞体积获取方法及系统与流程
1.本技术属基于细胞悬浮液显微放大数字图像获取目标样本中各成分特性和参数的技术领域,尤其涉及基于数字图像进行血液样本中红细胞或网织红细胞体积计算的技术领域。
背景技术:
2.现有技术中,对血液细胞中各种不同细胞的浓度和体积的分析,有不同的方法。其中之一是流式细胞仪利用电学检测原理或光学原理进行血液细胞的体积检测。无论是电学原理还是光学或光化学原理的细胞分析仪,其需要对小部分样品进行单个细胞依次进行识别;因此需要为单个细胞的流过设计精密的流体通道,并配合相应的复杂光学系统设计,以适应对单个细胞进行光电参数的捕获。需要复杂的流道设计和光学系统设计,系统硬件设计复杂成本高,且非常容易出现故障,通常需要定期维护以保证流道和光学系统维持正常工作状态;且这样的单细胞流道,细胞识别效率低;当细胞的形状特征发生变化时,识别的准确性会降低。
3.申请号为“cn2022107458528”名称为“基于显微放大数字图像的血液细胞分析方法及系统”的专利申请中设计了一种基于明场照明下的显微放大数字图像的血液细胞分析方法,能基于明场显微放大数字图像进行不同细胞类型的识别和计数,并计算出不同类型细胞的体积;用极简的硬件成本进行了全血细胞分析。且由于这样的方法基于明场图像,非常直观,准确性更好;既没有流式细胞中鞘流机构的设计,也没有复杂的分光光度计的设计;整个技术方案极简,从研发到使用维护的系统效率都很高,成本极低。然而,由于其是基于显微放大数字图像进行的体积计算,体积的计算是基于一定的形态建模特征上,对一些异常形态的细胞,无法获取其准确的体积信息。在部分建模的相关校准参数上,采用了现有技术中的部分计算参数,其校准参数的准确性也还有进一步的提升。在不同物种的红细胞进行分析时,由于不同物种的红细胞形态略有差异,采用单一的形态建模方式进行计算,其误差较大。
4.名词解释:wbc是英文“whitebloodcell”的缩写,中文意思是白细胞;在血液分析仪中wbc的含义是白细胞浓度,单位是“个/l”;rbc是英文“red bloodcell”的缩写,中文意思是红细胞;在血液分析仪中,rbc的含义是红细胞浓度,单位是“个/l”;hct是英文“hematocrit”的缩写,hct又称红细胞比容(pcv,packedcellvolume),中文意思是红细胞比容,是指一定体积的全血中红细胞所占容积的相对比例;在血液分析仪中,hct的含义是抗凝血积压后红细胞占全血的容积比;单位是%;hct测定可采用直接离心法(包括温氏法和微量法)或间接血细胞分析仪法测定;cv是英文“corpuscularvolume”的缩写,中文意思是红细胞体积;单位是“fl”;mcv是英文“meancorpuscularvolume”的缩写,中文意思是平均红细胞体积;在血
液分析仪中mcv的含义是所有红细胞的平均体积,即平均红细胞体积,单位是“fl”飞升;hgb是英文“hemoglobin”的缩写,中文意思是血红蛋白;在血液分析仪中hgb的含义是单位体积血液中的血红蛋白含量,即血红蛋白浓度,单位是“g/l”;ch是英文“corpuscularhemoglobin”的缩写,中文意思是红细胞的血红蛋白;在血液分析仪中ch的含义是单个红细胞的血红蛋白含量,单位是“pg”;mch是英文“meancorpuscularhemoglobin”的缩写,中文意思是平均红细胞血红蛋白含量;在血液分析仪中mch的含义是单个红细胞的平均红细胞血红蛋白含量,单位是“pg”皮克;mchc是英文“meancorpuscularhemoglobinconcentration”的缩写,中文意思是平均红细胞血红蛋白浓度;在血液分析仪中mchc的含义是单位体积红细胞的平均红细胞血红蛋白含量,单位是“g/l”;传统血液分析仪的计算过程中,mchc=hgb
÷
rbc
÷
mcv;mchc=mch
÷
mcv=hgb
÷
rbc
÷
mcv;mch=hgb
÷
rbc。
技术实现要素:
5.本技术要解决的技术问题在于避免现有技术上述不足之处,提出了一种基于显微放大图像的血液目标细胞体积获取方法;能基于显微放大数字图像进行血液单个红细胞或网织红细胞的体积的进行精准计算分析,将细胞的体积计算深入到单个细胞层面;且对异形细胞和切割异常进行了进一步的区分,提高了单个细胞体积计算的准确性;通过对细胞形态的分析和细胞投影形状的分析,能对相应的细胞进行适应性的处理,提高了不同状态红细胞体积计算的准确性;且能用一台设备对不同物种的血液进行分析,且通过选择物种类型,能选择相应物种血液最匹配的体积计算方法,大大提升了系统的适用范围,几乎适用于所有的宠物类血液分析,是一种可以跨物种的血液细胞体积分析方法,既能适用于人类以及与人类相似的物种,还能适用于其他的物种,大大拓展了血液细胞体积分析的深度和广度。
6.本技术解决上述技术问题的技术方案是一种基于显微放大图像的血液目标细胞体积获取方法,显微放大图像是基于血液细胞单层平铺在悬浮液中所获取的至少一幅显微放大数字图像;显微放大数字图像中包括了多个目标细胞的图像;目标细胞包括红细胞和/或网织红细胞;包括步骤5a:识别出显微放大数字图像中的目标细胞,获得显微放大数字图像中的每个目标细胞面积stc,并获得目标细胞面积平均值stca和目标细胞浓度;步骤5b1:获取每个目标细胞的长轴ax和短轴by数据,长轴ax=2a;短轴by=2b;获取已知的第二体积校正系数cvc2;单个目标细胞体积vtc=每个目标细胞面积stc
×
(目标细胞长轴半径a/目标细胞短轴半径b)
×
第二体积校正系数cvc2;其中a为长轴ax的半径,b为短轴by的半径;获取第二体积校正系数cvc2的步骤5b1da中包括以下步骤:步骤5b1da1:取获取显微放大数字图像所用的同一待分析的血液细胞的等量样品,获取目标细胞比容;步骤5b1da2:计算获取平均细胞体积zsc2=目标细胞比容/目标细胞浓度;步骤5b1da3:第二体积校正系数cvc2=平均细胞体积zsc2
÷
目标细胞面积平均值stca。
7.所述的基于显微放大图像的血液目标细胞体积获取方法,包括获取第二体积校正系数cvc2的步骤5b1da和/或获取第二体积校正系数cvc2的步骤5b1db:步骤5b1db中包括:
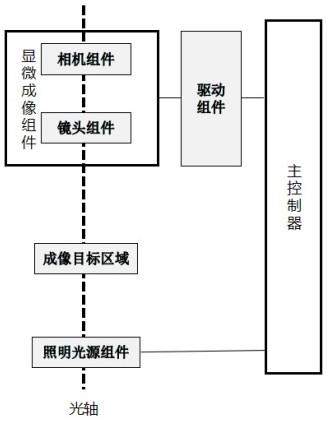
步骤5b1db1:取同一待分析的血液细胞样品,外部设备获取目标细胞的平均细胞体积zsc;步骤5b1db2:取和步骤5b1db1同一待分析的血液细胞样品,进行预处理制得细胞悬浮液,细胞悬浮液注入成像目标区域内;使血液细胞单层平铺在悬浮液中,并获取血液细胞单层平铺在悬浮液中的显微放大数字图像,并依据显微放大数字图像获取目标细胞面积平均值stca;步骤5b1db3:第二体积校正系数cvc2=平均细胞体积zsc
÷
目标细胞面积平均值stca。
8.步骤5a之后包括步骤5b1和/或步骤5b2:步骤5b2中:计算显微放大数字图像中的第一吸收参数α1=lg(空白平均灰度值/细胞像素平均灰度值);获取已知的第一体积校正系数cvc1;计算单个目标细胞体积vtc=第一吸收参数α1
×
每个目标细胞面积stc
×
第一体积校正系数cvc1;获取第一体积校正系数cvc1的步骤5b2ca中包括以下步骤:步骤5b2ca1:取获取显微放大数字图像所用的同一待分析的血液细胞的等量样品,获取目标细胞比容;步骤5b2ca2:计算获取平均细胞体积zsc2=目标细胞比容/目标细胞浓度;步骤5b2ca3:第一体积校正系数cvc1=平均细胞体积zsc2
÷
第一吸收参数α1
÷
目标细胞面积平均值stca。
9.所述的基于显微放大图像的血液目标细胞体积获取方法,包括获取第一体积校正系数cvc1的步骤5b2ca和/或获取第一体积校正系数cvc1的步骤5b2cb;步骤5b2cb中包括,步骤5b2cb1:取同一待分析的血液细胞样品,外部设备获取目标细胞的平均细胞体积zsc;步骤5b2cb2:取和步骤5b2cb1同一待分析的血液细胞样品,进行预处理制得细胞悬浮液,细胞悬浮液注入成像目标区域内;使血液细胞单层平铺在悬浮液中,并获取血液细胞单层平铺在悬浮液中的显微放大数字图像,并获取目标细胞面积平均值stca;步骤5b2cb3:依据步骤5b2cb2获得显微放大数字图像,计算显微放大数字图像中的第一吸收参数α1=lg(空白平均灰度值/细胞像素平均灰度值);步骤5b2cb4:第一体积校正系数cvc1=平均细胞体积zsc
÷
第一吸收参数α1
÷
目标细胞面积平均值stca。
10.步骤5a中,计算每个目标细胞面积stc时,获取每个目标细胞的长轴ax和短轴by数据的步骤,长轴ax=2a;短轴by=2b;判断长轴ax和短轴by之间的比值是否落入设定的阈值范围,该阈值范围是中心值为1的阈值范围;若长轴ax和短轴by之间的比值落入设定阈值范围,则将显微放大数字图像中的目标细胞投影的形态识别为圆形;目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×b2;
若长轴ax和短轴by之间的比值大于设定阈值范围,将显微放大数字图像中的目标细胞投影的形态识别为椭圆形;目标细胞面积stc=π
×a×
b;其中a为长轴ax的半径,b为短轴by的半径。
11.步骤5a中,计算每个目标细胞面积stc的步骤中,从显微放大数字图像识别出每个目标细胞的图像,计算每个目标细胞的图像中的像素点数,每个像素点的物理尺寸已知,以单个像素点的物理尺寸乘以计数目标细胞所占像素点个数,得到每个目标细胞面积stc。
12.获得显微放大数字图像中的每个目标细胞面积stc之前还包括以下步骤;步骤3a:将单个目标细胞的图像从显微放大数字图像提取或切割的步骤;步骤3b:判断步骤3a中单个目标细胞是属于正常细胞还是异常细胞,若属于异常细胞则转至步骤3c;若属于正常细胞则转至步骤3d;步骤3c:计算每个目标细胞的图像中的像素点数,每个像素点的物理尺寸已知,以单个像素点的物理尺寸乘以计数目标细胞所占像素点个数,得到每个目标细胞面积stc;步骤3d:判断步骤3b中单个正常目标细胞的外轮廓切割是否完整;若外轮廓切割不完整则转至步骤3e;步骤3e中包括:步骤3e1:获取每个目标细胞的长轴ax和短轴by数据的步骤,长轴ax=2a;短轴by=2b;步骤3e2:根据长轴ax和短轴by之间的比值是否落入设定的阈
值范围,该阈值范围是中心值为1的阈值范围;若长轴ax和短轴by之间的比值落入设定阈值范围,则将显微放大数字图像中的目标细胞投影的形态识别为圆形;目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×b2;
若长轴ax和短轴by之间的比值大于设定阈值范围,将显微放大数字图像中的目标细胞投影的形态识别为椭圆形;目标细胞面积stc=π
×a×
b;其中a为长轴ax的半径,b为短轴by的半径。
13.所述的基于显微放大图像的血液目标细胞体积获取方法,还包括步骤5f:加总显微放大数字图像中的各单个目标细胞体积vtc获取所有目标细胞体积avc,获取显微放大数字图像中的所有目标细胞数量ntc,计算目标细胞平均体积mcv=所有目标细胞体积avc
÷
所有目标细胞数量ntc。
14.所述的基于显微放大图像的血液目标细胞体积获取方法,包括步骤5m3:获取各目标血红蛋白含量ch,并根据各目标细胞体积vtc和各目标血红蛋白含量ch输出ch-cv联合散点图的步骤;ch-cv联合散点图用于统计不同体积目标细胞的血红蛋白分布规律;步骤5m4:在ch-cv联合散点图上展示至少一条ch范围指示线和至少一条cv范围指示线的步骤;步骤5m5:获取各目标细胞血红蛋白浓度chc;或获取各目标血红蛋白含量ch,计算chc=目标血红蛋白含量ch
÷
各目标细胞体积vtc;并根据各目标细胞的体积和目标细胞血红蛋白浓度chc输出chc-cv联合散点图的步骤;chc-cv联合散点图用于统计不同体积目标细胞的血红蛋白分布规律;步骤5m6:在chc-cv联合散点图上展示至少一条chc范围指示线和至少一条cv范围指示线的步骤。
15.步骤5m2:根据各单个目标细胞体积vtc,输出单个目标细胞体积vtc直方图的步骤;直方图用于统计不同目标细胞体积分布规律。
16.所述的基于显微放大图像的血液目标细胞体积获取方法,还包括目标细胞形态识别的步骤;当目标细胞形态识别被识别为类圆盘状目标细胞时,则再依据长轴ax和短轴by之间的比值进行细胞成像状态识别的步骤,当长轴ax和短轴by之间的比值落入设定的第一阈值范围内,则将显微放大数字图像中的目标细胞投影的形态识别为圆形,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当长轴ax和短轴by之间的比值落入设定的第一阈值范围之外,但落入设定第二阈值范围内,则将显微放大数字图像中的目标细胞投影的形态识别为椭圆形,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当长轴ax和短轴by之间的比值落入设定的第二阈值范围外,则将显微放大数字图像中的目标细胞投影的形态识别为梭形或长方形,选择进入步骤5b1进行每个目标细胞体积的计算,且每个目标细胞面积stc采用圆形建模公式计算,即每个目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×
b2。
17.所述的基于显微放大图像的血液目标细胞体积获取方法,其特征在于,还包括目标细胞形态识别的步骤;当目标细胞形态识别被识别为类球状目标细胞时,则再依据目标细胞的投影形态进行细胞成像状态识别的步骤,当目标细胞的投影形态为完整的圆形或椭圆形,则将细胞成像状态识别为正投影状态或轴测投影状态,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当目标细胞的投影形态为非完整的圆形或椭圆形,则将细胞成像状态识别为侧投影状态,选择进入步骤5b1进行每个目标细胞体积的计算,且每个目标细胞面积stc采用圆形建模公式计算,即每个目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×
b2。
18.所述的基于显微放大图像的血液目标细胞体积获取方法,还包括选择血液所属物种的步骤;并依据血液所属物种选择相应体积计算方法的步骤;当血液所属物种属于人类、猿类、猴类、犬类中的任意一种,则再依据长轴ax和短轴by之间的比值进行细胞成像状态识别的步骤,当长轴ax和短轴by之间的比值落入设定的第一阈值范围内,则将显微放大数字图像中的目标细胞投影的形态识别为圆形,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当长轴ax和短轴by之间的比值落入设定的第一阈值范围之外,但落入设定第二阈值范围内,则将显微放大数字图像中的目标细胞投影的形态识别为椭圆形,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当长轴ax和短轴by之间的比值落入设定的第二阈值范围外,则将显微放大数字图像中的目标细胞投影的形态识别为梭形或长方形,选择进入步骤5b1进行每个目标细胞体积的计算,且每个目标细胞面积stc采用圆形建模公式计算,即每个目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×
b2;所述目标细胞包括人血红细胞和/或犬血红细胞;当血液所属物种属于猫科动物中的任意一种,则再依据目标细胞的投影形态进行细胞成像状态识别的步骤,当目标细胞的投影形态为完整的圆形或椭圆形,则将细胞成像状态识别为正投影状态或轴测投影状态,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当目标细胞的投影形态为非完整的圆形或椭圆形,则将细胞成像状态识别为侧投影状态,选择进入步骤5b1进行每个目标细胞体积的计算,且每个目标细胞面积stc采用圆形建模公式计算,即每个目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×
b2;所述目标细胞包括猫血红细胞。
19.本技术解决上述技术问题的技术方案还可以是一种血液细胞分析系统,用于血液细胞分析,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,其特征在于,所述处理器执行所述程序时实现如上述的基于显微放大图像的血液目标细胞体积获取方法。
ꢁ
本技术解决上述技术问题的技术方案还可以是一种可读存储介质,其上存储有计算机程序,其特征在于,该程序被处理器执行时实现如上述的基于显微放大图像的血液目标细胞体积获取方法。
20.同现有技术相比较,本技术的有益效果之一,单个目标细胞体积vtc=每个目标细胞面积stc
×
(目标细胞长轴半径a/目标细胞短轴半径b)
×
第二体积校正系数cvc2;这一计算公式,非常适合与类圆盘形或类球形居多的物种血液红细胞体积计算,且通过每个目标细胞面积stc
×
(目标细胞长轴半径a/目标细胞短轴半径b)能将在成像过程中非圆形的轴测投影进行了矫正,使得计算结果更接近于真实的细胞体积;尤其是对类似硬币状即类圆盘状红细胞,在显微图像中出现侧投影的情况,也能很好地利用上述公式进行矫正,使得计算结果更接近于真实的细胞体积;利用第二体积校正系数cvc2再次进行体积的校准,使得计算结果更接近于真实的细胞体积。在细胞悬浮液中,细胞形态保持完整,细胞的体积测量也会更准确。使单个目标细胞体积的统计学分析就有了非常精准的基础,也使得针对单个目标细胞体积的统计分析能展开,为临床获取了更深一层的有价值信息。在多种贫血症的分型中,各种目标细胞体积的统计分析具有非常重要的临床价值。
21.同现有技术相比较,本技术的有益效果之二,通过对细胞形态的分析和细胞投影形状的分析,能对不同的细胞进行适应性的面积和体积计算方法的处理,提高了相应状态下的红细胞体积计算的准确性;且通过选择物种类型,能选择相应物种血液最匹配的体积
计算方法,大大提升了系统的适用范围,几乎适用于所有的宠物类血液分析,是一种可以跨物种的血液细胞体积分析方法,既能适用于人类以及与人类相似的物种,还能适用于其他的物种,大大拓展了血液细胞体积分析的深度和广度,能用一台设备对不同物种的血液进行分析,填补了跨物种血液分析系统的空白。
22.同现有技术相比较,本技术的有益效果之三,基于显微放大数字图像中的信息,对红细胞的体积计算有多种计算方法互相印证,保证了计算的可靠性。尤其是在对非人类物种的血液样品进行分析时,这样的互相印证是非常有必要的,能更好地保证测量结果的准确性。
23.同现有技术相比较,本技术的有益技术效果之四是,步骤5b1da2和步骤5b2ca2中,计算获取平均细胞体积zsc2=目标细胞比容/目标细胞浓度;其中目标细胞浓度采用的是当前基于血液细胞单层平铺在悬浮液中所获取的至少一幅显微放大数字图像所获取的目标细胞浓度;避免了采用等量样品进行平铺检测来获取目标细胞浓度的过程,提升了效率;也避免了采用现有技术中其他测量方法获取的目标细胞浓度而引入的偏差;采用第一吸收参数α1进行体积计算,吸收参数中也包含有细胞高度的信息,正常吸收系数越大,其细胞的高度也会相应增加。
24.同现有技术相比较,本技术的有益效果之五,基于显微放大数字图像中的信息,能同时进行多种细胞的体积计算,且成本低廉,无需事先进行离心的步骤,也无需复杂的流式细胞计数和分光光度计的测量过程。所有的计算都只是基于获取了足够放大倍数,且带有足够多信息的显微放大数字图像,颠覆了原有细胞分析仪的工作思路,是一种基于ai大数据图像处理技术在细胞分析领域的应用,是细胞分析仪的真正数字化。且单个细胞体积和单个细胞血红蛋白含量的联合,将单个细胞血红蛋白含量和单个细胞血红蛋白的体积联合进行统计学分析,为临床获取了更深一层的多维度的有价值信息。尤其是在多种贫血症的分型中,单细胞血红蛋白含量联合单个血红蛋白的体积的统计分析具有极其重要的临床价值同现有技术相比较,本技术的有益效果之六,从显微放大数字图像识别出每个目标细胞的图像,计算每个目标细胞的图像中的像素点数,每个像素点的物理尺寸已知,以单个像素点的物理尺寸乘以计数目标细胞所占像素点个数,得到每个目标细胞面积stc。采用像素点的物理大小进行目标面积的计算,大大简化了细胞面积计算的效率,是数字图像处理基础在细胞分析领域的高效得以发挥。
25.同现有技术相比较,本技术的有益效果之七在细胞面积计算之前,先对细胞形态的状态进行判断,对正常细胞(即正常形态的细胞)和异常细胞(即异常形态的细胞)先进行区分,根据区分结果进行不同的细胞面积计算算法匹配,使得异常形态细胞的面积和体积计算都更接近真实,更准确,在一些临床的形态异常病例的应用中非常有用,能避免将异常细胞当成正常细胞进行计算。
26.同现有技术相比较,本技术的有益效果之八,在计算细胞面积之前,先判断单个正常目标细胞的外轮廓切割是否完整;若外轮廓不完整则采用圆形或椭圆形的模型来进行细胞面积的计算,避免了因为切割算法误差导致的偏差,尤其是在部分红细胞不染色,且红细胞的红色比较弱时(如贫血导致的红细胞中血红蛋白偏少),其边缘容易被切割算法识别成背景,从而导致面积和体积的计算偏差。
附图说明
27.图1是显微图像获取装置的示意框图;图2是显微图像获取装置中光学部分的组成示意图;图3是成像目标区域的示意图;图中标号100是成像目标区域,包括了承载细胞悬浮液的芯片底座即试剂盒芯片;标号200是细胞悬浮液平铺区域,标号300是选取的一级视野目标成像区域;图4是成像目标区域一级视野的示意图;图中可见图3中的一级视野目标成像区域300被划分成了16个一级视野310;图5是成像目标区域分级视野的示意图;图中一级视野目标成像区域300被划分成了16个一级视野310;其中一个一级视野310又被划分成了25个二级视野510;图6是一个显微放大数字图像的局部,里面展示了目标细胞之一红细胞的不同状态;在细胞悬浮液中部分细胞处在完全展平的状态,其细胞主体所在中心平面和成像的光束正交,能获得其完整的正投影影像;在细胞悬浮液中部分细胞处在侧向悬浮状态,其细胞主体所在中心平面和成像的光束并不正交,因此只能获得其部分的投影影像;如图6中标号800所示的目标细胞,就处在这样的状态,此时投影是残缺的圆形或椭圆形;而图6中左上部分的几个目标细胞更接近于完整的正投影影像;图7是图6中一个椭圆形投影的示意图,图中长轴ax=2a,短轴by=2b;图8是正常细胞切割示意图之一,图中细胞外围黑色的是切割线;可见图中正常细胞的轮廓清晰规则,切割正常;图9是正常细胞切割示意图之二,图中左上角的正常细胞的轮廓并不太清晰,左上角的细胞出现了切割异常,切割线并未完整地切割出整个细胞;在部分细胞成像清晰度不足够的情况下,容易发生这样的切割异常;图10是包含有异常形态细胞的显微放大数字图像之一;图中存在部分正常形态细胞的图像,轮廓清晰规则,如标号c1所指的细胞;同时图中存在部分异常形态细胞的图像,轮廓清晰但不规则,如标号c2所指的细胞;图11是包含有异常形态细胞的显微放大数字图像之二;图中存在部分正常形态细胞的图像,轮廓清晰规则,如标号c3所指的细胞;同时图中存在部分异常形态细胞的图像,轮廓清晰但不规则,如标号c4所指的细胞;图12目标细胞和像素之间的关系示意图,底部轮廓为目标细胞,顶层的格子为像素示意;图13是类圆盘体状目标细胞正面在细胞悬浮液中的方向与显微成像的方向正交时,显微放大数字图像中呈现其正投影的模型示意图;图13至图18中箭头方向为显微成像时候光束入射的方向,即细胞成像的投影方向;图14是类圆盘体状目标细胞正面在细胞悬浮液中的方向与显微成像的方向斜交时,显微放大数字图像中呈现其轴测投影的模型示意图;图15是类圆盘体状目标细胞正面在细胞悬浮液中的方向与显微成像的方向侧交时,显微放大数字图像中呈现其侧投影的模型示意图;图16是类球体状目标细胞正面在细胞悬浮液中的方向与显微成像的方向正交时,显微放大数字图像中呈现其正投影的模型示意图;图中箭头方向为显微成像的方向;
图17是类球体状目标细胞正面在细胞悬浮液中的方向与显微成像的方向斜交时,显微放大数字图像中呈现其轴测投影的模型示意图;图18是类球体状目标细胞正面在细胞悬浮液中的方向与显微成像的方向侧交时,显微放大数字图像中呈现其侧投影的模型示意图。
具体实施方式
28.以下结合各附图对本技术的实施方式做进一步详述。
29.如图1至图3所示,一种用于获取显微放大图像的显微成像系统中,包括主控制器,显微成像组件,驱动组件和照明光源组件;显微成像组件包括透镜组件和相机组件,透镜组件也称镜头组件;透镜组件和相机组件组合在一起共同移动,显微成像组件用于获取成像目标区域范围内的显微放大后的数字化图像;显微成像组件和驱动组件连接,驱动组件控制显微成像组件相对于成像目标区域的距离;驱动组件和主控制器电连接,驱动组件接受主控制器指令,能带动显微成像组件沿着成像光轴移动,调整显微成像组件相对于成像目标区域的距离,以获取清晰的显微放大数字图像;成像目标区域设置在照明光源组件和显微成像组件之间;照明光源组件用于成像照明。
30.图2中,标号600是显微成像组件,标号620是相机组件,标号610是透镜组件;标号100是目标成像区域;标号700是照明光源组件;透镜组件610设置在成像目标区域上方,用于形成成像目标区域的显微放大数字图像;相机组件620用于获取该显微放大数字图像的数字化图像。
31.如图3所示,选择成像目标区域200中的一部分300,将该部分的成像目标区域划分成n1个一级视野;各一级视野范围大小设定成不同大小或相同大小,n1为大于等于2的自然数;将每个一级视野对应成像目标区域划分成m2个二级视野;各二级视野范围大小设定成不同大小或相同大小,m2为大于等于2的自然数;任选一个一级视野,以其中任意一个二级视野为聚焦目标,调整成像目标区域和显微成像组件的间距,使显微成像组件能获取该个二级视野的清晰的显微放大数字图像;在该焦距维持的状态下,在水平方向移动显微成像组件,使显微成像组件依次获取该二级视野对应的m2幅清晰的显微放大数字图像。
32.如图3所示,一种分级视野数字图像获取方法的实施例中,成像目标区域大小是12mm
×
14mm;即图3中标号为200的区域。选择成像目标区域中不小于四分之一的区域,即图3中标号为300的区域,如图4将其划分成16个一级视野;显微放大倍数范围是20倍至100倍。除了选择成像目标区域中的四分之一区域,还可以选择成像目标区域中的三分之一区域或五分之一区域或其他面积的大小。具体的成像目标区域面积大小,可跟随细胞悬浮液中体液和稀释液之间的稀释程度进行调整。细胞悬浮液中的血液细胞既包括染色后的细胞,也可以是没有染色后的细胞;在只进行部分细胞分析时,如只进行红细胞分析时,可以用不染色的细胞悬浮液。实际分割的区域数量可以根据分割区域大小和放大倍数进行调整以获得最佳的组合。
33.本技术中的细胞浓度是指单位体积内的细胞个数,因此浓度计算的实质是进行细胞计数。本技术中,显微放大数字图像是基于血液细胞单层平铺在悬浮液中所获取的至少一幅也可以是一组显微放大数字图像;一组显微放大数字图像中包括n
×
m幅显微放大数字图像;n和m均为大于等于1的自然数;从n
×
m幅显微放大数字图像选取x幅显微放大数字图
像用于目标细胞的浓度或体积计算,x为大于等于1的自然数;识别出所选中x幅显微放大数字图像中的目标细胞,并获得所选中x幅显微放大数字图像中的目标细胞数量ntc;x可以是1,当然也可以是其他数值;具体的数值,可以根据显微放大倍数、数字图像获取用的相机视野大小以及悬浮液的稀释浓度来平衡选择,数量只要能满足统计学上的基本要求即可。
34.一种基于显微放大图像的血液目标细胞体积获取方法的实施例中,显微放大图像是基于血液细胞单层平铺在悬浮液中所获取的至少一幅显微放大数字图像;显微放大数字图像中包括了多个目标细胞的图像;包括步骤5a:识别出显微放大数字图像中的目标细胞,获得显微放大数字图像中的每个目标细胞面积stc和目标细胞浓度;依据每个目标细胞面积stc,计算获取目标细胞面积平均值stca;步骤5a之后包括步骤5b1:获取每个目标细胞的长轴ax和短轴by数据的步骤,长轴ax=2a;短轴by=2b;获取已知的第二体积校正系数cvc2;单个目标细胞体积vtc=每个目标细胞面积stc
×
(目标细胞长轴半径a/目标细胞短轴半径b)
×
第二体积校正系数cvc2;其中a为长轴ax的半径,b为短轴by的半径;获取第二体积校正系数cvc2的步骤5b1da中包括以下步骤:步骤5b1da1:取获取显微放大数字图像所用的同一待分析的血液细胞的等量样品,获取目标细胞比容;步骤5b1da2:计算获取平均细胞体积zsc2=目标细胞比容/目标细胞浓度;步骤5b1da3:第二体积校正系数cvc2=平均细胞体积zsc2
÷
目标细胞面积平均值stca。目标细胞包括红细胞,此处的红细胞是指全生命周期的红细胞,尤其包括成熟状态的红细胞和/或网织红细胞;还可以包括其他生命周期的红细胞;例如晚幼红细胞、中幼红细胞、早幼红细胞、原始红细胞。
35.在另一些基于显微放大图像的血液目标细胞体积获取方法的实施例中,可以同时包括步骤5b1da和步骤5b1db,也可以选择其中任意一个步骤;当既包括获取第二体积校正系数cvc2的步骤5b1da,又包括第二体积校正系数cvc2的步骤5b1db时,第二体积校正系数cvc2可以是两个步骤计算出的第二体积校正系数cvc2的均值或加权平均数值,加权的权重可以根据血液样本和实际情况进行选择。
36.在一种基于显微放大图像的血液目标细胞体积获取方法的实施例中,步骤5b1db中包括:步骤5b1db1:取同一待分析的血液细胞样品,外部设备获取目标细胞的平均细胞体积zsc;步骤5b1db2:取和步骤5b1db1同一待分析的血液细胞样品,进行预处理制得细胞悬浮液,细胞悬浮液注入成像目标区域内;使血液细胞单层平铺在悬浮液中,并获取血液细胞单层平铺在悬浮液中的显微放大数字图像,并获取目标细胞面积平均值stca;步骤5b1db3:第二体积校正系数cvc2=平均细胞体积zsc
÷
目标细胞面积平均值stca。
37.一种基于显微放大图像的血液目标细胞体积获取方法的另一实施例中,步骤5a之后包括步骤5b2:计算显微放大数字图像中的第一吸收参数α1=lg(空白平均灰度值/细胞像素平均灰度值);获取已知的第一体积校正系数cvc1;计算单个目标细胞体积vtc=第一吸收参数α1
×
每个目标细胞面积stc
×
第一体积校正系数cvc1。第一体积校正系数cvc1的获取方法可以有多种,可以取其中任意一种,或者取多种方法获取的多个第一体积校正系数cvc1求其平均或加权平均,将多个第一体积校正系数cvc1的平均值或加权平均值用作计算用的第一体积校正系数cvc1。上述步骤中的显微放大数字图像包括至少一幅显微放大数字图像;血液中目标细胞是红细胞或网织红细胞。lg是对数运算符。
38.需要说明的是,计算显微放大数字图像中的第一吸收参数α1=lg(空白平均灰度值/细胞像素平均灰度值)。选择将单个细胞所在的区域做矩形的截图,即选择以该细胞为
中心的矩形区域来进行第一吸收参数α1的计算。空白平均灰度值的意思是取该矩形区域中没有被细胞所占据的区域的平均灰度值。细胞像素平均灰度值的意思是取该矩形区域中被细胞所占据的区域的平均灰度值。
39.上述实施例中,获取第一体积校正系数cvc1的步骤5b2ca中包括以下步骤:步骤5b2ca1:取获取显微放大数字图像所用的同一待分析的血液细胞的等量样品,获取目标细胞比容;步骤5b2ca2:计算获取平均细胞体积zsc2=目标细胞比容/目标细胞浓度;步骤5b2ca3:第一体积校正系数cvc1=平均细胞体积zsc2
÷
第一吸收参数α1
÷
目标细胞面积平均值stca。
40.上述实施例中,获取第一体积校正系数cvc1的步骤5b2cb中的步骤还可以包括以下步骤:步骤5b2cb1:取同一待分析的血液细胞样品,外部设备获取目标细胞的平均细胞体积zsc;步骤5b2cb2:取和步骤5b2cb1同一待分析的血液细胞样品,进行预处理制得细胞悬浮液,细胞悬浮液注入成像目标区域内;使血液细胞单层平铺在悬浮液中,并获取血液细胞单层平铺在悬浮液中的显微放大数字图像,并获取目标细胞面积平均值stca;步骤5b2cb3:依据步骤5b2cb2获得显微放大数字图像,计算显微放大数字图像中的第一吸收参数α1=lg(空白平均灰度值/细胞像素平均灰度值);步骤5b2cb4:第一体积校正系数cvc1=平均细胞体积zsc
÷
第一吸收参数α1
÷
目标细胞面积平均值stca。
41.由于第一吸收参数α1是和细胞尺寸是强相关的参数;根据朗博比尔定律,第一吸收参数α1的大小和细胞尺寸呈线性关系,因此可以利用吸收参数通过体积校正系数来获取目标细胞的体积。利用外部设备获取目标细胞的细胞体积zsc、目标细胞面积平均值stca和数量的过程与另一相应实施例中相同。
42.利用外部设备获取目标细胞的平均细胞体积zsc的方法可以有多种。对于其中的不同类型的细胞,其获取方法可以不同。对于网织红细胞和红细胞都可以采用现有技术中任意一种标准化测量设备获取其相应的平均细胞体积zsc。标准化测量设备可以是现有技术中的血液细胞分析系统或者更高测量准确性的其他设备。
43.对于红细胞,获取其平均细胞体积zsc的方法之一的过程包括:离心法先进行细胞分层,获取红细胞层占全血样本的体积比,即为红细胞比容也称红细胞压积hct;根据获得红细胞压积hct和对应全血样本的体积,计算该对应全血样本中的红细胞体积,即对应全血样本中的红细胞体积=该全血样本的体积
×
红细胞比积hct;红细胞浓度除了利用显微放大数字图像的方式获取之外,还可以利用从外部标准化测量设备获取的红细胞浓度,并根据红细胞浓度计算出对应全血样本中的红细胞数量=该全血样本的体积
×
红细胞浓度;平均细胞体积zsc=对应全血样本中的红细胞体积
÷
对应全血样本中的红细胞数量。获取红细胞浓度的外部标准化测量设备可以是现有技术中任意一种。红细胞比积hct也可以采用现有技术中已知的标准化测量设备获得。需要说明的是,在本技术中,利用外部设备计算各种校正系数过程中,已默认包含了必要的单位转换过程,即同一样本的定量转换过程,以上转换过程都为现有技术,不再赘述。
44.一种基于显微放大图像的血液目标细胞体积获取方法的另一实施例中,步骤5a中,计算每个目标细胞面积stc时,获取每个目标细胞的长轴ax和短轴by数据的步骤,长轴ax=2a;短轴by=2b;根据长轴ax和短轴by之间的比值是否落入设定的阈值范围,该阈值范围是中心值为1的阈值范围;若长轴ax和短轴by之间的比值落入设定阈值范围,则将显微放大
数字图像中的目标细胞投影的形态识别为圆形;目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×b2;
若长轴ax和短轴by之间的比值大于设定阈值范围,将显微放大数字图像中的目标细胞投影的形态识别为椭圆形;目标细胞面积stc=π
×a×
b;其中a为长轴ax的半径,b为短轴by的半径。
45.如图6和图7所示,图6是一个显微放大数字图像的局部,里面展示了目标细胞之一红细胞的不同状态;在细胞悬浮液中部分细胞处在完全展平的状态,其细胞主体所在中心平面和成像的光束正交,能获得其完整的正投影影像;在细胞悬浮液中部分细胞处在侧向悬浮状态,其细胞主体所在中心平面和成像的光束并不正交,因此只能获得其部分的投影影像;如图6中标号800所示的目标细胞,就处在这样的状态,此时投影是残缺的圆形或椭圆形;而图6中左上部分的几个目标细胞更接近于完整的正投影影像。图7是图6中一个椭圆形投影的示意图,图中长轴ax=2a,短轴by=2b。
46.在红细胞的投影面积计算时,根据长轴ax和短轴by之间的比值是否落入设定阈值范围,来进行投影近似圆程度的判断;若落入设定阈值范围,相当于该部分图像被识别为是红细胞的正投影;对红细胞的体积计算可以采用圆柱体模型,直接以该正投影的面积乘以高度参数获得红细胞的体积。若没有落入设定阈值范围,认为该部分投影是椭圆形,相当于该部分图像被识别为是红细胞的非正投影;在计算红细胞体积时,可以先将该椭圆形的面积换算成圆形正投影的面积再进行红细胞体积的计算。也就是在椭圆形面积的基础上再乘以a/b,或直接以长轴为半径计算面积用作红细胞体积计算时的圆柱形底面积。
47.一种基于显微放大图像的血液目标细胞体积获取方法的另一实施例中,步骤5a中还包括计算每个目标细胞面积stc的步骤;从显微放大数字图像识别出每个目标细胞的图像,计算每个目标细胞的图像中的像素点数,每个像素点的物理尺寸已知,以单个像素点的物理尺寸乘以计数目标细胞所占像素点个数,得到每个目标细胞面积stc。
48.在数字图像处理中,在一幅显微放大数字图像中需要先识别出目标细胞,进行体积计算的时,需要采用图像切割算法先将细胞从包含多个目标细胞的大图中将单个目标细胞切割出来,再去计算单个目标细胞面积;目标细胞正常情况下是圆形或类圆形,正常细胞成像切割出的外轮廓线条为圆形平滑曲线;当目标细胞受疾病或其他原因影响时,出现异常细胞,异常细胞成像切割出的外轮廓线条为波浪状曲线或瘤状突起,如果采用正常细胞的面积计算方式计算,导致面积计算偏多或偏少,引起体积计算的偏差。大多数目标细胞可被切割出完整的细胞外轮廓,因图像切割算法会受图片背景影响,极少数细胞被切割出的细胞外轮廓不完整,出现锯齿状边缘,导致面积计算偏多或偏少。
49.因此在部分实施例中,获得显微放大数字图像中的每个目标细胞面积stc之前还包括以下步骤;获得显微放大数字图像中的每个目标细胞面积stc之前还包括以下步骤;步骤3a:将单个目标细胞的图像从显微放大数字图像提取或切割的步骤;步骤3b:判断步骤3a中单个目标细胞是属于正常细胞还是异常细胞,若属于异常细胞则转至步骤3c;若属于正常细胞则转至步骤3d;步骤3c:计算每个目标细胞的图像中的像素点数,每个像素点的物理尺寸已知,以单个像素点的物理尺寸乘以计数目标细胞所占像素点个数,得到每个目标细胞面积stc;步骤3d:判断步骤3b中单个正常目标细胞的外轮廓切割是否完整;若外轮廓不完整则转至步骤3e;步骤3e中包括:步骤3e1:获取每个目标细胞的长轴ax和短轴by数据的步骤,长轴ax=2a;短轴by=2b;步骤3e2:根据长轴ax和短轴by之间的比值是否落入设定的阈
值范围,该阈值范围是中心值为1的阈值范围;若长轴ax和短轴by之间的比值落入设定阈值范围,则将显微放大数字图像中的目标细胞投影的形态识别为圆形;目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×b2;
若长轴ax和短轴by之间的比值大于设定阈值范围,将显微放大数字图像中的目标细胞投影的形态识别为椭圆形;目标细胞面积stc=π
×a×
b;其中a为长轴ax的半径,b为短轴by的半径。该阈值范围是[1,1.2]或[1,1.3],可以根据实际情况进行调整。
[0050]
步骤3b中是利用已受训练的ai人工智能模型b判断目标细胞是正常细胞或是异常细胞,如果经过步骤3b识别为异常细胞,则采用像素大小进行计算面积;如果经过步骤3b识别为正常细胞,则再进行切割外轮廓是否完整进行判断;利用已受训练的ai人工智能模型a对每个目标细胞成像及被切割出的外轮廓进行判断,判断切割出的外轮廓是否完整;详细的ai人工智能模型a可以是现有技术中的任意一种,在此不再赘述。
[0051]
如图8和图9所示;图8中正常细胞的轮廓清晰规则,图中细胞外围黑色的是切割线;可见图中正常细胞的轮廓清晰规则,切割正常。图9是正常细胞切割示意图之二,图中正常细胞的轮廓并不十分清晰,但是肉眼还是能识别出细胞的轮廓,但是在机器进行图像识别和切割时,左上角的细胞出现了切割异常,切割线并未完整地切割出整个细胞;在部分细胞成像清晰度不足够的情况下,容易发生这样的切割异常;对图9中的切割异常引起的形态识别的异常,需要加以关注,对该类切割异常需要进一步识别,以区别于异常细胞形态导致的形态异常,对图9这样的切割导致的异常,仍然可以用原来的形态计算模型即看成正常的圆形和椭圆形进行细胞面积的计算,避免了因为切割算法导致的偏差。
[0052]
如果是正常细胞且切割的轮廓正常,目标细胞面积stc计算方式采用上述任意一种计算方法。如果是异常细胞,stc计算方式采用计算每个目标细胞的图像中的像素点数,每个像素点的物理尺寸已知,以单个像素点的物理尺寸乘以计数目标细胞所占像素点个数,得到每个目标细胞面积stc。
[0053]
如图12所示,图中底层的大圈为目标细胞,上册小格为像素点区域示意,由于像素点的实际物理尺寸很小,因此直接用像素点来计算目标细胞的大小,准确性较高。如图10和图11所示,正常形态的细胞和异常形态的细胞往往同时存在同一样品中,尤其是在病理状态下,如食物中毒、遗传性血液疾病、脂类代谢异常、糖类代谢异常、肾功能损伤、骨髓造血异常等情况下,细胞形态异常是比较容易出现的异常,若还按照正常形态的模型进行面积和体积的计算会造成较大的偏差,尤其是异常形态细胞占比较高的情况下,偏差会更大;因此有必要先进行细胞形态正常和异常的识别,再进行面积和体积计算。因形态正常细胞与形态异常细胞有明显差异,所以可以训练ai人工智能模型进行判别。正常细胞和异常细胞的判断方法还可以是另外一种方法包括:
①
在细胞内找出第一位置的互相垂直的最长轴a和最短轴b,长度分别记为a0,b0;
②
向单一方向旋转x
°
,长度记为a1,b1;
③
再向同一方向旋转n次x
°
,总旋转度数(x
°×
n)《90
°
,依次记为a2,a3
……
an,b2,b3
……
,bn;
④
若符合a0-b0≥a1-b1≥a2-b2≥a3-b3
……
≥an-bn,n为自然数;则判为正常细胞,若不符合,则判为异常细胞。
[0054]
上述实施例中,血液中目标细胞包括红细胞、网织红细胞中的任意一种或多种。显微放大图像是基于血液细胞单层平铺在悬浮液中所获取的至少一幅显微放大数字图像;显微放大数字图像中包括了多个目标细胞的图像;识别出显微放大数字图像中的目标细胞,
提取或切割单个目标细胞的显微放大数字图像。基于显微放大数字图像中的目标细胞特征进行目标细胞浓体积计算,方法简单,计数和体积计算的准确率高。成像目标区域内置有包含血液细胞的细胞悬浮液,其中的细胞悬浮液盛放腔体是经由特殊设计的腔体,细胞悬浮液中基本是单层细胞平铺的状态用于细胞悬浮液成像。
[0055]
不同物种间目标细胞的形态有所差异,如图13至图15所示,有些物种的目标细胞形态是类圆盘体,在载玻片上的正投影为圆形或椭圆形、轴侧投影是圆形或椭圆形、侧投影是梭形或长方形。如图16至图18所示,有些物种的目标细胞形态是类球体,正投影是圆形、轴侧投影为圆形或椭圆形,侧投影是圆形或椭圆形。在一些特殊情况下,尤其是临床的病理状态下,会存在部分细胞是无法处于平铺或趋于平铺的状态,而是垂直悬浮状态,这样的情况会在图像上表现为其细胞形态的侧投影;相对于平铺状态形成的正投影,和趋于平铺状态的轴测投影,侧投影若还用常规的细胞面积计算算法,会导致更大的计算偏差;而产生侧投影的细胞,通常是细胞有异常,但形态本身也是趋于规则的,才能悬浮于悬浮液中,因此对侧投影,取其长短轴中的长轴进行体积的计算,会更接近于细胞的真实体积。即采用单个目标细胞体积vtc=每个目标细胞面积stc
×
(目标细胞长轴半径a/目标细胞短轴半径b)
×
第二体积校正系数cvc2;其中a为长轴ax的半径,b为短轴by的半径;这样的计算方法更接近于真实状态。且对圆形血红细胞的物种,采用该算法也更接近于真实的体积;避免了部分细胞在图像上的轴测投影导致的体积计算偏差。
[0056]
如图13至图15所示,当目标细胞是类圆盘体时,在悬浮液中在重力和浮力影响下自然沉降,会出现三种姿态,如图13所示,第一种姿态为目标细胞平躺在载玻片上,正投影为圆形或椭圆形,占大多数;如图14所示,第二种姿态为是倾斜躺在载玻片上,投影为圆形或椭圆形,占少数;如图15所示,第三种姿态为是侧躺在载玻片上,正投影为梭形或长方形,占极少数,且只有目标细胞为类圆盘体时才会出现,此时目标细胞受姿态影响,正投影成像的各种形态间面积差异较大。在该种情况下,若单个目标细胞体积vtc=每个目标细胞面积stc
×
第二体积校正系数cvc2,这样的单个目标细胞体积的计算误差较大;而采用单个目标细胞体积vtc=每个目标细胞面积stc
×
(目标细胞长轴半径a/目标细胞短轴半径b)
×
第二体积校正系数cvc2;利用目标细胞长轴半径a/目标细胞短轴半径这一公式对每个目标细胞面积stc进行修正后,细胞的面积的计算结果会更接近于真实的细胞面积,其体积计算的准确性也会因此得以提升。
[0057]
如图16至图18所示,当目标细胞是类球体时,在悬浮液中在重力和浮力影响下自然沉降,会出现两种姿态,如图16所示,第一种姿态为目标细胞平躺在载玻片上,正投影为圆形或椭圆形;如图17所示,第二种姿态为是倾斜躺在载玻片上,投影为圆形椭圆形,占少数;此时目标细胞成像面积受姿态影响较小,正投影成像的各种形态间面积差异小较小。如图18所示,第三种姿态为是竖向立在载玻片上,投影为部分的圆形或椭圆形,占少数;对于这样的单个目标细胞体积的计算若采用像素点进行计算会,误差较大;而采用单个目标细胞体积vtc=每个目标细胞面积stc
×
(目标细胞长轴半径a/目标细胞短轴半径b)
×
第二体积校正系数cvc2;利用目标细胞长轴半径a/目标细胞短轴半径b这一公式对每个目标细胞面积stc进行修正后,细胞的面积的计算结果会更接近于真实的细胞面积,其体积计算的准确性也会因此得以提升。
[0058]
在一些基于显微放大图像的血液目标细胞体积获取方法的实施例中,先进行目标
细胞形态识别的步骤;当目标细胞形态识别被识别为类圆盘状目标细胞时,则再依据长轴ax和短轴by之间的比值进行细胞成像状态即细胞姿态识别的步骤,当长轴ax和短轴by之间的比值落入设定的第一阈值范围内,则将显微放大数字图像中的目标细胞投影的形态识别为圆形,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当长轴ax和短轴by之间的比值落入设定的第一阈值范围之外,但落入设定第二阈值范围内,则将显微放大数字图像中的目标细胞投影的形态识别为椭圆形,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当长轴ax和短轴by之间的比值落入设定的第二阈值范围外,则将显微放大数字图像中的目标细胞投影的形态识别为梭形或长方形,选择进入步骤5b1进行每个目标细胞体积的计算,且每个目标细胞面积stc采用圆形建模公式计算,即每个目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×
b2。第一阈值范围可以是[1.0,1.2]或[1.0,1.3];第二阈值范围可以是(1.2,2.5]或(1.3,2.6]。具体的第一阈值范围和第二阈值范围在实际应用中可以根据不同的应用场景进行调整。
[0059]
当目标细胞形态识别被识别为类球状目标细胞时,则再依据目标细胞的投影形态进行细胞成像状态识别的步骤,当目标细胞的投影形态为完整的圆形或椭圆形,则将细胞成像状态识别为正投影状态或轴测投影状态,选择进入步骤5b1或步骤5b2进行每个目标细胞体积的计算;当目标细胞的投影形态为非完整的圆形或椭圆形,则将细胞成像状态识别为侧投影状态,选择进入步骤5b1进行每个目标细胞体积的计算,且每个目标细胞面积stc采用圆形建模公式计算,即每个目标细胞面积stc=π
×
a2,或目标细胞面积stc=π
×
b2。
[0060]
在一些基于显微放大图像的血液目标细胞体积获取方法的实施例中,还包括选择血液所属物种的步骤;并依据血液所属物种选择相应体积计算方法的步骤;当血液所属物种属于人类、猿类、猴类、犬类中的任意一种,所述目标细胞包括人血红细胞和/或犬血红细胞;后续的目标细胞体积计算步骤和目标细胞形态识别被识别为类圆盘状目标细胞时的体积计算步骤一致。
[0061]
当血液所属物种属于猫科动物中的任意一种,所述目标细胞包括猫血红细胞,后续的目标细胞体积计算步骤和目标细胞形态识别被识别为类球体状目标细胞时的体积计算步骤一致。
[0062]
两种目标细胞体积的计算公式都适用于本文中提到的各类场景下的目标细胞计算,按照本文对目标细胞形态进行区分后,可根据目标细胞的各类形态特点采用不同计算方式,从而使体积计算更精准。能将极少数的类圆盘体侧躺姿态的目标细胞体积计算变得更精准。
[0063]
上述计算和识别算法,在异常细胞出现概率增大时,能提升计算的准确性。
[0064]
在实际临床应用中,尤其是在兽用设备中,对有些无法采用现有常规血液分析仪进行测试对比获得的动物血液样本,也可以利用该方法获得相应的计算参数。
[0065]
上述用于红细胞、网织红细胞体积计算的血液细胞分析方法的实施例中,还包括步骤5f:加总显微放大数字图像中的各单个目标细胞体积vtc获取所有目标细胞的体积avc,获取显微放大数字图像中的所有目标细胞数量ntc,计算目标细胞平均体积mcv=所有目标细胞的体积avc
÷
所有目标细胞数量ntc。
[0066]
基于显微放大图像的血液目标细胞体积获取方法的实施例中包括,步骤5m:根据各单个目标细胞体积vtc,加总各单个目标细胞体积vtc求平均,计算获取目标细胞平均体
积。步骤5m2:根据各单个目标细胞体积vtc,输出单个目标细胞体积vtc直方图的步骤;直方图用于统计不同目标细胞体积分布规律。
[0067]
基于显微放大图像的血液目标细胞体积获取方法的实施例中包括,步骤5m3:获取各目标血红蛋白含量ch,并根据各目标细胞体积vtc和各目标血红蛋白含量ch输出ch-cv联合散点图的步骤;ch-cv联合散点图用于统计不同体积目标细胞的血红蛋白分布规律;步骤5m4:在ch-cv联合散点图上展示至少一条ch范围指示线和至少一条cv范围指示线的步骤;步骤5m5:获取各目标细胞血红蛋白浓度chc;或获取各目标血红蛋白含量ch,计算chc=目标血红蛋白含量ch
÷
各目标细胞体积vtc;并根据各目标细胞的体积和目标细胞血红蛋白浓度chc输出chc-cv联合散点图的步骤;chc-cv联合散点图用于统计不同体积目标细胞的血红蛋白分布规律。步骤5m6:在chc-cv联合散点图上展示至少一条chc范围指示线和至少一条cv范围指示线的步骤。
[0068]
一种血液细胞分析系统的实施例中,用于血液细胞分析,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,其特征在于,所述处理器执行所述程序时实现上述的基于显微放大图像的血液目标细胞体积获取方法。一种可读存储介质的实施例中,其上存储有计算机程序,该程序被处理器执行时实现如上述的基于显微放大图像的血液目标细胞体积获取方法。
[0069]
本技术中的基于显微放大图像的血液目标细胞体积获取方法及系统,识别出显微放大数字图像中的目标细胞,并获得显微放大数字图像中的每个目标细胞面积stc;单个目标细胞体积vtc=每个目标细胞面积stc
×
(目标细胞长轴半径a/目标细胞短轴半径b)
×
第二体积校正系数cvc2;或单个目标细胞体积vtc=第一吸收参数α1
×
每个目标细胞面积stc
×
第一体积校正系数cvc1。目标细胞体积计算,方法简单准确性高;使单个目标细胞体积的统计学分析就有了非常精准的基础,为临床获取了更深一层的有价值信息。能对不同状态、不同形态、不同物种的细胞进行适应性的面积和体积计算方法的处理,提高了相应状态下的红细胞体积计算的准确性。
[0070]
本技术中的第一、第二这样的序号只是为了表达方便,并不必然表示大小和时序上的顺序关系。步骤中的字母和序号,也只是为了表达的方便,并不必然表示时序上的顺序关系。
[0071]
如图1至图18所示以上所述仅为本技术的实施例,并非因此限制本技术的专利范围,凡是利用发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本技术的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1