基于光热弛豫定位显微镜的非荧光分子超分辨成像系统
1.本发明属于超分辨成像领域,具体涉及一种基于光热弛豫定位显微镜的非荧光分子超分辨成像系统。
背景技术:
2.超越衍射极限的光学成像为原位分析提供了结构和动态的见解,并在许多领域发现了富有成效的应用。基于荧光的超分辨率显微镜作为最广泛采用的成像技术,通过受激损耗(sted)机制或随机光学重构(palm或storm)将分辨率突破光学衍射极限,以精确定位荧光分子的位置。但此类技术需要特殊的荧光分子或复杂的采集方式。应对此问题,基于荧光的饱和效应的超分辨成像技术被开发出来,通过解调其强度调制中的高阶谐波突破分辨率,比如饱和激发显微镜(sax)。但是,这些超分辨成像最根本的挑战来自于对荧光标记的依赖性,其发展受到荧光标记的细胞毒性、标记效率和特异性的限制。
3.因此,无标记成像技术成为一大技术目标。为此,人们为内源性生物分子或材料的超分辨成像做出了巨大的努力。与sted机制类似,电子激发态的损耗被用于提高材料成像的分辨率,包括材料的饱和瞬态吸收(stan)以及通过吸收分子的不均匀漂白的光声成像。在结构化泵探针显微镜上展示了另一种结构化照明方法。同时,由焦点处的非均匀强度引起的非线性响应已被用于提高分辨率,包括非线性光声显微镜(nl-pam)和非线性光热成像(ni-ptm)。然而,这些技术大多基于信号的饱和效应以及光热非线性,因此,成像的目标分子种类有限,并且需要高功率的脉冲激光,这些阻碍了上述技术的广泛应用。
4.除了运用电子吸收进行无标记成像,振动光谱,如红外(ir)和拉曼(raman)光谱,提供了基于内秉分子态振动的分子结构信息,被用来朝着具有分子选择性的无标记超分辨成像发展,例如结构光照明拉曼显微镜。在近十年来,基于相干拉曼散射的超分辨成像得以展示,包括高阶相干反斯托克斯拉曼散射(ho-cars)、饱和相干反斯托克斯拉曼散射和饱和受激拉曼散射(ssrs)。然而,基于拉曼光谱技术的一个最根本限制是极弱的拉曼效应。相干拉曼散射超分辨成像需要高峰值功率的超快激光器来激发的高阶光学非线性,这增加了很高的光损伤风险,并且限制了其在生物学上的应用。
5.另一方面,红外光谱具有由于高散射截面而具备的高灵敏度,并且有低光子能量、极低光损伤等特点,随着近年来发展起来的中红外光热(mip)成像技术日益关注。传统红外成像的分辨率由于衍射极限被限制在几微米,与典型的光学显微镜分辨率相差甚远。虽然近场红外成像技术,如利用原子力显微镜为基础的红外光谱(afm-ir)实现了纳米级的空间分辨率,但是物理探针的使用限制了广泛的应用,尤其是在细胞内的成像。另一方面,mip将分子振动光谱技术融合进了光热成像技术,展示了对活细胞和生物的远场选键的三维成像。mip成像的分辨率达到了300nm级别,通过一束短波长可见光作为探测光来探测分子振动吸收产生的光热效应,从而突破了常规红外成像的衍射极限一个数量级。虽然mip成像满足远场、非接触和非侵入式红外成像技术的需要,但它仍然是一种受限于探测光衍射极限的成像方式,其分辨率远达不到超分辨的需求。因此,该领域目前缺乏一种普遍适用的无标
记超分辨成像方法。
技术实现要素:
6.鉴于上述,本发明的目的是提供一种基于光热弛豫定位显微镜的非荧光超分辨成像方法,该方法可以实现无标记、高灵敏、大光谱范围、低光损伤的远场超分辨成像,实现了近100nm的超分辨成像的空间分辨率。
7.为实现上述发明目的,实施例提供的一种基于光热弛豫定位显微镜的非荧光分子超分辨成像系统,包括泵浦光源,探测光源,显微镜、光电探测器、多阶谐波信号提取设备,成像处理设备;
8.所述显微镜的载物台载有待测样品,并能够对待测样品进行三维空间位移扫描,载有至少一个物镜用于聚焦激光,使得泵浦光和探测光的焦点重叠;
9.所述泵浦光源提供脉冲形式的泵浦光,该泵浦光通过物镜聚焦于待测样品,待测样品选择性吸收泵浦光后通过光热弛豫进行能量耗散,产生光热透镜效应;
10.所述探测光源提供连续的探测光,该探测光通过物镜聚焦照射到被泵浦光作用的待测样品,该作用导致探测光产生空间和时间上的变化,即调制,该调制在频域展现特征主要表现为:在高次谐波频率上,能够探测到更小的空间结构,能够超过探测光的衍射极限分辨率;
11.所述光电探测器采集经过调制的探测光并转换为电信号后输入至多阶谐波信号提取设备;
12.所述多阶谐波信号提取设备将电信号与谐波产生器输出的谐波频率的正弦信号混合后,通过低通滤波提取多阶谐波信号;
13.所述成像处理设备依据三维空间位移扫描时提取的多阶谐波信号进行超分辨成像,每个阶次的谐波信号形成一张图像,其中,阶次越高,形成越高分辨率的图像,分辨率依次增加的图像组成图像序列。
14.优选地,所述超分辨成像系统包括第一探测光路,基于该第一探测光路实现第一探测模式,其中,第一探测模式为探测光源的探测光与泵浦光源的泵浦光在物镜中方向相对,且探测光对待测样品实现背向探测;
15.第一探测光路为:泵浦光源输出的泵浦光经过第二物镜聚焦到待测样品,探测光源输出的探测光经过分束镜透射输入第一物镜,经过第一物镜聚焦照射到被泵浦光作用的待测样品,经过待测样品调制后的探测光反射回传到分束镜,并由分束镜反射后经过透镜聚焦穿过针孔,再经过滤光片滤光后被光电探测器接收。
16.优选地,所述超分辨成像系统包括第二探测光路,基于该第二探测光路实现第二探测模式,其中,第二探测模式为探测光源的探测光与泵浦光源的泵浦光在物镜中方向相对,且探测光对待测样品实现前向探测;
17.第二探测光路为:泵浦光源输出的泵浦光经过二向色镜透射输入第二物镜,经过第二物镜聚焦到待测样品,探测光源输出的探测光经过第一物镜聚焦到照射到被泵浦光作用的待测样品,经过待测样品调制后的探测光穿透待测样品后经过第二物镜输入二向色镜,并由二向色镜反射后经过透镜聚焦穿过针孔,再经过滤光片滤光后被光电探测器接收。
18.优选地,所述超分辨成像系统包括第三探测光路,基于该第三探测光路实现第三
探测模式,其中,第三探测模式为探测光源的探测光与泵浦光源的泵浦光在物镜中同向,且探测光对待测样品实现背向探测;
19.第三探测光路为:泵浦光源输出的泵浦光经过二向色镜反射输入第一物镜,经过第一物镜聚焦到待测样品,探测光源输出的探测光经过分束镜透射再经过二向色镜透射输入第一物镜,经过第一物镜聚焦照射到被泵浦光作用的待测样品,经过待测样品调制后的探测光经过第一物镜反射回传到二向色镜,经过二向色镜透射后再经过分束镜反射经过透镜聚焦穿过针孔,然后经过滤光片滤光后被光电探测器接收。
20.优选地,所述超分辨成像系统包括第四探测光路,基于该第四探测光路实现第四探测模式,其中,第四探测模式为探测光源的探测光与泵浦光源的泵浦光在物镜中同向,且探测光对待测样品实现前向探测;
21.第四探测光路为:泵浦光源输出的泵浦光经过二向色镜反射输入第一物镜,经过第一物镜聚焦到待测样品,探测光源输出的探测光经过二向色镜透射输入第一物镜,经过第一物镜聚焦照射到被泵浦光作用的待测样品,经过待测样品调制后的探测光穿透待测样品后经过第二物镜经过透镜聚焦穿过针孔输入至滤光片,然后经过滤光后被光电探测器接收。
22.优选地,探测光源输出的探测光首先经过单模光纤滤波处理后再经过光路传输至第一物镜。
23.优选地,所述探测光源出射紫外、可见光的连续探测光。
24.优选地,所述多阶谐波信号提取设备采用多通道数字锁相放大器,多通道数字锁相放大器对输入的电信号进行多阶谐波解调,以在频域中提取多阶谐波信号;
25.利用多通道数字锁相放大器对输入的电信号进行多阶谐波解调时,采用的基频为泵浦光源的脉冲重复频率。
26.优选地,对于中红外光,物镜采用反射式物镜,包括卡塞格林物镜、史瓦西物镜,该反射式物镜用于对中红外波段的泵浦光的聚焦进行聚焦优化。
27.优选地,物镜采用高数值孔径物镜,包括空气镜、水浸润以及油浸润物镜,用于对探测光的聚焦进行聚焦优化。
28.与现有技术相比,本发明具有的有益效果至少包括:
29.(一)通过对经过待测样品的光热效应和光热能量耗散调制的探测光进行多阶谐波解调后,根据从频域中提取高阶谐波信号进行超分辨成像,这样不需要荧光标记即可以实现对具有光学吸收度的分子或结构的超分辨成像,从根本上解决了常规超分辨成像所依赖的荧光分子的问题,包括光漂白、标记效率问题和标记选择性问题等多种限制,更从原理上排除了特殊设计荧光分子、高功率激光造成光伤害等超分辨荧光的种种限制。
30.(二)与传统的衍射受限的光热成像相比,本发明进一步突破了探测光的分辨率极限,分辨率优于传统光热成像。横向与轴向分辨率都获得显著性提升。尤其是在中红外泵浦下的光热高阶谐波提取成像中,能够探测并分辨出细胞中更小的脂滴以及蛋白结构。
31.(三)本发明的泵浦光功率依赖性在光热高阶谐波下均为线性,避免了常规非线性光热激发所需要的极高泵浦光能量及其对样品的光损伤问题。
32.(四)本发明具有广泛的兼容性,基于典型的光热成像显微镜,应用本发明即可得到超分辨功能,可以同时输出从基频到高次谐波的图像序列。并且本发明从设计上兼容荧
光成像和非线性光热成像。
33.(五)本发明对所涉及的光的吸收没有限制,包括但不限于电子吸收、振动吸收和振转吸收等,在材料科学、生物、医学等多个领域具有实际的应用。
附图说明
34.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图做简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动前提下,还可以根据这些附图获得其他附图。
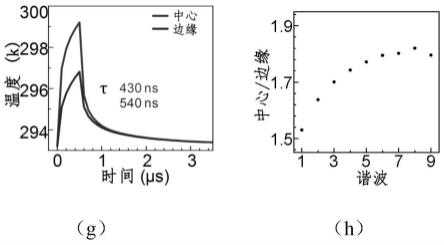
35.图1是实施例提供的光热弛豫成像的原理,其中,(a)为光热过程的能级图和温度响应;(b)为脉冲序列激发的光热(pt)过程,样品在加热(i)和光热耗散(ii)这两个状态中切换;(c)为在物体中心和边缘探测到的光热信号,由于位置相关的光热耗散,表现出不同的弛豫性质,即边缘由于膨胀效应更明显,向外做功使得该位置升温较低;(d)为在(c)中心和边缘检测到的谐波成分,其中h1,h2,
…
,hn为解调谐波阶数;(e)为两个相距40nm的200nm微球的1阶谐波温度响应的模拟计算结果;(f)为两个相距40nm的200nm微球的9阶谐波温度响应的模拟计算结果,比例尺为200nm;(g)为在下球中心和边缘的温度演化过程;(h)为中间信号与边缘信号在1至9阶谐波下的强度比;
36.图2为实施例提供的非荧光分子超分辨成像系统的结构图;
37.图3为实施例提供的多阶谐波信号提取设备提取多阶谐波信号的示意图;
38.图4为实施例提供的四种探测模式示意图;其中,(a)背向探测,对向泵浦;(b)前向探测,对向泵浦;(c)背向探测,同向泵浦;(d)前向探测,对向泵浦;
39.图5为实施例提供的e-pearl成像性能表征与细胞成像应用。其中,(a)为30nm合成的金纳米颗粒(aunps)的tem图像,比例尺为100nm;(b)为金纳米颗粒的传统光热成像(h1);(c)为单个30nm的金纳米颗粒在不同阶谐波下的e-pearl成像;(d)为1、4、7、11阶谐波下的轴向e-pearl成像,比例尺为500nm;(e)不同谐波阶pearl成像横向分辨率(点)及其拟合结果(虚线),误差棒表示对成像进行二维高斯拟合的标准差;(f)为单个金纳米颗粒的e-pearl信号、信噪比与谐波阶数的关系;(g)为选定谐波阶(1、9、20)下单个30nm的金纳米颗粒e-pearl信号的泵浦光功率依赖性;(h)为吞噬金纳米颗粒的细胞的反射光成像;(i)为同个细胞内的金纳米颗粒(aunp)的e-pearl成像,比例尺为5μm;(j)为(i)中放大图像,用于与传统光热成像进行分辨率比较,左图为h1阶次,右图为h5阶次,比例尺为5μm;(k)和(m)为(j)中h1阶次图像和h5阶次图像中箭头所示的信号强度剖面图;
40.图6为实施例提供的在中红外吸收下的v-pearl成像的性能表征,(a)为200nm pmma微球在1730cm-1
c=o波段的1至12阶谐波下的v-pearl成像;(b)测量了2μm pmma微球的光热弛豫迹,边缘距离中心900nm;(c)在(b)中的光热弛豫迹的fft;(d)在(c)中的谐波强度比(中心/边缘);(e)在(a)中的半最大值处测量的半峰全宽(fwhm),误差条表示对成像进行二维高斯拟合的标准差,比例尺为200nm;(f)γ-戊内酯在一、四次谐波解调时v-pearl信号的功率依赖性;
41.图7是实施例提供的成软骨细胞的v-pearl成像,其中,(a)-(b)成软骨细胞在8次谐波下1750cm-1
脂质c=o带和1650cm-1
酰胺i带的v-pearl成像,虚线圈表示细胞核,箭头表
示蛋白液滴和细胞骨架;(c)脂质通道(a)和蛋白质通道(b)合并的v-pearl成像;(d)分别在(a)(b)所示点获得的脂滴和蛋白质液滴的光热光谱;(e)在(a)中的虚线框所示的同一区域,通过常规mip(h1)和v-pearl(h8)放大图像,箭头表示v-pearl成像显示的小脂滴;(f)为(e)图白色箭头所指的1次和8次谐波解调信号剖面图,比例尺为10μm;
42.图8是实施例提供的酿酒酵母活细胞的v-pearl成像,(a)酵母细胞反射图像;(b)和(c)分别为酵母细胞在1750cm-1
脂质c=o伸缩振动和1650cm-1
酰胺i波段的四次谐波解调的v-pearl图像;(d)测量(b)中脂滴在一次谐波和四次谐波解调下的尺寸分布;(e)为(a),(b)和(c)的空间频率谱;(f)为酵母细胞的反射成像图,(g)和(h)分别为酵母细胞在1750cm-1
脂质c=o波段和1650cm-1
酰胺i波段的v-pearl图像;(i)来自(b)和(c)白框的v-pearl重叠图像;(j)酵母细胞中两个液滴的强度曲线(如(h)中的箭头所示)和高斯拟合,为了视觉清晰,曲线进行了垂直偏移;(k)为酵母细胞中v-pearl观察到的小于100nm的特征;(m)为(k)中的剖面强度图与高斯拟合,图中比例尺为1μm。
具体实施方式
43.为使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例对本发明进行进一步的详细说明。应当理解,此处所描述的具体实施方式仅仅用以解释本发明,并不限定本发明的保护范围。
44.针对现有荧光超分辨成像依赖于荧光标记,但荧光标记分子的细胞毒性、标记效率低,以及难以标记小分子等局限,导致超分辨成像受限制的问题,以及针对无标记超分辨成像中所需高激光功率所导致的光损伤风险以及在生物体中应用受到的限制的问题,实施例提供了一种基于光热弛豫定位显微镜的非荧光分子超分辨成像系统,通过该系统超分辨成像不需要额外的荧光标记,使用场景拓宽到任意具有光学吸收的分子或结构,在生物、医学、材料和物理等研究和应用领域具有不可替代的价值。
45.经研究发现,通过光学探测不均匀光热弛豫进而打破光学衍射极限,将该技术称为光热弛豫定位(pearl)。pearl显微镜的概念是光热弛豫过程的时间特征定位。脉冲泵浦光激发产生的光热过程包括两个步骤,由振动吸收产生的加热阶段和通过热弛豫产生的光热能量耗散阶段,如图1中(a)的加热阶段i和光热耗散阶段ii。对于均一样品中,虽然单位体积内分子吸收的能量是恒定的,但是最终的光热升温的效果是不一样的,这是因为吸收的能量更加倾向于在边缘处通过膨胀而转换成光声成分,如图1中(b-c)所示。这种光热能量耗散在空间和时间上演化,并由探测光的焦斑进行探测,高频下的信号在边缘处降低地更快,如图1中(d)所示。这种特征可以在频域提取,提取方法有诸多种,其中一种是通过锁相放大器进行高阶谐波解调。
46.为了进一步阐述pearl的超分辨成像机制,实施例中提供了计算模拟的pearl分辨率提升的结果。建模所述样品位两个直径200nm,并且相距40nm的聚甲基丙烯酸甲酯(pmma)微球。通过快速傅里叶变换提取出的温度演化场的高阶谐波成分,最终的结果呈现出了显著性的分辨率提升,如图1中的(d)所示。并且微球中心与边缘的光热弛豫的时间演化也有明显的差别,中心与边缘的比值在高阶谐波也呈现上升,表明了清晰的分辨率提升,如图1中的(g-h)所示。
47.基于以上,实施例提供了一种基于光热弛豫定位显微镜的非荧光分子超分辨成像
系统,如图2所示,包括泵浦光源1,探测光源2,显微镜3、光电探测器4以及多阶谐波信号提取设备5,成像处理设备6。
48.所述显微镜3的载物台载有待测样品,并能够对待测样品进行三维空间位移扫描,载有至少一个物镜用于聚焦激光,使得泵浦光和探测光的焦点重叠;泵浦光源1提供脉冲形式的泵浦光,该泵浦光通过物镜聚焦于待测样品,待测样品选择性吸收泵浦光后通过光热弛豫进行能量耗散,产生光热透镜效应;探测光源2提供连续的探测光,该探测光通过物镜聚焦照射到被泵浦光作用的待测样品,该作用导致探测光产生空间和时间上的变化,即调制,该调制在频域展现特征主要表现为:在高次谐波频率上,能够探测到更小的空间结构,能够超过探测光的衍射极限分辨率;光电探测器4采集经过调制的探测光并转换为电信号后输入至多阶谐波信号提取设备;如图3所示,多阶谐波信号提取设备5将电信号与谐波产生器输出的谐波频率的正弦信号混合后,通过低通滤波提取多阶谐波信号;成像处理设备6用于根据多阶谐波信号进行超分辨成像。
49.当利用显微镜1对待测样品进行三维空间位移扫描时,光电探测器4实时采集逐像素扫描位置的探测光并转换成电信号,多阶谐波信号提取设备5实时从电信号中提取多阶谐波信号,该多阶谐波信号包括从基频(h1)信号至高阶谐波(h25)信号甚至更高阶谐波信号,统合待测样品全像素位置的同一阶次的谐波信号(电压值)形成一张图像,对应一个分辨率。其中,阶次越高,形成图像的分辨率越高,直至分辨率达到100nm左右,分辨率依次增加的图像组成图像序列。
50.如图4所示,通过搭建不同的探测光路,实现四种不同的探测模式。
51.如图4中(a)所示,超分辨成像系统包括第一探测光路,基于该第一探测光路实现第一探测模式,其中,第一探测模式为探测光源的探测光与泵浦光源的泵浦光在物镜中方向相对,且探测光对待测样品实现背向探测,简称背向探测,对向泵浦;其中,第一探测光路为:泵浦光源输出的泵浦光经过第二物镜聚焦到待测样品,探测光源输出的探测光经过分束镜透射输入第一物镜,经过第一物镜聚焦照射到被泵浦光作用的待测样品,经过待测样品调制后的探测光反射回传到分束镜,并由分束镜反射后经过透镜聚焦穿过针孔,再经过滤光片滤光后被光电探测器接收。采用的针孔结构用于对探测光进行共聚焦,实现空间滤波,尤其提高z轴分辨率,进而提高激光光斑质量更高。
52.如图4中(b)所示,超分辨成像系统包括第二探测光路,基于该第二探测光路实现第二探测模式,其中,第二探测模式为探测光源的探测光与泵浦光源的泵浦光在物镜中方向相对,且探测光对待测样品实现前向探测,简称前向探测,对向泵浦;其中,第二探测光路为:泵浦光源输出的泵浦光经过二向色镜透射输入第二物镜,经过第二物镜聚焦到待测样品,探测光源输出的探测光经过第一物镜聚焦到照射到被泵浦光作用的待测样品,经过待测样品调制后的探测光穿透待测样品后经过第二物镜输入二向色镜,并由二向色镜反射后经过透镜聚焦穿过针孔,再经过滤光片滤光后被光电探测器接收,此处的针孔的作用是进行共聚焦探测,提高z轴分辨率。
53.如图4中(c)所示,超分辨成像系统包括第三探测光路,基于该第三探测光路实现第三探测模式,其中,第三探测模式为探测光源的探测光与泵浦光源的泵浦光在物镜中同向,且探测光对待测样品实现背向探测,简称背向探测,同向泵浦;其中,第三探测光路为:泵浦光源输出的泵浦光经过二向色镜反射输入第一物镜,经过第一物镜聚焦到待测样品,
探测光源输出的探测光经过分束镜透射再经过二向色镜透射输入第一物镜,经过第一物镜聚焦照射到被泵浦光作用的待测样品,经过待测样品调制后的探测光经过第一物镜反射回传到二向色镜,经过二向色镜透射后再经过分束镜反射经过透镜聚焦穿过针孔,然后经过滤光片滤光后被光电探测器接收。
54.如图4中(d)所示,超分辨成像系统包括第四探测光路,基于该第四探测光路实现第四探测模式,其中,第四探测模式为探测光源的探测光与泵浦光源的泵浦光在物镜中同向,且探测光对待测样品实现前向探测,简称为前向探测,同向泵浦;第四探测光路为:泵浦光源输出的泵浦光经过二向色镜反射输入第一物镜,经过第一物镜聚焦到待测样品,探测光源输出的探测光经过二向色镜透射输入第一物镜,经过第一物镜聚焦照射到被泵浦光作用的待测样品,经过待测样品调制后的探测光穿透待测样品后经过第二物镜经过透镜聚焦穿过针孔输入至滤光片,然后经过滤光后被光电探测器接收。
55.实施例中,光电探测器可以采用高带宽光电二极管,通过高带宽光电二极管对探测光进行前向或背向采集。如图4所示,探测光的输出端设有改变传播方向的透镜组,具体组成透镜组的反射镜和透射镜的个数和位置不受局限,只要引导调制的探测光传输即可。探测光源输出的探测光首先经过单模光纤滤波处理后再经过光路传输至第一物镜,通过单模光纤滤波能够提高成像系统的图像质量。
56.实施例中,如图4所示,滤光片的输入端设有聚焦光路的透镜组。具体透镜组包含的两个凸透镜之间设有一个针孔,该针孔用于对探测光进行共聚焦探测,以消除杂散光和镜面反射的干扰,提高z分辨率。
57.如图4中(a)和(b)所示,实施例提供的非荧光分子超分辨成像系统中,照射到待测样品的泵浦光与探测光方向相反,且共线,这样的设计可以对两个波长相差较大的激光分别进行优化,并在空间上进行微调,使得两个焦点重叠,从而最大化光热信号。此外,根据实际情况可以进行背向探测,如图4中(a)和(c)所示。
58.实施例中,多阶谐波信号提取设备采用多通道数字锁相放大器,多通道数字锁相放大器对输入的电信号进行多阶谐波解调,以在频域中提取多阶谐波信号;利用多通道数字锁相放大器对输入的电信号进行多阶谐波解调时,采用的基频为泵浦光源的脉冲重复频率。
59.实施例提供的非荧光分子超分辨成像系统中,泵浦光源出射可见光到中红外波长的泵浦光,这样范围的泵浦光可以探测多种不同分子。实施例中,对中红外波长的泵浦光,显微镜的物镜采用反射式物镜,如卡塞格林物镜或史瓦西物镜,该物镜用于对中红外波段的泵浦光的聚焦进行聚焦优化。对探测光,显微镜的物镜可以采用高数值孔径物镜,该高数值孔径物镜用于对探测光的聚焦进行聚焦优化,提高分辨率。
60.下面结合具体的待测样品对上述非荧光分子超分辨成像系统的成像应用进行说明。
61.当采用可见光泵浦进行电子吸收的光热弛豫定位成像,简称e-pearl成像时,以波长为532nm的脉冲纳秒激光器作为泵浦光源,以波长638nm连续波激光器作为探测光源,泵浦光源发射的泵浦光与探测光源出射的探测光共线合束后,发送至显微镜上的第一物镜上,如图4中(c)所示,通过第一物镜对光束聚焦后照射到载物台上待测样品,以对待测样品进行扫描,待测样品振动吸收泵浦光产生光热效应后通过光热弛豫产生光热能量耗散,产
生光热透镜效应;探测光通过物镜聚焦照射到被泵浦光作用的待测样品,该作用导致探测光产生空间和时间上的变化,即调制,该调制在频域展现特征主要表现为:在高次谐波频率上,能够探测到更小的空间结构,能够超过探测光的衍射极限分辨率。经过时间调制的探测光被光电探测器采集和转换后输入至多通道数字锁相放大器。多通道数字锁相放大器对输入的探测光进行多阶谐波解调。如图3所示,解调时采用的基频(即一阶谐波)采用泵浦光源的重复频率,即脉冲激光每秒发出的脉冲个数。在解调时,可以选择任意阶谐波(n次谐波阶,n=1,2,
…
,n)进行解调,提取每个信道的幅值和相对相位。探测光通过光电二极管转换为电信号后,可以进行高速数字化数模转换进行采集,从而进行任意谐波的数字解调,可以无损地执行任意数量的谐波信号,然后利用高阶谐波信号进行超分辨成像,得到新的且更清晰的图像,而不会影响基频的传统光热图像。
62.实施例中,对如图5中(a)所示的具有宽吸收带和低细胞毒性的金纳米颗粒(aunps)进行e-pearl成像的性能研究与细胞应用。与如图5中(b)所示的传统的衍射受限的光热成像相比,e-pearl成像在高阶谐波下的空间分辨率显著提高,在横向和轴向都超过了衍射极限,如图5中(c-e)所示。分辨率从370nm到270nm,横向分辨率提高了1.4倍,超过探测光的衍射极限。受光电探测器带宽和多通道数字锁相放大器带宽的限制,谐波次数高于22(11mhz)的信号未被采集,只要光电探测器和多通道数字锁相放大器带宽够用,能够采集高于22阶的谐波信号。增加的一系列新的图像,不仅在更高的谐波阶数上分辨率更高,同时提供了通过多维图像处理进一步提高图像质量的可能性。
63.如图5中(f)所示,e-pearl成像的谐波信号显示出对泵浦功率的高度的线性依赖性,这表明pearl不同于基于非线性信号生成的超分辨成像模式,具有独特的机制。非线性信号是由高阶热扰动或非线性吸收产生的,例如饱和、非线性共振等,发生在极高泵浦光功率激发下。因此,这些模式需要严格的正弦波形的泵浦光,其中任何寄生频率成分将导致不必要的背景。相比之下,pearl信号来源于弛豫曲线的谐波信号,并且应该与泵浦光强度线性相关。这种关系避免了使用高功率激光脉冲,适用于更广泛的吸收场景。
64.实施例中,通过成像癌细胞对aunps的摄取,展示了e-pearl成像在生物系统中的应用,如图5中(h)-(i)。纳米结构的细胞摄取已被广泛应用于生物和医学的光热成像,如疾病标志物。与未调制的反射成像相比,光热成像具有aunps的高光热转换的优点,光热成像以高对比度获取了aunps在细胞体内的分布。通过如图5中(j)、(k)、(m)的详细的对比,e-pearl成像在空间分辨率上优于常规光热成像,为纳米结构的细胞分布和材料成像提供了新的方法。
65.当采用中红外泵浦、可见光探测进行光热弛豫定位成像,即建立用于振动光谱的pearl显微镜,简称v-pearl成像。探测光源出射的波长为405nm的探测光作为衍射极限分辨率和高光子能量的光损伤之间的平衡,并由于其较短的波长而增加了散射,提高了背向探测模式下的光子数,进一步提高了信噪比。采用卡塞格林物镜和高数值孔径物镜对泵浦光束和探针光束的聚焦分别进行了聚焦优化,进行对向传播。光热调制探测光束可以通过高带宽光电二极管的正向或背向探测模式进行收集。这里,为了消除杂散光和镜面反射的干扰,在背向探测路径上共聚焦放置了一个针孔。
66.进一步地,测试分辨率,对平均尺寸为200nm的聚甲基丙烯酸甲酯(pmma)微球进行v-pearl成像如图6中(a)所示,红外泵浦波长设置在1730cm-1
c=o伸缩振动峰。反射图像中
pmma微球的半峰全宽(fwhm)约为310nm,而v-pearl图像中测量的fwhm在10次谐波时从325
±
3nm减少到126
±
6nm,如图6中(e)所示。在较高的谐波下,信噪比降低了约2.8倍,但获得了2.6倍的分辨率提高。尽管如此,考虑到红外吸收的高信号水平和在高阶谐波下1/f噪声的降低,这样的折衷在实验上对提高分辨率是值得的。
67.实施例中还测量了单个2μm pmma微球的中心和边缘位置探测光束的光热弛豫,如图6中(b)-(d)。两个位置的弛豫都由一个加热和一个耗散过程组成:一个是在几十纳秒的时间尺度上的快速耗散,另一个是在微秒尺度上的长时间耗散。快速耗散部分主要是由于光声传递,处于微球中心处强度下降16%,边缘下降68%,了光热转换效率的差异。另一部分是更为缓慢的指数衰减型弛豫,中心和边缘的弛豫时间分别为3.8μs和6.7μs。光热弛豫可以描述为fft波形所示的各种谐波分量的傅立叶级数,如图6中(c)所示,其中心与边缘之间的强度比在高阶谐波时增大,如图6中(d)所示。这与仿真结果具有一致性。此外,实施例中验证了v-pearl信号的线性功率依赖性,如图6中的(f)所示。
68.实施例中还展示了v-pearl的哺乳动物细胞成像应用。细胞器的生理功能直接受其空间分布的调节,而细胞器的分布受细胞骨架介导的转运的精细控制。其中,脂质液滴(ld)已成为一种重要的细胞器,对细胞的生存和状态起着至关重要的作用。ld作为多功能细胞器,其功能是储能单元、有毒代谢物的存储空间或信号转导平台,其分布是决定其功能的关键。基于荧光的超分辨成像在揭示细胞器运输和相互作用机制方面做出了巨大贡献。然而,并不是所有的生物分子或细胞器都能被有效地进行荧光标记,并且常常收到标记分子的显著影响。在这里,实施例使用哺乳动物细胞的超分辨红外成像来展示无标记的细胞器示踪。在脂质1750cm-1
c=o对称振动峰和蛋白质的1650cm-1
酰胺i带峰对培养三天的成软骨细胞进行v-pearl成像,解调波数为8阶,如图7中(a)-(c)所示。实施例发现了大量的ld在细胞体内积累,如图7中(a)、(c)所示。大部分蛋白质信号分布在细胞质和细胞核中,显示软骨细胞呈纺锤形。并且还观察到一些蛋白液滴,如图7中(b)所示。实施例中还发现ld沿着细胞骨架紧密定位,如图7中(c)所示,这表明ld通过这些富含蛋白质的结构运输。ld和蛋白液滴的原位红外光热光谱验证了其分子结构,如图7中(d)所示。重要的是,v-pearl能分辨出更多300-400nm的小ld特征,这是传统mip成像(mip,h1)由于分辨率不足而无法达到的,如图7中(e)和(f)所示,在这类难以标记或获取分子信息的细胞器的空间和光谱可视化方面都具有巨大潜力。
69.本实施例还提供了对酵母细胞的v-pearl超分辨成像。酵母是研究细胞生物学,特别是脂质代谢的一个强大的模型生物。然而,在单个酵母细胞约2-4μm大小的情况下,一个主要的限制是缺乏工具来可视化微小的ld(通常为0.05-0.5μm)。实施例首次使用v-pearl显微镜对酵母细胞进行亚细胞远场红外成像。酵母细胞含有稀疏的ld,在反射图像中不明显,如图8中(a)所示。在四次谐波v-pearl成像中,单个ld在1750cm-1
处可见,而在1650cm-1
酰胺i带发现了蛋白质信号,如图8中(b)和(c)。实施例还测量了细胞内ld的大小分布,如图8中(d)所示,显示在1次和4次谐波解调之间ld大小的直方图有明显的差异。这些ld的平均尺寸在1阶解调(传统mip)下为197
±
19nm,4阶解调下为185
±
16nm。此外,还比较了成像图的空间频率分布,其中v-pearl显示出更丰富的空间频率分量,特别是在较高的空间频率,这代表着更高的空间分辨率,如图8的(e)所示。此外,v-pearl成像发现小ld和一对蛋白滴(每个约170nm)之间有细微的空间分离结构,如图8中(i)所示。与1650cm-1
的理论的红外分
辨率相比,该方法的分辨率提高了43.5倍。同时,线廓和高斯拟合显示出在2次和3次谐波处分辨率提高的趋势。相比之下,在常规mip中只发现了一个带有轻微肩的单峰,如图8中(j)所示。此外,在酵母的v-pearl成像中观察到的最小特征是~86nm,这是第一次用远场红外成像分辨出100nm以下的特征,如图8中的(k),(m)所示。
70.以上所述的具体实施方式对本发明的技术方案和有益效果进行了详细说明,应理解的是以上所述仅为本发明的最优选实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充和等同替换等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1