一种评估肿瘤内三级淋巴结构的试剂盒及其方法与流程
1.本发明涉及生物学检测领域,更具体地,涉及评估肿瘤内三级淋巴结构的试剂盒及其方法。
背景技术:
2.目前,已经有多种抗pd-l1/pd-1的药物被获批用于实体瘤的治疗,但大多数用药患者并没有从中获益。三级淋巴结构(tertiary lymphoid structures,tls)是指在非淋巴组织中发现的类淋巴结构。tls多见于多种处于发炎状态的组织中,可驱动免疫细胞活化,其形成与慢性炎性疾病、自身免疫病和癌症等多种慢性疾病有关。在肿瘤环境中,tls可促进免疫细胞浸入实体瘤,因而tls的发展与未经治疗的患者的生存率显著相关。这使得三级淋巴结构是有效预测免疫检查点抑制剂疗效的生物标志物。
3.目前临床常用的评估三级淋巴结构的技术为免疫组化(immunohistochemistry,ihc)技术,利用抗原抗体反应原理对肿瘤组织进行染色,由专业病理医生在显微镜下对多张切片的染色进行分析,该技术需耗费较多的肿瘤组织切片,获得的信息较为粗糙,对判读者的要求较高,且不能反应各类细胞在空间上的关系。
技术实现要素:
4.为了解决上述技术问题,本发明提供了一种评估肿瘤内三级淋巴结构的试剂盒及其方法,能够在一张组织切片的玻片上实现多重荧光的免疫组化染色,可以同时对多种靶点分子进行标记,能够避免浪费宝贵的临床肿瘤样本,节省了样本。
5.一方面,本发明实施例提供了一种评估肿瘤内三级淋巴结构的试剂盒,所述试剂盒包括:非特异性蛋白阻断剂、一抗、二抗和荧光染料,
6.所述非特异性蛋白阻断剂为牛血清白蛋白,所述一抗包括五种标记物,所述五种标记物分别为:标记物cd8、标记物cd20、标记物cd23、标记物panck和标记物pdl1,所述二抗包括辣根过氧化物酶标记的igg抗体,所述荧光染料包括:与所述标记物cd8相配合的荧光染料ppd480、与所述标记物cd20相配合的荧光染料ppd520、与所述标记物cd23相配合的荧光染料ppd570、与所述标记物panck相配合的荧光染料ppd620和与所述标记物pdl1相配合的荧光染料ppd690,所述二抗为与所述荧光染料相配合的二抗工作液。
7.具体地,所述试剂盒还包括抗原修复液,所述抗原修复液包括免疫组化抗原修复液。
8.具体地,所述试剂盒还包括抗原修复液,所述抗原修复液为三羟甲基氨基甲烷缓冲液或乙二胺四乙酸缓冲液。
9.具体地,所述试剂盒还包括加固液,所述加固液为浓度为10%的中性福尔马林溶液。
10.具体地,所述试剂盒还包括水化剂,所述水化剂为包括浓度分别为100%、95%和75%的乙醇。
11.具体地,所述标记物cd8的稀释倍数为200倍,所述标记物cd20的稀释倍数为400倍,所述标记物cd23的稀释倍数为1000倍,所述标记物panck的稀释倍数为400倍,所述标记物pdl1的稀释倍数为250倍。
12.具体地,所述试剂盒还包括:缓冲液、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,dapi)工作液、封片剂、脱蜡剂和灭菌去离子水。
13.另一方面,本发明实施例提供了一种采用上述试剂盒评估肿瘤内三级淋巴结构的方法,所述方法包括:
14.步骤1:将带有标本的玻片进行脱蜡和水化处理,得到预处理玻片;
15.步骤2:将所述预处理标本进行加固,得到加固玻片;
16.步骤3:高温煮沸抗原修复液后,向所述抗原修复液中加入所述加固玻片并低温加热10分钟,得到修复后的玻片;
17.步骤4:将所述修复后的玻片用灭菌去离子水清洗1次,再用缓冲液冲洗1次,去除多余的水分,用组化笔圈画出组织,并滴加所述非特异性蛋白阻断剂,室温保湿并振荡孵育10分钟,并弃去所述非特异性蛋白阻断剂;
18.步骤5:滴加稀释后的所述一抗中的一种标记物,于室温保湿振荡孵育30~60min,用缓冲液冲洗3次,每次2分钟;
19.步骤6:弃去所述缓冲液,滴加所述二抗,于室温保湿震荡孵育10分钟,用所述缓冲液冲洗3次,每次2分钟,弃去所述缓冲液;
20.步骤7:滴加所述荧光染料中与所述一种标记物相配合的荧光染料,于室温保湿震荡孵育10分钟,用所述缓冲液冲洗2分钟,得到第一次染色的玻片;
21.步骤8:将所述抗原修复液煮沸1min,放入所述第一次染色的玻片于低温加热10分钟,取出自然冷却至室温;
22.步骤9:重复四次步骤5~8,使所述五种标记物分别进行标记。
23.步骤10:滴加4',6-二脒基-2-苯基吲哚工作液并于室温保湿孵育10min,用缓冲液清洗后滴加封片剂进行封片处理;
24.步骤11:评估肿瘤内三级淋巴结构。
25.具体地,使用成像显微镜采集光谱图像和分析软件对所述肿瘤内三级淋巴结构进行评估。
26.具体地,所述标记物cd8稀释200倍,所述标记物cd20稀释400倍,所述标记物cd23稀释1000倍,所述标记物panck稀释400倍,所述标记物pdl1稀释250倍。
27.具体地,所述五种标记物按照所述标记物cd23、所述标记物cd20、所述标记物panck、所述标记物pdl1和所述标记物cd8的顺序依次分别进行标记。
28.具体地,在本实施例中低温均指的是低功率加热,使其温度保持在98℃~100℃之间。
29.具体地,所述评估肿瘤内三级淋巴结构的方法包括:采用每种所述标记物各自对应的荧光通道进行检测,并使用成像显微镜采集荧光光谱图像和分析软件对所述肿瘤内三级淋巴结构进行评估,所述标记物cd8对应480nm荧光通道,所述标记物cd20对应570nm荧光通道,所述标记物cd23对应620nm荧光通道,所述标记物panck对应690nm荧光通道,所述标记物pdl1对应520nm荧光通道。
30.本发明实施例提供的试剂盒根据高效价对应低强度信号染料以及各染料间补偿最少的原则,完成对抗体与荧光染料的最优匹配。利用本发明实施例提供了试剂盒评估肿瘤内三级淋巴结构能够在一张组织切片的玻片上实现多重荧光的免疫组化染色,可以同时对多种靶点分子进行标记,能够避免浪费宝贵的临床肿瘤样本,节省了样本,同时还能分析在在同一张切片玻片内各个靶点在空间上的关系。
31.本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在说明书、权利要求书以及附图中所特别指出的结构来实现和获得。
附图说明
32.附图用来提供对本发明技术方案的进一步理解,并且构成说明书的一部分,与本技术的实施例一起用于解释本发明的技术方案,并不构成对本发明技术方案的限制。
33.图1是本发明实施例提供的标记物cd8于480nm荧光通道上的荧光图。
34.图2是本发明实施例提供的标记物cd20于570nm荧光通道上的荧光图。
35.图3是本发明实施例提供的标记物cd23于620nm荧光通道上的荧光图。
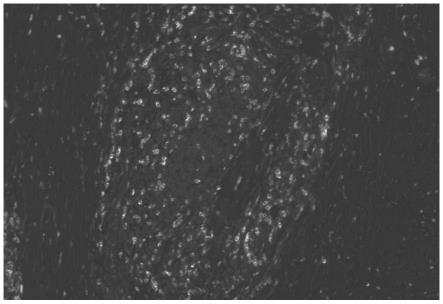
36.图4是本发明实施例提供的三级淋巴结结构全图。
37.图5是本发明实施例提供的标记物pdl1于520nm荧光通道上的荧光图。
38.图6是本发明实施例提供的标记物panck于690nm荧光通道上的荧光图。
39.图7是本发明实施例提供的标记物pdl1和标记物panck共表达的荧光图。
具体实施方式
40.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例的附图,对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
41.实施例一
42.一方面,本发明实施例提供了一种评估肿瘤内三级淋巴结构的试剂盒,试剂盒包括:非特异性蛋白阻断剂、一抗、二抗和荧光染料。
43.非特异性蛋白阻断剂为牛血清白蛋白,一抗包括五种标记物,五种标记物分别为:细胞毒性t细胞标记物cd8、成熟b细胞标记物cd20、滤泡树突细胞标记物cd23、广谱角蛋白标记物panck和细胞程序性死亡配体标记物pdl1,二抗包括辣根过氧化物酶标记的igg抗体,荧光染料包括:与细胞毒性t细胞标记物cd8相配合的荧光染料ppd480、与成熟b细胞标记物cd20相配合的荧光染料ppd520、与滤泡树突细胞标记物cd23相配合的荧光染料ppd570、与广谱角蛋白标记物panck相配合的荧光染料ppd620和与细胞程序性死亡配体标记物pdl1相配合的荧光染料ppd690,二抗为与荧光染料相配合的二抗工作液,具体为hrp标记的二抗。在实现时,荧光染料为使用上述五种荧光染料的母液按照1:100的稀释倍数稀释于信号放大液(1
×
plus amplification,来自美国akoya)中。
44.具体地,所述标记物cd8的稀释倍数为200倍,所述标记物cd20的稀释倍数为400倍,所述标记物cd23的稀释倍数为1000倍,所述标记物panck的稀释倍数为400倍,所述标记
物pdl1的稀释倍数为250倍,在实现时,用抗原修复液稀释至相应倍数。稀释后的标记物的浓度可满足高信噪比的图像同时特异性也最佳。
45.在本实施例中,非特异性蛋白阻断剂的用量为150μl,一抗中的稀释后的五种标记物的使用量均为150μl,五种荧光染料的使用量均为150μl。
46.具体地,试剂盒还包括抗原修复液,抗原修复液包括免疫组化抗原修复液,该免疫组化抗原修复液由中杉金桥生产,产品编号为zli-9030,其主要成分包括tris-hcl缓冲盐溶液、牛血清白蛋白和叠氮钠。
47.具体地,试剂盒还包括抗原修复液,抗原修复液为三羟甲基氨基甲烷缓冲液或乙二胺四乙酸缓冲液。抗原修复液的配置方法包括:取1袋1.58g tris或edta溶于1000ml超纯水中,加入0.5ml吐温,用ph试纸监测溶液的ph值,调整ph值至9.0,在调整时可采用盐酸,得到抗原修复液。
48.具体地,试剂盒还包括加固液,加固液为浓度为10%的中性福尔马林溶液。
49.具体地,试剂盒还包括脱蜡剂,脱蜡剂为二甲苯。在实现时,可采用二甲苯是的分析纯,并使用原液。
50.具体地,试剂盒还包括水化剂,水化剂为包括浓度分别为100%、95%和75%的乙醇。在实现时,梯度浓度分别为100%、95%和75%的乙醇的配置方法包括:浓度为100%的乙醇采用原液无水乙醇100ml直接使用;浓度为95%的乙醇由5ml灭菌去离子水和95ml无水乙醇混合后配制而成;浓度为75%的乙醇由25ml灭菌去离子水和75ml无水乙醇混合后配制而成。
51.具体地,试剂盒还包括缓冲液,缓冲液为1
×
tbst缓冲液。缓冲液的配置方法包括:将50ml的20倍母液和950ml灭菌去离子水混合,制备得1000ml的1
×
tbst缓冲液,瓶装备用。
52.具体地,试剂盒还包括dapi工作液,dapi工作液的配置方法包括:取dapi粉末加入去离子水中,并按照20mg/ml的浓度溶解,制得存储液,于4℃避光存储,dapi工作液为该存储液按照1:100的稀释倍数稀释于灭菌去离子水中,现用现配。
53.具体地,试剂盒还包括封片剂,封片剂为水溶性抗荧光淬灭封片剂。
54.具体地,试剂盒还包括灭菌去离子水。在实现时,制备去离子水1800ml,分装至6个瓶子中,装液量小于2/3,300ml/瓶,标注灭菌日期,在0.15mpa和121℃条件下灭菌30分钟。
55.由于不同荧光染料激发波长及发射波长、信号强度存在差异,不同抗体的效价及特异性也存在差异,本发明实施例根据高效价对应低强度信号染料以及各染料间补偿最少的原则,完成对抗体与荧光染料的最优匹配。
56.实施例二
57.本发明实施例提供了一种采用上述试剂盒评估肿瘤内三级淋巴结构的方法,方法包括:
58.步骤1:将带有标本的玻片进行脱蜡和水化处理,得到预处理玻片;具体地,将带有标本的玻片依次放入三份二甲苯中,每份均浸泡5分钟,完成脱蜡处理,然后再将脱蜡后的玻片依次放入两份浓度为100%的乙醇中,每份均浸泡5分钟,再放入浓度为95%的乙醇中,浸泡3分钟,最后放入浓度为75%的乙醇中,浸泡2分钟,使用灭菌去离子水洗3次,每次均1分钟,完成水化处理。
59.在本实施例中,带有标本的玻片具体为人源性扁桃体标本,该人源性扁桃体标本
由合作医院科研项目组提供。
60.步骤2:将预处理标本进行加固,得到加固玻片;具体地,将水化后的玻片放入浓度为10%的中性福尔马林中浸泡10分钟,使用灭菌去离子水洗3次,每次水洗1分钟,完成加固。
61.步骤3:高温煮沸抗原修复液后,向抗原修复液中加入加固玻片并低温加热10分钟,取出自然冷却至室温,得到修复后的玻片;具体地,向修复杯中倒入抗原修复液,用微波炉高火煮沸抗原修复液后放入加固后的玻片。
62.步骤4:将修复后的玻片用灭菌去离子水清洗1次,再用缓冲液冲洗1次,甩去多余的水分,用组化笔圈画出组织,并滴加非特异性蛋白阻断剂,室温(室温指15~25℃)保湿并振荡孵育10分钟,并弃去非特异性蛋白阻断剂;
63.步骤5:滴加稀释后的一抗中的一种标记物,于室温保湿振荡孵育30~60min,用缓冲液冲洗3次,每次2分钟;
64.步骤6:弃去缓冲液,滴加二抗,于室温保湿震荡孵育10分钟,用缓冲液冲洗3次,每次2分钟,弃去缓冲液;
65.步骤7:滴加荧光染料中与一种标记物相配合的荧光染料,于室温保湿震荡孵育10分钟,用缓冲液冲洗2分钟,得到第一次染色的玻片;
66.步骤8:将抗原修复液煮沸1min,放入第一次染色的玻片于低温加热10分钟,取出自然冷却至室温;
67.步骤9:重复四次步骤5~8,使五种标记物分别进行标记。
68.步骤10:滴加4',6-二脒基-2-苯基吲哚工作液并于室温保湿孵育10min,用缓冲液冲洗2min,待组织微干后滴加封片剂进行封片处理,并用无色指甲油固定盖玻片;
69.步骤11:评估肿瘤内三级淋巴结构。
70.具体地,所述评估肿瘤内三级淋巴结构的方法包括:采用每种所述标记物各自对应的荧光通道进行检测,并使用成像显微镜采集荧光光谱图像和分析软件对所述肿瘤内三级淋巴结构进行评估,所述标记物cd8对应480nm荧光通道,所述标记物cd20对应570nm荧光通道,所述标记物cd23对应620nm荧光通道,所述标记物panck对应690nm荧光通道,所述标记物pdl1对应520nm荧光通道。
71.具体地,所述标记物cd8稀释200倍,所述标记物cd20稀释400倍,所述标记物cd23稀释1000倍,所述标记物panck稀释400倍,所述标记物pdl1稀释250倍。
72.具体地,所述五种标记物按照所述标记物cd23、所述标记物cd20、所述标记物panck、所述标记物pdl1和所述标记物cd8的顺序依次分别进行标记。本发明实施例将容易受到多轮修复影响的抗体放在首轮染色,将不受多轮修复影响的放在最后一轮染色,这样能够保证抗体表现与常规ihc一致且不受其他抗体信号的串扰。
73.具体地,将经过脱蜡处理的玻片依次放入两份浓度为100%的乙醇中,分别浸泡5分钟,再放入浓度为95%的乙醇中,分别浸泡3分钟,最后放入浓度为75%的乙醇中,分别浸泡2分钟,使用灭菌去离子水洗3次,每次各1分钟,完成水化。
74.具体的实验条件如表1所示。
75.表1为本实施例提供的实验条件
[0076][0077]
采用如表1所示的实验条件得到如图1至图7所示的三级淋巴结构的荧光结构图,图1为标记物cd8在细胞膜着色,于480nm荧光通道上显示黄色(由于将附图修改为黑白图片,其黄色显示为灰色),且分布于三级淋巴结构周边及交界处。图2为标记物cd20在细胞膜着色,于570nm荧光通道上显示红色(由于将附图修改为黑白图片,其红色显示为灰色),且分布于三级淋巴结构次中心部位,个别位于周边区域。图3为标记物cd23在细胞膜着色,于620nm荧光通道上显示青色(由于将附图修改为黑白图片,其青色显示为灰色),且位于三级淋巴结构中央亮区。图4为三级淋巴结结构全图,展示了标记物cd8、标记物cd20和标记物cd23的空间位置关系,且由该图可知,该病例结构特征符合为成熟的三级淋巴结构(mtls)。结合图1至图4可知,将多光谱图像拆分后得到的单通道图与抗体单染测试结果对比,重点观察抗体表达部位及表达样式。图5为标记物pdl1在细胞膜着色,于520nm荧光通道上显示橙色(由于将附图修改为黑白图片,其橙色显示为灰色),且显示隐窝上皮及旁边生发中心阳性。图6为标记物panck在细胞质着色,于690nm荧光通道上显示绿色(由于将附图修改为黑白图片,其绿色显示为灰色),且显示隐窝上皮阳性。图7为标记物pdl1和标记物panck共表达的荧光图。
[0078]
由图1至图7可知,该试剂盒能够在一张组织切片的玻片上实现多重荧光的免疫组化染色,可以同时对多种靶点分子进行标记,能够避免浪费宝贵的临床肿瘤样本,节省了样本,同时还能分析在在同一张切片玻片内各个靶点在空间上的关系。
[0079]
虽然本发明所揭露的实施方式如上,但所述的内容仅为便于理解本发明而采用的实施方式,并非用以限定本发明。任何本发明所属领域内的技术人员,在不脱离本发明所揭露的精神和范围的前提下,可以在实施的形式及细节上进行任何的修改与变化,但本发明的专利保护范围,仍须以所附的权利要求书所界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1