用于光激化学发光检测的感光微球的制作方法
1.本技术涉及光激化学发光技术领域,尤其涉及一种用于光激化学发光检测的感光微球。
背景技术:
2.光激化学发光是一种典型的均相免疫检测技术,它的发光系统由“发光微球”和“感光微球”构成,且两种微球在液相中有很好悬浮特性,微球在液相中和抗原或抗体相遇完全符合液态动力学特征。基于两种被包被在纳米微球表面的抗原或抗体在液相中形成免疫复合物,从而将发光微球和感光微球拉近。在激发光的激发下,发光微球和感光微球之间发生单线态氧的转移,进而发光微球产生高能级的红光,即化学发光信号,通过光子计数器和数学拟合即可将红光中的光子数换算为待测样本中的靶分子浓度。当待测样本中不含靶分子时,两种微球间则无法形成免疫复合物,此时两种微球的间距超出单线态氧传播范围,单线态氧在液相中迅速淬灭,光激化学发光检测时则没有高能级红光信号产生。因此,包含有感光微球的感光试剂是光激化学发光分析系统的检测试剂中不可或缺的重要组成成分之一,它的作用在于其试剂中的感光微球受外在激发光的激发后能够产生单线态氧,单线态氧把能量传递至距离感光微球200nm范围内的发光微球,发光微球才能产生化学发光信号。通过采集化学发光信号,利用光子计数器和数学拟合将光子数换算为靶分子的浓度,从而实现对待测样本中的靶分子的检测。
3.因此,如何获得一种一致性较好、符合临床检验需求的感光微球是目前需要解决的问题。
技术实现要素:
4.为解决或部分解决相关技术中存在的问题,本技术提供一种感光微球,能够根据确定的感光量的数值范围规范感光微球,使得感光微球在临床应用中的测试结果具有一致性和可重复性,且确保测试结果具有较高准确度和精密性。
5.本技术提供一种感光微球,所述感光微球包括载体和通过载体承载的感光物质,所述感光微球的感光量ps在1.34到16.28之间;所述感光量ps=od
λ1
/c2*103,其中:od
λ1
是在300nm~800nm范围的可见光区对浓度为c2的所述感光微球进行全波长扫描后所得的波长-吸光度曲线的最大吸收峰所对应的吸光度值,λ1是所述最大吸收峰对应的波长;c2是感光微球在进行光激化学发光检测时的浓度,c2的单位为ug/ml。
6.在一实施方式中,所述感光微球的浓度;其中,k是载体浓度-吸光度曲线的线性关系中对应的斜率,b是所述载体浓度-吸光度曲线的线性关系中对应的截距;od
λ2
是感光微球在波长λ2下对应的吸光度值,所述载体浓度-吸光度曲线为采用不同浓度的多个载体在波长λ2下获得的曲线;所述波长λ2为具有相同浓度的所述感光微球与所述载体在所述波长-吸光度曲线中具有相同或相近的吸光度值
对应的波长。
7.在一实施方式中,c2选自10ug/ml~200ug/ml。
8.在一实施方式中,所述载体浓度-吸光度曲线的线性关系为y=kx+b,其中:x为预设粒径的载体的不同浓度,y为载体在对应的所述浓度下的吸光度值,k为斜率,b为截距。
9.在一实施方式中,所述波长λ2选自od
感光微球
/od
载体
的比值在0.85至1.15以内的任一波长值,且波长λ2不等于波长λ1;其中,od
感光微球
和od
载体
分别是利用相同浓度的所述感光微球和所述载体各自在300nm~800nm范围内同一波长值所对应的吸光度值。
10.在一实施方式中,所述波长λ2为400nm~600nm。
11.在一实施方式中,所述感光微球为填充有感光物质的载体,其中,所述波长λ1是所述感光物质在300nm~800nm范围的可见光区对所述感光物质进行全波长扫描后所得的波长-吸光度曲线中的最大吸收峰所对应的波长。
12.在一实施方式中,所述波长λ1为600nm~700nm。
13.在一实施方式中,所述感光微球按照所述载体与所述感光物质的质量比为10:(0.04~4)制得。
14.在一实施方式中,所述载体的粒径为190nm~280nm。
15.载体本技术提供的技术方案可以包括以下有益效果:本技术的技术方案,在确定吸光度值od
λ1
和浓度c2的数值后,根据吸光度值od
λ1
和浓度c2的比值,即可确定感光微球的感光量ps。当感光微球的感光量ps的数值在1.34到16.28之间时,将该感光微球应用于感光试剂中与发光微球进行混合反应,则可以使发光微球的化学发光信号的强度满足在光激化学发光检测中的需求,减少化学发光信号受到其他干扰因素的影响所导致的检测结果的波动,使得检测结果在临床应用中具有一致性和可重复性,且使检测结果具有更明确的区分度和较高的精密性。本技术的感光微球,通过明确的数值限定,给出了感光微球应用于光激化学检测中可供执行的性能标准,具有明确的可操作性,适用于行业规范的推广。
16.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本技术。
附图说明
17.通过结合附图对本技术示例性实施方式进行更详细地描述,本技术的上述以及其它目的、特征和优势将变得更加明显,其中,在本技术示例性实施方式中,相同的参考标号通常代表相同部件。
18.图1是本技术具体实施例示出的粒径仪测出的20ug/ml载体的粒径结果图;图2是本技术具体实施例示出的粒径仪测出的20ug/ml感光微球的粒径结果图;图3是本技术具体实施例示出的感光物质的波长-吸光度曲线;图4是本技术具体实施例示出的不同浓度的载体的波长-吸光度曲线;图5是本技术具体实施例示出的不同浓度的感光微球的波长-吸光度曲线;图6是本技术具体实施例示出的10μg/ml的载体和感光微球的波长-吸光度曲线;
图7是本技术具体实施例示出的波长500nm下的载体的载体浓度-吸光度曲线;图8是本技术具体实施例示出的感光物质的质量占比-感光量曲线。
具体实施方式
19.下面将参照附图更详细地描述本技术的实施方式。虽然附图中显示了本技术的实施方式,然而应该理解,可以以各种形式实现本技术而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了使本技术更加透彻和完整,并且能够将本技术的范围完整地传达给本领域的技术人员。
20.在本技术使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本技术。在本技术和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。还应当理解,本文中使用的术语“和/或”是指并包含一个或多个相关联的列出项目的任何或所有可能组合。
21.应当理解,尽管在本技术可能采用术语“第一”、“第二”、“第三”等来描述各种信息,但这些信息不应限于这些术语。这些术语仅用来将同一类型的信息彼此区分开。例如,在不脱离本技术范围的情况下,第一信息也可以被称为第二信息,类似地,第二信息也可以被称为第一信息。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本技术的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
22.一实施例中的用于光激化学发光检测的感光微球,感光微球的感光量ps在1.34到16.28之间;感光微球的感光量ps根据下述公式(1)确定。
23.ps=od
λ1
/c2*103(1)其中,od
λ1
是在300nm~800nm范围的可见光区对浓度为c2的感光微球进行全波长扫描后所得的波长-吸光度曲线的最大吸收峰所对应的吸光度值,λ1是所述最大吸收峰对应的波长;c2是感光微球在进行光激化学发光检测时的浓度,c2单位是ug/ml。
24.本技术中,感光微球包括载体和通过载体承载的感光物质。载体可以是高分子微粒,感光物质可以包被于载体的表面和/或填充于载体的内部。其中,感光物质可以在光激发下能够产生活性氧(如,单线态氧),高分子微粒可以为聚苯乙烯微球,当然,也可以为其它可供检测的其他材质的微球,于此不作限制。感光物质例如可以是光敏剂或感光染料,它可以是本领域已知的感光物质,例如亚甲基蓝、玫瑰红、卟啉、酞菁和叶绿素,且不局限于此。感光微球还可以填充其他敏化剂,其非限定性的例子是某些化合物,它们催化过氧化氢转化为单线态氧和水。其他一些敏化剂的例子包括:1,4-二羧基乙基-1,4-萘内过氧化物、9,10-二苯基蒽-9,10-内过氧化物等,加热这些化合物或者这些化合物直接吸收光会释放单线态氧。
25.进一步地,通过分光光度计等设备采用300nm~800nm范围的可见光对该溶于缓冲溶液的浓度为c2的感光微球进行全波长扫描,读取不同波长扫描所对应的吸光度值,生成对应的波长-吸光度曲线后,波长λ1选自该感光微球在波长-吸光度曲线中最大特征峰(即最大吸收峰)所对应的波长;相应的,选择波长-吸光度曲线中最大特征峰所对应的吸光度值,即可确定该浓度为c2的感光微球在波长λ1对应的吸光度值od
λ1
。进一步地,为了确保波长λ1的取值准确性,在一实施方式中,可以预先分别测出已知不同浓度但具有相同感光物
质的感光微球的波长-吸光度曲线,在各个浓度的感光微球的波长-吸光度曲线中选取对应最大特征峰对应的波长作为λ1的取值。通过下文中的实验验证,具有同一感光物质的感光微球在不同浓度下对应的最大特征峰相同,且感光微球的最大特征峰与其所承载的感光物质的最大特征峰相同,例如,以感光物质为酞菁铜为例,感光物质和感光微球的波长λ1均为680nm。因此,通过选择感光微球的波长-吸光度曲线的最大特征峰所对应的波长λ1,继而确定对应的吸光度值od
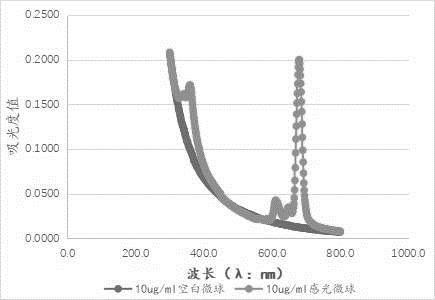
λ1
,可以确保感光量的计算结果的准确性。当感光微球采用不同材料的感光物质后,则可以适应性地重新采用300nm~800nm范围的可见光区进行扫描,以确定波长λ1的具体数值。
26.需要说明的是,在未使用之前,感光微球在保存时的初始状态一般为冻干的固态物质或冷藏的液体。当感光微球为固态物质时,需要加入缓冲溶液进行复溶,复溶后的感光微球溶液的浓度即为初始浓度c1。当感光微球保存为液体时,此时的浓度即为初始浓度c1。在进行光激化学发光检测时,感光微球可能采用初始浓度直接参与检测,即此时的感光微球参与检测时的浓度c2等于c1;或者,也可以对具有初始浓度c1的感光微球进行稀释后再参与检测,即此时的感光微球参与检测时的浓度c2不等于c1,c2的取值为对应的初始浓度稀释后的真实浓度。可以理解,当波长λ1的具体数值确定后,感光微球的浓度c2改变时,对应的吸光度值od
λ1
可能相应不同,od
λ1
的取值根据实际测量确定。在确定吸光度值od
λ1
和浓度c2的数值后,根据吸光度值od
λ1
和浓度c2的比值,可以确定该感光微球的感光量ps。当感光微球的感光量ps的数值在1.34到16.28之间时,将该感光微球应用于感光试剂中与发光微球进行反应,则可以使发光微球的化学发光信号的强度满足在光激化学发光检测中的需求,减少化学发光信号受到其他干扰因素的影响所导致的检测结果的波动,使得检测结果在临床应用中具有一致性和可重复性,且使检测结果具有更明确的区分度和较高的精密性。本技术的感光微球,通过明确的感光量的数值限定,给出了感光微球应用于光激化学检测中可供执行的性能标准,具有明确的可操作性,适用于行业规范的推广。
27.进一步地,为了便于明确感光微球的浓度c2的调节范围,感光微球的浓度c2的根据下述公式(2)确定。
28.(2)其中,k是载体浓度-吸光度曲线的线性关系中对应的斜率,b是所述载体浓度-吸光度曲线的线性关系中对应的截距,od
λ2
是感光微球在波长λ2下对应的吸光度值,载体浓度-吸光度曲线为采用不同浓度的载体在波长λ2下获得的曲线;波长λ2为具有相同浓度的感光微球与载体在波长-吸光度曲线中具有相同或相近的吸光度值对应的波长。
29.具体地,为了获得满足感光量ps范围的感光微球的浓度c2,可以利用与感光微球相同材质和粒径的载体进行实验,以确定感光微球的浓度c2的范围。需要明确的是,基于感光微球和载体的制作工艺的限制,本技术中的关于“粒径相同”、“同一粒径”等定义是指微球之间粒径差值为
±
5nm,这样的微球之间粒径差距微小,可视为粒径相同。其中,可以预先调配多个不同浓度、粒径相同的载体,载体的粒径选自190nm~280nm。并采用同一波长λ2的可见光分别扫描测量各浓度的载体对应的吸光度值,从而可以建立载体浓度与吸光度的关系曲线,继而获得载体浓度与吸光度对应的线性关系,该线性关系可以采用下述公式(3)进行表示。
30.y=kx+b(3)其中,x为预设粒径的载体的不同浓度,y为载体在对应的浓度下的吸光度值,k为公式(2)中的斜率,b为公式(2)中的截距。也就是说,通过公式(3)的相关计算,可以确定公式(2)中的k和b的数值,进而确定感光微球的浓度c2。进一步地,为了确定k和b的数值,在一实施例中,波长λ2选自od
感光微球
/od
载体
的比值在0.85至1.15以内的任一波长值,且波长λ2不等于波长λ1;其中,od
感光微球
和od
载体
分别是利用相同浓度的感光微球和载体各自在300nm~800nm范围内同一波长值所对应的吸光度值。本实施例中,波长λ2不等于波长λ1,即波长λ2为波长-吸光度曲线中的非特征峰所对应的波长,即避开感光物质特征峰的波长,减少感光物质自身的吸光度值对载体的吸光度值的影响。可以理解,在采用300nm~800nm范围内中的相同的波长分别扫描相同微球浓度的感光微球和载体,可以获得该浓度下的感光微球在全波长范围内的吸光度值od
感光微球
,及获得该浓度下的载体在全波长范围内的相同波长对应的吸光度值od
载体
。经申请人研究发现,具体实验数据可查看下文的相关内容,选取od
感光微球
/od
载体
比值满足0.85至1.15范围内的波长作为λ2,相比于选择上述比值范围之外的波长,可以更准确地通过载体的载体浓度-吸光度曲线来确定感光微球的浓度c2的取值范围。经实验可知,波长λ2范围在440nm~580nm时,感光微球吸光度值od
感光微球
和载体吸光度值od
载体
的比值在0.85至1.15以内,说明感光物质的含量对微球浓度的测定影响较小,否则反之。在一实施方式中,波长λ2可以是440nm~580nm。例如,波长λ2可以是440nm、450nm、460nm、470nm、480nm、490nm、500nm、510nm、520nm、530nm、540nm、550nm、560nm、570nm、580nm。需要理解的是,感光微球所选取的感光物质不同时,受到感光物质本身性质的影响,感光物质的最大特征峰会发生相应变化,同理可知,波长λ1和波长λ2相应调整,od
λ1
和od
λ2
也相应调整。
31.在确定波长λ2后,即可以采用同一波长λ2对多个已知不同浓度x但同一粒径的载体进行扫描,获得对应的吸光度值y,从而根据公式(3)建立方程,以计算获得k和b的数值,从而可以根据公式(2)计算与载体粒径相同的感光微球的浓度c2。进一步地,同一浓度的不同粒径的载体对感光物质的载带量可以不同,从而影响吸光度值,即载体浓度-吸光度曲线还与载体的粒径相关。因此,为了建立准确可靠的载体浓度-吸光度曲线,在一实施方式中,选择粒径为190nm~290nm以内的载体建立对应的载体浓度-吸光度曲线,以控制感光微球的浓度c2的计算结果与真实浓度的偏差值在10%以内。例如,载体的预设粒径可以是190nm、200nm、220nm、240nm、260nm、280nm或290nm。例如,可以采用190nm的载体建立对应的载体浓度-吸光度曲线,从而根据公式(3)建立方程,以计算获得k和b的数值。优选地,c2选自10ug/ml~200ug/ml。
32.具体地,在已知感光量ps的范围在1.34到16.28之间,及根据上述计算已知k、b和λ2的前提下,反过来说,感光微球的浓度c2即可根据公式(1)和(2)进行调节。也就是说,在实际光激化学检测过程中,任意配置未知浓度的感光微球后,在未知浓度的具体数值不明的情况下,将该未知浓度的感光微球分别经过波长λ1和波长λ2扫描并获得对应的吸光度值,即od
λ1
和od
λ2
,再通过公式(2)计算未知浓度的具体数值后,如果未知浓度的取值范围落入10ug/ml~200ug/ml,即可将计算所得的浓度c2代入公式(1)中计算感光量ps,如果ps数值在1.34到16.28之间,则表示配置的感光微球的浓度可以应用于光激化学发光检测。
33.综上可知,在已知感光微球浓度c2且取值范围在10ug/ml~200ug/ml的情形下,可以不需要使用公式(2)和(3),直接根据公式(1)计算获得该感光微球对应的感光量ps值;同
理,在未知感光微球浓度c2的具体数值的前提下,可以根据上述方式确定该感光微球对应的感光量ps值。如果计算结果ps值在1.34到16.28之间,则确定该感光微球可以达到上述效果,即可以应用于光激化学发光检测中,且检测结果的准确性和精密性符合临床应用要求。
34.进一步地,为了减少载体及感光物质以外的物质对吸光度值的影响,在一实施方式中,感光微球的表面不包被多糖;或者每克质量的所述感光微球的多糖含量不高于25mg。其中,多糖是指含有三个或更多个未修饰或修饰的单糖单元的碳水化合物,例如葡聚糖、淀粉、糖原、菊粉、果聚糖、甘露聚糖、琼脂糖、半乳聚糖、羧基葡聚糖和氨基葡聚糖等。通过不添加多糖,或者控制多糖的含量,从而减少对吸光度值的测定结果的干扰,继而使临床应用时的检测结果更准确。
35.下面结合具体实验数据对本技术的感光微球的感光量予以说明。
36.一、微球的制备1. 载体的制备a)准备100ml的三口烧瓶,向三口烧瓶中分别加入40mmol苯乙烯、5mmol丙烯醛、10ml水,搅拌10min后,向三口烧瓶通入n230min。
37.b)称取0.11g过硫酸铵和0.2g氯化钠并分别溶于40ml水中配置成水溶液。将该水溶液加入到步骤a)的三口烧瓶的反应体系中,并继续通n230min。
38.c)将反应体系升温至70℃,反应15小时,获得乳液。
39.d)将反应完成后的乳液冷却至室温后,再用合适的滤布对乳液进行过滤。将过滤后得到的乳液用去离子水通过离心沉降清洗,直至离心出的上清液的电导率接近去离子水,然后用水稀释,以乳液形式保存。
40.e)由纳米粒度仪测得该乳液中的乳胶微球粒径的高斯分布平均粒径为190nm。
41.2. 感光微球的制备a)准备25ml的圆底烧瓶,加入0.11g酞菁铜(即感光物质)和10ml n,n-二甲基甲酰胺,通过磁力搅拌均匀,将圆底烧瓶进行水浴升温至75℃,获得感光物质溶液。
42.b)准备100ml的三口烧瓶,分别加入10ml95%乙醇、10ml水和10ml浓度为10%的上述1.e)制备的载体,通过磁力搅拌均匀,将三口烧瓶水浴升温至70℃。
43.c)将步骤a)中的感光物质溶液缓慢滴加至步骤b)中的三口烧瓶中,70℃反应2小时后停止搅拌,自然冷却,获得乳液。可以理解,上述步骤b)载体和步骤a)感光物质溶液的质量比例可以根据后续实验需求进行调整。
44.d)将上述步骤c)获得的乳液按照30000g离心力离心1小时,离心后弃去上清液,再用50%乙醇重新悬浮。重复离心清洗三次后用ph值=10的50mmol/l的 cb缓冲液将感光微球重新悬浮至后续实验中所需浓度。
45.二、确定感光微球浓度c2的取值适用范围的方法本实验采用预设粒径建立载体浓度与吸光度值的线性关系,从而根据上述公式(2)中的吸光度值od
λ2
获得感光微球的浓度c2。本实验用于解释说明上述公式(2)和公式(3)的建立过程。
46.1.微球的全波长扫描及粒径检测为了确保实验所使用的微球的粒径的一致性,预先进行粒径检测。
47.其中,实验涉及的主要原料及设备如表1所示。
48.表1实验过程具体如下:1.1微球粒径的选择本实验中,为了确保数据的一致性,可以统一利用粒径相同,例如预设粒径均为190nm的感光微球和载体进行后续实验。
49.1.2配制不同浓度的载体和感光微球将上述制得的感光微球和载体使用去离子水分别稀释,配制不同浓度的载体和感光微球,各自制得的浓度分别为10ug/ml,20ug/ml,30ug/ml,40ug/ml,50ug/ml,60ug/ml,70ug/ml,80ug/ml,90ug/ml,100ug/ml等共计10个浓度。即分别配置前述10个浓度的载体和前述10个浓度的感光微球;另外配制5ug/ml的感光物质溶液。
50.2.微球粒径检测打开粒径仪,以20ug/ml的载体和感光微球的粒径为例进行检测。
51.其中,实验数据如图1和图2所示。载体的平均粒径为187.1nm,感光微球的平均粒径为190.9nm。
52.从粒径仪的检测结果可以看出,载体和感光球的粒径均为190nm左右,且波峰较窄,微球粒径较均一,可以作为后续实验所需的微球。
53.3. 选择波长打开紫外分光光度计,预热30min,调节紫外分光光度计,设置波长为300nm~800nm,步长为1nm,使用去离子水校零,依次检测步骤1.2配置的各个浓度点的感光微球、载体和感光物质溶液。需要理解的是,当扫描的波长小于300nm时易受其他物质的吸光度值的干扰,从而影响检测结果的准确性和精密性,因此波长设置需要大于300nm。
54.4. 实验数据4.1 感光物质如图3所示,图3为感光物质在300nm~800nm扫描后的波长-吸光度曲线。由图3可以看出,感光物质分别在360nm、610nm、650nm、680nm处出现明显的波峰,其中680nm处为主峰,即为感光物质的最大特征峰。
55.4.2 载体图4为10个不同浓度点的载体在300nm~800nm扫描后的波长-吸光度曲线。由图4可以看出,不同浓度的载体在经300nm~800nm可见光扫描后,曲线图中并没有特征峰。同时,由图4可知,不同浓度的载体,扫描后对应的吸光度值不一样,载体的微球浓度与吸光度值呈
正相关。
56.4.3 感光微球图5为10个不同浓度点的感光微球在300nm~800nm扫描的波长吸光度曲线,由图5可以看出,不同浓度的感光球在经300nm~800nm可见光扫描后,由图5可以看出,感光微球分别在360nm、610nm、650nm、680nm处出现明显的波峰,其中680nm处为主峰,即感光微球的最大特征峰与感光物质的最大特征峰相同。即感光微球填充的感光物质将直接影响最大特征峰所对应的波长值。另外,由图5可知,不同浓度的感光微球,扫描后对应的吸光度值不一样,感光微球的微球浓度与吸光度值呈正相关。因此,不同浓度的感光微球会影响感光量ps的数值。
57.4.4 波长λ1和波长λ2的确定本步骤4.4中,将相同浓度点的感光微球和载体的波长-吸光度曲线进行对比。如图6所示,以浓度均为10μg/ml的感光微球和载体为例,相同浓度的载体和感光微球在扫描300nm~800nm波长后,感光微球出现的680nm特征峰为感光物质的最大特征峰。因此,通过读取680nm的吸光度值最能反应感光微球中的感光物质的含量,即可选择最大特征峰对应的波长作为λ1,即λ1为680nm。可以理解,本实验采样的感光物质为酞菁铜,当感光物质为其他原料时,最大特征峰则可能会不同,则对应的波长λ1根据实际情况确定。
58.对于波长λ2的确定,其目的是用于根据对应的吸光度值od
λ2
来确定感光微球的浓度c2。因此,对于根据吸光度值测定感光微球浓度,则需要避开感光物质的最大特征峰,即波长λ2与λ1不同。这样的设计,是因为当选择感光物质出现波峰的区域时,该波峰对应的波长下的吸光度值包含载体的自身的吸光度值加上感光物质的吸光度值,从而对感光微球的浓度测试有影响。从图6可以看出,在400nm~600nm之间选择λ2最佳,该波长区间内没有特征峰。虽然波长300nm~330nm区间内也不存在感光物质的特征峰,但该波长容易受其他待测样本中的蛋白类物质的影响,影响在临床中的应用。而在波长700nm~800nm之间对应的吸光度值较低,导致检测灵敏度低,测试结果波动大,而在400nm~600nm之间对应的吸光度值较一致,因此,波长λ2选自400nm~600nm之间。
59.进一步地,为了精准确定波长λ2的数值,采用其中一个相同浓度的感光微球和载体的吸光度进行分析。以浓度50ug/ml的感光微球和载体为例,如下表2所示。
60.表2
为了降低感光物质对测定的微球浓度的影响,所选的波长λ2的范围需要在同一波长下的od
感光微球
/od
载体
的比值在0.85至1.15以内,也即(1+15%)。如下表2可知,当波长λ2的440nm~580nm之间时,50ug/ml的感光微球的吸光度值od
感光微球
与50ug/ml的载体的吸光度值od
载体
的比值在0.85至1.15以内,以此说明在该区间内的波长对应的感光物质的吸光度值对感光微球和载体的吸光度值影响较小,而当od
感光微球
/od
载体
的比值大于1.15时,说明感光物质的含量会影响感光微球的浓度的确定。优选地,当波长为500nm和510nm时,od
感光微球
/od
载体
的比值均为1.05,比值恒定说明感光物质的影响恒定。因此,本实施例中,优选波长λ2为500nm。可以理解,当选用不同材料的感光物质制备感光微球时,可以参照上述方法重新确定波长λ2。
61.5.载体浓度-吸光度曲线的建立本实施例中,通过选用同一种预设粒径的载体在波长λ2下,测试载体不同浓度的吸光度值,从而建立载体浓度-吸光度曲线。
62.在上述步骤4.4确定波长λ2后,本实验选用波长λ2为500nm,粒径为190nm左右的载体进行研究,载体浓度-吸光度曲线如图7所示。
63.具体的,为了获得不同浓度的载体,首先通过传统的干燥法得出载体的质量,向已知质量的载体中加入去离子水,配制成10mg/ml的载体,再进一步用去离子水稀释10mg/ml载体,分别配制成浓度为10ug/ml,20ug/ml,30ug/ml,40ug/ml,50ug/ml,60ug/ml,70ug/ml,80ug/ml,90ug/ml,100ug/ml等共计10种浓度的载体。接着对每一种浓度的载体通过波长500nm扫描,获得每一种浓度对应的吸光度值od
500
,即可建立载体浓度与吸光度值的线性关系y=kx+b。在已知浓度x的值,当λ2为500nm时,吸光度值y可直接根据分光度计测得,从而可以计算获得k为0.0021,b为0.0359。在确定k和b的数值后,根据公式(2),即载体浓度x=(od
λ2-b)/k=(od
λ2-0.0359)/0.0021。
64.由于上述实验仅采用粒径为190nm的载体进行不同浓度的吸光度值的测量而获得k和b的数值,为了验证上述载体浓度x的计算结果的准确度,申请人采用不同粒径的载体进行验证。先分别配制不同粒径的载体,各载体的粒径包括190nm,200nm,220nm,240nm,260nm,280nm,300nm等共计7种粒径。再按照干燥法计算的载体质量,将每一种粒径的载体分别配制成40ug/ml,50ug/ml,60ug/ml的理论浓度值。在已知理论浓度值的前提下,按照波长500nm对每一粒径的每一浓度的载体的吸光度值od
λ2
进行检测。为了获得准确的结果,每一粒径的每种浓度分别分成3份进行吸光度值的检测。在获得每一份载体的每一种粒径的每一浓度对应的吸光度值od
λ2
后,按照(od
λ2-0.0359)/0.0021计算对应的浓度值,并将计算结果与理论浓度值进行比较,以确定计算结果的偏差。结果如下表3所示:表3由表3数据可以看出,当载体的粒径小于或等于280nm时,浓度的回收偏差在10%以内,即根据(od
λ2-0.0359)/0.0021计算的载体浓度值x与理论浓度值的偏差在10%以内,说明本技术采用的根据吸光度值确定感光微球浓度的方法具有较好的准确率。因此,可以将采用上述方法确定的k和b的数值应用于公式(2)中的感光微球的浓度c2的计算。从图7可知,本实验中,当c2的取值为10 ug/ml~100ug/ml时,具有较好的线性关系。需要说明的是,受
限于本次实验的数量,c2的取值不仅限于10 ug/ml~100ug/ml,还可以结合下述实验进一步确定c2的取值范围。
65.三、比较不同质量比例的感光微球对感光量的影响1.制备不同质量比例的感光微球先按照上述步骤一、2中的感光微球的制备方法,采用不同的载体与感光物质的质量比制备对应的感光微球,即先制备载体与感光物质的质量比例为10:4、10:2、10:1、10:0.2、10:0.04、10:0的6种感光微球,即表4和表5中的微球1至微球6。其中,10:0表示感光微球中不含感光物质,仅为空的载体。接着将制备好的不同质量比例的感光微球分别用去离子水分别稀释,即将制备好的六种质量比例所对应的感光微球各按照500倍、1000倍及2000倍进行稀释,每种质量比例的感光微球均获得3种稀释后的不同浓度的感光微球。将各稀释所得的感光微球经紫外分光度计扫描,获得波长λ1680nm和波长λ2500nm对应的吸光度值od,并根据上述公式(2)计算获得对应的浓度值c2,及根据上述公式(2)计算获得对应的感光量ps。具体数据如下表4所示。需要说明的是,由图5可知,在波长λ1处,感光微球有很强的吸收峰,即最大特征峰,其对应的吸光度值最能反应感光物质的浓度。感光微球的吸光度值包含载体和感光物质的吸光度值,因此,感光物质的真实的吸光度值od
λ1感光物质
为od
λ1感光微球-od
λ1载体
。
66.表4进一步地,根据上表4中的每一种质量比例在不同稀释倍数的感光物质的感光量计算对应的感光量均值和变异系数cv值,其中,cv值即标准偏差与均值的比率,具体计算结
果可参考下表5中的相关数据。
67.从上表4可知,当稀释倍数为500x时,感光微球6的浓度值c2按照公式(2)的计算值为199,与对应的理论浓度值198非常接近。因此,补充了上述实验二的c2的取值范围,即c2的取值范围可以是10 ug/ml~200ug/ml。
68.表5由上表4可知,同一质量比例的感光物质在采用不同倍数稀释后计算获得的感光量较为一致;由表5可知,不同质量比例的感光物质的感光量的cv值均在10%以内,说明根据公式(1)和(2)确定感光量的计算结果波动较小,计算较为准确。且说明针对同一质量比例的感光物质,其感光量与对应的稀释倍数即感光微球的浓度有关。
69.进一步地,根据表5可以绘制获得图8所示的感光物质的不同质量占比与计算所得的感光量的曲线示意图。从图8可知,根据吸光度值检测单位浓度的感光微球的感光量与感光物质的质量占比的相关性一致,即感光物质的质量占比越大,感光物质浓度越高,则感光量越大。于此同时,当载体与感光物质质量比例小于10:1时,感光量与感光浓度的线性关系较优;当载体与感光物质质量比例为10:(2~4)之间时,感光量的增幅明显变小,说明感光物质的占比,即感光物质填充于载体的量逐渐增大至趋于饱和。这样的趋势变化,符合感光微球的真实感光量的变化。另外,当载体与感光物质质量比例10:4时,所获得的感光微球的感光量达到峰值20.12,即使继续提高感光物质的质量占比,也不会进一步增大感光微球的感光量,因此通过控制载体和感光物质的质量比,从而节约材料成本。
70.四、比较不同感光量的感光微球在临床应用中的性能1.根据不同感光量的感光微球制备不同感光量的感光试剂a)感光微球混悬液处理:吸取一定量上述步骤一、2制备的感光微球于高速冷冻离心机中进行离心,弃去上清液后,再加入一定量mes缓冲液,接着在超声细胞破碎仪上通过超声波震荡至微球重新悬浮,最后加入mes缓冲液调节感光微球浓度至100mg/ml。
71.b)亲和素溶液配制:称量一定量链霉亲和素,加mes缓冲液溶解至8mg/ml。
72.c)混合:将处理好的100mg/ml感光微球混悬液、8mg/ml的亲和素以及mes缓冲液,以2:5:1的体积比进行混合,迅速混匀,得到反应液。
73.d)反应:采用mes缓冲液配制25mg/ml的nabh3cn溶液,将nabh3cn溶液与反应液按照1:25的体积比迅速混匀,恒温37℃旋转反应48小时。
74.e)封闭:采用mes缓冲液配制75mg/ml的gly甘氨酸溶液以及25mg/ml的nabh3cn溶液,将gly甘氨酸溶液、nabh3cn溶液及反应液按照2:1:10的体积比配置混合液,将混合液加
入上述步骤d)反应后的溶液中混合均匀,并恒温37℃旋转反应2小时后,再加入200mg/ml 的bsa溶液(mes缓冲液)与反应液体积比为5:8的混合液,迅速混匀,再恒温37℃旋转反应16小时。
75.f) 清洗:向步骤e中反应好的溶液中加入mes缓冲液,高速冷冻离心机离心,弃除上清液后,加入新鲜的mes 缓冲液,并采用超声法重新悬浮,再次离心,如此反复清洗3次,最后用少量的mes缓冲液进行悬浮,测定固含量为10mg/ml。
76.g)感光试剂配制:使用感光试剂的通用缓冲液配制出包被有链霉亲和素的采用上述6种质量比例的不同感光量的感光微球,从而配置获得6种不同感光量的感光试剂。6种感光试剂的感光量如下表6所示。
77.表62.评估6种不同感光量的感光试剂的性能将上述6种具有不同感光量的感光试剂应用于临床样本的检测,从而评估不同的感光量的感光试剂在临床应用于检测样本的基本性能。
78.实验原料及设备仪器规格及型号厂家lica检测仪ht博阳生物科技(上海)有限公司乙肝表面抗原检测试剂盒hbsag博阳生物科技(上海)有限公司2.1测试6种不同感光量的感光试剂的灵敏度采用6种已知不同靶分子浓度的乙肝表面抗原hbsag的试剂盒样本cal1至cal6,及采用6种上述制得的不同感光量的感光试剂1至6。首先将每一种样本分别加入各自对应的反应容器中,再各反应容器中分别依序加入发光试剂和生物素试剂,每一反应容器在37℃中温育结合,形成第一复合物发光微球-抗体-抗原-抗体-生物素。再向各反应容器中分别加入对应的感光试剂,利用lica检测仪进行光激化学发光检测,获得对应的化学发光信号值。各感光试剂对应检测到的化学发光信号值的数据如下表7的第三列至第八列所示。其中样本cal1的靶分子浓度为0,即不含乙肝表面抗原,样本cal1为阴性样本,对应测得的数值可以作为各感光试剂的信号值的测值基准。
79.表7其中,表7中的第一列的理论值为根据6种样本中的对应已知的靶分子浓度。表7中的第三列至第八列则为各个包含感光试剂和发光试剂的试剂盒在lica检测仪中针对各种靶分子浓度的样本测得的化学发光信号值。根据表中数据可知,针对同一个靶分子浓度的样本,感光试剂的感光量在1.34-16.28之间,感光量越大,测得的信号值的数据越大;当感光试剂感光量达到20.12时,反而出现信号下降现象。因此,选择1.34
‑ꢀ
16.28为感光量ps的取值范围。
80.进一步地,如下表8所示,针对同一个感光试剂,从不同的靶分子浓度的样本对应的信号值的比值可知,当感光试剂的感光量低于1.34时,感光试剂1对应的各个信号值之间的数值区别度极低,即检测灵敏度低,根据信号值无法区分不同浓度靶分子的样本。而感光试剂2对应的信号值虽然低于感光试剂3至6,但是可以针对不同浓度的靶分子呈现一定的区分。感光试剂3至6对应的信号值,在针对低浓度的靶分子和更高浓度的靶分子均体现明确的信号值;同时,同一感光试剂针对不同大小的靶分子浓度之间对应的信号值数值差距明显,体现出良好的区分度,从而还可以根据信号值判断靶分子的浓度区间。
81.表82.2测试5种不同感光量的感光试剂的检测结果的准确度实验样品的准备:选取具有已知相同质量的靶分子并稀释为三种已知不同浓度的质控样本sp1、sp2和sp3;选取靶分子浓度按照线性递减的10个样本s1至s10,所有样本的靶分子均为hbsag;选取4个不含靶分子的阴性样本n1、n2、n3、n4。
82.将上述共计17个不同的样本分别与5个不同感光量的感光试剂2至6进行靶分子浓度的测试。根据lica检测仪测得的化学发光信号转换得到对应的第三至第七列的浓度数据,如下表9所示,将第一列为各样本中的真实浓度数值即理论值作为参照。
83.表9
由于感光试剂1的感光量过低,因此本次实验无需继续采用感光试剂1参与准确度的性能测试。由上表9的测试数据可知,感光试剂的感光量越高,测试数据越接近理论值,即准确度越高。其中感光试剂2的感光量最低,针对低浓度靶分子的样本所测得的浓度数值与理论值波动较大,而针对高浓度靶分子的样本所测得的浓度数值与理论值较为接近,因此感光试剂2的感光量可以视为感光量的下限。也就是说,当感光微球的感光量低于1.34后,将会出现无法准确测得各种浓度的靶分子的情形,不利于满足临床检测需求。
84.2.3测试5种不同感光量的感光试剂的检测结果的精密性继续选取上述2.2中的具有已知相同质量的靶分子的、稀释为三种已知不同浓度的样本sp1、sp2和sp3,将每种浓度的样本分为10份,分别与5种感光试剂进行测试,测试获得对应的浓度值,及10份样本的浓度均值mean、标准差stdev及变异系数cv。具体数值如下表10所示。
85.表10
从上表10的数据可知,感光试剂2针对最低浓度的同一样本sp1的cv值大于10%,说明测试结果的波动较大,精密性一般,因此感光试剂2的感光量1.34可以作为临床检测中的感光微球所需具备的感光量的下限。
86.以上已经描述了本技术的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。本文中所用术语的选择,旨在最好地解释各实施例的原理、实际应用或对市场中的技术的改进,或者使本技术领域的其他普通技术人员能理解本文披露的各实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1