一种细胞外囊泡的分离和鉴定方法
本发明涉及细胞外囊泡的分离和鉴定,具体涉及一种细胞外囊泡的分离和鉴定方法。
背景技术:
1、细胞外囊泡(extracellular vesicles,evs)是指从细胞膜上脱落或者由细胞分泌的双层膜结构的囊泡状小体,直径从30nm到10000nm不等。胞外囊泡主要由微囊泡(microvesicles,mvs)和外泌体(exosomes,exos)组成,微囊泡是细胞激活、损伤或凋亡后从细胞膜脱落的小囊泡,直径约为150nm-10000nm;外泌体由细胞内的多泡小体(multivesicular bodies)与细胞膜融合后以外分泌的形式释放到细胞外,直径约为30nm-150nm。细胞外囊泡广泛存在于细胞培养上清以及各种体液(血液、淋巴液、唾液、尿液、精液、乳汁)中,携带有细胞来源相关的多种蛋白质、脂类、dna、mrna、mirna等,参与细胞间通讯、细胞迁移、血管新生和免疫调节等过程。在糖尿病、心血管疾病、艾滋病、慢性炎症疾病以及癌症中都发现细胞外囊泡水平的升高,它们很有可能成为这类疾病的诊断标志物,因此,对细胞外囊泡进行准确的分离与鉴定显得尤为重要。
2、目前,细胞外囊泡(evs)国内外运用的分离方法主要有差速/密度梯度离心法、沉淀法、粒径分离法、免疫亲和法和微流控技术,上述方法存在价格高昂、纯度低、用时长操作复杂、分离效率低等缺点;鉴定方法主要有透射电子显微镜、流式细胞术、酶联免疫吸附分析、蛋白质印迹、动态光散射技术和纳米颗粒跟踪分析技术,上述方法存在操作复杂、重复性不佳以及不适合检测生物液体中的标志蛋白等缺点。
技术实现思路
1、为了解决上述技术问题,本发明的目的是提供一种细胞外囊泡的分离和鉴定方法,以解决现有分离和鉴定方法操作复杂、重复性不佳的问题。
2、本发明解决上述技术问题的技术方案如下:提供一种细胞外囊泡的分离和鉴定方法,依次包括以下步骤:
3、(1)将微流控装置通入电流,电流正极和负极分别对应微流控装置出口和入口;
4、微流控装置包括五个部分,第一部分为28-32nm微孔膜,28-32nm微孔膜下方依次设置有相同孔径大小的微孔和第一收集通道;第二部分为140-160nm微孔膜,140-160nm微孔膜下方依次设置有相同孔径大小的微孔和第二收集通道;第三部分为1.2-1.8μm微孔,1.2-1.8μm微孔下方设置有第三收集通道;第四部分为2-4μm微孔,2-4μm微孔下方设置有第四收集通道;第五部分为5-7μm微孔,5-7μm微孔下方设置有第五收集通道;
5、将待分离细胞外囊泡样品从微流控装置入口进入,施加电压,然后分别从第一收集通道、第二收集通道、第三收集通道、第四收集通道和第五收集通道收集不同大小的细胞外囊泡;
6、(2)将多聚赖氨酸溶液滴在玻片上,进行包被30-50min,风干,然后滴加步骤(1)得到的细胞外囊泡溶液,室温孵育25-35min,再滴加荧光素-5-马来酰亚胺溶液,室温避光孵育25-35min,最后在共聚焦显微镜下进行荧光鉴定。
7、在上述技术方案的基础上,本发明还可以做如下改进:
8、进一步,微流控装置包括五个部分,第一部分为30nm微孔膜,30nm微孔膜下方依次设置有30nm微孔和第一收集通道;第二部分为150nm微孔膜,150nm微孔膜下方依次设置有150nm微孔和第二收集通道;第三部分为1.5μm微孔,1.5μm微孔下方设置有第三收集通道;第四部分为3μm微孔,3μm微孔下方设置有第四收集通道;第五部分为6μm微孔,6μm微孔下方设置有第五收集通道。
9、进一步,步骤(2)中,多聚赖氨酸溶液的浓度为90-110μg/ml。
10、进一步,步骤(2)中,多聚赖氨酸溶液的浓度为100μg/ml。
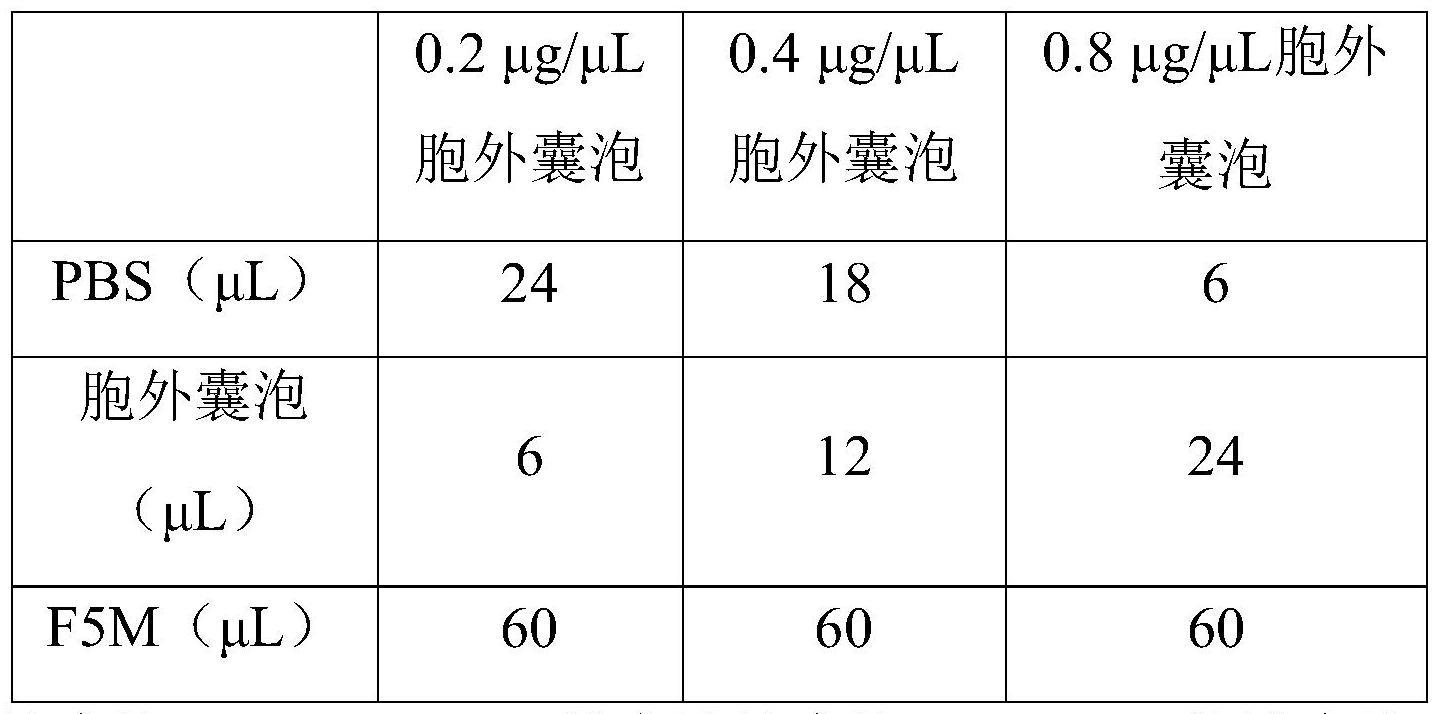
11、进一步,步骤(2)中,细胞外囊泡溶液的浓度为0.8-1.2μg/μl。
12、进一步,步骤(2)中,细胞外囊泡溶液的浓度为1μg/μl。
13、进一步,步骤(2)中,荧光素-5-马来酰亚胺溶液的浓度为1.8-2.2μmol/l。
14、进一步,步骤(2)中,荧光素-5-马来酰亚胺溶液的浓度为2μmol/l。
15、进一步,步骤(2)中,多聚赖氨酸溶液、细胞外囊泡溶液和荧光素-5-马来酰亚胺溶液的体积比为1:1:0.8-1.2。
16、进一步,步骤(2)中,多聚赖氨酸溶液、细胞外囊泡溶液和荧光素-5-马来酰亚胺溶液的体积比为1:1:1。
17、本发明还提供上述方法在细胞外囊泡的分离和鉴定方面的应用。
18、本发明具有以下有益效果:
19、1、本发明采用的是微流控技术和电泳驱动过滤结合的方式,evs的磷脂膜带有负电荷,而蛋白质或其他分子由于氨基酸的侧链而具有不同的电荷,通过给微流控装置通入电流,带有负电荷的evs会向正极也就是过滤孔方向移动,然后根据孔的大小将evs与其他物质分离。
20、样品进入通道后会水平流动,但是在施加的电压下evs和带有负电荷的蛋白质会垂直迁移,向阳极移动,带中性电荷或正电荷的颗粒(例如,组氨酸、赖氨酸、非极性脂质)通过阴极的吸引力随样品流移动或远离样品流。当样品流到达30nm微孔膜时,在电流的作用下只有小于30nm的颗粒才能穿过膜以及微孔,之后颗粒会进入收集通道;大于30nm的颗粒会随着液体的流动来到150nm的微孔膜处,然后在电流的作用下只有小于150nm的颗粒才能穿过膜以及微孔进入收集通道,大于150nm的颗粒在液体的流动下继续前进到达1.5μm的微孔,在电场的作用下,小于1.5μm的颗粒被留下并收集,其余的继续流动到达3μm的微孔,在电场的作用下,小于3μm的颗粒被留下并收集,其余的继续流动到达6μm的微孔,小于6μm的颗粒被留下并收集,其余的被排出(当孔径大小为其他大小时,原理相同)。
21、微流控技术的工作原理是基于微通道中的微流体力学原理。不同于传统流体力学,在微米级别下,流体的表面张力和黏度等物理特性会发生显著变化,微通道中的流体流动也会受到微观效应的影响,如毛细效应、惯性效应、电动效应等。胞外囊泡本身带有一定的电荷,在压力作用下矩形微流道中形成二维电场,而外电场则对矩形微流道中的流场产生进一步的影响,从而趋动微流道中胞外囊泡的分离。
22、2、囊泡被分离出来以后,可以粘附在pll上,与f5m结合进行荧光观察,也可以收集进行蛋白质组学寻找特异性蛋白等。通过该装置可以收集30-150nm的外泌体,150nm-1.5μm的小微囊泡,1.5-3μm的大囊泡,3-6μm的特大囊泡,由于一个微流控装置可以设计多个过滤收集装置,所以可以同时处理多个样品。
23、3、利用电场和滤过系统对胞外囊泡进行分类,同时已实现胞外囊泡的粘附、荧光标记,发展了胞外囊泡标志物的特异性标记技术,利用共聚焦显微镜可以精确观察胞外囊泡及其标记物,可以在3h以内完成检测,实现了对囊泡的分类及快检。
技术特征:
1.一种细胞外囊泡的分离和鉴定方法,其特征在于,依次包括以下步骤:
2.根据权利要求1所述的细胞外囊泡的分离和鉴定方法,其特征在于,步骤(2)中,多聚赖氨酸溶液的浓度为90-110μg/ml。
3.根据权利要求1所述的细胞外囊泡的分离和鉴定方法,其特征在于,步骤(2)中,多聚赖氨酸溶液的浓度为100μg/ml。
4.根据权利要求1所述的细胞外囊泡的分离和鉴定方法,其特征在于,步骤(2)中,细胞外囊泡溶液的浓度为0.8-1.2μg/μl。
5.根据权利要求1所述的细胞外囊泡的分离和鉴定方法,其特征在于,步骤(2)中,细胞外囊泡溶液的浓度为1μg/μl。
6.根据权利要求1所述的细胞外囊泡的分离和鉴定方法,其特征在于,步骤(2)中,荧光素-5-马来酰亚胺溶液的浓度为1.8-2.2μmol/l。
7.根据权利要求1所述的细胞外囊泡的分离和鉴定方法,其特征在于,步骤(2)中,荧光素-5-马来酰亚胺溶液的浓度为2μmol/l。
8.根据权利要求1所述的细胞外囊泡的分离和鉴定方法,其特征在于,步骤(2)中,多聚赖氨酸溶液、细胞外囊泡溶液和荧光素-5-马来酰亚胺溶液的体积比为1:1:0.8-1.2。
9.根据权利要求1所述的细胞外囊泡的分离和鉴定方法,其特征在于,步骤(2)中,多聚赖氨酸溶液、细胞外囊泡溶液和荧光素-5-马来酰亚胺溶液的体积比为1:1:1。
10.权利要求1-9任一项所述的细胞外囊泡的分离和鉴定方法在细胞外囊泡的分离和鉴定方面的应用。
技术总结
本发明公开了一种细胞外囊泡的分离和鉴定方法,涉及细胞外囊泡的分离和鉴定技术领域。该方法依次包括以下步骤:将微流控装置通入电流,电流正极和负极分别对应微流控装置出口和入口;将待分离细胞外囊泡样品从微流控装置入口进入,施加电压,然后收集不同大小的细胞外囊泡;将多聚赖氨酸溶液滴在玻片上,进行包被,风干,然后滴加细胞外囊泡溶液,室温孵育,然后滴加荧光素‑5‑马来酰亚胺溶液,室温避光孵育,再在共聚焦显微镜下进行荧光鉴定。本发明采用的是微流控技术和电泳驱动过滤结合的方式对细胞外囊泡进行分离,采用荧光素‑5‑马来酰亚胺进行标记检测,实现了对囊泡的分类及快检。
技术研发人员:曾烨
受保护的技术使用者:四川大学
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!