多能干细胞来源小细胞外囊泡的特征性标志物组合及其应用的制作方法
本发明属于生物,尤其是涉及一种多能干细胞来源小细胞外囊泡的特征性标志物组合及其应用。
背景技术:
1、小细胞外囊泡(small extracellular vesicles,sevs)是由活细胞分泌的直径小于200nm的具有磷脂双分子层膜结构的微小囊泡。sevs的表面和内部含有蛋白质、核酸等多种生物活性物质。通过递送这些生物活性成分,sevs能够充当细胞间通讯的媒介,影响邻近或远处细胞的生物学行为,发挥相关的生物学功能。其中,干细胞来源的sevs能够发挥与其亲本干细胞相似的生物学功能,同时避免干细胞直接移植的成瘤和血管栓塞等潜在风险。另外,干细胞来源的sevs还具有免疫原性低,能够穿过皮肤、黏膜、血脑屏障等特点,在组织修复与疾病治疗中极具潜力。在不同类型的干细胞来源的sevs中,多能干细胞来源的小细胞外囊泡(pluripotent stem cell derived small extracellular vesicles,psc-sevs)具有独特的抗衰老功能。多能干细胞来源的小细胞外囊泡分为:胚胎干细胞来源的小细胞外囊泡(embryonic stem cell derived small extracellular vesicles,esc-sevs)和诱导多能干细胞来源的小细胞外囊泡(induced pluripotent stem cell derived smallextracellular vesicles,ipsc-sevs)。psc-sevs在多种衰老相关的退行性疾病中显示出治疗效果,包括:心脑血管相关疾病、骨关节肌腱相关疾病、皮肤衰老相关疾病、卵巢早衰等。此外多能干细胞来源的sevs还具有容易分离纯化,便于大量生产和储存等特点,在临床转化应用方面显示出独特优势。
2、目前,psc-sevs的科学研究及临床转化应用迅速发展,但由于sevs有不同的生产和分离纯化方法,sevs的表征方法和检测指标也同样复杂多样,目前的sevs领域尚缺乏完备的质量控制标准。对于psc-sevs,目前的主要的质量控制指标包括:透射电镜下的直接形态观察,颗粒群体的尺寸分布,sevs表面和内部标志物(cd9,cd63,cd81,tsg101等)的western blot鉴定,sevs的颗粒蛋白比等。经过以上检测可以判定样品中的颗粒是否是sevs,以及其中含有sevs的数量和纯度,无法区分sevs的细胞来源。不同细胞来源的sevs在生物学功能上有着天壤之别,在实际应用中需要严格鉴定sevs的细胞来源,并根据细胞来源匹配其特定的生物学功能。对于psc-sevs的临床转化应用,其独特的抗衰老功能是至关重要的,因此,对于psc-sevs的鉴定,不能仅有sevs的通用性质分析,必须确认sevs的细胞来源。遗憾的是,目前psc-sevs特异性的检测指标依然缺乏,难以通过对sevs产品的直接鉴定来确认产品是psc-sevs。
3、因此,通过对psc-sevs进行成分解析,寻找特异性的标志物,为psc-sevs建立快速、简便的鉴定方法,对于psc-sevs的临床转化应用有实际意义。
技术实现思路
1、鉴于现有技术中多能干细胞来源小细胞外囊泡(psc-sevs)鉴定存在的技术缺陷,本发明提供一种多能干细胞来源小细胞外囊泡的特征性标志物组合及其应用。
2、本发明的目的可以通过以下技术方案来实现:
3、本发明提供一种多能干细胞来源小细胞外囊泡的特征性标志物组合,所述特征性标志物组合包括跨膜蛋白podocalyxin-like protein-1(podxl)及其糖基化表位tra-1-60和tra-1-81,和膜表面抗原stage-specific embryonic antigen-4(ssea-4),以及标志物cd9,cd63以及cd81。
4、本发明还提供一种鉴定多能干细胞来源小细胞外囊泡的方法,基于所述多能干细胞来源小细胞外囊泡的特征性标志物组合来鉴定小细胞外囊泡是否为多能干细胞来源小细胞外囊泡;
5、基于多能干细胞来源小细胞外囊泡的特征性标志物组合,对待检测的小细胞外囊泡进行免疫荧光染色,
6、当podxl/tra-1-60/tra-1-81阳性颗粒比例大于50%,且ssea4阳性颗粒比例大于50%,且cd9阳性颗粒比例大于50%,且cd9/cd63/cd81阳性颗粒比例大于70%时,鉴定小细胞外囊泡为多能干细胞来源的小细胞外囊泡;
7、当podxl/tra-1-60/tra-1-81阳性颗粒比例大于50%,ssea4阳性颗粒比例大于50%,cd9阳性颗粒比例大于50%,cd9/cd63/cd81阳性颗粒比例大于70%这四个条件不同时达到时,鉴定小细胞外囊泡为非多能干细胞来源的小细胞外囊泡。
8、在本发明的一个实施方式中,检测podxl/tra-1-60/tra-1-81阳性颗粒比例的方法为:
9、在免疫荧光染色时进行三种标志物podxl/tra-1-60/tra-1-81的联合染色,即染色时同时加入三种标志物podxl、tra-1-60、tra-1-81对应的荧光标记的适配体分子,然后孵育后,统计podxl/tra-1-60/tra-1-81同时阳性的颗粒比例;
10、检测ssea4阳性颗粒比例的方法为:
11、在免疫荧光染色时,加入ssea4对应的荧光标记的适配体分子,然后孵育后,统计ssea4阳性颗粒比例;
12、检测cd9阳性颗粒比例的方法为:
13、在免疫荧光染色时,加入cd9对应的荧光标记的适配体分子,然后孵育后,统计cd9阳性颗粒比例;
14、检测cd9/cd63/cd81阳性颗粒比例的方法为:
15、在免疫荧光染色时进行三种标志物cd9/cd63/cd81的联合染色,即染色时同时加入三种标志物cd9、cd63、cd81对应的荧光标记的适配体分子,然后孵育后,统计cd9/cd63/cd81同时阳性的颗粒比例。
16、在本发明的一个实施方式中,使用荧光标记的能够特异性识别podxl,tra-1-60,tra-1-80,ssea-4,cd9,cd63,cd81的适配体分子对样品进行免疫荧光染色。所述适配体分子包括但不限于特异性抗体和核酸适配体。
17、在本发明的一个实施方式中,荧光标记的能够特异性识别podxl,tra-1-60,tra-1-80,ssea-4,cd9,cd63,cd81的适配体分子分别为:af488 anti-human podxl antibody、af488 anti-human tra-1-60-r antibody、af488 anti-human tra-1-81antibody、af488anti-human ssea-4antibody、af488 mouse anti-human cd9、af488 mouse anti-humancd63、fitc mouse anti-human cd81。
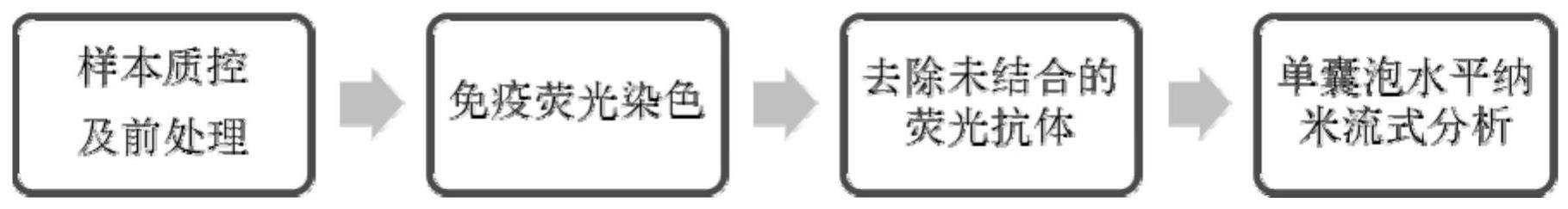
18、在本发明的一个实施方式中,在进行免疫荧光染色前,计算颗粒蛋白比,颗粒蛋白比(小细胞外囊泡纯度指标)大于1*10^8particles/μg protein,且颗粒浓度在5*10^9particles/ml以上的样品可以进行后续免疫荧光染色以及鉴定;
19、若在进行免疫荧光染色前,待测样本的颗粒浓度过低,需要浓缩使得样本的颗粒蛋白比大于1*10^8particles/μg protein,且颗粒浓度在5*10^9particles/ml以上,再进行后续免疫荧光染色以及鉴定。
20、在本发明的一个实施方式中,使用荧光标记的能够特异性识别podxl,tra-1-60,tra-1-80,ssea-4,cd9,cd63,cd81的适配体分子对样品进行免疫荧光染色时,分别用荧光标记的适配体分子和样本在37℃孵育30min。
21、在本发明的一个实施方式中,进行免疫荧光染色后,去除免疫荧光染色后未结合的游离荧光标记的适配体分子,以降低游离荧光干扰,去除方法选自超速离心法、超滤法或尺寸排阻色谱法。
22、在本发明的一个实施方式中,进行免疫荧光染色,且去除免疫荧光染色后未结合的游离荧光标记的适配体分子后,进行单囊泡水平的纳米流式分析,获得podxl/tra-1-60/tra-1-81阳性颗粒比例、ssea4阳性颗粒比例、cd9阳性颗粒比例以及cd9/cd63/cd81阳性颗粒比例。
23、在本发明的一个实施方式中,鉴定多能干细胞来源小细胞外囊泡的方法,包括以下步骤:
24、(1)、样品质控:
25、在进行免疫荧光染色前,计算颗粒蛋白比,颗粒蛋白比大于1*10^8particles/μgprotein,且颗粒浓度在5*10^9particles/ml以上的样品可以进行后续免疫荧光染色以及鉴定;若在进行免疫荧光染色前,待测样本的颗粒浓度过低,需要浓缩使得样本的颗粒蛋白比大于1*10^8particles/μg protein,且颗粒浓度在5*10^9particles/ml以上,再进行后续免疫荧光染色以及鉴定;
26、(2)、免疫荧光染色:
27、将样本分装至低吸附管,分别按比例加入podxl/tra-1-60/tra-1-81、ssea4、cd9以及cd9/cd63/cd81对应的荧光标记的适配体分子,涡旋振荡后,在37℃孵育30min;
28、荧光标记的能够特异性识别podxl,tra-1-60,tra-1-80,ssea-4,cd9,cd63,cd81的适配体分子分别为:af488 anti-human podxl antibody、af488 anti-human tra-1-60-r antibody、af488 anti-human tra-1-81antibody、af488 anti-human ssea-4antibody、af488 mouse anti-human cd9、af488 mouse anti-human cd63、fitc mouse anti-humancd81;
29、(3)、去除免疫荧光染色后未结合的游离荧光标记的适配体分子:
30、孵育结束后,选自超速离心法、超滤法或尺寸排阻色谱法去除免疫荧光染色后未结合的游离荧光标记的适配体分子;
31、(4)、纳米流式检测仪检测:对于去除游离荧光标记的适配体分子后的样品,使用pbs稀释到最适检测浓度后,使用纳米流式检测仪进行单囊泡水平的纳米颗粒荧光分析,获得podxl/tra-1-60/tra-1-81阳性颗粒比例、ssea4阳性颗粒比例、cd9阳性颗粒比例以及cd9/cd63/cd81阳性颗粒比例;
32、(5)、鉴定:
33、当podxl/tra-1-60/tra-1-81阳性颗粒比例大于50%,且ssea4阳性颗粒比例大于50%,且cd9阳性颗粒比例大于50%,且cd9/cd63/cd81阳性颗粒比例大于70%时,鉴定小细胞外囊泡为多能干细胞来源的小细胞外囊泡;
34、当podxl/tra-1-60/tra-1-81阳性颗粒比例大于50%,ssea4阳性颗粒比例大于50%,cd9阳性颗粒比例大于50%,cd9/cd63/cd81阳性颗粒比例大于70%这四个条件不同时达到时,鉴定小细胞外囊泡为非多能干细胞来源的小细胞外囊泡。
35、在本发明的一个实施方式中,使用纳米流式检测仪对样本进行荧光分析时,样本的荧光背景信号与空白对照相比无明显升高,验证未结合的游离荧光标记的适配体分子已经除去。
36、在本发明的一个实施方式中,多能干细胞来源小细胞外囊泡的特征性标志物podxl/tra-1-60/tra-1-81和ssea-4还具有其他应用,包括但不限于:作为药物挂载位点用于psc-sev的载药,以及作为荧光蛋白等融合的基因位点用于psc-sev的示踪等。
37、本技术方案克服了现有技术中缺乏psc-sevs特异性鉴定指标的问题,提供psc-sevs的特异性标志物:跨膜蛋白podocalyxin-like protein-1(podxl)及其糖基化表位tra-1-60和tra-1-81,膜表面抗原stage-specific embryonic antigen-4(ssea-4),以及标志物cd9,cd63,cd81。本发明提供的psc-sevs鉴定方法:对psc-sevs的特异性标志物podxl和ssea4进行免疫荧光染色和单囊泡水平的纳米流式分析,验证样品中podxl/tra-1-60/tra-1-81阳性颗粒比例大于50%,且ssea4阳性颗粒比例大于50%,且cd9阳性颗粒比例大于50%,且cd9/cd63/cd81阳性颗粒比例大于70%,则可鉴定样品为psc-sevs。
38、与现有技术相比,本发明利用这些可靠的多能干细胞来源小细胞外囊泡的特征性标志物及其组合进行单囊泡水平的纳米流式分析,能够实现简便、快速地鉴定多能干细胞来源小细胞外囊泡。本发明对于多能干细胞来源小细胞外囊泡的产品质控和临床转化有实际意义。
- 还没有人留言评论。精彩留言会获得点赞!