生物制药用一次性膜材迁移至注射液中的二苄胺测定方法与流程
本申请涉及药液检测,特别是涉及一种生物制药用一次性膜材迁移至注射液中的二苄胺测定方法。
背景技术:
1、随着医药行业的迅猛发展,公众对药品安全的要求也越来越高,这种要求不仅仅限于药品本身的质量,也逐渐扩展到药品的辅料及其包装材料的质量。当我们在讨论药品包装材料质量的时候,往往更多想到的是包装材料产品本身的质量,然而还有一个问题已经成为目前药品研发团队中越来越重要的挑战,那就是包装材料相容性问题。由相容性引起的产品质量问题层出不穷,如未镀膜活塞中的硫化剂浸出问题、钠钙玻璃瓶产生的雪花状玻璃脱片问题,这些问题不仅对产品质量产生较大的影响,甚至会直接对药品的最终使用者产生安全隐。
2、为鼓励企业开展科学有效的相容性研究,国家药品监督管理局(nmpa)已陆续发布《化学药品注射剂与塑料包装材料相容性研究技术指导原则》、《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则》和《化学药品与弹性体密封件相容性研究技术指导原则》的指导原则,旨在指导企业和研究者对药品中可能的浸出物进行风险评估。pqri也在2006年发布经口鼻吸入产品(oindp)中浸出物和可提取物的最佳实践研究,指导原则的发布也推动pqri下的非肠道和眼用(podp)产品中浸出物和可提取物小组的工作。美国药典(usp)也在2015年分别发布<1663>和<1664>两个关于可提取物和浸出物的指导原则。
3、二苄胺是重要的有机合成中间体,常用来合成药品包装材料的的熟化剂,例如硫化促进剂二硫化四苄基秋兰姆(tbztd)和二苄基二硫代氨基甲酸锌(zbec)。二苄胺作为cramerⅲ类化合物,毒性强,如果从包材迁移到药液中,则会对使用者产生严重的安全隐患,然而现有技术中缺乏针对膜材迁移至注射液中二苄胺进行检测的方法,因此,开发一种准确、灵敏的检测注射液中二苄胺的方法具有重要的临床意义。
技术实现思路
1、本申请实施例提供了一种生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,以解决现有技术中存在的技术问题。
2、本申请提供了一种生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,包括以下步骤:
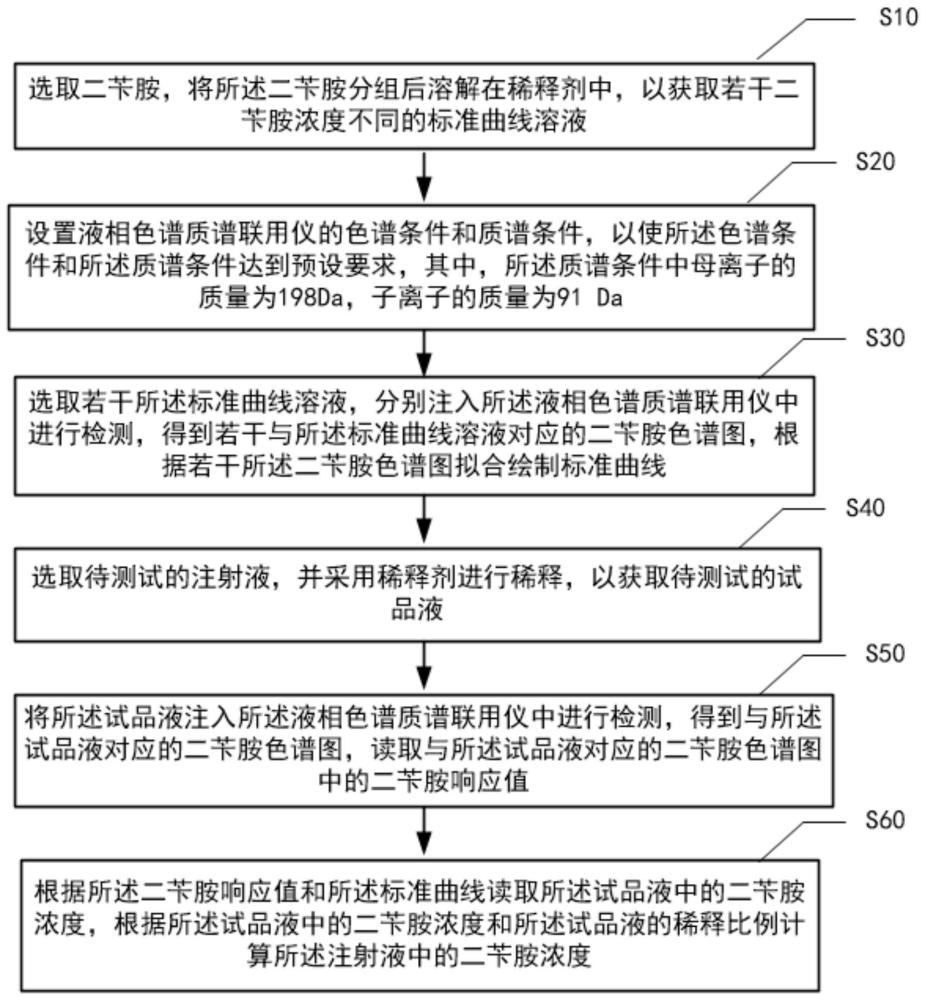
3、选取二苄胺,将所述二苄胺分组后溶解在稀释剂中,以获取若干二苄胺浓度不同的标准曲线溶液;
4、设置液相色谱质谱联用仪的色谱条件和质谱条件,以使所述色谱条件和所述质谱条件达到预设要求,其中,所述质谱条件中母离子的质量为198da,子离子的质量为91da;
5、选取若干所述标准曲线溶液,分别注入所述液相色谱质谱联用仪中进行检测,得到若干与所述标准曲线溶液对应的二苄胺色谱图,根据若干所述二苄胺色谱图拟合绘制标准曲线;
6、选取待测试的注射液,并采用稀释剂进行稀释,以获取待测试的试品液;
7、将所述试品液注入所述液相色谱质谱联用仪中进行检测,得到与所述试品液对应的二苄胺色谱图,读取与所述试品液对应的二苄胺色谱图中的二苄胺响应值;
8、根据所述二苄胺响应值和所述标准曲线读取所述试品液中的二苄胺浓度,根据所述试品液中的二苄胺浓度和所述试品液的稀释比例计算所述注射液中的二苄胺浓度。
9、优选地,所述稀释剂为甲醇溶液。
10、优选地,所述选取二苄胺,将所述二苄胺分组后溶解在稀释剂中,以获取若干二苄胺浓度不同的标准曲线溶液的步骤包括:
11、选取二苄胺,并按质量要求进行分组;
12、将分组后的所述二苄胺分别置于对应的若干第一量瓶中,并向若干所述第一量瓶中加入甲醇溶液进行溶解,得到若干初始溶液;
13、向若干所述初始溶液中分别继续加入所述甲醇溶液,以得到二苄胺浓度分别为0.36ng/ml、0.59ng/ml、1.19ng/ml、1.78ng/ml、2.38ng/ml的标准曲线溶液。
14、优选地,所述选取待测试的注射液,并采用稀释剂进行稀释,以获取待测试的试品液的步骤包括:
15、选取待测试的所述注射液注入第二量瓶中,加入甲醇溶液进行稀释,以得到注射液的浓度为5ul/ml的待测试的试品液。
16、优选地,所述液相色谱质谱联用仪的色谱条件的预设要求为:采用硅胶填料作为液相色谱柱,液相流速为0.27ml/min-0.33ml/min,液相进样量为1.8ul-2.2ul,所述液相色谱柱的柱温为30℃-40℃,样品室温度为12℃-16℃。
17、优选地,所述液相色谱柱包括流动相a和流动相b;
18、其中,所述流动相a为氨水与纯化水的比值为1:500-1:1000的混合液,所述流动相b为甲醇;
19、所述流动相a与所述流动相b的比值为27:70-33:70。
20、优选地,所述硅胶填料为acquity uplc beh c18,所述液相色谱柱的尺寸为2.1mm×50mm,其中,所述硅胶填料中填料颗粒的直径为1.7μm。
21、优选地,所述液相色谱质谱联用仪的质谱条件的预设要求为:设置所述液相色谱质谱联用仪的扫描离子模式为正离子模式,气帘气为27psi-33psi,碰撞气为8psi-10psi,离子喷雾电压为5000v-6000v,雾化温度为500℃-600℃,雾化气(gs1)为45psi-55psi,辅助加热气为45psi-55psi,驻留时间为55ms-65ms;去簇电压碰撞能为22v-24v。
22、优选地,所述二苄胺的化学结构式为:
23、
24、本发明的有益效果在于:本申请提供的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,首先配制若干二苄胺浓度不同的标准曲线溶液,然后根据二苄胺检测的需要分别设置液相色谱质谱联用仪的色谱条件和质谱条件达到预设要求,使得液相色谱质谱联用仪能单独检测出溶液中二苄胺;将二苄胺浓度不同的所述标准曲线溶液,分别注入液相色谱质谱联用仪中进行检测,记录对应的二苄胺色谱图;根据二苄胺色谱图绘制标准曲线,得到二苄胺浓度与二苄胺质谱响应值的关系,接着将待测试的注射液进行稀释后注入液相色谱质谱联用仪进行检测,测得相应的二苄胺响应值,将注射液的响应值导入标准曲线进行计算,即可快速的获得注射液中的二苄胺浓度。
25、本申请的一个或多个实施例的细节在以下附图和描述中提出,以使本申请的其他特征、目的和优点更加简明易懂。
技术特征:
1.一种生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,包括以下步骤:
2.根据权利要求1所述的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,所述稀释剂为甲醇溶液。
3.根据权利要求2所述的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,所述选取二苄胺,将所述二苄胺分组后溶解在稀释剂中,以获取若干二苄胺浓度不同的标准曲线溶液的步骤包括:
4.根据权利要求2所述的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,所述选取待测试的注射液,并采用稀释剂进行稀释,以获取待测试的试品液的步骤包括:
5.根据权利要求1所述的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,所述液相色谱质谱联用仪的色谱条件的预设要求为:采用硅胶填料作为液相色谱柱,液相流速为0.27ml/min-0.33ml/min,液相进样量为1.8ul-2.2ul,所述液相色谱柱的柱温为30℃-40℃,样品室温度为12℃-16℃。
6.根据权利要求5所述的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,所述液相色谱柱包括流动相a和流动相b;
7.根据权利要求5所述的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,所述硅胶填料为acquity uplc beh c18,所述液相色谱柱的尺寸为2.1mm×50mm,其中,所述硅胶填料中填料颗粒的直径为1.7μm。
8.根据权利要求1所述的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,所述液相色谱质谱联用仪的质谱条件的预设要求为:设置所述液相色谱质谱联用仪的扫描离子模式为正离子模式,气帘气为27psi-33psi,碰撞气为8psi-10psi,离子喷雾电压为5000v-6000v,雾化温度为500℃-600℃,雾化气(gs1)为45psi-55psi,辅助加热气为45psi-55psi,驻留时间为55ms-65ms;去簇电压碰撞能为22v-24v。
9.根据权利要求1所述的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,其特征在于,所述二苄胺的化学结构式为:
技术总结
本发明提供了一种生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,包括以下步骤:配置二苄胺浓度不同的标准曲线溶液;设置液相色谱质谱联用仪的色谱条件和质谱条件达到预设要求,其中,质谱条件中母离子的质量为198Da,子离子的质量为91Da;将若干二苄胺浓度不同的标准曲线溶液注入液相色谱质谱联用仪,绘制标准曲线;将待测试的注射液稀释后注入液相色谱质谱联用仪中进行检测,读取二苄胺响应值;根据二苄胺响应值和标准曲线计算注射液中的二苄胺浓度。本发明提供的生物制药用一次性膜材迁移至注射液中的二苄胺测定方法,可方便快捷的检测出生物制药用一次性膜材迁移至注射液中的二苄胺浓度。
技术研发人员:朱楠楠,高杰,朱海伟,陈星,马红
受保护的技术使用者:百林科生物检测(江苏)有限公司
技术研发日:
技术公布日:2024/3/4
- 还没有人留言评论。精彩留言会获得点赞!