一种同时测定水体中四类蓝藻毒素的串联固相萃取-液相色谱-串联质谱检测方法与流程
本发明属于藻毒素检测,尤其涉及一种同时测定水体中四类蓝藻毒素的串联固相萃取-液相色谱-串联质谱检测的方法。
背景技术:
1、近年来我国水体富营养化严重,根据2022年生态环境部公布的全国地表水环境质量状况的报告显示,204个湖(库)营养状况中富营养湖(库)占30%。水体富营养化刺激蓝藻的滋生,加重了蓝藻细胞的次级代谢产物(蓝藻毒素)对生态环境以及人类安全的威胁。藻类水华爆发时,水体中蓝藻占有绝对优势,导致水体浑浊、溶解氧降低、水质恶劣、鱼类及其他浮游生物大量死亡,严重威胁居民饮用水安全。据报道,2007-2011年期间,美国共报告了458例疑似人类疾病和175例与蓝藻水华事件相关的动物死亡。藻类污染逐渐成为了世界性的环境问题,给生态环境及人类社会带来了巨大的威胁。
2、目前对蓝藻毒素的调查绝大多数关注微囊藻毒素,对其他蓝藻毒素的研究很少。但实际上富营养化水体中多种藻毒素并存,据报告显示,尽管全球各地淡水湖泊中蓝藻毒素贡献最大的是微囊藻毒素(63%),其他蓝藻毒素的占比:柱胞藻毒素为10%,鱼腥藻毒素为9%,节球藻毒素约占2%,其贡献也不容小觑。其中微囊藻毒素、柱胞藻毒素及节球藻毒素为致癌物质,鱼腥藻毒素具有神经危害。
3、常见藻毒素的检测方法有液相色谱法、液相色谱-质谱联用色谱法、elisa法等。其中液相色谱-串联质谱法(lc-ms/ms)因为可进行多种蓝藻毒素分析以及其高灵敏度,被广泛应用于环境水中蓝藻毒素的检测,常与固相萃取前处理联合使用。但目前绝大多数固相萃取-lc-ms/ms法仅针对单个类别的毒素(如微囊藻毒素),很少关注水体中可能存在的其它藻毒素。通过查阅有限的文献,微囊藻毒素及节球藻毒素多选用hlb小柱或c18小柱进行浓缩富集,鱼腥藻毒素可采用hlb小柱及硅胶柱富集,而柱胞藻毒素则多用碳墨基小柱。由于这四类蓝藻毒素在固相萃取小柱上保留行为的差异,如何将水体中的目标蓝藻毒素同时浓缩富集是需要考虑的问题。
4、此外,自然界中蓝藻毒素含量较低,常以痕量形式存在且天然水体基质较为复杂,毒素检测容易受到基质效应的干扰,如何对水体中这些蓝藻毒素准确定性与定量也是需要解决的问题。
5、综上所述,现有水体中蓝藻毒素检测技术还有待发展和补充。因此需要建立一个同时且快速检测水体中多类蓝藻毒素且可准确定量的检测方法,并将其应用到日常监测中,保障饮用水的安全性,对保护人民群众的身体健康有重要意义。
技术实现思路
1、为了解决现有技术中存在的问题,现提供一种同时测定水体中四类蓝藻毒素的串联固相萃取-液相色谱-串联质谱检测方法,包括步骤:
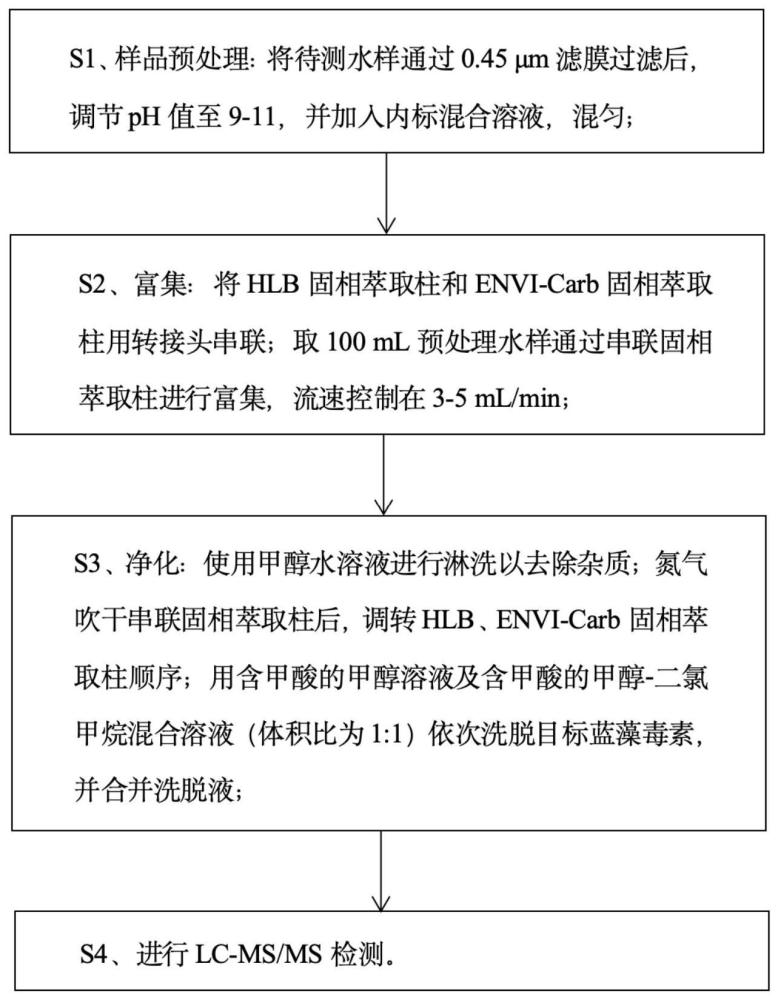
2、s1、样品预处理:将待测水样通过0.45μm滤膜过滤后,调节ph值至9-11,并加入内标混合溶液,混匀;
3、s2、富集:将hlb固相萃取柱和envi-carb固相萃取柱用转接头串联;取100ml预处理水样通过串联固相萃取柱进行富集,流速控制在3-5ml/min;
4、s3、净化:使用甲醇水溶液进行淋洗以去除杂质;氮气吹干串联固相萃取柱后,调转hlb、envi-carb固相萃取柱顺序;用含甲酸的甲醇溶液及含甲酸的甲醇-二氯甲烷混合溶液(体积比为1:1)依次洗脱目标蓝藻毒素,并合并洗脱液;
5、s4、进行lc-ms/ms检测。
6、优选地,步骤s4中lc-ms/ms检测的液相条件为:c18色谱柱,所述色谱柱温度为40℃,进样体积为2μl-10μl;流动相a液为含0.1%甲酸的水溶液,流动相b液为含0.1%甲酸的乙腈溶液;
7、梯度洗脱程序:所述流动相a液与流动相b液的整体流速为0.3ml/min;
8、质谱条件为:电喷雾离子化正离子模式(esi+);多反应监测模式(mrm);碰撞气压力(cad)为medium;气帘气压力(cur)为35psi;电喷雾电压(is)为5500v;离子源温度(tem)为300-600℃。
9、提供一个实施例,c18色谱柱为acquityuplc beh c18色谱柱。
10、提供一个实施例,acquity uplc beh c18色谱柱的参数为2.1mm×150mm,1.7μm。
11、提供一个实施例,梯度洗脱程序为:0-1.5min,5%的所述流动相b液;1.5-7.0min,5%-90%的所述流动相b液;保持1min;8.1-10.0min,90%-5%的所述流动相b液。
12、需要说明的是,步骤s1中加入的内标混合溶液,包含有5种同位素内标和亮氨酸脑啡肽。
13、需要说明的是,步骤s2中在取100ml预处理水样加入串联固相萃取柱进行富集,流速控制在3-5ml/min之间,还包括以6ml二氯甲烷、6ml甲醇及6ml超纯水(ph值9-11)依次活化串联的固相萃取柱,流速控制在1-2滴/秒。
14、需要说明的是,在步骤s3中,还包括流动相a液;流动相a液为含0.1%甲酸的水溶液。
15、还需要说明的是,流动相a液+流动相b液的总流速为0.3ml/min。
16、需要进一步说明的是,在步骤s3中,梯度洗脱程序为:
17、先经过0-1.5min,5%的流动相b液+95%的流动相a液;再过1.5-7.0min,5%-90%的流动相b液+95%-10%的流动相a液,保持1min;最后经过8.1-10.0min,90%-5%的流动相b液+10%-95%流动相a液。
18、优选地,步骤s1中用2mol/l的naoh溶液将ph值调至9-11。
19、需要说明的是,步骤s1中将待测水样通过0.45μm滤膜过滤后,调节ph值至9-11,并加入内标混合溶液,混匀。
20、需要说明的是,化合物的多反应监测离子对以及质谱相关参数如表1所示:
21、表1蓝藻毒素的多反应监测离子对及质谱相关参数
22、
23、其中,带*的为定量离子。
24、表2蓝藻毒素内标的多反应监测离子对及质谱相关参数
25、 物质 母离子/m/z 子离子/m/z 锥孔电压(v) 碰撞能量(v) <![cdata[mc-lr-<sup>15</sup>n<sub>10</sub>]]> 503.4 135 20 16 <![cdata[mc-yr-<sup>15</sup>n<sub>10</sub>]]> 528.1 135 30 15 <![cdata[mc-rr-<sup>15</sup>n<sub>13</sub>]]> 526.2 135 20 33 <![cdata[cyn-<sup>15</sup>n<sub>5</sub>]]> 421.1 197 90 47 leu-enk 556.3 396.8 60 33 <![cdata[ana-<sup>13</sup>c<sub>4</sub>]]> 170.1 153.1 45 19
26、需要说明的是,将ana-a、cyn、nod以及mcs四类藻毒素的单标配制成混合标准储备液,用于绘制标准曲线。移取一定量的混合标准储备液,使用含30%乙腈的水溶液配成浓度为0.50、1.0、5.0、20.0、50.0、100.0、150.0μg/l的标准系列工作液,其中内标的浓度均为1μg/l。按照上述分析条件测定,以蓝藻毒素浓度为横坐标,蓝藻毒素峰面积与内标峰面积的比值为纵坐标,进行线性回归。相关系数均大于0.998。
27、需要说明的是,根据不同蓝藻毒素在色谱柱的出峰时间及性质进行内标的选择。
28、表3化合物的标准曲线、内标选择及线性关系
29、 物质 标准曲线 线性范围(μg/l) 相关系数 内标 ana-a y=0.142x-0.008 0.5-75 0.9998 <![cdata[ana-<sup>13</sup>c<sub>4</sub>]]> cyn y=0.475x-0.002 0.5-150 0.9998 <![cdata[cyn-<sup>15</sup>n<sub>5</sub>]]> [d-asp3]mc-lr y=0.405x+0.008 0.5-150 0.9991 <![cdata[mc-lr-<sup>15</sup>n<sub>10</sub>]]> mc-hilr y=0.713x+0.022 0.5-150 0.9986 <![cdata[mc-yr-<sup>15</sup>n<sub>10</sub>]]> mc-htyr y=0.900x+0.06 0.5-150 0.9985 <![cdata[mc-yr-<sup>15</sup>n<sub>10</sub>]]> mc-la y=0.409x+0.004 0.5-150 0.9997 leu-enk mc-lf y=0.140x-0.0005 0.5-150 0.9996 leu-enk mc-lr y=0.442x+0.003 0.5-150 0.9989 <![cdata[mc-lr-<sup>15</sup>n<sub>10</sub>]]> mc-lw y=0.389x-0.0100 0.5-150 0.9994 <![cdata[mc-rr-<sup>15</sup>n<sub>13</sub>]]> mc-ly y=0.116x+0.0004 0.5-150 0.9985 <![cdata[mc-lr-<sup>15</sup>n<sub>10</sub>]]> mc-rr y=0.541x-0.049 0.5-150 0.9989 <![cdata[mc-rr-<sup>15</sup>n<sub>13</sub>]]> mc-wr y=0.502x-0.039 0.5-150 0.9995 <![cdata[mc-rr-<sup>15</sup>n<sub>13</sub>]]> mc-yr y=0.732x+0.009 0.5-150 0.9990 <![cdata[mc-yr-<sup>15</sup>n<sub>10</sub>]]> nod y=0.105x-0.034 0.5-150 0.9993 leu-enk
30、需要说明的是,样品中蓝藻毒素色谱峰的保留时间与相应标准色谱峰的保留时间相比较,变化范围应在±2.5%之内。
31、需要说明的是,检测水中蓝藻毒素的检出限为0.1-0.9ng/l,定量限为0.3-2.9ng/l。
32、优选地,所述方法应用于同时测定的四类藻毒素分别为鱼腥藻毒素(anatoxin-a,ana-a)、柱胞藻毒素(cylindrospermopsin,cyn)、节球藻毒素(nodularin,nod)以及微囊藻毒素(microcystins,mcs)。
33、优选地,所述方法使用多种同位素内标用于准确定量;所述多种同位素内标包括鱼腥藻毒素-13c4、柱胞藻毒素-15n5、微囊藻毒素mc-lr-15n10、微囊藻毒素mc-yr-15n10、微囊藻毒素mc-rr-15n13。
34、优选地,所述步骤s2前处理中将hlb固相萃取柱和envi-carb固相萃取柱串联后,hlb柱在上,envi-carb柱在下。
35、优选地,所述步骤s3中所述上下调转固相萃取柱的位置后,为envi-carb柱在上,hlb柱在下。
36、优选地,步骤s2前处理中,所述洗脱液的处理方式为:洗脱液在常温下使用氮气浓缩至近干,以含30%乙腈的水溶液定容至0.5ml;经超声5min,涡旋3min后转移至进样瓶中。
37、优选地,步骤s4中若微囊藻毒素可产生[m+2h]2+带电加和离子,则以[m+2h]2+离子作为该微囊藻毒素的分子离子。
38、优选地,步骤s4中需10min的单次进样即可完成对四类藻毒素的同时分析。
39、本发明的有益效果:
40、(1)本发明通过串联两种不同性质的固相萃取小柱进行浓缩富集,可同时测定ana-a、cyn、nod以及mcs四类蓝藻毒素,简化了前处理步骤,大大提高了检测效率;同时使用c18反相液相色谱柱,仅需10min的单次进样即可完成对四类藻毒素的同时分析,减少单个样品的上机检测时间,降低了时间成本,解决了传统分析技术中样品检测周期长、多类蓝藻毒素难以同时处理的问题,更好地满足快速分析的需求。
41、(2)本发明基于内标技术对水体中的四类蓝藻毒素进行准确定性,通过五种同位素内标mc-lr-15n10、mc-yr-15n10、mc-rr-15n13、cyn-15n5、ana-13c4以及一种非同位素内标leu-enk校正不同水体复杂的基质效应,可保证在各类水体中定量的准确性。
42、(3)本发明使用lc-ms/ms方法对水体中四类蓝藻毒素进行准确定量,灵敏度高,四类蓝藻毒素的检出限(lod)0.1-0.9ng/l,定量限(loq)为0.3-2.9ng/l,远低于我国目前水体微囊藻毒素(蓝藻毒素之一)的限量标准,能够检测水环境样品中痕量蓝藻毒素,增强了方法的实用性和可操作性,可作为检测水中四类蓝藻毒素含量的可靠方法。
- 还没有人留言评论。精彩留言会获得点赞!