AQP1作为胶质瘤辅助治疗中一个潜在的预后标志物和药物靶标的制作方法
本发明涉及生物医药领域,特别是涉及AQP1作为胶质瘤辅助治疗中一个潜在的预后标志物和药物靶标。
背景技术:
水通道蛋白(AQPs)属于小分子疏水性内在膜蛋白家族,介导涉及渗透压梯度的水分子跨膜转运(Verkman 2005)。哺乳动物机体内存在13种水通道蛋白(AQP-AQP12)。此类AQPs可分成两个功能组:传统的水通道蛋白(AQP 1,2,4,5,8),只便于水分子转运;甘油水通道蛋白(AQP3,7,9,10),也可以传输不带电荷的小分子,如甘油,乳酸和尿素(verkman 2005)。
由于AQPs与肿瘤发展关系密切,故其研究备受大众关注。在肝脏,结肠,宫颈癌,以及在食管鳞状细胞癌中AQP3的表达量均上调(Kusayama et al. 2011, Hara-Chikuma & Verkman 2008, Guo et al. 2013, Shi et al. 1971, Li et al. 2013)。AQP3的表达量也与肝细胞癌预后不良有关(Guo et al. 2013)。在卵巢癌,宫颈癌和乳腺癌患者中发现高表达的AQP5(Wang et al. 2012, Yang et al. 2006, Zhang et al. 2012, Jung et al. 2011)。此外,AQP5已被证实是宫颈癌,肝癌和乳腺癌预后较差的指标(Guo et al. 2013, Zhang et al. 2012, Shi et al. 2012)。相比于正常组织和良性肿瘤,AQP7和AQP9在卵巢上皮癌中的表达水平均较高(Verkman et al. 2008)。
值得注意的是,AQP家族的两个成员,AQP1和AQP4已确定存在于脑肿瘤(Benga & Huber 2012)。AQP4在乳腺癌和非小细胞肺癌中表达量较低(Shi et al. 2012, Warth et al. 2011)。相反,AQP4在高级别星形细胞瘤中表达量较高且呈广泛分布,其有可能成为肿瘤相关水肿的治疗靶标(Saadoun et al. 2002b, Warth et al. 2007, Warth et al. 2005, Warth et al. 2004, Sawada et al. 2007)。此外,我们以前的研究表明:AQP4与脑胶质瘤细胞的侵袭和迁移相关,siRNA介导的AQP4表达下调可诱导脑胶质瘤细胞凋亡(Ding et al. 2011, Ding et al. 2013)。最新证据表明,AQP1在肺,结肠和乳腺癌中表达量增加(Hoque et al. 2006, Otterbach et al. 2010, Yoshida et al. 2013)。另外研究显示,AQP1的表达与结肠癌和乳腺癌患者的肿瘤高级别及较短生存期有关(Yoshida et al. 2013, Otterbach et al. 2010)。然而,迄今为止,有关人脑肿瘤中AQP1表达情况的报道仍较少。先前基于相对少量患者组织样本的免疫组化研究表明(由世界卫生组织[WHO] 定义的各病理分级约五个胶质瘤患者病例),在低级别到高级别的星形细胞瘤中,AQP1的表达量存在潜在上调趋势(Saadoun et al. 2002a, Oshio et al. 2005, Deb et al. 2012)。基于这些研究,我们推测AQP1的表达与胶质瘤分级和胶质瘤患者术后生存期相关。
最近研究显示,AQP1在肿瘤生长和血管生成中具有一定的作用。AQP1在肿瘤血管内皮细胞中呈广泛表达,而AQP1缺失可抑制内皮细胞迁移,从而延迟肿瘤血管生成,(Saadoun et al. 2005, Nicchia et al. 2013, Esteva-Font et al. 2013, Verkman et al. 2008)。最近,AQP1在促进肿瘤细胞迁移方面的关键性作用也备受关注。AQP1促进多种肿瘤细胞系(包括HT20结肠癌细胞,B16F10黑色素瘤细胞和4T1乳腺肿瘤细胞)的肿瘤细胞迁移(Jiang 2009, Hu & Verkman 2006)。但是AQP1介导肿瘤细胞迁移的分子机制尚不清楚。在这方面,Monzani等人提出通过相关Lin-7 /β-catenin的机制,AQP1可提高HMEC-1人微血管内皮细胞及WM115人黑色素瘤细胞系的迁移能力(Monzani et al. 2009)。具体而言,AQP1与Lin-7联合免疫沉淀及AQP1的表达抑制均显著影响F-肌动蛋白细胞骨架组织以及LIN - 7/β-catenin的表达。然而目前还没有相关的临床数据得以证实人肿瘤组织中AQP1和β-catenin之间的关系。
技术实现要素:
水通道蛋白(AQPs)属于小分子疏水性内在膜蛋白家族,介导涉及渗透压梯度的水分子跨膜转运(Verkman 2005)。AQP家族的两个成员,AQP1和AQP4已确定存在于脑肿瘤(Benga & Huber 2012)。研究证实,AQPs与肿瘤发展关系密切,但有关脑胶质瘤AQP1与β-catenin肿瘤病理分级,组织学分级,患者总生存率(OS)及无进展生存期(PFS)报道仍较少。同时,至今还没有相关的临床数据证实人肿瘤组织中AQP1和β-catenin之间的关系。
鉴于以上所述现有技术,本发明第一方面提供AQP1在提高人神经胶质瘤细胞增殖及侵袭力中的作用。
由于细胞迁移能力通常与细胞侵袭能力呈正相关;相关数据显示,与非肿瘤组织相比,脑胶质瘤组织中AQP1 mRNA表达量呈上调,且AQP1过表达可提高LN229细胞的增殖与侵袭力,所以AQP1过表达在提高人神经胶质瘤细胞增殖及侵袭力中具有实际应用价值。
本发明第二方面提供AQP1表达水平与β-catenin表达水平呈正向关系。
由于先前研究显示,神经胶质瘤细胞中AQP1和β-catenin关系密切,其两者增加量与组织学分级相对应。此外,AQP1标签指数与β-catenin蛋白表达正相关。AQP1高表达与高等级胶质瘤和β-catenin蛋白高表达显著相关,所以AQP1表达量与β-catenin表达量之间存在正向关系。
本发明第三方面提供AQP1及β-catenin与肿瘤病理分级之间呈正相关。
由于1级神经胶质瘤及54%二级胶质瘤(n=33)存在高表达AQP1,然而71%三级胶质瘤中(n=39)和69%GBM(n=45)存在高表达AQP1(表2)。AQP1的表达水平随肿瘤组织学分级显著增加。与低等级(1级与2级)胶质瘤相比,高等级(3级与4级)胶质瘤具有大量的胞浆内β-catenin蛋白的表达,所以AQP1及β-catenin表达水平随与肿瘤病理分级显著增加。
本发明第四方面提供β-catenin表达与神经胶质瘤患者预后之间的关系。
由于高表达β-catenin蛋白与OS和PFS显著相关。高表达β-catenin蛋白患者总生存率的中值为31个月,而低表达β-catenin蛋白患者总生存率为27个月。高表达和低表达患者PFS中值分别为18和22个月,所以β-catenin表达与神经胶质瘤患者预后之间存在密切的关系。
本发明第五方面提供AQP1可作为人神经胶质瘤总生存期(OS)及无进展生存期(PFS)的预后指标和药物靶标。
由于高表达AQP1患者生存率低于低表达AQP1患者,且AQP1过表达与无进展生存期(PFS)下降密切有关,高表达AQP1患者总生存率的中值为26个月,而低表达AQP1患者总生存期45个月。高表达及低表达患者PFS中值分别为18和47个月。表明AQP1与胶质瘤患者预后不良息息相关。所以AQP1作为人神经胶质瘤总生存期(OS)及无进展生存期(PFS)的预后指标具有重要的临床意义。
本发明第六方面提供AQP1作为胶质瘤辅助治疗中一个潜在的预后标志物和药物靶标。
由于高表达AQP1,高表达β-catenin,年龄,肿瘤大小,高病理分级分别与OS缩短密切相关。此外,高表达AQP1,高表达β-catenin,肿瘤大小,年龄,高病理分级,以及缺乏辅助放疗均与PFS期下降密切相关。多变量分析表明,AQP1表达量,年龄,肿瘤大小,组织学分级为OS的独立预后因素,仅AQP1表达量及组织学分级与PFS有关。总之,我们的分析结果显示,AQP1的表达与OS相关,且肿瘤分级是患者PFS独立预后指标,所以AQP1作为胶质瘤辅助治疗中一个潜在的预后标志物和药物靶标具有实际应用价值。
综上所述,本发明发明人证实了AQP1是AQP1作为胶质瘤辅助治疗中一个潜在的预后标志物和药物靶标。发现AQP1与体外细胞模型及临床样品中β-catenin的表达呈正相关。通过细胞模型及临床样品检测,发现了AQP1与β链蛋白在神经胶质瘤发展中的作用;也表明了AQP1作为胶质瘤辅助治疗中一个潜在的预后标志物和药物靶标具有重要的临床意义。
附图说明:
图1:LN229细胞系中AQP1的过表达导致细胞增殖及β-catenin的上调。同源LN229细胞系未发现AQP1表达。肾组织作为阳性对照(A)。建立稳定表达AQP1的AQP1/LN229细胞系。AQP1与GFP作为一个重组蛋白表达(B)。AQP1过表达导致β链蛋白表达水平上调(C)。表达AQP1的绿色荧光蛋白(GFP)慢病毒载体或空白载体转染LN229细胞,结果显示AQP1位于细胞质内(D:×200)。转染AQP1的LN229细胞系的代表性显微图(上图)和Brdu定量检测(下图)(E:×200)。
图2:AQP1过表达导致LN229细胞增殖及侵袭能力增强。MTT检测结果显示AQP1过表达导致LN229细胞增殖能力增强(A)。在第7天细胞增值率明显升高。(P*<0.05)。软琼脂实验表明AQP/LN229细胞集落形成能力增强。典型的细胞集落图像(B:×200)。基底膜侵袭实验显示AQP1过表达可增加神经脑胶质瘤细胞侵袭性(C:×200)。
图3:神经脑胶质瘤组织中AQP1中表达。A:基于源于伦勃朗数据库的基因表达分析数据分析标准AQP1 mRNA表达水平。这些数据包括神经脑胶质瘤组织(n=454)和非肿瘤组织(n=24)。B:人神经脑胶质瘤组织中AQP1蛋白的Western Blot检测。神经脑胶质瘤中AQP1蛋白条带大小为28kd。阴性对照包括:N(正常组织)和S(神经鞘瘤)
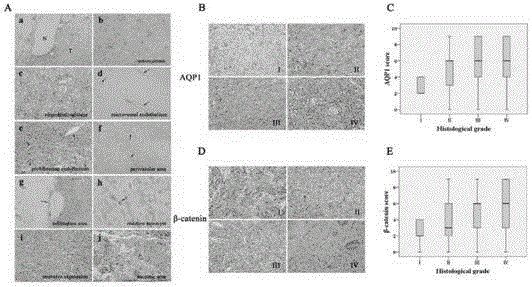
图4:神经脑胶质瘤组织中AQP1和β-catenin的免疫组化。AQP1免疫反应性研究(A)。正常脑组织(N)和肿瘤组织(T)中AQP1的表达情况(40×)(a)。星形胶质细胞瘤(200×)(b)和少突神经胶质瘤(200×)(c)中AQP1的表达情况。二级肿瘤的内皮细胞免疫组化染色观察AQP1表达情况(40×)(d)。成胶质细胞瘤内增殖的内皮细胞无AQP1表达(200×)(e)。血管周围大量AQP1表达(40×)(f)。活性星形细胞中AQP1表达(100×)(h)。几乎所有的肿瘤细胞中AQP1显著表达(200×)(i)。接近坏死区域的胶质母细胞瘤(GBM)中无AQP1或微弱AQP1表达(200×)(j)。不同等级的神经胶质瘤中AQP1(B)及β-catenin (D)免疫组化(I-IV,200×)。不同等级的胶质瘤中AQP1(C)(P=0.017)和β-catenin(E)(P=0.010)得分示意图。
图5:总生存期(OS)及无进展生存期(PFS)的实验结果。所有神经胶质瘤患者(AQP1均表达)的总生存期(OS)及无进展生存期(PFS)(A和B)。胶质母细胞瘤患者(AQP1均表达)的总生存期(OS)及无进展生存期(PFS)(C和D)。所有神经胶质瘤患者(β-catenin均表达)的总生存期(OS)及无进展生存期(PFS)(E和F)。
具体实施方式:
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的免疫组织化学(IHC)分析,Western blot(免疫印迹法),细胞培养,载体构建和慢病毒转染,MTT法,软琼脂分析法,侵袭检测,BrdU标记检测法,统计分析及相关领域的常规技术。
水通道蛋白(AQPs)属于小分子疏水性内在膜蛋白家族,介导涉及渗透压梯度的水分子跨膜转运(Verkman 2005)。哺乳动物机体内存在13种水通道蛋白(AQP-AQP12)。此类AQPs可分成两个功能组:传统的水通道蛋白(AQP 1,2,4,5,8),只便于水分子转运;甘油水通道蛋白(AQP3,7,9,10),也可以传输不带电荷的小分子,如甘油,乳酸和尿素(verkman 2005)。AQP家族的两个成员,AQP1和AQP4已确定存在于脑肿瘤(Benga & Huber 2012)。AQP1在细胞模型及临床样品中的表达情况,发现了胶质母细胞瘤细胞系中过表达AQP1可增强细胞增殖及侵袭力。冻存人脑胶质瘤组织的Western blot检测结果显示,高度恶性肿瘤中AQP1表达量居高。研究发现,AQP1只存在于低级别胶质瘤的细胞膜,但显著存在于高级别胶质瘤的细胞膜及胞浆内。通过细胞模型及临床样品检测,表明了AQP1作为胶质瘤辅助治疗中一个潜在的预后标志物和药物靶标。
各实施例中所使用的LN229人胶质母细胞瘤细胞系来源美国典型菌种保藏中心(Manassas, VA, USA),并于RPMI-1640培养基中进行培养,培养条件为5% CO2,37°C;培养基中含有10%胎牛血清、100µg/ ml青霉素、100μg/ mL的链霉素。重组人表皮生长因子(EGF)来源于R&D系统公司(Minneapolis, MN, USA)。细胞系由天津医科大学附属肿瘤研究医院检测。
各实施例中所使用的临床样品由天津医科大学附属肿瘤研究医院提供,由1999至2013年间,186个神经胶质瘤确诊患者在放疗和化疗之前的原发肿瘤标本组成。其中135例病患的随访信息均可用,随访时间直至2013年10月份或直到他们发展成为神经胶质瘤或直至死亡。30-33级患者术后放疗的照射剂量60Gy。术后化疗采用替莫唑胺。
免疫组织化学(IHC)分析
水通道蛋白和β-catenin的免疫组织化学使用福尔马林固定,进行石蜡包埋的组织切片(5μm)。载玻片在65°C下烘烤3h,用二甲苯脱蜡,再溶解于浓度递减的乙醇中,并用磷酸盐缓冲盐水进行清洗。AQP1和β-catenin的抗原修复通过在高压锅中加热,分别在柠檬盐酸缓冲液(PH6.0)加热2分钟50秒,其次在乙二胺四乙酸(EDTA)中加热2分钟15秒。用过氧化氢和正常山羊血清封闭切片,随后与抗AQP1多克隆抗体(1:500, SC-20810, Santa Cruz Biotechnology, Santa Cruz, CA, USA)或抗β-catenin的鼠抗人的多克隆抗体(1:150,SC-7963, Santa Cruz Biotechnology)温育过夜。所有的载玻片均置于3,3-二氨基联苯胺四盐酸盐中3-10分钟。阴性对照包括用非免疫血清替代初级抗体。
免疫组化结果由两位病理学家来进行评估,而他们对病人的临床资料并不了解。免疫组化评定结果基于双评分系统(染色强度乘以染色区),得出的数值总范围为0-9。染色强度评定如下:0=没有着色,1=明确,但微弱着色,2=中度着色,3=强度着色。染色区域评定如下:0=0-25%区域着色,1=26-50%区域着色,2=51-75%区域着色,3=肿瘤细胞的76-100%区域着色。高表达AQP1和β-catenin免疫组化的评分为5-9,蛋白质低表达和中度表达组评分为1-4,蛋白质无表达组评分为0分。生存分析结果显示,患者分为以下几组:无/低AQP1表达(综合得分0-3),中/高AQP1表达(综合得分4-9),无/低β-catenin表达(综合得分0-4),中/高β-catenin表达(综合得分5-9)。
Western blot(免疫印迹法)
在2010至2013年间收集的新鲜冻存神经胶质瘤样品(n=26,二级:10,Ⅲ级:7,IV级:9)应快速冷冻,并在取用之前存储于-80°C。用于本研究的所有肿瘤组织均是最初样品。在切除手术之前,患者未接受放疗或化疗。大脑标本必须来源于两个脑水肿患者和一个神经鞘瘤患者。
简而言之,使用超声细胞破碎机装置将组织进行粉碎。然后组织和细胞置于1×SDS裂解缓冲液中,在冰上(62.5 mM三羟甲基氨基甲烷盐酸盐, 2%十二烷基硫酸钠, 10%甘油)裂解30分钟。将样品煮沸10分钟,然后10000rpm,离心10分钟,去除上清液。蛋白经SDS-PAGE分离,并电转移到硝酸纤维素膜上。转印膜在一抗作用下4℃孵育过夜(AQP1抗体(1:500),β-catenin(1:2000),绿色荧光蛋白(1:7000,KM8009; SanJian, China),β-actin(1:5000, SC-47778, Santa Cruz Biotechology)。转移膜在抗兔抗体(Odyssey LiCor, IR800,1:8000)或抗鼠抗体(Odyssey LiCor, IR700,1:8000)作用下室温孵育50分钟。用LiCor Odyssey成像系统对转移膜进行分析,并用LiCor Odyssey软件进行光密度分析。
细胞培养和试剂
LN229人胶质母细胞瘤细胞系来源美国典型菌种保藏中心(Manassas, VA, USA),并于RPMI-1640培养基中进行培养,培养条件为5% CO2,37°C;培养基中含有10%胎牛血清、100µg/ ml青霉素、100μg/ mL的链霉素。重组人表皮生长因子(EGF)来源于R&D系统公司(Minneapolis, MN, USA)。细胞系由天津医科大学附属肿瘤研究医院检测。
载体构建和慢病毒转染
提取接受乳腺癌根治术的患者的新鲜正常乳腺体中总RNA。在距离恶性病变2厘米左右获取邻近的正常组织。组织用Trizol试剂(Invitrogen公司提供)处理(具体操作按照制造商的说明书)。总RNA用M-MLV反转录酶(Takara)反转录成cDNA。采用选择性引物对人AQP1基因组进行PCR扩增(基因库登录号:NM_198098.2),F:5′-AATTGAATTCGCCACCATGGCCAGCGAGTTCAAG-3′和R:5′-CGGGATCCCTATTTGGGCTTCATCTC-3′。序列两侧设立EcoRI和 BamH1位点,用于克隆入慢病毒为基础的PCDH-CMV-MCS-EF1-Puro载体。mGFP也插入慢病毒载体,产生可见报告基团。通过测序分析证实重组产物的正确结构。人胚胎肾293T细胞接种并在磷酸钙转染后24h转染,用于生产相关病毒。转染48h后,收集含有慢病毒颗粒的细胞上清液。LN229细胞(1.5×105/孔)接种于6孔板,并与含聚凝胺(10 μg/ml)的慢病毒上清液共同孵育4-5h,孵育条件5% CO2,37°C。在两天内,通过嘌呤(1 μg/ml)选择稳定转染LN229细胞系。借助Western blot实验检测稳定转染细胞系中AQP1的表达水平。
MTT法
细胞铺于24孔板中(5×103cell/孔),并孵育24h。使用 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)对活性细胞进行定量检测。简而言之,将50μl的MIT存储液(5 mg/ml)加至每个孔中,37°C孵育。孵育4h后,去除培养基,用二甲基亚砜溶解转换后的染料。采用酶标仪(BioTek Epoch)检测570nm处的光密度值(OD)。增值率由以下公式进行计算:增值率=每个时间点的OD/第一天的OD。MTT测定法中样品一式三份,并重复3次。
软琼脂分析法
软琼脂测定法可测定单个细胞在非依赖性生长的体外环境下长成集落的存活能力。简而言之,稳定转染的细胞(AQP1/ LN229或载体/ LN229)接种于顶层为0.35%琼脂和底层为0.6%琼脂的完全培养基的6孔培养板中(1×104细胞/孔)。培养板在37°C下孵育4周,其次用0.005%的结晶紫染色1h。菌落大于50μm进行评分,使用Olympus显微镜(Olympus,Japan)拍照。所有数据代表三个独立的实验。
侵袭检测
Boyden chamber侵袭测定法来检测体外细胞侵袭力(Corning, NY, USA)。简而言之,将24孔插入式细胞培养皿(8μm孔径)覆盖基质胶。用胰蛋白酶对细胞进行消化,并将200μL细胞悬浮液(5×105细胞/ ml)加入孔中(一式三份)。将培养基(350μL)(RPMI-1640,0.1%牛血清蛋白,25mM的羟乙基哌嗪乙硫磺酸)且含有10 ng/ml的表皮细胞生长因子(EGF)加至较低的孔中,37°C ,5% CO2培养24h。通过擦拭细胞膜的上测,去除非侵入细胞;同时固定并染色侵入细胞。在五个预先确定的领域,计数侵入细胞,并在显微镜下(放大倍数200倍)进行拍摄。所有测定数据由三个独立的实验中重复测定得出。
BrdU标记检测法
细胞接种于35mm的平底培养皿(1×105细胞/孔),并培养72h。用溴脱氧尿苷(BrdU)标记试剂(1 mg/ml)处理48h,将细胞用4%多聚甲醛固定30分钟。在与硼酸钠中和之前,将细胞经2M盐酸在37°C条件下处理10分钟。再与0.2%的Triton-X-100孵育10分钟后,将细胞用3%的牛血清蛋白(BSA)在室温下封闭1h。然后将细胞与鼠抗BrdU抗体(1:200;ZM0013;ZhongShan, China)在 4°C下过夜孵育,随后用羊抗抗体(Alexa Fluor594缀合二抗)(1:100;ZF-0513;ZhongShan)避光孵育1h。最后,细胞用49,6-二脒基-2-苯基吲哚(DAPI)(1 μg/ml)染色10分钟。
BrdU-DAPI双染色的细胞被认为是BrdU阳性细胞。使用荧光显微镜(TE2000-U, Nikon, Japan,倍率200×)拍摄图像。所有的实验都进行了三次。
统计分析
IHC统计分析采用SPSS17.0软件 (IBM, Armonk, New York, USA)。方差分析检测主要进行组间比较及两个变量关联性分析,并由斯皮尔曼等级相关法进行评价。总生存率(OS)和无进展生存率(PFS)分别采用Kaplan-Meier法估算,对数秩检验应用于计算P值。根据已鉴定的相关预后因素来建立Cox比例风险模型。患者生存时间从手术之日起计算,直至因神经胶质瘤死亡或神经胶质瘤全身复发为止,以最后随访时间或非癌症相关死亡的时间作为审查结点。在所有分析中,P ≤0.05则被认为具有统计学意义。使用Prism3软件(GraphPad Software)(San Diego,CA,USA)进行细胞增殖统计分析,所有数据表示为平均值±标准偏差。采用双尾t检验用以测定组间比较值具有重要统计学意义。
实施例1
AQP1过表达提高LN229细胞的增殖与侵袭力
先前研究表明,AQP1可提高HT20,12/40B16F10以及4T1细胞系的细胞迁移能力(Jiang 2009, Hu & Verkman 2006)。为了研究AQP1在脑胶质瘤中的作用,我们采用Western Blot方法检测AQP1在同源性LN229细胞系中的表达情况。在LN229细胞中未检测到AQP1表达(图1A)。然后,我们将表达AQP1序列全长的质粒转染LN229细胞,获得稳定表达AQP1的LN229细胞,并命名为AQP1/LN229细胞系。将空载体转染LN229细胞,获得稳定表达空载体的LN229细胞,并命名为载体/LN229细胞系,作为对照细胞系。与载体/LN229细胞相比,AQP1蛋白表达水平在AQP1/LN229细胞中显著上调(图1B)。为了完成AQP1的细胞定位,故进行免疫荧光染色实验,经细胞质染色图案得出结论(图1D)。
为了探索AQP1在细胞增殖中的作用,我们进行了BrdU实验。与对照组相比, AQP1过表达组中BrdU检测阳性细胞数显著增加(图1E)。与此结果一致,MTT检测法显示,在第七天时,AQP1/LN229组的细胞增殖率明显高于对照组(图2A)。软琼脂实验也用于测定AQP1/LN229及载体/LN229组中的细胞增殖率。与空载体对照组相比,AQP1过表达组形成的细胞集落数的显著增加。这些结果表明,AQP1在调节神经胶质瘤细胞增殖方面具有重要作用(图2B)。
细胞迁移能力的减弱通常会导致细胞侵袭能力的降低。先前研究表明,AQP1介导多类细胞迁移(Saadoun et al. 2005, Jiang 2009, Hu & Verkman 2006, Monzani et al. 2009)。因此,我们采用基质胶Boyden测定法,对AQP1过表达细胞组的侵袭能力进行测定。结果显示AQP1/LN229组与对照组存在显著差异(图2C)。与对照组相比,AQP1过表达组具有较高的侵袭率。此外,Monzani等人之前的研究表明,通过在HMEC-1 和WM115 细胞系中Lin-7/β-catenin相互作用,AQP1可提高细胞的迁徙能力(Monzani et al. 2009)。Western Blot实验显示,在LN229细胞系中,伴随AQP1过表达,β-catenin表达水平升高(图1C)。
实施例2
人脑胶质瘤组织中AQP1的表达情况
为了进一步探讨AQP1在脑胶质瘤组织中的功能性作用,基于源于伦勃朗数据库的基因表达分析数据,我们进一步检测AQP1 mRNA表达水平。(分子脑瘤数据查找,https://caintegrator.nci.nih.gov/rembrandt/)。这些数据包括脑胶质瘤组织(n=454)以及非肿瘤组织(n=24)。有效数据表明,与非肿瘤组织相比,脑胶质瘤组织(1.96±0.29)中AQP1 mRNA水平呈上调(图3A)。其次,我们利用Western Blot实验检测多种WHO等级的神经胶质瘤中AQP1蛋白表达水平(图3B)。两个正常的脑样本和一个神经鞘样本被作为对照组。通过Western Blot实验发现,在非肿瘤组织和神经鞘瘤样本裂解液中未检测到AQP1表达。与之相反,在人体胶质瘤组织中AQP1表达水平上调。此外,与低等级(2级)脑胶质瘤相比,AQP1在高等级(3到4级)胶质瘤中表达水平显著上调。特别是,在2级脑胶质瘤的10例样品中,仅有3例显示高表达的AQP1;其余均在高等级胶质瘤中存在高表达的AQP1。
实施例3
神经胶质瘤患者中AQP1的表达情况
有趣的是,我们观察到AQP1-免疫组化显示特定图案(图4Aa-j)。与先前研究相比,正常脑组织的神经胶质细胞中未检测到AQP1表达(Saadoun et al. 2002a, Hayashi et al. 2007)。与之相反,肿瘤区域的AQP1表达水平上调(图4Aa)。在星形细胞瘤(图4Ab)和少突神经胶质瘤(图4Ac)中观察到AQP1表达。在星形细胞瘤中,AQP1染色呈现了典型的星形胶质细胞外观。在低等级的胶质瘤内皮细胞中,人体胶质瘤组织切片中观察到AQP1表达,而在高等级脑胶质瘤的增殖内皮细胞中AQP1表达缺失。此外,AQP1免疫反应更加聚集且在血管周围分布更加密集(图4Af)。进一步的观察显示,AQP1在肿瘤浸润区域(图4Ag)存在表达,且定位于星形胶质瘤活性区(图4Ah)。在等级4的神经胶质瘤(胶质母细胞瘤,GBM)中,AQP1呈现两种免疫组化染色的模式。在特定区域中,在肿瘤细胞中AQP1一直表达,且与特定结构并无关联(图4Ai)。然而,在其他区域,AQP1染色在坏死区域中呈现无或微弱。
AQP1表达量与胶质瘤等级呈正相关。在一般情况下,细胞膜,细胞质以及两种肿瘤细胞中均可检测到AQP1的免疫反应性(图4B)。在低等级(1级和2级)的神经胶质瘤中,AQP1的表达水平主要受限于一定比例的肿瘤细胞的细胞膜。在高等级(3级和4级)的神经胶质瘤中,AQP1呈现广泛且密集的细胞膜和细胞内表达。1级神经胶质瘤及54%二级胶质瘤(n=33)存在高表达AQP1,然而71%三级胶质瘤中(n=39)和69%GBM(n=45)存在高表达AQP1(表2)。AQP1中间值及其数值范围见图4C。AQP1的表达水平随肿瘤组织学分级显著增加(rs=0.175,P=0.017,表2),但与阶层年龄限制,肿瘤大小,性别,病理类型,水肿程度以及肿瘤位置无关。
实施例4
神经胶质瘤患者的AQP1表达与预后的关系
在135个神经胶质瘤患者的有效随访资料中,32例患者由于失去随访,故未能提供相关资料。剩余103患者的全面随访数据从1至158个月。其中,72位患者在随访期间因胶质瘤死亡,78位患者呈现疾病恶化。
通过比较高表达(AQP1=3-9)与低表达(AQP1=0-2)的AQP1组发现,总生存率(OS)存在明显不同(P=0.001,图5A)。此外,高表达AQP1患者生存率低于低表达AQP1患者,同时上调的AQP1与无进展生存期(PFS)下降有关(P=0.000,图5B)。高表达AQP1患者总生存率的中值为26个月(95%Cl:置信区间,22.19-29.82),而低表达AQP1患者总生存期45个月(95%Cl:置信区间,34.23-58.76)。高表达及低表达患者PFS中值分别为18(95%Cl:置信区间,12.41-23.59)和47个月(95%Cl:置信区间,36.84-61.35)。Kaplan-Meier生存分析结果显示,AQP1与胶质瘤患者预后不良有关
Kaplan-Meier分析结果也用于评估GBM患者。在低/高表达AQP1组,高表达AQP1患者表现较低的OS(P=0.035,图5C)和PFS(P=0.043,图5D)
实施例5
胶质瘤患者中β-catenin的表达
先前研究显示,神经胶质瘤细胞中的AQP1和β-catenin关系非常密切。在此基础上,我们假设此关联也适用于体内研究。先前研究显示,神经胶质瘤中β-catenin呈过表达,其高表达与胶质瘤恶性程度相关(Liu et al. 2011, Rossi et al. 2011)。在我们的研究中,β-catenin蛋白主要在细胞质中呈不同强度及不同位置的表达(图4D)。与低等级(1级与2级)胶质瘤相比,高等级(3级与4级)胶质瘤具有大量的胞浆内β-catenin蛋白的表达。然而,在标本(包括高等级胶质瘤)中并没有观察到明显的细胞核染色,。1级胶质瘤及39%二级胶质瘤(n=24)存在β-catenin蛋白高表达,但55%三级胶质瘤(n=30)和58%GBM(n=38)存在β-catenin蛋白高表达(表3)。β-catenin蛋白数值的范围及其中间值见图4C。β-catenin蛋白的表达与组织学分级密切有关(rs=0.188,P=0.010,表3),而与其他临床病理特征无明显关系。
实施例6
神经胶质瘤患者中β-catenin蛋白表达与预后之间的关系
Kaplan-Meier分析结果显示,高表达β-catenin蛋白与OS(P=0.034,图5E)和PFS(P=0.005,图5F)显著相关。高表达β-catenin蛋白患者总生存率的中值为31个月(95%Cl:置信区间,0.00-89.77),而低表达β-catenin蛋白(综合评分:0-2)患者总生存率为27个月(95%Cl:置信区间,19.33-34.67)。高表达和低表达患者PFS中值分别为18(95%Cl:置信区间,12.18-23.82)和22个月(95%Cl:置信区间,7.65-36.36)。
实施例7
神经胶质瘤患者中AQP1与β-catenin蛋白之间的关系
接下来,我们对神经胶质瘤患者中AQP1和β-catenin蛋白之间的关系进行研究。AQP1和β-catenin蛋白的增加量与组织学分级相对应。此外,AQP1标签指数与β-catenin蛋白表达正相关(rs=0.168,P=0.022,表4)。AQP1高表达与高等级胶质瘤和β-catenin蛋白高表达显著相关。
实施例8
神经胶质瘤患者中AQP1表达的多因素分析
为进一步评估AQP1的独立预测价值,我们采用Cox回归方法(表5和6),依据可能预后因素(如病理分级,年龄,肿瘤大小等)进行亚组分析。单因素分析表明,高表达AQP1,高表达β-catenin,年龄,肿瘤大小,高病理分级分别与OS缩短显著相关(表5)。此外,高表达AQP1,高表达β-catenin,肿瘤大小,年龄,高病理分级,以及缺乏辅助放疗均与PFS期下降显著相关(表6)。多变量分析表明,AQP1表达量,年龄,肿瘤大小,组织学分级为OS的独立预后因素(表5),仅AQP1表达量及组织学分级与PFS有关(表6)。总之,我们的分析结果显示,AQP1的表达与OS相关(HR:风险比,3.023; 95%CI,1.045-8.745; P = 0.041),且肿瘤分级是患者PFS独立预后指标(HR, 3.224; 95% CI, 1.089-9.548; P=0.035)
AQP1表达是一个继年龄,肿瘤大小,性别,切除,家族史,病理分级,化疗的程度,和影像学图像的独立预后指标。然而,β-catenin多变量分析研究结果显示,其不再是患者OS(P=0.064)及PFS(P=0.513,表5和6)的一项独立预后指标。
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!