临床药物试验及受试者管理系统和方法与流程
本发明涉及管理系统,具体地,涉及临床药物试验及受试者管理系统与方法。
背景技术:
目前我国90%新药临床试验信息的处理过程采用的是传统手工方式,即从研究立项、试验记录到申报注册完成通过手工记录、纸张提交、书面审查的方法完成,导致了人力、物力、财力和时间的极大消耗,同时数据的可靠性、安全性、准确性、完整性得不到有效保证,检查与核查工作无法有效开展,数据信息利用率低。急需找到一种安全高效的方法,利用医院的信息集成平台,支撑临床试验系统获得检验、检查数据的可行性。临床试验项目是医院信息化建设的薄弱环节,医院一直以“患者为中心”为原则,以“提高临床试验质量、保证受试者的安全”为目标,但传统的纸质化管理流程无法进行事中的管理和干预,对于受试者而言存在较多的医疗风险,为保证受试者的安全,质控部门需要花费巨大的人力和物力进行监管和核查。近年来医院信息化发展迅速,医院数据中心的建设成为不可或缺的环节,各项临床资源通过医院数据中心平台进行整合、优化、分析、统计,为医院的管理与决策提供更多的数据支撑和强有力的论据。临床药物试验研究方案管理系统是基于医院的临床数据中心平台,整合临床各医疗业务域的数据信息,结合医疗诊疗常规和研究计划,规范研究者在试验阶段的医疗行为,从而保证受试者在研究过程中的安全与权益。临床试验研究过程大多是通过事后的纸质材料的记录,才能了解与分析试验过程中的情况,访视过程也存在一定的监管延迟情况,无法在事中进行监管。基于医院的临床数据中心平台,实时监控受试者的诊疗信息,如医嘱信息、检查信息及结果、检验信息及结果等,从而规格研究者的医疗行为,保证受试者的安全。
临床试验数据具有如下特征:1、数据来源复杂,涵盖医疗过程的各个环节,数据设计了医疗检验、检查,数据来源于多个不同的平台及系统;2、同类数据具有异构的多种来源,即使是不同的分中心平台,数据也存在很大的不同。
技术实现要素:
针对现有技术中的缺陷,本发明的目的是提供一种临床药物试验及受试者管理系统,包括以下模块:
机构管理模块:对立项与项目档案的信息进行管理;
伦理管理模块:对项目可行性论证的信息进行管理;
系统管理模块:对用户与工作的信息进行管理;
其中,机构管理模块、伦理管理模块以及系统管理模块所管理信息在数据库中存在关联关系。
优选地,所述机构管理模块包括:
立项管理模块:对项目立案过程进行信息管理;
质控设置模块:建立质控模块,供质控管理模块选择使用;
质控管理模块:根据选择的质控模块自动生成质控表,记录质控结果;
受试者管理模块:对受试者进行编号入组、出组、脱落操作并管理不良事件;
项目进度生成模块:根据受试者出入组情况自动生成项目进度;
试验药物管理模块:对试验药物的接收、发放、回收药物出入库的信息进行管理;
文件管理模块:对项目文件资料进行管理。
优选地,所述伦理管理模块包括:
八大审查申请模块:对初始审查、修正案审查、定期跟踪审查、不良事件审查、违背方案审查、暂停/终止研究审查、结题审查、复审审查的信息进行管理;
文件库管理模块:对审查文件资料进行管理;
实地访查模块:记录访查信息;
受试者抱怨模块:对受理、处理受试者的抱怨信息进行管理。
优选地,所述系统管理模块包括:
组织机构管理模块:按树形结构管理机构人员信息,其中,所述机构人员信息包括人员履历;
培训管理模块:根据培训记录,自动在人员履历内生成人员培训经历;
流程管理模块:利用工作流引擎,对机构的工作流程进行管理;
用户管理模块:为组织机构内的人员分配账号、密码;
角色管理模块:为用户分配角色。
优选地,所述立项管理模块包括:立项申请模块、专业负责人审批模块、机构办审核模块、机构办主任审批模块、提交伦理审查模块、签订合同模块、归档立项模块。
优选地,所述立项管理模块控制生成项目档案;
所述质控管理模块、受试者管理模块、项目进度模块、试验药物管理模块、文件管理模块对所述项目档案进行管理。
优选地,还包括:
后台信息系统:所述后台信息系统包括医院的信息系统;
伺机服务器:与后台信息系统进行数据交换处理;
中间数据库:对各个临床试验平台所产生的数据以及伺机服务器所采集的医院的信息系统的数据进行交换、比较;
临床试验平台:用于提供临床药物试验数据。
本发明还提供了一种临床药物试验及受试者管理方法,包括所述临床药物试验及受试者管理系统对临床药物试验及受试者进行管理的步骤。
与现有技术相比,本发明具有如下的有益效果:
1、能够根据临床试验项目内容进行相应的设置:如基本信息设置、入组套餐设置、用药方案设置、项目访视设置;
2、支持系统监控信息、用户管理、权限的管理等模块的维护和设置;
3、设计了一套基于企业服务总线的集成方式,降低连接各个异构应用系统的工作量,降低异构系统间的耦合度,提高系统的灵活性和响应速度;
4、设计了一套灵活高效可扩展的数据接口,以支撑不同数据源的数据集中使用。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为本发明提供的临床药物试验及受试者管理系统功能结构图;
图2为机构管理模块流程图;
图3为立项管理模块预定义流程图;
图4为本发明实施例操作界面示意图;
图5为立项管理模块优选例流程示意图;
图6为本发明数据共享示意图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
如图1所示,实施例中,本发明提供的临床药物试验及受试者管理系统包括以下模块:机构管理模块:对立项与项目档案的信息进行管理;伦理管理模块:对项目可行性论证的信息进行管理;系统管理模块:对用户与工作的信息进行管理。其中,机构管理模块、伦理管理模块以及系统管理模块所管理信息在数据库中存在关联关系。所述机构管理模块、伦理管理模块以及系统管理模块分别又对应不同的子模块。
所述机构管理模块又包括:立项管理模块:对项目立案过程进行信息管理;质控设置模块:建立质控模块,供质控管理模块选择使用;质控管理模块:根据选择的质控模块自动生成质控表,记录质控结果;受试者管理模块:对受试者进行编号入组、出组、脱落操作并管理不良事件;项目进度生成模块:根据受试者出入组情况自动生成项目进度;试验药物管理模块:对试验药物的接收、发放、回收药物出入库的信息进行管理;文件管理模块:对项目文件资料进行管理。
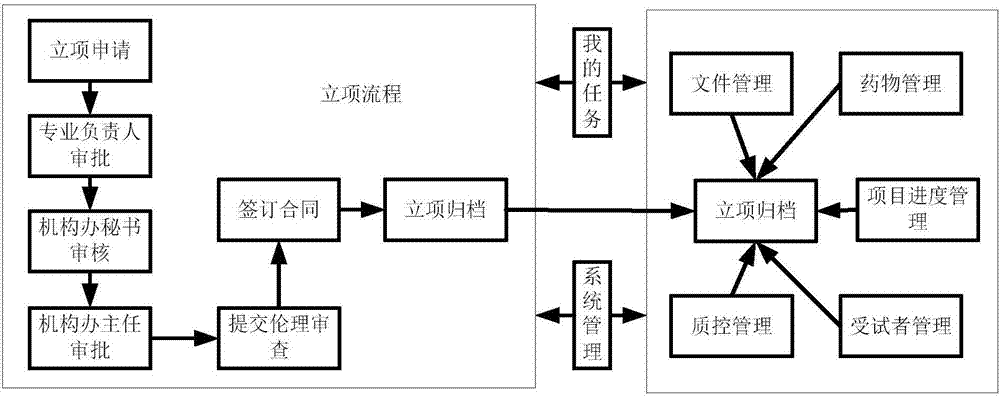
如图2所示,立项管理模块包括:立项申请模块、专业负责人审批模块、机构办审核模块、机构办主任审批模块、提交伦理审查模块、签订合同模块、归档立项模块。立项管理模块控制生成项目档案;质控管理模块、受试者管理模块、项目进度模块、试验药物管理模块、文件管理模块对所述项目档案进行管理。
实施例中,图3为预定义的工作流程,流程的每个环节都有特定的人员登陆系统来处理,多人员共同协作完成立项流程,走完此流程就完成了立项,系统自动生成项目档案。立项后可对项目进行文件管理、药物管理、进度管理、受试者管理、质控管理、档案管理等。优选地,立项管理模块还可以是如图5所示的流程,其中:
(1)申办方填写项目信息、研究信息、上传待审文件资料,提交。系统自动生成受理号。
(2)审查受理,查看申请信息,若有问题说明并驳回重新提交,无问题继续提交下一步。
(3)审查处理,选择审查方式、主审、独立顾问、方案工作表、知情同意工作表等,提交。
(4)(5)主审审查,填写方案工作表、知情同意书工作表、意见等,提交。
(6)会议审查,秘书记录会议信息、独立顾问参与咨询,提交。
(7)会审通过,批件自动生成,提交。
(8)会审不通过,驳回重新修改提交。
(9)资料归档。
所述伦理管理模块包括:八大审查申请模块:对初始审查、修正案审查、定期跟踪审查、不良事件审查、违背方案审查、暂停/终止研究审查、结题审查、复审审查的信息进行管理;文件库管理模块:对审查文件资料进行管理;实地访查模块:记录访查信息;受试者抱怨模块:对受理、处理受试者的抱怨信息进行管理。伦理管理模块具有以下特点:
1、任务化:系统分伦理秘书、伦理委员、审查申请人员、独立顾问等角色,每人均分配系统账号,以自己的账号登陆工作,分工明确,相互协作,各尽其职。
2、流程化:本系统使用先进的工作流引擎,流程的运转情况以图形化的形式展现出来,方便我们整体掌控流程。把流程的各个环节分配给不同的人员来处理,相互合作提高了工作效率。
3、规范化:系统预定义了各类审查规则,按照规则启动审查流程,运转流程,保证了审查的规范性。
4、多元化:系统在建立信息化的同时,各个处理过程、审查工作表、批件、意见等都可以下载打印,满足了同时保存纸质文档的需要。
5、低风险:由于伦理委员会的特殊性,上级的检查、复审也有严格的要求,所以信息化系统不能随意安装使用。我们的系统是按照各位伦理专家的意见研发的,符合上级检查的要求。
系统管理模块包括:组织机构管理模块:按树形结构管理机构人员信息,其中,所述机构人员信息包括人员履历;培训管理模块:根据培训记录,自动在人员履历内生成人员培训经历;流程管理模块:利用工作流引擎,对机构的工作流程进行管理;用户管理模块:为组织机构内的人员分配账号、密码;角色管理模块:为用户分配角色,如“伦理秘书”、“机构办秘书”等。
实施本发明时,可建立如图4所示的操作界面,其中:
(1)预设八个审查流程,在此模板可以发起审查申请。
(2)记录培训方式、地点、经费等信息。
(3)此模块主要是处理、查询自己的任务。
(4)管理与定义的流程,控制流程运转。
(5)记录访查信息,处理受试者抱怨。
(6)管理各专业组信息。
(7)数据统计模块。
(8)存放sop等、按项目存放文件资料。
(9)系统预定义的,可下载打印。
(10)保存放委员简历,在其他地方可调阅。
(11)管理系统的基本信息,人员、角色、菜单、资源等。
实施例中,本发明提供的临床药物试验及受试者管理系统还包括:后台信息系统:所述后台信息系统包括医院的信息系统;伺机服务器:与后台信息系统进行数据交换处理;中间数据库:对各个临床试验平台所产生的数据以及伺机服务器所采集的医院的信息系统的数据进行交换、比较。
临床药物试验及受试者管理系统结合数据共享和中间件技术,使用伺机服务器完成与各异构服务器单元的数据交互,并且使用结构化的中间数据库完成对试验原始数据的收集、分析、对比等工作,支持数据的横向、纵向比较。这里提出的异构结构,包括多个用于临床药物试验的临床实验平台,各种医院的信息系统,用于后台信息系统数据交换处理的伺机服务器,用于对各个临床试验平台所产生的数据以及伺机服务器所采集的医院信息系统数据进行交换、比较的中间件数据库平台,该底层平台的结构如图6所示。
伺机服务器从后台系统开放的数据表、视图文件或者外部文件中自动读取数据,融合存入中间数据库。实验平台a和b位于不同的地理位置采集原始的临床试验数据存入中间数据库。临床试验数据交换平台支持预先设置试验筛选条件列表,根据该筛选条件列表,从中间数据库的病人病历记录及志愿者信息记录中自动筛选出符合临床试验要求的受试者列表,并且根据该受试者列表进行临床试验,从而缩短试验的准备时间,受试者列表中的受试者基本信息从病历记录以及志愿者信息记录中自动提取,极大的降低了筛选病人的阶段填写、复核病历报告表的工作量。中间数据库用于记录来自临床试验平台的临床试验数据,以及伺机服务器采集的来自后台信息系统的数据。通过设计中间数据库,实现了信息采集和处理的全自动化、接口的灵活配置以及临床试验平台与接口数据共享的分离,形成了完整的数据接口平台。数据通过中间数据库进行交换,实现了对试验数据的隔离保护。同时在新接入临床系统时,不需要修改临床试验平台,并且可以支持在临床试验平台中的同一定义数据提供两个以上不同系统的接入。提供的数据差异设定功能,提高了临床试验平台的扩展性和安全性,实现了多中心间的数据比较和共同分析功能。
以上对本发明提供的临床药物试验及受试者管理系统进行了说明,相应地,本发明还提供了一种临床药物试验及受试者管理方法,包括利用所述临床药物试验及受试者管理系统对临床药物试验及受试者进行管理的步骤。
本领域技术人员知道,除了以纯计算机可读程序代码方式实现本发明提供的系统及其各个装置、模块、单元以外,完全可以通过将方法步骤进行逻辑编程来使得本发明提供的系统及其各个装置、模块、单元以逻辑门、开关、专用集成电路、可编程逻辑控制器以及嵌入式微控制器等的形式来实现相同功能。所以,本发明提供的系统及其各项装置、模块、单元可以被认为是一种硬件部件,而对其内包括的用于实现各种功能的装置、模块、单元也可以视为硬件部件内的结构;也可以将用于实现各种功能的装置、模块、单元视为既可以是实现方法的软件模块又可以是硬件部件内的结构。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!