一种心血管OCT与冠脉造影自动配准方法与装置与流程
本发明属于医学成像技术领域,具体涉及一种心血管oct与冠脉造影自动配准方法与装置。
背景技术:
光学相干断层扫描技术(opticalcoherencetomography,oct)是近十年迅速发展起来的一种成像技术,它利用弱相干光干涉仪的基本原理,检测生物组织不同深度层面对入射弱相干光的背向反射或几次散射信号,通过扫描,可得到生物组织二维或三维结构图像。而血管内光学相干断层成像结合光学技术与超灵敏探测器获取血管腔横断面图像,空间分辨率高,但其组织穿透力较弱。血管内光学相干断层扫描采用低相干的近红外光在血管腔内进行360°扫描,根据从组织反射或散射回来的不同光学特征进行组织分析成像,获得血管横断面图像,其成像分辨率接近组织学分辨率,是目前分辨率最高、成像最清晰的血管内成像技术。
冠动脉造影是诊断冠状动脉粥样硬化性心脏病(冠心病)的一种常用而且有效的方法,是一种较为安全可靠的有创诊断技术,现已广泛应用于临床,被认为是诊断冠心病的“金标准”。现有的冠脉造影图像的造影过程是利用dsa,先将作为造影剂的碘对比剂注入冠脉开口,依靠碘对比剂流经的方向和充盈的冠脉,然后借助x线辅助采集病人的冠脉中被碘对比剂充盈的冠脉的造影图像。
冠脉造影可以实时动态的观察冠状病变的狭窄程度及是否有侧支循环等。心血管oct能够准确的定量某一截面位置的管腔狭窄程度。基于共识,心血管oct在判定支架释放方面可能有益,可以发现支架贴壁不良及边缘夹层,帮助判别斑块的性质,但是不建议应用心血管oct对冠状动脉狭窄程度进行功能学判断。因此我们结合心血管oct图像以及冠状造影图像,更加真实的反映血管内的情况。
但是两个基于不同图像技术的图像的配准是耗时的,现在仍或多或少的依赖于与用户的交互,而且使用血管造影剂也会干扰图像的配准。在进行心血管oct与冠脉造影的图像配准时,因为血管造影图像分辨率比较低,在检测探针标记点时会产生较多的标记候选点,利用用户手工标出标记带,可以帮助计算机加速标记点的选择、跟踪以及中心线的生成。也即现有的配准技术通过计算机识别标记点,不仅会在产生血管中心线时产生较大误差,而且会增加配准的时间。
因此,如何高效率的实现一种心血管oct与ivus图像的配准成为目前的热点问题。
技术实现要素:
为了解决现有技术中存在的上述问题,本发明提供了一种心血管oct与冠脉造影自动配准方法与装置。本发明要解决的技术问题通过以下技术方案实现:
本发明实施例提供了一种心血管oct与冠脉造影自动配准方法,包括:
(a)通过光学相干断层扫描系统和血管造影系统分别获取oct图像和冠脉造影图像;
(b)获得进行oct区域的所述冠脉造影图像的第一主血管的血管中心线;
(c)根据所述第一主血管的血管中心线完成所述oct图像与所述冠脉造影图像的配准。
在本发明的一个实施例中,步骤(b)包括:
(b1)获取所述冠脉造影图像的第二主血管;
(b2)获取所述第二主血管的轮廓;
(b3)根据所述轮廓的曲率获得所述第二主血管的矢向量,根据所述矢向量、所述轮廓获取所述第二主血管的血管中心线;
(b4)获取所述冠脉造影图像中的探针标记点;
(b5)根据所述探针标记点的位置、所述第二主血管的血管中心线获取所述第一主血管的血管中心线。
在本发明的一个实施例中,步骤(b1)包括:
(b11)对所述冠脉造影图像进行二值化处理获得二值图;
(b12)在所述二值图中,利用形态学方法,获得所述第二主血管。
在本发明的一个实施例中,所述轮廓包括第一轮廓线和第二轮廓线,所述第一轮廓线用于标识所述第二主血管的外边缘,所述第二轮廓线用于标识所述第二主血管的内边缘。
在本发明的一个实施例中,步骤(b3)包括:
(b31)根据所述第一轮廓线的曲率获得位于所述第一轮廓线上采样点的矢向量;
(b32)确定沿所述矢向量方向的直线,以所述采样点为起点,以所述直线与所述第二轮廓线的交点作为终点获得采样线段;
(b33)获得各所述采样点对应的所述采样线段的中点;
(b34)以所述第二主血管的起始位置为起点,所述第二主血管的终止位置为终点,连接所述中点获得所述第二主血管的血管中心线。
在本发明的一个实施例中,步骤(b4)包括:
(b41)获取具有log响应且距离所述第二主血管最近的像素点;
(b42)将所述像素点识别为探针标记点。
在本发明的一个实施例中,步骤(b5)包括:
采用距离变换算法根据所述探针标记点的位置、所述第二主血管的血管中心线计算所述第一主血管的血管中心线。
在本发明的一个实施例中,步骤(c)包括:
(c1)获取进行所有oct区域的所述冠脉造影图像的所述第一主血管的血管中心线;
(c2)计算不同时间的所述oct图像对应在所述第二主血管的血管中心线上的位置;
(c3)通过帧配准完成所述oct图像与所述冠脉造影图像的配准。
本发明的另一个实施例提供了一种心血管oct与冠脉造影自动配准装置,包括数字信号处理单元及存储单元,所述存储单元用于存储处理指令,所述处理指令被所述数字信号处理单元执行时实现如权利要求1-8任一项方法中的步骤。
与现有技术相比,本发明的有益效果:
1.本发明的方法可以自动计算并配准oct图像与冠脉造影图像,从而节省了时间,使用户可以快速清楚的观察到血管同一点在血管内部和外部的形态,更好地做出临床判断;
2.本发明的方法操作简单,易于实现。
附图说明
图1为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的流程示意图;
图2为本发明实施例提供的另一种心血管oct与冠脉造影自动配准方法的流程示意图;
图3为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法中血管造影系统获得的冠脉造影图像;
图4为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的二值化处理后的冠脉造影图像;
图5为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的形态学处理过的冠脉造影图像;
图6为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的血管中心线的计算原理示意图;
图7为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的近端探针标记点的位置示意图;
图8为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的探针标记点的位置示意图;
图9为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的进行第一主血管的血管中心线的位置示意图;
图10为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的配准结果示意图;
图11为本发明实施例提供的一种心血管oct与冠脉造影自动配准装置的模块结构示意图。
具体实施方式
下面结合具体实施例对本发明做进一步详细的描述,但本发明的实施方式不限于此。
实施例一
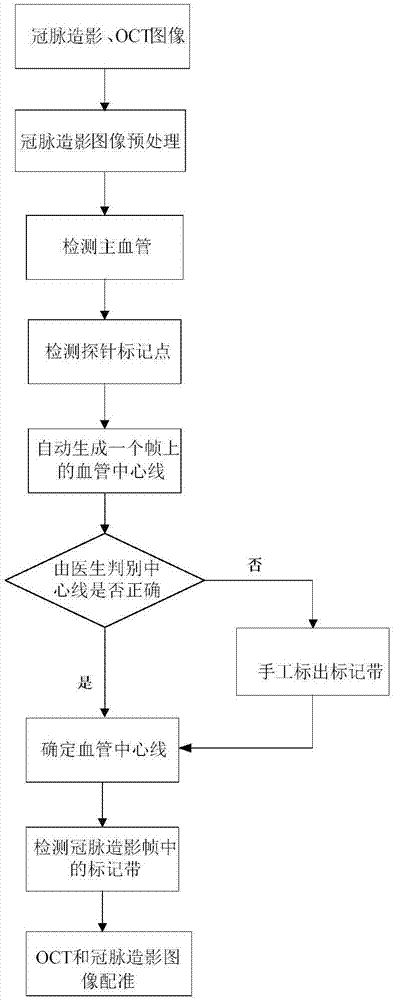
请参见图1,图1为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的流程示意图。
一种心血管oct与冠脉造影自动配准方法,包括:
(a)通过光学相干断层扫描系统和血管造影系统分别获取oct图像和冠脉造影图像;
(b)获得进行oct区域的所述冠脉造影图像的第一主血管的血管中心线;
(c)根据所述第一主血管的血管中心线完成所述oct图像与所述冠脉造影图像的配准。
本发明实施例的一种心血管oct与冠脉造影自动配准方法可以实现将同一血管段的oct图像和冠脉造影图像进行配准,配准过程自动完成,可以快速的得到清晰、准确的配准图像,使用户能够更好的做出临床判断。
实施例二
请再次参见图1同时请参见图2,图2为本发明实施例提供的另一种心血管oct与冠脉造影自动配准方法的流程示意图。本实施例在上述实施例的基础上,重点对一种心血管oct与冠脉造影的自动配准方法的详细流程进行进一步描述。具体地,
一种心血管oct与冠脉造影自动配准方法,通过以下步骤来实现:
s10.通过光学相干断层扫描系统和血管造影系统分别获取oct图像和冠脉造影图像;请参见图3,图3为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法中血管造影系统获得的冠脉造影图像,图中100为第二主血管。
s11.获得进行oct区域的所述冠脉造影图像的第一主血管的血管中心线。因为进行冠脉造影是对心脏的整段血管进行造影,但是oct只是对整段血管中的一部分进行血管成像,把oct成像的那段血管在冠脉造影图像中表示出来,称为进行oct区域的冠脉造影图像。
s111.请参见图4,图4为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的二值化处理后的冠脉造影图像,图中100为第二主血管。获取所述冠脉造影图像的第二主血管。
对所述冠脉造影图像进行二值化处理获得二值图。
优选地,分别利用最大类间方差法以及hessians矩阵处理对所述冠脉造影图像进行处理,利用最大类间方差法,根据灰度特性,区分出前景和后景,前景部分指的是所述第二主血管,后景为其他图像区域。最终结果以二值图表现出来。
进一步地,对所述冠脉造影图像进行二值化处理前,可以利用拉普拉斯高算法对血管造影系统获得的冠脉造影图像进行处理,该算法对图像中的边缘部分进行增强,以使后续对主血管的检测更加准确。
进一步地,在所述二值图中,利用形态学方法,获取所述第二主血管。请参见图5,图5为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的形态学处理过的冠脉造影图像;
优选地,形态学方法包括:膨胀处理、腐蚀处理和骨架处理。
s112.获取所述第二主血管的轮廓;
优选地,采用dp算法获取所述第二主血管的轮廓。具体方法如下:
dp算法大致可概述为:从图片的第一行到第n行寻找一条路径使得损失最小。因为边缘是连续性的,第θ行的路径总是来自于第θ-1行,所以损失函数为:
c(ρ,θ)=f(ρ,θ)θ=1
c(ρ,θ)=minc(ρ*,θ-1)+f(ρ,θ)1<θ≤n
ρ和θ分别是直角坐标系中像素点的横坐标和纵坐标,c(ρ,θ)是从第1行到点(ρ,θ)的损失和,f(ρ,θ)是每点的能量函数,ρ*∈[ρ-m,ρ+m],m是查找范围。至此,轮廓的检测可被转化为寻找全局最小的损失和,通过最小损失和推算回路径。
s113.请参见图6,图6为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的血管中心线的计算原理示意图,图中,101为第一轮廓线,102为第二轮廓线,103为矢向量,104为第二主血管的血管中心线,105为中点。根据所述轮廓的曲率获得所述第二主血管的矢向量,根据所述矢向量、所述轮廓获取所述第二主血管的血管中心线;
进一步地,所述轮廓包括第一轮廓线和第二轮廓线。所述第二主血管有两条轮廓线,以与这两条轮廓线相匹配的圆来说,半径大的轮廓线称为外边缘,半径小的轮廓线称为内边缘,所述第一轮廓线用于标识所述第二主血管的外边缘,所述第二轮廓线用于标识所述第二主血管的内边缘。
进一步地,根据所述第一轮廓线的曲率获得位于所述第一轮廓线上采样点的矢向量;
进一步地,确定沿所述矢向量方向的直线,以所述采样点为起点,以所述直线与所述第二轮廓线的交点作为终点获得采样线段;
进一步地,获得各所述采样点对应的所述采样线段的中点;
进一步地,以所述第二主血管的起始位置为起点,所述第二主血管的终止位置为终点,连接所述中点获得所述第二主血管的血管中心线。
s114.请参见图7,图7为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的近端探针标记点的位置示意图。获取所述冠脉造影图像中的探针标记点。
根据oct成像时显现的不透明标记带,对所述冠脉造影图像中的所述第二主血管区域附近的50个像素点以及所述第二主血管区域进行log响应判断,检测到具有较高log响应且距离所述第二主血管最近的像素点,将所述像素点识别为探针标记点。此时,可以在所述冠脉造影图像中观察到两个探针标记点;在本发明中,将距离图像上边缘更近的探针标记点记为远端标记点,另一个则记为近端标记点。
s115.请同时参见图8和图9,图8为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的探针标记点的位置示意图,图9为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的第一主血管的血管中心线的位置示意图,图9中,106为第一主血管的血管中心线。根据所述探针标记点的位置、所述第二主血管的血管中心线获取所述第一主血管的血管中心线。
进一步地,采用距离变换算法根据所述探针标记点的位置、所述第二主血管的中心线计算所述第一主血管的血管中心线。具体地,由于检测得到的是所述探针标记点的位置,但是所述近端探针标记点距离所述第一主血管的起始点仍有一定的距离,假设近端标记点与起始点之间的距离为m,所述m为已知数值。根据实际血管大小与所述冠脉造影图像之间的比例尺1:n,根据m和n推算出所述第一主血管的起始位置x=m×n+x0,x0为检测到的近端探针标记点的位置,所述远端标记点为所述第一主血管的终点。根据所述第一主血管的起始位置确定所述第一主血管的血管中心线。
进一步地,由于冠脉造影图像分辨率较低,所以依然有可能存在中心线并不准确的情况。因此将检测到的中心线结果显示于装置上,由用户判断结果是否准确。若结果准确,则以该所述第一主血管的血管中心线为基准,以确定所有回拉帧中的血管中心线;若不正确,用户则手动标记所述第一主血管的血管中心线,或直接对所述第一主血管的血管中心线进行位置修改。
进一步地,若用户对所述第一主血管的血管中心线进行了更改,使用dijkstra最短路径算法,对用户手工确定的标记带进行平滑性处理。最后将所述标记带认定为所述第一主血管的血管中心线,从而将其确定为基准,以确定所有回拉帧中的中心线。同时将通过标记点的位置确定所述标记带为oct图像的远端标记点还是近端标记点。
s12.根据所述第一主血管的血管中心线完成所述oct图像与所述冠脉造影图像的配准。
s121.获取进行所有oct区域的所述冠脉造影图像的所述第一主血管的血管中心线;
由于心脏的跳动,即心脏收缩以及心脏扩张,帧与帧之间主血管的区域会产生位置差异。通过步骤s11,可以获得所有回拉帧中的所述第二主血管位置和探针标记点,结合步骤s115的算法的同时利用sift算法,对提取到的所述第一主血管的血管中心线进行特征点提取与匹配,从而得到更准确的所有回拉帧中所述第一主血管的血管中心线。
s122.计算不同时间的所述oct图像对应在所述第二主血管的血管中心线上的位置。计算所有进行oct区域的所述第一主血管的血管中心线的长度,利用公式
还可以利用公式xt=vt+l得到不同时间的所述oct图像对应在所述第一主血管的血管中心线上的位置,v为回拉速度。
s123.通过帧配准完成所述oct图像与所述冠脉造影图像的配准。
请参见图10,图10为本发明实施例提供的一种心血管oct与冠脉造影自动配准方法的配准结果示意图,图中,107为冠脉造影图像,108为oct图像,109为回拉点,110为配准线,111为管腔示意图,112为纵向l-轴示意图。根据配准结果,当切换所述oct图像时,会自动显示其在冠脉造影图像中的位置。当拉动纵向oct截面图和管腔分析图中的配准线时,oct横向界面和配准的冠脉造影图像会随之改变,同时在冠脉造影图像上会显示出回拉的具体位置。
通过本发明实施例,可以达到以下有益效果:
1.本发明实施例的方法将oct图像与冠脉造影图像进行配准,并且配准过程在一定程度上实现了自动化,从而实现了oct图像与冠脉造影图像的快速配准。
2.本发明实施例的方法可以使用户能够快速的观察到血管同一点内部和外部的形态,节省了时间。
3.本发明实施例的方法简单,易于实现。
实施例三
请参见图11,图11为本发明实施例提供的一种心血管oct与冠脉造影自动配准装置的模块结构示意图。本实施例在上述实施例的基础上,重点对oct与冠脉造影的自动配准装置进行描述。
一种心血管oct与冠脉造影自动配准装置,包括数字信号处理单元及存储单元,所述存储单元用于存储处理指令,所述处理指令被所述数字信号处理单元执行时实现如上述任一实施例中的方法。
进一步地,所述装置包括探测模块1、光信号处理模块2、血管造影机3、第一数据采集模块4、第二数据采集模块5、数据分析模块6以及显示模块7,其中,所述探测模块1、所述光信号处理模块2、所述第一数据采集模块4、所述数据分析模块6以及所述显示模块7依次串接,所述血管造影机3、所述第二数据采集模块5依次串接于所述数据分析模块6的输入端;其中,
所述探测模块1用于采集血管信号;
所述光信号处理模块2用于对血管信号进行处理得到oct图像;
所述血管造影机3用于得到冠脉造影图像;
所述第一数据采集模块4用于收集所述光信号处理模块2得到的所述oct图像;
所述第二数据采集模块5用于收集所述血管造影机3得到的所述冠脉造影图像;
所述数据分析模块6用于对所述oct图像和所述冠脉造影图像进行处理;
所述显示模块7用于将配准后的结果呈现出来。
进一步地,所述数据分析模块6包括依次串接的图像处理模块61、轮廓检测模块62、探针标记检测模块63、图像配准模块64,其中,
所述图像处理模块61用于处理所述冠脉造影图像形成第二主血管;
所述轮廓检测模块62用于检测所述第二主血管的轮廓;
所述探针标记检测模块63用于检测探针标记点,从而得到oct图像的位置;
所述图像配准模块64用于完成所述oct图像与所述冠脉造影图像的配准。
首先通过所述探测模块1采集需要取样的血管信号,通过所述光信号处理模块2对所述血管信号进行处理得到oct图像,随后所述第一数据采集模块4收集所述oct图像得到多帧所述oct图像;同时,所述血管造影机3获取同一血管段的冠脉造影图像,随后通过所述第二数据采集模块5收集所述冠脉造影图像得到多帧所述冠脉造影图像;通过所述数据模块6处理得到的多帧所述oct图像和多帧所述冠脉造影图像,形成配准,最后通过所述显示模块7将配准后的结果呈现出来。
本发明实施例,通过这种模块结构,实现了高效率的心血管oct图像与冠脉造影图像的配准,得到更具优势的图像,使用户能够更好的进行临床判断。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!