一种基于DNA核酶的DNA分子逻辑门的制作方法
本发明属于分子计算技术领域,具体涉及一种基于dna核酶的dna分子逻辑门。
背景技术:
dna由于具有遵循可预测的沃森-克里克碱基配对原则和微小的性能,使其具有优秀的数据存储能力,成为了在纳米技术领域中极具潜力的新材料。到目前为止,dna一直被用来构建逻辑运算、级联网络和循环电路,而基于dna的计算系统,尤其在生物工程系统中调节信号放大和信息处理方面的起着至关重要的作用,上述说明其在分子纳米工程和分子计算领域巨大的潜力。
基于粘性末端(toehold)介导的链置换反应,大多数dna逻辑计算系统采用了两种主要的机制:非催化电路和催化电路。在非催化电路中,输入dna链可以直接与目标门反应,产生输出产物,作为下一个信息过程的输入。然而,非催化的触发系统对大量的dna输入是有要求的,因为需要dna的输入与dna门的底物的比例是相等的。相比之下,在催化电路中,输入dna触发器可以循环多次,并在不被消耗的情况下维持自身。dna的催化功能提供了更多的可能性来执行复杂的信息过程,如信号放大和传输。尽管dna催化机制有望实现,但由于缺乏连接信息流的链接,因此设计一个合理的级联dna逻辑网络是非常困难的。
由dna核酶(dnazyme)介导的酶切技术是一种常见的生物手段,dna核酶不但具有dna所拥有的极强的并行性、超大存储空间和酶本身的特异性,同时还具有高于其它蛋白酶的酶催效率以及成熟的生成技术。因此,将dna核酶应用于dna计算中具有巨大的发展潜力。另外,dna核酶是一种具有催化功能的dna分子,因其具有的特异识别性和易溶性、离子依赖等特性,可以构建各种dna分子逻辑门,来进行分子计算。这种分子计算方法具有高效、反应迅速等特点。近年来,越来越多的实验人员利用dna核酶的生化特性来探究dna分子计算,使得分子计算技术更加多元化。
技术实现要素:
为此,本发明的目的是提供一种基于dna核酶的dna分子逻辑门。
为此,本发明的技术方案如下:
一种基于dna核酶的dna分子逻辑门,包括:输入信号、dna逻辑计算单元和输出信号,
所述输入信号包括:至少一个dna催化链h和/或至少一个dna核酶;
所述dna逻辑计算单元包括:a链、dna复合物b和信号底物;
所述输出信号包括:信号底物发生反应,释放信号;
所述dna复合物b包括b链和b*链,所述b链与所述b*链杂交相连,并且在所述b链上留有粘性末端;
所述b*链包括b1链和b2链,所述b1链和b2链相连或不相连;
所述a链和b链杂交相连组成具有核酸内切酶功能的dna核酶2;
所述dna核酶2可以识别所述信号底物中的特定序列,并催化切割所述信号底物而释放信号;
所述dna催化链h可以通过与所述b链的粘性末端结合,发生链置换反应;
所述b链上在所述b链与b1链或b2链杂交处具有所述a链的结合位点,促使a链和b链杂交相连;所述a链的结合位点所在位置为靠近具有所述粘性末端的一端。
上述dna分子逻辑门中,所述a链的结合位点为与a链中的对应位置通过碱基互补的结合序列,所述a链的结合位点为4-8个碱基。
上述dna分子逻辑门中,所述信号底物为中间含有所述dna核酶2酶切位点、两端分别修饰有荧光基团和淬灭基团的dna链。
上述dna分子逻辑门中,所述dna分子逻辑门为yes门,所述yes门中:
所述输入信号为dna催化链h,所述b1链和b2链不相连,其两者在与b链结合时,两者不间隔碱基。
上述dna分子逻辑门中,所述dna分子逻辑门为级联yes门,所述级联yes门中:
所述输入信号为dna核酶1,
所述dna逻辑计算单元还包括:
dna催化链h或其前体;
所述b1链和b2链通过一段核酸序列l相连,所述核酸序列l与b链不杂交,形成loop环;
所述dna催化链h前体含有所述dna核酶1的酶切位点,经过dna核酶1催化后生成dna催化链h。
上述dna分子逻辑门中,所述dna分子逻辑门为级联两层yes门,所述级联两层yes门中:
所述输入信号为dna核酶1*;
所述dna逻辑计算单元还包括:
dna催化链h1、dna复合物d和c链;
所述dna复合物d包括d链和d*链,所述d链与所述d*链杂交相连,并且在所述d链上留有粘性末端;
所述d*链包括d1链和d2链,所述d1链和d2链通过一段核酸序列l1相连,所述核酸序列l1与d链不杂交,形成loop环;
所述核酸序列l1含有所述dna核酶1*的酶切位点;
所述dna催化链h1可以通过与所述d链的粘性末端结合,发生粘性末端介导的链置换反应;
所述d链上在所述d链与d1链或d2链杂交处具有所述c链的结合位点,促使c链和d链杂交相连;所述c链的结合位点所在位置为靠近具有所述粘性末端的一端;
所述c链和d链杂交相连组成dna核酶1,所述dna核酶1作为下一层yes门的输入信号。
上述dna分子逻辑门中,所述dna分子逻辑门为or门,所述or门中:
所述输入信号为dna核酶1或dna核酶3;
所述dna逻辑计算单元还包括:dna催化链h1或其前体、dna催化链h2或其前体;
所述b1链和b2链相连通过一段核酸序列l相连,所述核酸序列l与b链不杂交,形成loop环;
所述dna催化链h1前体和核酸序列l含有所述dna核酶1的酶切位点;
所述dna催化链h2前体和核酸序列l含有所述dna核酶3的酶切位点;
所述dna催化链h1前体被所述dna核酶1酶切后形成dna催化链h1;
所述dna催化链h2前体被所述dna核酶3酶切后形成dna催化链h2;
所述dna催化链h1和h2分别可以通过与所述b链的粘性末端结合,发生粘性末端介导的链置换反应。
上述dna分子逻辑门中,所述dna分子逻辑门为and门,所述and门中:
所述输入信号为dna核酶1和dna核酶3;
所述dna逻辑计算单元还包括:dna催化链h前体;
所述b1链和b2链相连通过一段核酸序列l相连,所述核酸序列l与b链不杂交,形成loop环;
所述核酸序列l含有所述dna核酶1的酶切位点;
所述dna催化链h前体含有所述dna核酶3的酶切位点,经所述dna核酶3酶切后形成dna催化链h。
上述dna分子逻辑门在分子计算中的应用。
一种上述dna分子逻辑门的自催化dna电路,
所述输入信号包括:dna核酶1;
所述dna逻辑计算单元还包括:a1链;
所述b1链和b2链相连通过一段核酸序列l相连,所述核酸序列l与b链不杂交,形成loop环;所述核酸序列l含有所述dna核酶1的酶切位点;
所述a1链和b链杂交相连组成具有核酸内切酶功能的dna核酶1*;所述dna核酶1*和所述dna核酶1具有相同的酶切位点。
本发明有益效果为:
本发明提供了一个由dna核酶调控的分子逻辑计算系统。在该计算系统中,混合催化的dna电路结合了两种机制:dna核酶催化和熵驱动的链置换。在此系统中,dna核酶扮演了一个输入信号和一个输出报告的多重角色。为此,成功构建了一系列的逻辑门(是门,或门和与门等)。此外,还建立了更为复杂的两层级联电路和反馈自催化逻辑电路。结果经非变性聚丙烯酰胺凝胶电泳(page)和实时荧光检测得到证实。通过上述原理设计和多种实验验证,证明提出的dna核酶调控策略是构建复杂催化分子计算模型的一种合理可行的方法,很可能在分子传感、纳米器件和dna计算等领域具有更广泛的应用前景。
附图说明
图1为基于dna核酶的dna分子yes门示意图,其中(a)为基础yes门原理图,(b)为反应抽象图,(c)为page实验结果图,(d)为荧光实验结果图。
图2为不同浓度的dna催化链h的信号放大能力结果图,(a)为page实验结果图,(b)为荧光检测曲线图;其中(1-7)分别对应h1浓度梯度(单位:μm):0,0.025,0.05,0.1,0.2,0.4,0.6。
图3为基于dna核酶的dna分子级联yes门示意图,其中(a)为级联yes门原理图,(b)为反应抽象图,(c)为page实验结果图,(d)为荧光实验结果图。
图4为不同浓度的dnazyme-2下的控制的信号放大能力结果图,(a)为page实验结果图,(b)为荧光检测曲线图;其中(1-6)分别对应dnazyme-2(dna核酶2)浓度梯度(单位:μm):0,0.1,0.3,0.6,0.9,0.12。
图5为基于dna核酶的dna分子级联两层yes门示意图,其中(a)为级联原理图,(b)为反应抽象图,(c)为荧光实验结果图。
图6为存在dnazyme-3和催化剂h1或h4时控制荧光实验的结果;其中各曲线分别表示:(1)只加入输入信号dnazyme-3(dna核酶3),不加dna催化链h1和h4;(2)加入dnazyme-3和h4,不加h1;(3)加入h1和h4,不加dnazyme-3;(4)加入dnazyme-3和h1,不加h4;(5)加入dnazyme-3,h1和h4;(6)只加h4,不加dnazyme-3和h1;(7)只加h1,不加dnazyme-3和h4;(8)加入dnazyme-3,h1和h4。
图7为两层yes门级联的page验证结果图。
图8为实施例3核酶调控的级联两层yes门中的实验结果与仿真结果图;其中实线代表仿真结果曲线,点线表示实验结果曲线。
图9为基于dna核酶的dna分子or门示意图,其中(a)为or门原理图,(b)为反应抽象图,(c)为荧光实验结果图,(d)为page实验结果图。
图10为基于dna核酶的dna分子and门示意图,其中(a)为and门原理图,(b)为page实验结果图,(c)为荧光实验结果图。
图11为基于dna核酶的dna分子逻辑门的反馈式自催化电路的示意图,其中(a)为反馈式自催化原理图,(b)控制实验原理图,(c)为反馈式自催化抽象图,(d)为page实验结果图,(e)为荧光实验结果图。
具体实施方式
下面结合具体实施例对本发明做进一步说明,但本发明要求保护的范围并不局限于实施例表述的范围,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或成分比例上作任何变化,凡是具有与本申请相同或相近似的技术方案,均落在本发明的保护范围内。本发明中所使用的材料和装置,如无特殊说明,均为市售。
实验材料制备
(1)实施例中所应用的dna链经设计后从上海生工定制。
(2)实施例中所应用的dna链都用实验用水溶解,并用nanodrop2000仪器测定浓度。
(3)实施例的实验反应都在1×tae/mg2+缓冲液(40mmtris,20mmaceticacid,2mmedta,和12.5mmmagnesiumacetate,最终溶液ph=8.0)中进行。
(4)聚丙烯酰胺凝胶电泳(page)实验所用母液为45%page溶液(配置方法为:称取217g丙烯酰胺和8g亚甲双丙烯酰胺,在37℃下溶解,加入去离子水定容至500ml)。
聚丙烯酰胺凝胶电泳(page)实验检测方法:
配制12%page胶(12ml蒸馏水,6ml45%page溶液,150ul10%过硫酸铵(aps)溶液,15ul四甲基乙二胺(temed)溶液)。
荧光实验检测方法:
实验仪器:agilent,型号:mx3005p。实验程序我们采用每6分钟检测一次,共检测10小时,温度为25℃,检测荧光选择fam。
本实施例中所涉及的具体的dna链序列如表1中所示。
表1dna链的核酸序列
实施例1基于dna核酶的dna分子的基础yes门
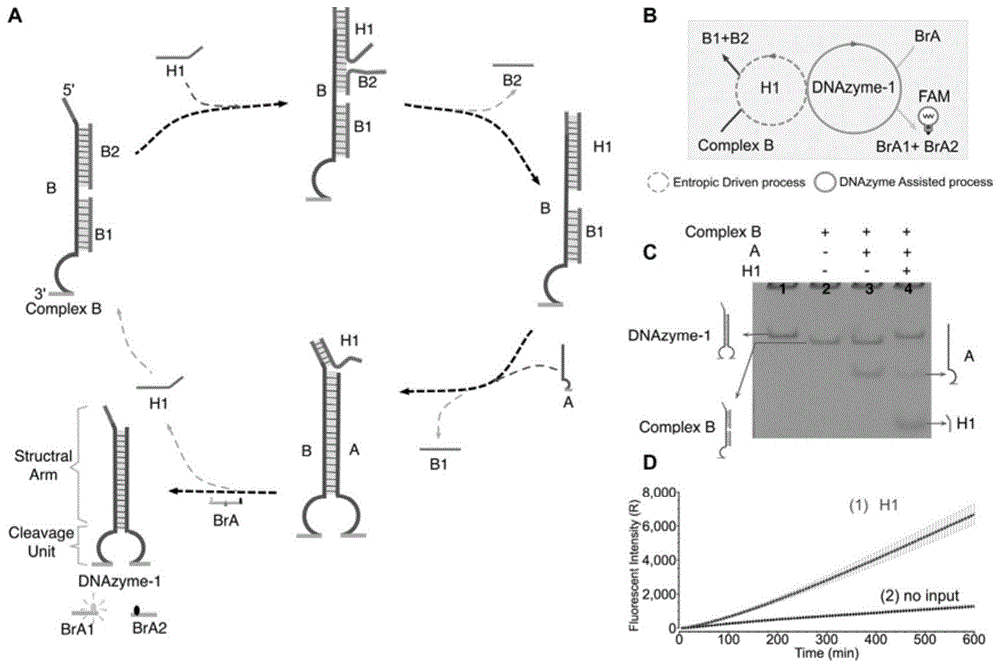
如图1所示,一种基于dna核酶的dna分子逻辑门,包括:输入信号、dna逻辑计算单元和输出信号,
所述输入信号包括:dna催化链h1;
所述dna逻辑计算单元包括:a链、dna复合物b(complexb,包括b/b1/b2)和信号底物;所述b1链和b2链不相连;所述a链和b链杂交相连组成具有核酸内切酶功能的dnazyme-1;
所述dnazyme-1可以识别所述信号底物中的特定序列,并催化切割所述信号底物而释放信号;
所述dna催化链h1可以通过与所述b链的粘性末端结合,发生链置换反应;
所述b链上在所述b链与b1链或b2链杂交处具有所述a链的结合位点,促使a链和b链杂交相连;所述a链的结合位点所在位置为靠近具有所述粘性末端的一端。
所述a链的结合位点为与a链中的对应位置通过碱基互补的结合序列,所述a链的结合位点为4-8个碱基。
所述输出信号包括:信号底物发生反应,释放信号;
所述信号底物为荧光信号底物链bra,为中间含有所述dnazyme-1酶切位点、两端分别修饰有荧光基团(fam)和淬灭基团(bhq)的dna链。bra1和bra2分别信号底物链bra被切断后产生的新的dna链。
“yes”门是通过一条dna链触发从而生成dnazyme-1(dna核酶1)的,dnazyme被设计成两个单独的部分:a链和b链。b链最初通过嵌入dna复合物b(b/b1/b2)受到保护。只有当a和b杂交时,才能产生完整的dna核酶1作为一个活跃的输出去切割荧光链bra产生荧光信号。在这里,bra链的在中间区域有一个核酶裂解位点(tragg),在其两端功能化修饰有荧光基团和淬灭基团。而核酶切割可以导致荧光基团与淬灭基团之间的分离,从而导致荧光强度的增加(输出信号)。
在此yes中,使用的两种催化过程为熵驱动和dnazyme催化机制。因此,dnayzme的结构设计为两个功能部件:结构臂和裂解单元,如图1(a)左下角的dnazyme-1结构,其上面互补杂交形成的双链部分(structuralarm包括的范围)为结构臂;下面两个半圆形的单链组成的部分(cleavageunit包括的范围)为裂解单元,如图1(a)所示。值得注意的是熵驱动dna链置换机制被用来控制结构臂的杂交状态。在缺少触发物的情况下,dna复合物b和a链能共存于溶液中,只有添加催化链h1才能触发反应。特别地,催化链h1可以通过一个6nt(6个碱基)的特异性结合位点与dna复合物中的b链杂交,从而导致b2与b链的分离。随后,在b链上会产生一个新的4个特异性位点的单链区域,从而促进下游的链置换。随后,a链可以通过此4nt的特异性位点与b链杂交,最终形成一个活跃的dna核酶dnazyme-1,同时释放原来的b1和催化链h1。注意在这种情况下,催化链h1可以多次循环利用来参与反应。最后,形成的dnazyme-1可以裂解荧光基质bra,从而导致荧光信号的显著增加。在图1(b)中,可以将反应描述为一个抽象图,其中虚线圈和实线圆圈分别代表了熵驱动机制的催化(entropicdrivenprocess)和核酶催化(dnazymeassistedprocess)。
yes门的反应原理被聚丙烯酰胺凝胶电泳(page)实验(如图1(c)所示)和荧光分析实验结果(如图1(d))证实。如图1(c)的第3泳道,不添加催化链h1时,置换反应没有发生,因此相对应的两个独立的复合物b(complexb)和a链的凝胶带可以被观察到的。然而,在催化链h1存在的情况下,complexb的凝胶带消失而产生一条dnazyme-1新带(第4泳道)。其中,泳道1是最终输出产物所对应条带的位置,泳道2是初始复合物b所对应条带的位置。
此外,为了测试催化链h1的信号放大能力,一系列逐渐减少催化链h1浓度的控制实验也被实施,如图2(a)所示,结果表明,即使是很低比率的催化链h1([h1]:[dna复合物]=1:6)也可以触发反应生成大量dnazyme-1,因此,这也成功证明了h1较强的催化能力。
此外,还对yes门进行了实时荧光信号检测实验。在添加了催化链h1(如图1(d),曲线1)后,观察到荧光信号显著增加,证实了我们的设计是可行的。另外,为了确定催化链h1适当的反应浓度,还进行了一系列不同催化链h1浓度的控制实验。如图2(b)所示,随着h1浓度的增加,荧光强度相应增加。基于上述实验结果,0.1-0.2μm被确定为不同逻辑操作实验中催化链h1的合适浓度。图2(b)中(1-7)分别对应h1浓度梯度(单位:μm):0,0.025,0.05,0.1,0.2,0.4,0.6。
实施例2基于dna核酶的dna分子级联yes门
为了研究构建基于dna核酶调控的分子逻辑电路的可行性,开发构建本实施例中的级联的yes门,该电路设计为由dna核酶输入触发,并生成另一个dna核酶。本实施例中所涉及的具体的dna链序列如表1中所示。
如图3所示,在该系统中,dna核酶dnazyme-2(如图3,dnazyme-2是由表1中d链和c链序列杂交组成)被设计作为一个输入信号,触发级联yes门,并产生dna核酶dnazyme-1,从而引起荧光强度的增加。
所述dna分子级联yes门包括:输入信号、dna逻辑计算单元和输出信号,所述输入信号包括:dna核酶dnazyme-2;
所述dna逻辑计算单元包括:dna复合物b*(complexb*,包括dnazyme-1的左半部分b和b*-crd链)、链a(dnazyme-1的右半部分)、dna催化链前体h2和荧光底物bra。dnazyme-1的左半部分上留有粘性末端。
所述输出信号包括:信号底物发生反应,释放信号;所述信号底物为荧光信号底物,中间含有所述dnazyme-1酶切位点、两端分别修饰有荧光基团(fam)和淬灭基团(bhq)的dna链。
其中,b*-crd链和dna催化链前体h2的圆环部分都被设计包含一个核糖核苷酸的裂解位点(tragg)。因此,在加入dnazyme-2的情况下,b*-crd链中的裂解位点将被切成两段,从而激活dna复合体b*(包括b*1和b*2)。同时,dnazyme-2还会切断dna催化链前体h2的茎环,释放催化剂链h2*,催化链h2*可以通过与所述b链的粘性末端结合,发生链置换反应;可以启动熵驱动链置换机制,从而生成dnazyme-1。与实施例1的基本的yes门类似,催化剂链h2*可以多次循环参与生成dnazyme-1的反应。最后,生成物dnazyme-1可以直接裂解荧光底物bra,从而引起荧光信号显著增加。该反应可以被描述为一个抽象图(如图3(b)所示),其中线圈从左至右分别代表催化剂链h2*、dnazyme-1和dnazyme-2的催化作用。
为了验证级联yes门的可行性,进行了实时荧光检测和page实验。在荧光实验中,当没有加入dnazyme-2时,没有检测到荧光信号增加(图3(d),曲线2);然而当加入dnazyme-2时,检测到荧光信号显著增加(图3(d),曲线1)。同样,在page实验中,通过对凝胶条带的分析表明,在泳道5中,添加输入核酶dnazyme-2,会有一条与dnazyme-1(泳道1)对应的新条带生成并且发夹催化链h2所在条带消失(图3(c),泳道5)。然而,当不存在dnazyme-2时,没有产物dnazyme-1生成并且发夹预催化结构h2完好无损(图3(c),泳道4)。总之,我们通过荧光实验和page实验成功验证了级联yes门的可行性。同时为了确定最合适的反应浓度,我们也做了一系列不同dnazyme-2浓度(0.03μm-3μm)下的控制page实验和实时荧光检测实验,如图4所示,其中(b)图中(1-6)分别对应dnazyme-2(dna核酶2)浓度梯度(单位:μm):0,0.1,0.3,0.6,0.9,1.2。
实施例3核酶调控的级联两层yes门
为了检验基于dna核酶调控的分子逻辑电路的可扩展性,本实施例建立了一个级联两层yes门。其主要通过dna核酶dnazyme-3(dnazyme-3是由表1中d1链和c1链序列杂交形成)调控生成dnazyme-2a,再通过dnazyme-2a调控生成dnazyme-1。本实施例中所涉及的具体的dna链序列如表1中所示。
如图5所示,dnazyme-3被设计作为第一层yes门的输入信号;关于第一层的计算单元,所述dna逻辑计算单元包括dna复合物d(d′链和d*-erf链,其中链d*-erf上loop环的位置设置裂解位点,d*1和d*2经loop环位置的序列相连)、催化链h4和c′链。
然后,通过熵驱动机制,在催化链h4的作用下,互补链c′可以置换出d*1和d*2,从而产生完整的输出dnazyme-2a。
随后,新形成的dnazyme-2a作为新的输入信号触发第二层yes门。
所述dna逻辑计算单元还包括dna复合物b*(结构和功能同实施例1)和催化剂h1。
所述输出信号包括:信号底物发生反应,释放信号;所述信号底物为荧光信号底物,中间含有所述dnazyme-1酶切位点、两端分别修饰有荧光基团(fam)和淬灭基团(bhq)的dna链。
同样,由dnazyme-2a触发,激活第二层yes门中的dna复合物b*。通过催化剂h1,生成dnazyme-1,最终裂解荧光链bra,导致荧光信号显著增加。反应可以描述为一个抽象图,如图5(b)所示,其中从左到右的虚线表示h4和h1的催化作用,实线表示dnazyme-3、dnayzme-2a、dnazyme-1的催化作用。
在荧光实验中,当存在输入dnazyme-3和两个催化剂链h4和h1时,显著的荧光输出信号被检测到(如图5(c),曲线3)。然而,在没有输入dnazyme-3的情况下,相对较低的荧光渗漏也被检测到(曲线2)。这种现象可能是由于两个催化剂h4和h1共存在相同的复杂系统中存在相互作用的缘故。同时,缺乏两种催化剂(曲线1)时,没有荧光输出信号产生,图6显示了存在dnazyme-3和催化剂h1或h4时控制荧光实验的结果;其中图中各曲线分别表示:(1)只加入输入信号dnazyme-3(dna核酶3),不加dna催化链h1和h4;(2)加入dnazyme-3和h4,不加h1;(3)加入h1和h4,不加dnazyme-3;(4)加入dnazyme-3和h1,不加h4;(5)加入dnazyme-3,h1和h4;(6)只加h4,不加dnazyme-3和h1;(7)只加h1,不加dnazyme-3和h4;(8)加入dnazyme-3,h1和h4。
此外,还采用了page实验来验证两层yes门级联,如图7所示,也进一步说明了两层逻辑dna电路的成功运行。实验结果也通过级联仿真模型被确认,如图8所示,其中x轴代表时间(单位:秒)y轴代表输出产物浓度(单位:m,即mol/l)实线代表仿真结果曲线,点线表示实验结果曲线。
实施例4由dnazyme调控的or门
本实施例设计了一个由dnazyme-2和dnazyme-3触发的or逻辑门。本实施例中所涉及的具体的dna链序列如表1中所示。
如图9所示,在这个系统中:
所述输入信号为dnazyme-2或dnazyme-3。(dnazyme-2由表1中d链和c链序列杂交形成;dnazyme-3由表1中d1链和c1链序列杂交形成)
dna逻辑单元包括dna复合物e(b′/b4,其中b′为dnazyme-4左半部分,b4上形成loop环,具有两个核苷酸裂解位点),荧光基质cre,催化链前体h2和h3,以及单链a2(dnazyme-4的右半部分)。
在该系统中,催化链前体h2和h3,采用发夹结构设计,减少了可能的泄漏。值得注意的是,不同于其他门上的单一裂解位点的设计,这里的复合物e(b′/b4)包含两个核苷酸裂解位点,分别对应于dnazyme-2和dnazyme-3(如图9所示)。同时,两种发夹催化链前体h2和h3,可以分别通过dnazyme-2和dnazyme-3来激活。这意味着在添加任何输入dnazyme-2或dnazyme-3时,dna复合物e和dna催化链前体都可以通过环形位点的裂解同时被激活,从而导致dnazyme-4的产生。最后,形成的产物dnazyme-4裂解荧光链cre使荧光输出信号显著增加。该反应可以被描述为图9(b)中的一个抽象图,其中虚线代表h2或h3的催化,实线圆圈分别代表dnazyme-2、dnayzme-3和dnazyme-4的催化作用。
在荧光实验中,当存在dnazyme-2或dnazyme-3时,可以观察到荧光输出信号明显增加(图9(c),曲线2和3)。与此同时,同时添加dnazymes-2和dnazyme-3导致一个更大的荧光输出信号增加(曲线1)。这种协同效应可能是由于生成大量的dnazyme-4引起的当同时触发这反应。在没有任何输入的情况下,没有明显的荧光增加。然而,仍然可以观察到少量的荧光,表明在控制反应中发生了一定程度的泄漏(图9(c),曲线4)。
为了更好地证实or门的运算,进行了page电泳实验。没有两个输入dnazymes-2和dnazyme-3时,没有代表dnazyme-4的条带被观察到(图9(d),泳道5)。然而,当dnazyme-2或dnazyme-3被添加时,一个符合dnazyme-4所在位置的新条带生成(泳道7和6)并且对应于复合物e所在条带很大程度上消失了。另外,dnazymes-2和dnazyme-3的同时加入也导致了dnazyme-4(泳道8)的产生,这些page实验结果与荧光实时检测结果几乎相同,如图9(c)所示。
实施例5由dnazyme调控的and门
本实施例中所涉及的具体的dna链序列如表1中所示。
如图10所示,类似于实施例4或门的设计,and门所使用的计算组件包括:
所述输入信号为dnazyme-2和dnazyme-3。(dnazyme-2的由表1中d链和c链序列杂交形成;dnazyme-3由表1中d1链和c1链序列杂交形成)
dna逻辑单元包括dna复合物b′(b′/b*-crd,b′为dnazyme-4左半部分),荧光基质cre,催化链前体h3,以及单链a2(dnazyme-4的右半部分)。
这里的dna链b*-crd和h3的环状部分都包含一个核苷酸裂解位点,分别对应于dna核酶dnazyme-2和dnazyme-3。由于dnazyme-2只能识别b*-crd的裂解位点,而dnazyme-3只能识别h3的裂解位点,因此,当最多只有一个输入信号时,是无法生成dna核酶dnazyme-4的,输出信号为0;然而,当同时加入dnazyme-2和dnazyme3时,dnazyme-2会特异性识别并裂解b*-crd环状部分的裂解位点使其处于激活状态,同时,dnazyme-3也会特异性识别并裂解h3的裂解位点,生成催化链h3*,类似于基础是门反应,h3*会启动熵驱动链置换机制,从而生成dnazyme-4。催化剂h3*可以多次循环参与生成dnazyme-4的反应。最后,生成物dnazyme-4可以直接裂解荧光底物cre,从而引起荧光信号显著增加,输出信号为1。从而实现与门逻辑运算。
如图10(b)中,第2泳道中条带位置表示输出产物dnazyme-4所在位置。不添加任何输入信号(泳道4),只加入一个输入信号dnazyme-2(泳道6)或者dnazyme-3(泳道5)时,没有代表输出产物dnazyme-4的条带被观察到。然而,当同时加入输入信号dnazyme-2和dnazyme-3时(泳道7),可以看到一条符合输出产物dna核酶dnazyme-4的新条带生成。在图10c中,我们可以看到只有同时加入输入信号dnazyme-2和dnazyme-3(曲线3)时,荧光信号才有显著的增多,输出信号为1,而只加入一种输入信号(曲线1和曲线2)时,荧光信号几乎都没有增加,输出信号为0。
实施例6采用反馈机制的自催电路
本实施例设计了一个自催化dna电路,建立了一个反馈回路来催化反应本身(如图11所示)。此实施例基于实施例2中所述的基于dna核酶的dna分子级联yes门结构而设置。图11(a)表示具有自催效果的设计原理图,图11(b)表示没有自催效率的设计原理图。
本实施例中所涉及的具体的dna链序列如表1中所示。
此分子计算模型被分为两个功能部分:荧光报告和自催化回路,由dna核酶dnazyme-2同时启动。
输入信号为dnazyme-2。(dnazyme-2由表1中d链和c链序列杂交形成)
所述dna逻辑计算单元包括:dna复合物b′(complexb′,包括dnazyme-1的左半部分b′和b*-crd链)、a1链(dnazyme-2b的右半部分)、a2链(dnazyme-4的右半部分),dna催化链h1和荧光底物bra。其中dnazyme-2b可以识别dna复合物b′中b*-crd的识别位点,进行断裂。
在触发后,dna复合物b′(b′/b*-crd)可以被激活,dna核酶产物dnazyme-2b和dnazyme-4分别在荧光报告和自催化回路中生成。由于dnazyme-2b的设计目标是触发dna复合物b*,与最初的输入信号dnazyme-2作用一样,因此,自催化回路构造原理为输入信号dnazyme-2初始触发复合物b′,从而生成dnazyme-2b和dnazyme-4,其中生成的dnazyme-2b由于与初始输入信号dnazyme-2的作用相同,因此也能作用复合物b′,进一步生成dnazyme-2b和dnazyme-4。因此,反馈电路可以加速dnazyme-2b和dnazyme-4的生成,从而实现自催化反应。
为了较为详细的比较自催化效果,进行了控制实验(图11(b)),将a1链替换为a0链,a0链和b′链组成核酶dnazyme-5,而核酶dnazyme-5被设计成在反应中不会产生任何功效,即图11(a)生成的dna核酶产物dnazyme-2b替换为dnazyme-5,其中dna核酶dnazyme-5被设计成在反应中不会产生任何功效,从而不会产出自催化效果。在控制实验中,只有最初的输入信号dnazyme-2作为触发器,而在反应过程中没有产生其他的自催化(self-catalysis)触发。相反,在自催化回路中,反馈机制可以加速新的输入信号dnazyme-2b的生成,从而显著促进反应,导致荧光强度更高。
通过page实验来验证自催化反馈的效果(图11(d))。由于反馈效应,只要加入少量输入dnazyme-2就足以触发整个自催化dna电路。因此,在本实施例中,设置了各种不同浓度的dnazyme-2来触发反应的实验:0.05μm,0.15μm,0.45μm,1.35μm。对于不同浓度的dnazyme-2,控制实验(泳道3-6)和自催化(泳道7-10)实验所对应的条带存在显著差异。在这里,我们使用目标产物的生成量来确定自催化的效果,其中包括dnazyme-2b、dnazyme-5和dnazyme-4(图11(d))。当使用0.05μm浓度的dnazyme-2,在控制实验中没有目标产物被检测到(泳道3),而有一条较弱的目标条带被观察到在自催化实验(泳道7),从而成功证明了自催化反应的性能。同时,随着dnazyme-2浓度的增加,控制和自催化实验的目标产物之间的差异逐渐减小(图11(d))。
通过催化比率来测量反馈效率,而催化比率是通过比较控制和自催化实验中目标产品的增量来获得的,同时也反映了自催化能力,从软件imagej的结果,不同的催化比率dnazyme-2浓度(0.05μm、0.05μm、0.05μm和1.35μm)分别为0.96,1.18,0.23,0.18。显然,随着dnazyme-2浓度的增加,催化比值呈下降趋势。
这种现象归结为,在dnazyme-2浓度低的情况下,由最初的dnazyme-2直接诱导的目标产品数量相当小,由反馈触发dnazyme-2b引起的数量相对较高。因此,自催化作用较低的dnazyme-2浓度更容易观察到。自催化仿真模型也验证了这种推测。
- 还没有人留言评论。精彩留言会获得点赞!