植酸酶突变体的制作方法
本发明涉及生物
技术领域:
,特别涉及一种植酸酶突变体、其制备方法及应用、编码该植酸酶突变体的dna分子、载体、宿主细胞。
背景技术:
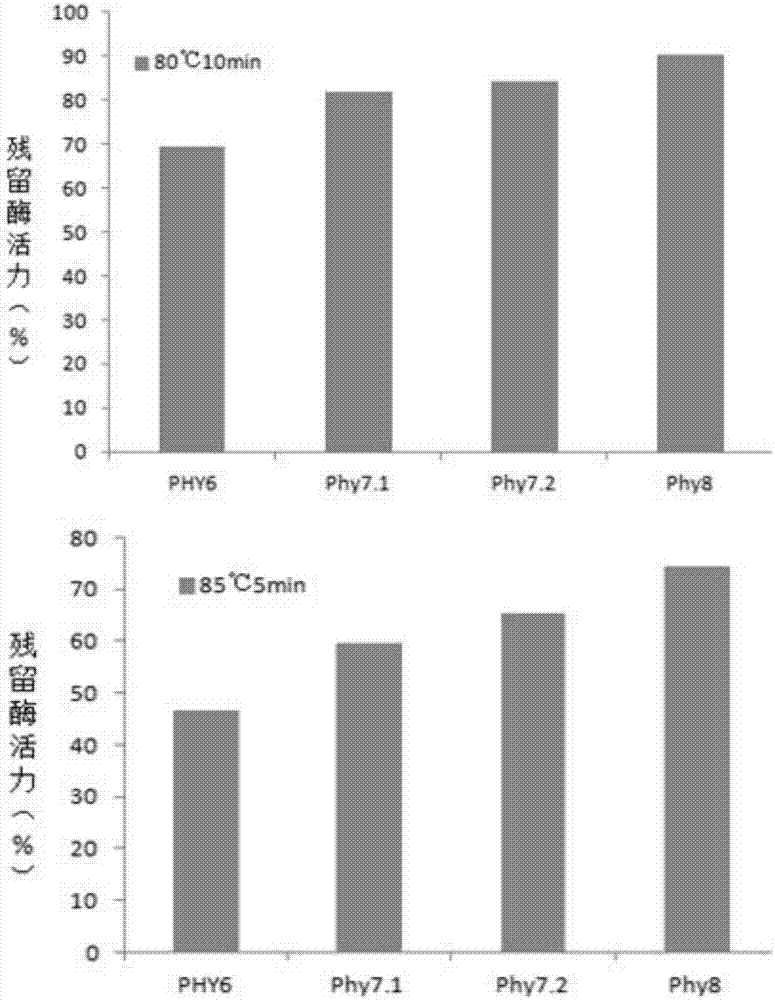
:植酸酶是一种能水解植酸的磷酸酶类。它能将植酸磷(六磷酸肌醇)降解为肌醇和无机磷酸。此酶分为两类:3-植酸酶(ec.3.1.3.8)和6-植酸酶(ec.3.1.2.6)。植酸酶广泛存在于植物、动物和微生物中,如玉米、小麦等高等植物,枯草芽孢杆菌、假单孢杆菌、乳酸杆菌、大肠杆菌等原核微生物及酵母、根霉、曲霉等真核微生物中。在谷物、豆类和油料等作物籽实中,磷的基本贮存形式是植酸磷,其含量高达1%~3%,它占植物中总磷的60%~80%。但是以植酸磷形式存在的磷却因单胃动物体内缺乏能分解植酸的酶而难以被利用,其利用率仅在0%~40%,从而造成了许多问题:首先是造成磷源浪费,一方面饲料中的磷源不能得到有效利用,另一方面为了满足动物对磷的需求,又必须在饲料中添加无机磷,提高了饲料成本;其次是形成高磷粪便污染环境。饲料中85%左右的植酸磷会被动物直接排出体外,粪便中大量的植酸磷使水和土壤受到严重污染。另外,植酸磷还是一种抗营养因子,它在动物胃肠道的消化吸收过程中会与多种金属离子如zn2+、ca2+、cu2+、fe2+等以及蛋白质螯合成相应的不溶性复合物,降低了动物对这些营养物质的有效利用。植酸酶可作为一种单胃动物的饲料添加剂,它的饲喂效果已在世界范围内得到了确证。它可使植物性饲料中磷的利用率提60%,粪便中磷排泄量减少40%,同时还可降低植酸的抗营养作用。因此在饲料中添加植酸酶对提高畜禽业生产效益及降低植酸磷对环境的污染有重要意义。现工业化生产的植酸酶主要有来源于黑曲霉的真菌植酸酶和来源于大肠杆菌的细菌植酸酶两种。其中来源于大肠杆菌的植酸酶appa具有高比活性及良好的消化道稳定性等特点。目前主要通过在粉末饲料直接添加或颗粒饲料后喷涂的方法应用在饲料行业。因为目前在颗粒饲料生产过程中有一个短暂的80-90℃的高温阶段。细菌植酸酶appa热稳定性较差,其水溶液在70℃下保温5分钟剩余酶活性低于30%,直接添加到动物饲料中进行制粒后存留酶活一般低于20%,使appa植酸酶在颗粒饲料的应用受到限制。采用饲料制粒后植酸酶液体喷涂到饲料上的方法不仅增加设备投入,而且对酶制剂的稳定性、饲料中分布均一性都无法很好的保证。因此,提高热稳定性对目前饲料用植酸酶具有重要的现实意义。技术实现要素:有鉴于此,本发明提供一种植酸酶突变体,获得突变体蛋白,提高其耐热性,从而有利于植酸酶在饲料领域的广泛应用。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种植酸酶突变体,其具有(ⅰ)、(ⅱ)或(ⅲ)所示的氨基酸序列中任意一个:(ⅰ)与植酸酶的氨基酸序列seqidno:1具有至少70%同源性的序列;(ⅱ)具有所述植酸酶的至少一个免疫表位,且所述植酸酶的氨基酸序列经修饰、取代、缺失或添加一个或几个氨基酸获得的氨基酸序列;(ⅲ)由如seqidno:2所示的核苷酸序列或其互补序列或因遗传密码的简并性而与如seqidno:2所示的核苷酸序列或其互补序列的核苷酸序列不同的序列编码的氨基酸序列;在本发明的另一些实施例中,所述取代为取代1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个或18个氨基酸。在本发明的一些实施例中,植酸酶突变体的氨基酸序列与植酸酶的氨基酸序列具有至少75%同源性的序列。在本发明的另一些实施例中,植酸酶突变体的氨基酸序列与植酸酶的氨基酸序列具有至少80%同源性的序列。在本发明的另一些实施例中,植酸酶突变体的氨基酸序列与植酸酶的氨基酸序列具有至少85%同源性的序列。在本发明的另一些实施例中,植酸酶突变体的氨基酸序列与植酸酶的氨基酸序列具有至少90%同源性的序列。在本发明的另一些实施例中,植酸酶突变体的氨基酸序列与植酸酶的氨基酸序列具有至少95%同源性的序列。在本发明的一些实施例中,所述修饰包括酰胺化、磷酸化、甲基化、乙酰化、泛素化、糖基化或羰基化。在本发明的一些实施例中,所述取代为取代16个、17个或18个氨基酸。在本发明的另一些实施例中,所述取代为第46位、第62位、第70位、第73位、第75位、第80位、第114位、第137位、第142位、第146位、第159位、第161位、第176位、第187位、第255位或第380位中的一个或多个氨基酸被取代。在本发明的另一些实施例中,所述取代为第46位、第62位、第70位、第73位、第75位、第80位、第114位、第137位、第142位、第146位、第159位、第161位、第176位、第187位、第255位和/或第380位的氨基酸被取代。在本发明的一些实施例中,所述植酸酶具有如seqidno:1所示的氨基酸序列,编码所述植酸酶的核苷酸序列之一如seqidno:2所示。在本发明的另一些实施例中,植酸酶突变体具有如seqidno:3或seqidno:5或seqidno:7或seqidno:9所示的氨基酸序列。本发明还提供了编码上述的植酸酶突变体的dna分子。在本发明的一些实施例中,编码上述的植酸酶突变体的dna分子具有如seqidno:4或seqidno:6或seqidno:8或seqidno:10所示的核苷酸序列。本发明还提拱了具有上述dna分子的载体。在本发明的另一些实施例中,所述取代为氨基酸序列为seqidno:1的植酸酶的第46位氨基酸由trp变为glu,第62位氨基酸由gln变为trp,第70位氨基酸由gly变为glu,第73位氨基酸由ala变为pro,第75位氨基酸由lys变为cys,第80位氨基酸由ser变为pro,第114位氨基酸由thr变为his,第137位氨基酸由asn变为val,第142位氨基酸由asp变为arg,第146位氨基酸由ser变为glu,第159位氨基酸由arg变为tyr,第161位氨基酸由thr变为pro,第176位氨基酸由asn变为pro,第187位氨基酸由ser变为pro,第255位氨基酸由tyr变为asp,第380位氨基酸由ala变为pro。上述植酸酶突变体的氨基酸序列如seqidno:3所示,编码的核甘酸序列之一如seqidno:4所示。本发明还包括携带有编码序列为seqidno:4的植酸酶突变体基因的质粒。在本发明的另一些实施例中,所述取代还包括第126位和/或第211位氨基酸被取代。在本发明的另一些实施例中,所述取代还包括第126位的氨基酸被取代。在本发明的另一些实施例中,所述取代还包括将氨基酸序列为seqidno:3的植酸酶的第126位氨基酸由asn变为asp。上述突变体的氨基酸序列为seqidno:5,其一种编码基因的核酸序列为seqidno:6。本发明还包括携带有编码序列为seqidno:6的植酸酶突变体基因的质粒。在本发明的另一些实施例中,所述取代还包括第211位的氨基酸被取代。在本发明的另一些实施例中,氨基酸序列为seqidno:3的植酸酶的第211位氨基酸由vla变为trp。上述植酸酶突变体的氨基酸序列为seqidno:7,其一种编码基因的核酸序列为seqidno:8。本发明还包括携带有编码序列为seqidno:8的植酸酶突变体基因的质粒。在本发明的另一些实施例中,所述取代还包括第126位和第211位的氨基酸同时被取代。在本发明的另一些实施例中,氨基酸序列为seqidno:3的植酸酶的第126位氨基酸由asn变为asp,第211位氨基酸由vla变为trp。上述植酸酶突变体的氨基酸序列为seqidno:9,其一种编码基因的核酸序列为seqidno:10。本发明还包括携带有编码序列为seqidno:10的植酸酶突变体基因的质粒。本发明还提供了上述植酸酶突变体的制备方法,包括:步骤1:获取编码具有(ⅰ)、(ⅱ)或(ⅲ)所示的氨基酸序列中任意一个的dna分子:(ⅰ)与植酸酶的氨基酸序列具有至少70%同源性的序列;(ⅱ)具有植酸酶的至少一个免疫表位,且所述植酸酶的氨基酸序列经修饰、取代、缺失或添加一个或几个氨基酸获得的氨基酸序列;(ⅲ)由如seqidno:2所示的核苷酸序列或其互补序列或因遗传密码的简并性而与如seqidno:2所示的核苷酸序列或其互补序列的核苷酸序列不同的序列编码的氨基酸序列;所述取代为取代1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个或18个氨基酸;步骤2:将步骤1获得的所述dna分子与表达载体融合,构建重组表达载体,转化宿主细胞;步骤3:诱导含重组表达载体的宿主细胞表达融合蛋白,分离纯化表达的融合蛋白。在本发明的一些实施例中,制备方法中所述修饰包括酰胺化、磷酸化、甲基化、乙酰化、泛素化、糖基化或羰基化。在本发明的另一些实施例中,制备方法中所述取代为第46位、第62位、第70位、第73位、第75位、第80位、第114位、第137位、第142位、第146位、第159位、第161位、第176位、第187位、第255位或第380位中的一个或多个氨基酸被取代。在本发明的另一些实施例中,所述取代为第46位、第62位、第70位、第73位、第75位、第80位、第114位、第137位、第142位、第146位、第159位、第161位、第176位、第187位、第255位和/或第380位的氨基酸被取代。在本发明的另一些实施例中,制备方法中所述取代还包括第126位和/或第211位的氨基酸被取代。在本发明的一些实施例中,所述步骤1具体为以编码seqidno:3或seqidno:5或seqidno:7或seqidno:9所示氨基酸序列的cdna为模板,经引物扩增。步骤2所述宿主细胞为毕赤酵母。本发明还提供了上述植酸酶突变体在饲料中的应用。本发明还提供了一种宿主细胞,包含上述重组表达载体。在本发明的一些实施例中,宿主细胞为毕赤酵母。将上述的质粒转入毕赤酵母中,重组表达的植酸酶突变体的耐热性得到显著提升。本发明提供了一种植酸酶突变体,其具有(ⅰ)、(ⅱ)或(ⅲ)所示的氨基酸序列中任意一个:(ⅰ)与植酸酶的氨基酸序列具有至少70%同源性的序列;(ⅱ)具有所述植酸酶的至少一个免疫表位,且所述植酸酶的氨基酸序列经修饰、取代、缺失或添加一个或几个氨基酸获得的氨基酸序列;(ⅲ)由如seqidno:2所示的核苷酸序列或其互补序列或因遗传密码的简并性而与如seqidno:2所示的核苷酸序列或其互补序列的核苷酸序列不同的序列编码的氨基酸序列;所述取代为取代1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个或18个氨基酸。本发明以植酸酶phy6为基础,提供了包含n126d单点突变的植酸酶突变体phy7.1,包含v211w单点突变的植酸酶突变体phy7.2,包含n126d和v211w两点突变的植酸酶突变体phy8。与植酸酶phy6相比,80℃处理10min后,突变体phy7.1、phy7.2和phy8的残留酶活分别提高了12.48%、15.50%和20.90%;85℃处理5min后,突变体phy7.1、phy7.2和phy8的残留酶活分别提高了13.05%、18.50%和27.56%,其耐热性显著高于植酸酶phy6,从而有利于植酸酶在饲料中的广泛应用。附图说明图1为phy6,phy7.1,phy7.2和phy8耐热性比较图。具体实施方式为了提高植酸酶的耐热性,申请人在野生型植酸酶appa((氨基酸序列为seqidno:1,其编码核苷酸序列为seqidno:2)基础上进行了16个位点突变(w46e,q62w,g70e,a73p,k75c,s80p,t114h,n137v,d142r,s146e,r159y,t161p,n176p,s187p,y255d,a380p),获得了植酸酶突变体phy6,其氨基酸序列为seqidno:3,其编码核苷酸序列为seqidno:4。所述植酸酶突变体phy6的耐热性得到显著提升。(此部分内容已经在2015年8月26日申请的申请号为201510532520.1、
专利名称:为“植酸酶突变体”的国内发明专利中详细阐述)。本发明公开了一种植酸酶突变体、其制备方法及应用、编码该植酸酶突变体的dna分子、载体、宿主细胞,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及 应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明用到了遗传工程和分子生物学领域使用的常规技术和方法,例如molecularcloning:alaboratorymanual,3nded.(sambrook,2001)和currentprotocolsinmolecularbiology(ausubel,2003)中所记载的方法。这些一般性参考文献提供了本领域技术人员已知的定义和方法。但是,本领域的技术人员可以在本发明所记载的技术方案的基础上,采用本领域其它常规的方法、实验方案和试剂,而不限于本发明具体实施例的限定。例如,本发明可选用如下实验材料和试剂:菌株与载体:大肠杆菌dh5α、毕赤酵母gs115、载体ppic9k、amp、g418购自invitrogen公司。酶与试剂盒:pcr酶及连接酶购买自takara公司,限制性内切酶购自fermentas公司,质粒提取试剂盒及胶纯化回收试剂盒购自omega公司,genemorphii随机诱变试剂盒购自北京博迈斯生物科技有限公司。培养基配方:大肠杆菌培养基(lb培养基):0.5%酵母提取物,1%蛋白胨,1%nacl,ph7.0);lb-amp培养基:lb培养基加100μg/ml氨苄青霉素;酵母培养基(ypd培养基):1%酵母提取物、2%蛋白胨2%葡萄糖;酵母筛选培养基(md培养基):2%蛋白胨、2%琼脂糖;bmgy培养基:2%蛋白胨,1%酵母提取物,100mm磷酸钾缓冲液(ph6.0),1.34%ynb,4×10-5生物素,1%甘油;bmmy培养基:2%蛋白胨,1%酵母提取物,100mm磷酸钾缓冲液(ph6.0),1.34%ynb,4×10-5生物素,0.5%甲醇。下面结合实施例,进一步阐述本发明:实施例1耐热突变体的筛选为了进一步提高植酸酶突变体phy6的耐热性,对phy6基因seqidno:4进行蛋白结构分析,该蛋白有两个结构域:n端的134个氨基酸残基与c端的152个氨基酸残基共同组成结构域1,剩余中间124氨基酸残基组成结构域2,保守序列和活性中心均位于结构域1中,在不破坏蛋白二级结构与活性中心的前提下,进一步对该基因进行突变。1.1设计pcr引物phy6-f1、phy6-r1:phy6-f1:ggcgaattccagtcagaaccagagttgaagtt(下划线为限制性内切酶ecori识别位点),如seqidno:11所示;phy6-r1:atagcggccgcttacaaggaacaagcagggat(下划线为限制性内切酶noti识别位点),如seqidno:12所示;以phy6基因(seqidno:4)为模板,利用上述引物用genemorphii随机突变pcr试剂盒(stratagene)进行pcr扩增,胶回收pcr产物,ecori、noti进行酶切处理后与经同样酶切后的pet21a载体连接,转化至大肠杆菌bl21(de3)中,涂布于lb+amp平板,37℃倒置培养,待转化子出现后,用牙签逐个挑至96孔板,每个孔中加入150ul含有0.1mmiptg的lb+amp培养基,37℃220rpm培养6h左右,离心弃上清,菌体用缓冲液重悬,反复冻融破壁,获得含有植酸酶的大肠杆菌细胞裂解液。分别取出40ul裂解液至两块新的96孔板,将其中一块96孔板于80℃处理10min;然后向两块96孔板中各加入80ul底物,于37℃反应30min后加入80ul终止液(钒酸铵:钼酸铵:硝酸=1:1:2),测定生成的无机磷含量。不同的突变子高温处理后保持的活性不同。实验结果表明,有些突变对phy6蛋白耐热性没有影响,有些突变甚至使其耐热性或酶活变得更差了,另外还有些突变虽然能提高phy6蛋白对温度的耐受性,但突变后其酶学性质发生了显著的变化,这些均不符合要求。最终,申请人得到既能显著提高phy6蛋白耐热性,又不会影响其酶活及原有酶学性质的突变位点及位点的组合:n126d单点突变、v211w单点突变、n126d和v211w两点突变。将上述含n126d单点突变的植酸酶突变体命名为phy7.1,其氨基酸序列为seqidno:5,参照该序列得到一个编码核苷酸序列为seqidno:6;将上述含v211w单点突变的植酸酶突变体命名为phy7.2,其氨基酸序列为seqidno:7,参照该序列得到一个编码核苷酸序列为seqidno:8;将上述含n126d和v211w两点突变的植酸酶突变体命名为phy8,其氨基酸序列为seqidno:9,参照该序列得到一个编码核苷酸序列为seqidno:10。1.2基因的合成及扩增由上海捷瑞生物工程有限公司依照毕赤酵母的密码偏爱性分别优化合成phy6的基因序列seqidno:4,以及上述3条突变体的基因序列seqidno:6、seqidno:8、seqidno:10,并且在合成序列5’和3’两端分别加上ecori和noti两个酶切位点。1.3表达载体的构建将1.2中合成的4条基因序列分别进行ecori和noti双酶切,然后与经同样酶切后的ppic-9k载体16℃过夜连接,并转化大肠杆菌dh5a,涂布于lb+amp平板,37℃倒置培养,待转化子出现后,菌落pcr(反应体系:模板挑取的单克隆,rtaqdna聚合酶0.5ul,10×buffer2.0μl,dntps(2.5mm)2.0μl,5’aox引物(10m):0.5μl,3’aox引物:0.5μl,ddh2o14.5μl,反应程序:95℃预变性5min,30cycles:94℃30sec,55℃30sec,72℃2min,72℃10min)。验证阳性克隆子,经测序验证后获得了正确的重组表达质粒,将携带phy6基因序列seqidno:4的重组表达质粒命名为ppic9k-phy6, 将携带上述3个突变体基因seqidno:6、seqidno:8、seqidno:10的重组表达质粒依次分别命名为ppic9k-phy7.1、ppic9k-phy7.2、ppic9k-phy8。1.4毕赤酵母工程菌株的构建1.4.1酵母感受态制备将毕赤酵母gs115菌株进行ypd平板活化,30℃培养48h后接种活化的gs115单克隆于6mlypd液体培养基中,30℃、220rpm,培养约12h后转接菌液于装有30mlypd液体培养基的三角瓶中,30℃、220rpm培养约5h,经紫外分光光度计检测其菌体密度,待其od600值在1.1–1.3范围后,4℃9000rpm离心2min分别收集4ml菌体至灭菌ep管中,轻轻弃上清,用灭菌的滤纸吸干残留的上清后用预冷的1ml灭菌水重悬菌体,4℃、9000rpm离心2min,轻轻弃上清,重复用1ml灭菌水洗一遍后,4℃、9000rpm离心2min,轻轻弃上清,预冷的1ml山梨醇(1mol/l)重悬菌体;4℃、9000rpm离心2min,轻轻弃上清,预冷的100-150μl山梨醇(1mol/l)轻柔重悬菌体。1.4.2转化和筛选分别将表达质粒ppic9k-phy6、ppic9k-phy7.1、ppic9k-phy7.2和ppic9k-phy8用saci进行线性化,线性化片段纯化回收后通过电穿孔法分别转化毕赤酵母gs115,在md平板上筛选得到毕赤酵母重组菌株gs115/ppic9k-phy6、gs115/ppic9k-phy7.1、gs115/ppic9k-phy7.2和gs115/ppic9k-phy8,然后在含不同浓度遗传霉素的ypd平板(0.5mg/ml-8mg/ml)上筛选多拷贝的转化子。将毕赤酵母重组菌株gs115/ppic9k-phy6的一个转化子命名为毕赤酵母phy6(pichiapastorisphy6),重组菌株gs115/ppic9k-phy7.1的一个转化子命名为毕赤酵母phy7.1(pichiapastorisphy7.1),重组菌株gs115/ppic9k-phy7.2的一个转化子命名为毕赤酵母phy7.2(pichiapastorisphy7.2),重组菌株gs115/ppic9k-phy8的一个转化子命名为毕赤酵母phy8(pichiapastorisphy8)。将毕赤酵母phy6、毕赤酵母phy7.1、毕赤酵母phy7.2和毕赤酵母phy8分别转接于bmgy培养基中,30℃、250rpm振荡培养1d;再转入bmmy培养基中,30℃、250rpm振荡培养;每天添加0.5%的甲醇,诱导表达4d;9000rpm离心10min去除菌体,即得到分别含植酸酶突变体phy6、phy7.1、phy7.2和phy8的发酵上清液。(1)植酸酶酶活单位的定义在温度为37℃、ph为5.0的条件下,每分钟从浓度为5.0mmol/l植酸钠中释放1μmol无机磷,即为一个植酸酶活性单位,以u表示。(2)植酸酶酶活测定方法取甲、乙两支25ml比色管,各加入1.8ml乙酸缓冲液(ph[5.0)、0.2ml样品反应液,混匀,37℃预热5min。在甲管中加入4ml底物溶液,乙管中加入4ml终止液,混匀,37℃反应30min,反应结束后甲管中加入4ml终止液,乙管中加入4ml底物溶液,混匀。静置10min,分别在415nm波长处测定吸 光值。每种样品作3个平行,取吸光值的平均值,通过标准曲线用回归直线方程计算植酸酶活性。酶活x=f×c/(m×30)其中:x——酶活力单位,u/g(ml);f——试样溶液反应前的总稀释倍数;c——根据实际样液的吸光值由直线回归方程计算出的酶活性,u;m——试样质量或体积,g/ml;30——反应时间;采用上述植酸酶酶活测定方法对毕赤酵母phy6、phy7.1、phy7.2和phy8发酵上清液进行酶活测定,检测结果见表1。表1酶活测定结果样品吸光值1吸光值2吸光值3平均值酶活(u/ml)phy60.4910.4870.4900.489241phy7.10.4720.4670.4700.470223phy7.20.4700.4630.4660.466205phy80.4850.4790.4830.482237毕赤酵母phy6、毕赤酵母phy7.1、毕赤酵母phy7.2和毕赤酵母phy8发酵上清液的酶活分别为241u/ml、223u/ml、205u/ml和237u/ml。1.5发酵验证在10升发酵罐上分别进行毕赤酵母phy6、毕赤酵母phy7.1、毕赤酵母phy7.2和毕赤酵母phy8的发酵,发酵使用的培养基配方为:硫酸钙1.1g/l、磷酸二氢钾5.5g/l、磷酸二氢铵55g/l、硫酸镁16.4g/l、硫酸钾20.3g/l、氢氧化钾1.65g/l、消泡剂0.05%。发酵生产工艺:ph5.0、温度30℃、搅拌速率300rpm、通风量1.0-1.5(v/v)、溶氧控制在20%以上。整个发酵过程分为三个阶段:第一阶段为菌体培养阶段,按7%比例接入种子,30℃培养24-26h,以补完葡萄糖为标志;第二阶段为饥饿阶段,当葡萄糖补完之后,不流加任何碳源,当溶氧上升至80%以上表明该阶段结束,为期约30-60min;第三阶段为诱导表达阶段,流加甲醇诱导,并且保持溶氧在20%以上,培养时间在150-180h之间;发酵结束后,发酵液通过板框过滤机处理后获得粗酶液。采用实施例1中1.4.2所述植酸酶酶活测定方法对上述粗酶液进行检测,结果见表2。表2酶活测定结果样品吸光值1吸光值2吸光值3平均值酶活(u/ml)phy60.4880.4870.4900.48811403phy7.10.4750.4780.4800.47810807phy7.20.4690.4730.4700.47110713phy80.4830.4800.4810.48111133重组表达植酸酶突变体phy6的毕赤酵母phy6最终的发酵酶活为11403u/ml,重组表达植酸酶突变体phy7.1的毕赤酵母phy7.1最终的发酵酶活为10807u/ml,重组表达植酸酶突变体phy7.2的毕赤酵母phy7.2最终的发酵酶活高达10713u/ml,重组表达植酸酶突变体phy8的毕赤酵母phy8最终的发酵酶活高达11133u/ml。1.6酶学特性分析1.6.1最适作用温度分别在30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃,ph5.5条件下测定上述毕赤酵母phy6、phy7.1、phy7.2和phy8发酵所得粗酶液的酶活,以最高酶活力为100%,计算相对酶活。结果显示:与植酸酶突变体phy6相比,本发明提供的突变体phy7.1、phy7.2和phy8的最适作用温度没有发生变化,均为75℃。1.6.2最适作用ph值分别用ph2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0的0.1m乙酸-乙酸钠缓冲液对上述毕赤酵母phy6、phy7.1、phy7.2和phy8发酵所得粗酶液进行稀释,在37℃条件下测定酶活,以最高酶活力为100%,计算相对酶活。结果显示:与植酸酶突变体phy6相比,本发明提供的突变体phy7.2的最适ph没有变化,为5.0,而phy7.1和phy8最适作用ph均下调0.5个单位,为4.5。1.6.3耐热性分析用预热10min、ph5.0的0.25m乙酸钠缓冲液分别将上述毕赤酵母phy6、phy7.1、phy7.2和phy8发酵所得粗酶液稀释10倍,混合均匀,85℃处理5min,80℃处理10min,结束时取样并冷却至室温,然后测定稀释后的酶活,以未处理样品的酶活计100%,计算残留酶活。结果如图1所示:与植酸酶phy6相比,80℃处理10min后,本发明提供的突变体phy7.1、phy7.2和phy8的残留酶活分别提高了12.48%、15.50%和20.90%;85℃处理5min后,本发明提供的突变体phy7.1、phy7.2和phy8的残留酶活分别提高了13.05%、18.50%和27.56%,与植酸酶phy6相比具有极显著差异(p<0.01)。综上,本发明以植酸酶phy6为基础,提供了包含n126d单点突变的植酸酶突变体phy7.1,包含v211w单点突变的植酸酶突变体phy7.2,包含n126d和v211w两点突变的植酸酶突变体phy8。与植酸酶phy6相比,突变体phy7.1、phy7.2和phy8的最适作用温度没有发生改变,phy7.2的最适ph没有发生变化,phy7.1和phy8的最适作用ph均下调0.5个单位,但phy7.1、phy7.2和phy8的耐热性都得到极显著(p<0.01)提升,从而有利于其在饲料中的广泛应用。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1