一种用于药品生产质量管理的偏差管理系统及方法与流程
本发明涉及药品质量管理,特别涉及一种用于药品生产质量管理的偏差管理系统及方法。
背景技术:
1、根据药品生产质量管理的相关法规,制药企业应当建立药品质量管理体系,涵盖影响药品质量的所有因素,包括确保药品质量符合预定用途的有组织、有计划的全部活动。
2、目前,大多药企均采用纸质资料来记录各项质量活动,在人员记录、评估、审批等相关药品质量管理活动过程中,不可避免地出现记录填写不规范问题、人员违规后补记录问题、人员出差/休假无法及时审批问题、纸质资质归档及储存耗费大量人力物力等问题。
3、药品质量偏差管理作为药品生产质量管理的重要组成部分,同样需要建立高效、可控的管理程序。
技术实现思路
1、为了解决上述背景技术提出的目前药品质量偏差管理不具备高效、可控管理的技术问题,本发明实施例提供了如下技术方案。
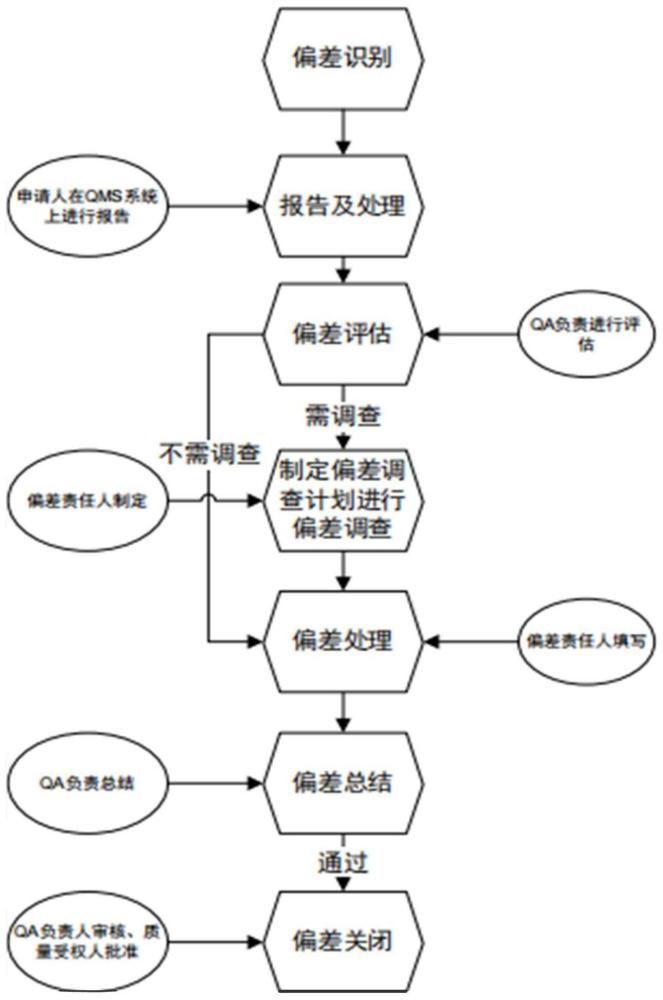
2、本发明实施例提供一种用于药品生产质量管理的偏差管理系统,其包括:偏差识别模块、偏差分析评估记录模块、偏差评审设置模块、偏差评审记录模块、偏差调查计划制定模块、偏差调查计划审核记录模块、偏差调查结果记录模块、偏差总结记录模块和偏差总结审核记录模块;
3、所述偏差识别模块,用于获取药品生产质量管理活动过程中偏离既定程序、工艺或方法的偏差信息,并将偏差信息传送至所述偏差评审设置模块;
4、所述偏差分析评估记录模块,用于记录与偏差信息相关的审核信息,及影响偏差分析和评估的信息,并将审核信息,及影响偏差分析和评估的信息传送至偏差评审设置模块;
5、所述偏差评审设置模块,用于设置与偏差信息,审核信息,及影响偏差分析和评估的信息对应的所需审批流程,并将审批流程传送至所述偏差评审记录模块;
6、所述偏差评审记录模块,分别用于记录审批流程对应的审批级别不同的多个审核意见,并将审批级别不同的多个审核意见进行汇总后传送至所述偏差调查计划制定模块;
7、所述偏差调查计划制定模块,用于记录根据汇总后的审核意见确定的偏差调查计划信息,并将偏差调查计划信息传送至所述偏差调查结果记录模块;
8、所述偏差调查计划审核记录模块,用于记录偏差调查计划信息的多级审批结果;
9、所述偏差调查结果记录模块,用于记录根据多级审批通过后的偏差调查计划信息调查后的调查结果,并将调查结果传送至所述偏差总结记录模块;
10、所述偏差总结记录模块,用于记录根据调查结果确定的偏差总结意见和偏差药品处置决定;
11、所述偏差总结审核记录模块,用于记录审核后的偏差总结意见和偏差药品处置决定。
12、进一步地,
13、所述偏差识别模块与偏差发现部门的偏差发现人关联;其中,所述偏差发现人获取药品生产质量管理活动过程中的偏差信息,并向所述偏差识别模块填写偏差信息;
14、所述偏差分析评估记录模块与偏差发现部门的部门负责人和质量管理人员关联;部门负责人审核与偏差发现相关的信息,质量管理人员分析评估与偏差相关的信息,并向偏差分析评估记录模块中标准化填写审核信息和分析评估信息;
15、所述偏差评审设置模块与质量保证部人员关联;其中,所述质量保证部人员设置与偏差信息,审核信息,及影响偏差分析和评估的信息对应的所需审批流程,并向所述偏差评审设置模块填写审批流程;
16、所述偏差评审记录模块与评审小组成员和质量保证部人员关联;其中,所述评审小组成员对审批流程进行审核,并向所述偏差评审记录模块填写审核意见;所述质量保证部人员对所述评审小组成员审核后的审核意见进行汇总,并向所述偏差评审记录模块填写汇总后的审核意见;
17、所述偏差调查计划制定模块与偏差发现部门的指定人员;其中,所述指定人员根据汇总后的审核意见确定的偏差调查计划信息,并向所述偏差调查计划制定模块填写偏差调查计划信息;
18、所述偏差调查计划审核记录模块与偏差发现部门的部门负责人、质量保证部人员和质量保证部部门负责人关联;所述偏差发现部门的部门负责人、所述质量保证部人员和所述质量保证部部门负责人依次审核偏差调查计划信息,并均向所述偏差调查计划审核记录模块填写相应的审批结果;
19、所述偏差调查结果记录模块与调查人员关联;其中,所述调查人员根据偏差调查计划信息调查偏差药品,并向所述偏差调查结果记录模块填写调查后的调查结果;
20、所述偏差总结记录模块与质量保证部人员关联;其中,所述质量保证部人员根据调查结果确定偏差总结意见和偏差药品处置决定,并向所述偏差总结记录模块填写偏差总结意见和偏差药品处置决定;
21、所述偏差总结审核记录模块与评审小组成员关联;其中,所述评审小组成员审核偏差总结意见和偏差药品处置决定,并向偏差总结审核记录模块填写审核后的偏差总结意见和偏差药品处置决定。
22、进一步,一种用于药品生产质量管理的偏差管理系统,还包括:偏差批准关闭模块,其用于记录质量受权人对偏差的最终审批意见及是否同意偏差关闭的决定。
23、进一步地,所述偏差批准关闭模块与质量受权人关联;其中,所述质量受权人在所述偏差批准关闭模块审核与偏差相关的所有信息,并向所述偏差批准关闭模块填写是否同意偏差处理结果以及是否同意偏差关闭的决定。
24、进一步地,所述偏差信息包括:偏差发现人、偏差涉及的产品、偏差发现时间、偏差发现地点和偏差点。
25、进一步地,所述影响偏差分析和评估的信息包括:偏差的影响评估、分析内容、调查要求和评审小组成员。
26、进一步地,所述偏差评审记录模块,包括:
27、多个意见记录单元,其分别用于记录与评审信息对应的审批级别不同的多个审核意见;
28、意见汇总单元,其用于对审批级别不同的多个审核意见进行汇总,并将汇总后的审核意见传送至所述调查计划指定模块。
29、本发明实施例还提供一种用于药品生产质量管理的偏差管理方法,置于计算机设备上的药品生产质量管理平台包括的偏差管理系统,执行如下步骤:
30、获取获取药品生产质量管理活动过程中偏离既定程序、工艺或方法的偏差信息;
31、记录与偏差发现相关的信息的审核信息,及影响偏差分析和评估的信息;
32、设置与偏差信息,审核信息,及影响偏差分析和评估的信息对应的所需审批流程;
33、记录审批流程对应的审批级别不同的多个审核意见,并将审批级别不同的多个审核意见进行汇总;
34、记录根据汇总后的审核意见确定的偏差调查计划信息;
35、记录偏差调查计划信息的多级审批结果;
36、记录根据多级审批通过后的偏差调查计划信息调查后的调查结果;
37、记录根据调查结果确定的偏差总结意见和偏差药品处置决定;
38、记录审核后的偏差总结意见和偏差药品处置决定。
39、进一步地,一种用于药品生产质量管理的偏差管理方法,还包括:
40、偏差发现人获取药品生产质量管理活动过程中的偏差信息,并填写偏差信息;
41、部门负责人审核与偏差发现相关的信息,质量管理人员分析评估与偏差相关的信息,并填写审核信息和分析评估信息;
42、质量保证部人员设置与偏差信息,审核信息,及影响偏差分析和评估的信息对应的所需审批流程,并填写审批流程;
43、评审小组成员对审批流程进行审核,并填写审核意见;质量保证部人员对评审小组成员审核后的审核意见进行汇总,并填写汇总后的审核意见;
44、偏差发现部门的指定人员根据汇总后的审核意见确定偏差调查计划信息,并填写偏差调查计划信息;
45、偏差发现部门的部门负责人、质量保证部人员和质量保证部部门负责人依次审核偏差调查计划信息,并填写相应的审批结果;
46、调查人员根据偏差调查计划信息调查偏差药品,并填写偏差药品调查后的调查结果;
47、质量保证部人员根据调查结果确定偏差总结意见和偏差药品处置决定,并填写偏差总结意见和偏差药品处置决定;
48、评审小组成员审核偏差总结意见和偏差药品处置决定,并填写审核后的偏差总结意见和偏差药品处置决定。
49、进一步地,一种用于药品生产质量管理的偏差管理方法,还包括:
50、质量受权人审核与偏差相关的所有信息,并填写是否同意偏差处理结果以及是否同意偏差关闭的决定。
51、本发明实施例提供的上述用于药品生产质量管理的偏差管理系统及方法,与现有技术相比,其有益效果如下:
52、本发明实施例提供的偏差管理系统用于管理药品生产质量管理过程中的异常情况,确保偏差管理活动的发起、审核、批准等均过程均符合相关法规要求;同时,确保通过该系统所生产的报告、记录符合电子记录的相关要求。
53、还有,采用该系统处理偏差管理活动,能够有效提高质量活动的审批效率,外出人员随时都可处理相关质量活动,提高记录的规范性,杜绝后补记录、替换记录等行为,同时用电子文档代替纸质文档,有效降低纸质文档的归档、管理成本。
54、总之,本发明实施例提供的偏差管理系统实现了高效、可控化规范管理。
- 还没有人留言评论。精彩留言会获得点赞!