一种面向数字人的跨模态医学影像配准方法、系统和设备
本发明涉及图像处理,尤其涉及一种面向数字人的跨模态医学影像配准方法、系统和设备。
背景技术:
1、综合来说,数字人指存在于非物理世界中,由计算机手段创造及使用,并具有多重人类特征的综合产物。早期的数字人主要通过手绘、动作捕捉、计算机图形学技术等方法制作,近年来,随着深度学习算法的突破,数字人的概念和应用场景再次得到全方位拓展,数字人更细化为由人物形象、语音生成、动画生成、音视频合成显示、交互等5个模块组成。但现有数字人重建技术聚焦于表观建模,如面部的几何形状、纹理和皮肤材质等,往往忽略了内部骨骼结构和表观模型之间的相关性。同时,考虑到对内部结构有需求的应用场景,如:医疗整容行业需要可视化人体内部结构在手术前后的效果对比。因此,考虑结合人体内部医学影像和外表扫描图像等多模态数据,同时对数字人内部的肌肉、骨骼、肌腱、脂肪、血管甚至神经等结构和外表皮肤进行建模,实现更加符合解剖学规律数字人的生成。
2、医学影像例如计算机断层扫描(computed tomography,ct)和磁共振成像(magnetic resonance imaging,mri)等技术则可以以非侵入的方式获取针对人体或人体部位的影像知识,为构建内部解剖结构正确的数字人提供数据支撑。ct图像提供了非常清晰的骨骼和器官轮廓信息,但是受试者面临高辐射照射的威胁,同时采集过程仅能在临床允许的情况下进行。mri扫描是一种安全的解决方案,可以在人体软组织(如肌肉、脂肪、肌腱和神经元)中提供良好的对比度。然而,由于人体软组织结构复杂,mri中骨骼结构不清晰,因此很难提取出与面部外观相关的解剖结构。除了以上采集过程,医学图像和数据的存储和共享过程中往往面临信息泄露的风险。通用数据保护法规(gdpr)通常需要对图像进行匿名化处理,即去除部分面部特征(例如使用freesurfer)或模糊面部,以保证测试对象的隐私,这也加剧了从医学图像中重建面部解剖结构的难度。
3、大多数现有的解剖约束参数化人体器官模型都基于公共ct、mri数据集或人工生成数据集。然而,基于数据驱动的器官解剖结构重建需要大量带有人工标注的ct或mri图像。但现有医学影像数据面临如下困难:(1)大量影像资料尚未数字化,且医院间的数据共享和互通程度较低,数据获取困难;(2)与自然图像相比,医学影像数据规模较小,一个数据集通常只含几百张图像;(3)大多数标注依赖人工识别,数据标注耗费大量人力财力。因此现存的医学影像数据集规模难以满足高质量、可扩展、自动化的过程,而临床的采集获取又面临以上种种挑战。近年来,随着高性能计算资源的快速普及,基于深度学习的数据生成技术已被广泛用于医学成像,因为与传统的图像处理算法相比,这些新方法在许多情况下提供了卓越的性能。
4、在获取大量的医学影像数据之后,需要高效、准确、稳健的3d头骨重建算法支持下游任务,为实现数字人参数化模型驱动的内外一致性提供基础。然而,头骨重建在数据准备方面也面临着多项挑战,包括但不限于以下方面:(1)辐射风险和数据采集困难:要构建准确的数字人,必须获得内外一致的数据。然而,获得精准的骨骼信息通常需要使用计算机断层扫描(ct)技术,而这种技术涉及高辐射照射,对被试者的健康构成风险,且数据采集相对困难。(2)姿势不一致和配准复杂性:内外一致数据通常需要来自不同受试者,他们可能具有不同的形状和姿势。这导致了数据的配准问题,使数据处理变得更加复杂。(3)标注困难和成本高昂:在ct影像中标注骨骼结构需要经验丰富的医生,通常需要数小时的耗时,并且标注的准确性因个体差异而异。这不仅耗时,还难以确保准确性,因此迫切需要一种方法,可以自动从外部mri图像中推断内部骨骼信息。(4)数据不完整和实际困难:在实际应用中,获取完全匹配的ct-mri数据对于受试者来说并不容易。此外,采集ct和mri数据不仅可行性低,而且可能对受试者的健康产生不必要的影响。
技术实现思路
1、针对上述存在的问题,本发明旨在提供一种面向数字人的跨模态医学影像配准方法、系统和设备,通过将模板ct图像与多个mri图像进行配准,实现了内部骨骼与mri外表面的一致性,避免了高辐射风险、减少了内外数据不一致和标注成本的问题,可用于为3d头骨重建任务提供依据。
2、为了实现上述目的,本发明所采用的技术方案如下:
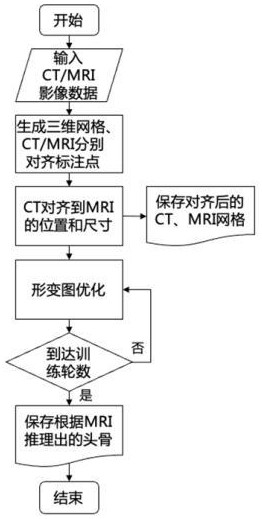
3、一种面向数字人的跨模态医学影像配准方法,包括以下步骤:
4、s1:ct头骨模型数据和mri数据提取;
5、s2:通过平移、旋转和缩放操作,初步对齐ct与mri图像;
6、s3:基于ct头骨模型数据,训练基于形变图优化的配准模型;
7、s4:使用步骤s3中训练好的配准模型,输出与mri影像外表面掩膜相匹配的形变后的ct头骨三维网格,实现影像数据的配准。
8、进一步的,步骤s1中所述的ct头骨模型数据的提取包括以下步骤:
9、s101a:提取ct头骨模板掩膜和ct头骨模板标注点;
10、s102a:通过marching cubes算法,根据ct头骨模板掩膜生成ct头骨的三维网格;所述三维网格包括顶点、面以及法线信息;
11、s103a:坐标变换,使ct头骨模板标注点对齐到ct头骨三维网格的正确位置和尺寸。
12、进一步的,步骤s1中所述的mri数据的提取包括以下步骤:
13、s101b:提取一系列mri数据中的mri影像数据、mri影像外表面掩膜和mri影像头骨标注点;
14、s102b:使用marching cubes算法根据mri影像外表面掩膜生成mri面部的三维网格;
15、s103b:坐标变换,使mri影像头骨标注点对齐到mri面部三维网格的正确位置和尺寸。
16、进一步的,步骤s2的具体操作包括以下步骤:
17、s201:计算ct头骨三维网格和mri面部三维网格的中心差异,并执行平移,确保它们的原点对齐;
18、s202:执行绕x、y和z轴的旋转,确保两个模型的朝向一致;
19、s203:计算mri影像头骨标注点和ct头骨模板标注点之间的缩放比例,同时调整ct头骨三维网格和ct头骨模板标注点,使两种影像初步对齐;
20、s204:将ct头骨三维网格、mri面部三维网格和相应的点云以三维场景的形式展示并输出保存,确保两种影像的一致性。
21、进一步的,步骤s3的具体操作包括以下步骤:
22、s301:创建用于表示ct头骨三维网格形变的deformationgraph模型,该模型由控制节点和顶点组成;
23、s302:初始化随机梯度下降优化器,并以最小化总损失为目标,对deformationgraph模型的旋转和平移参数进行优化循环。
24、进一步的,步骤s302中所述的总损失 loss计算公式为:
25、;
26、式中,为旋转损失,为正则化损失、为一致性损失,、、分别表示旋转损失、正则化损失和一致性损失的权重。
27、进一步的,旋转损失、正则化损失和一致性损失的定义分别为:
28、;
29、;
30、;
31、其中,表示节点,表示的旋转矩阵,表示旋转矩阵的平方偏差,表示节点的数量;表示与节点相连的节点集合,是权重系数,表示节点的空间位置,表示实数集,表示大小为的节点的平移向量,表示二范数的平方;为变形后的顶点,向量是约束的指定位置,表示约束点的索引,从1到,表示约束点的个数,表示节点的空间位置,表示大小为的节点的平移向量。
32、进一步的,步骤s4的具体操作包括以下步骤:
33、s401:使用步骤s3中训练好的配准模型,通过ct_deformationgraph.predict函数预测ct头骨三维网格的形变,将得到的新的顶点位置应用到ct头骨模型上,从而实现ct头骨模型的形变;
34、s402:ct头骨三维网格通过形变图优化,将ct头骨模板标注点向mri影像头骨标注点拟合,最终输出与mri影像外表面掩膜相匹配的形变后的ct头骨三维网格,实现影像数据配准。
35、进一步的,本发明还包括一种面向数字人的跨模态医学影像配准系统,所述配准系统包括ct头骨模型数据提取模块、mri数据提取模块、ct与mri图像初步对齐模块和配准模型模块;
36、所述ct头骨模型数据提取模块和mri数据提取模块分别用于ct头骨模型数据和mri数据提取;
37、所述ct与mri图像初步对齐模块用于通过平移、旋转和缩放操作,初步对齐ct与mri图像;
38、所述配准模型模块用于对ct头骨模型和mri影像数据进行配准,输出与mri影像外表面掩膜相匹配的形变后的ct头骨三维网格;
39、所述ct头骨模型数据提取模块、mri数据提取模块、ct与mri图像初步对齐模块和配准模型模块基于如前所述的配准方法实现。
40、进一步的,本发明还包括一种面向数字人的跨模态医学影像配准设备,所述配准设备包括至少一个处理器;以及与所述处理器通信连接的存储器;其中,所述存储器存储有可被所述处理器执行的指令,所述指令被所述处理器执行,以使所述处理器能够执行如前所述的配准方法。
41、本发明的有益效果是:
42、1、本发明针对医学影像配准困难,成本高昂等问题,提出了以ct图像为模板配准到mri图像,同时获取内部骨骼标注信息和外部表观信息的配准方法。采用基于形变图优化的配准方法,将ct头骨模型形变以适应mri面部模型的形状,然后将模板ct图像与多个mri图像进行配准,以获得内部骨骼与mri外表面一致的数字人多模态数据集。该方法避免了传统数据集构建过程中常见的问题,如受试者高辐射风险、标注成本高和内外数据不一致等难题,为医学影像处理领域提供了更为可靠和可行的数据资源。
43、2、本发明仅使用一张清晰的ct图像,就可以通过配准得到每个mri图像的内部骨骼标注信息,从而构建内外一致的数字人多模态数据集,明显减少了数据集构建成本,并且有较高的精度,能够更准确地分析患者的医学影像数据,为临床诊断和治疗决策提供更可靠的依据,提升医疗领域的整体质量和效率;而且该方法减少了在医学图像配准和分析过程中的手动干预,有望提高整体自动化水平。
- 还没有人留言评论。精彩留言会获得点赞!