基于极性反转电压策略的纳喷雾离子源及其操作方法与流程
本发明涉及一种纳喷雾质谱离子源,尤其涉及一种基于机型反转电压策略的纳喷雾离子源及其操作方法。
背景技术:
在现有技术中,质谱(mass spectrometry,MS)是一种将不同化合物按质荷比(m/z)进行分离和检测的装置。质谱具有高灵敏度、多物质同时检测的能力以及化学专一性,因而在化合物的定性和定量分析中备受青睐。近年来,随着生命科学,尤其是细胞生物学的兴起,质谱被广泛地应用于痕量生物分子的检测。很多生物分子具有含量低、样品难以制备,并且需要保存于缓冲盐体系中的特点,这对质谱的灵敏度及其对缓冲盐基质的耐受性提出了更高的要求。
离子源是质谱不可或缺的组成部分,也是直接影响质谱检测灵敏度及基质耐受性的关键部件之一。近年来提出的纳喷雾离子源(nano-electrospray ionization,nano-ESI)是较为成功的一种生物样品离子源。纳喷雾离子源需要在特殊拉制的纳喷雾喷针(nano-tip)上实现。nano-tip一般为中空的玻璃或石英管。经拉制,管子的一端被加工成为具有1-10μm内径的尖端。测样前,溶液样品被注入nano-tip中。进样量为5μL左右。检测时,样品溶液被施加1-2kV直流高压电。在高压电场的驱动下,样品溶液从nano-tip尖端形成电喷雾,实现生物分子的离子化。
相对于普通电喷雾(electrospray ionization,ESI)而言,nano-ESI具有较低的流动相流速(nL/min级别)和较高的离子化效率,且对缓冲盐基质具有一定的耐受性,更有利于痕量生物分子的检测。此外,nano-ESI不需要辅助气的协助,装置更为简单。这些优势使得nano-ESI在生化领域受到更为广泛的应用。
在普通ESI或nano-ESI中,正离子模式的信号增强一般依赖于向溶液中添加额外的有机酸(如0.1%甲酸或乙酸等)。样品中的高浓度缓冲盐基质需要进行额外的预处理降低其浓度或彻底除去,以防止对待测分子的信号产生干扰。
随着应用研究的不断深入,人们需要进一步提高nano-ESI的检测灵敏度及其对缓冲盐基质的耐受性。
技术实现要素:
针对上述现有技术中的缺点和不足,本发明的目的在于提供一种高检测灵敏度以及对缓冲盐基质具有高耐受性的基于极性反转电压策略的纳喷雾离子源以及其操作方法。
本发明的目的是通过以下技术方案实现的:
一种基于极性反转电压策略的纳喷雾离子源,包括
纳喷雾喷针,用于装载样品溶液;
金属电极,插入到纳喷雾喷针内,与样品溶液直接接触;
绝缘端盖,封堵在纳喷雾喷针的尾端,防止漏电;
高压电源,具有正反双向输出功能,与金属电极连接,连接金属电极的电线穿过绝缘端盖。
优选地,所述高压电源的正向输出电压范围为0至+3kV,反向输出电压范围为0至-5kV。
优选地,所述金属电极为惰性电极。
优选地,所述惰性电极为铂丝。
一种基于极性反转电压策略的纳喷雾离子源的操作方法,包括如下步骤:
S1,从纳喷雾喷针的尾端注入样品溶液;
S2,将金属电极从纳喷雾喷针尾端插入到纳喷雾喷针内,直至金属电极与样品溶液接触到;
S3,用绝缘端盖封住纳喷雾喷针的尾端并连通高压电源和金属电极;
S4,打开高压电源先对金属电极输出-2.5kV至5.0kV电压,持续输出3s至12s;然后对金属电极输出+1.5kV至+2.0kV电压,用于产生纳喷雾。
优选地,在步骤S4中,在打开高压电源后,先对金属电极输出-3kV电压,持续输出6s;然后对金属电极输出+1.75kV电压。
与现有技术相比,本发明实施例至少具有以下优点:
本发明首先使用反相负高压对样品溶液进行预处理,然后使用正相高压产生纳喷雾,相比于普通nano-ESI而言,本发明在检测效果上具有以下优势:
(1)更高的信号强度:待测生物分子的信号强度得到了增强(1-2个数量级)。
(2)更高的信噪比:所得待测生物分子的质谱图具有更高的信噪比(1-2个数量级)。对待测分子产生信号增强的同时,有效地抑制了噪音的信号强度,从而使得待测分子的信噪比得到了显著增强。
(3)对缓冲盐基质的耐受性增强:能够承受更高浓度的缓冲盐基质。对于普通nano-ESI无法完成检测的高浓度缓冲盐基质样品(mM级浓度),本发明能够顺利地进行检测。
(4)在检测过程中,不会导致蛋白质分子折叠结构的展开。
(5)装置和操作简单,无需额外添加剂和其它预处理手段。在本发明中,无需额外添加有机酸,就能够实现信号的显著增强。并且,本发明对mM级别的高浓度缓冲盐基质具有较强的耐受性,无需额外预处理手段,可直接实现对待测分子的检测。
附图说明
图1为本发明基于极性反转电压策略的纳喷雾离子源的结构以及电压施加策略示意图;
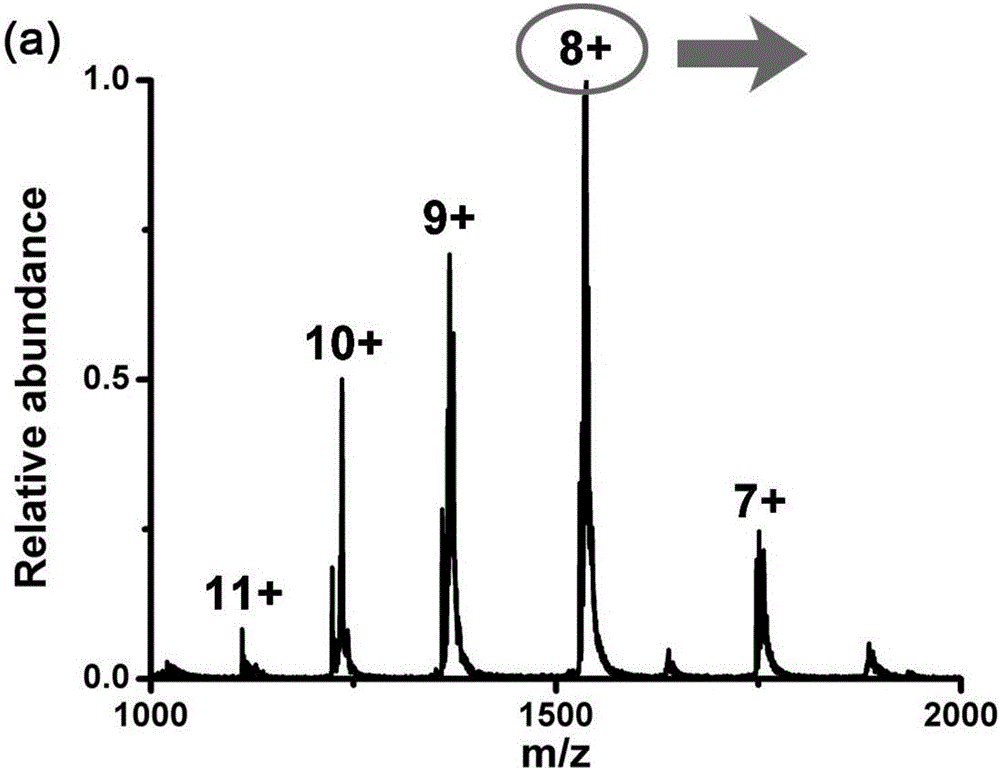
图2a为通过普通纳喷雾离子源产生的纳喷雾对10μM细胞色素c的检测结果示意图;
图2b为图2a中主峰(带有8+电荷数的峰)的放大图;
图2c为通过本发明基于极性反转电压策略的纳喷雾离子源产生的纳喷雾对10μM细胞色素c的检测结果示意图;
图2d为图2c中主峰(带有8+电荷数的峰)的放大图;
图3a为通过普通纳喷雾离子源对100nM细胞色素c样品的检测结果示意图;
图3b为通过本发明基于极性反转电压策略的纳喷雾离子源产生的纳喷雾对100nM细胞色素c的检测结果示意图;
图3c为通过普通纳喷雾离子源对10nM细胞色素c样品的检测结果示意图;
图3d为通过本发明基于极性反转电压策略的纳喷雾离子源产生的纳喷雾对10nM细胞色素c的检测结果示意图;
图3e为通过普通纳喷雾离子源对1nM细胞色素c样品的检测结果示意图;
图3f为通过本发明基于极性反转电压策略的纳喷雾离子源产生的纳喷雾对1nM细胞色素c的检测结果示意图;
图4a为通过普通纳喷雾离子源对胰岛素的检测结果示意图;
图4b为图4a中主峰(带有5+电荷数的峰)的放大图;
图4c为通过本发明基于极性反转电压策略的纳喷雾离子源产生的纳喷雾对胰岛素的检测结果示意图;
图4d为图4c中主峰(带有5+电荷数的峰)的放大图;
图5a为通过普通纳喷雾离子源对含有NaCl基质的胰岛素样品的检测结果示意图;
图5b为通过本发明基于极性反转电压策略的纳喷雾离子源产生的纳喷雾对含有NaCl基质的胰岛素样品的检测结果示意图;
图6a为通过本发明基于极性反转电压策略的纳喷雾离子源产生的纳喷雾对浓度为10μM细胞色素c样品检测后生成的带有8+电荷的质子化的细胞色素c离子[M+8H]8+的萃取离子色谱图;
图6b为通过本发明基于极性反转电压策略的纳喷雾离子源产生的纳喷雾对浓度为10μM细胞色素c样品检测后生成的带有8+电荷的Na+加合离子[M+5H+3Na]8+的萃取离子色谱图;
图6c为图6a和图6b当时间上处于第一区域时所得到的质谱图;
图6d为图6a和图6b当时间上处于第二区域时所得到的质谱图。
具体实施方式
下面结合实施例及其附图对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。
一种基于极性反转电压策略的纳喷雾离子源,包括
纳喷雾喷针,用于装载样品溶液;纳喷雾喷针的材质不限,一般为玻璃或石英;尖端内径与普通纳喷雾所需内径一致,为1至10μm。Nano-tip尾端的尺寸不限。
金属电极,插入到纳喷雾喷针内,与样品溶液直接接触;电极材质不限,但应具有化学惰性,不易与样品溶液发生化学反应导致腐蚀和溶解。一般为铂丝。
绝缘端盖,封堵在纳喷雾喷针的尾端,防止漏电;
高压电源,具有正反双向输出功能,与金属电极连接,连接金属电极的电线穿过绝缘端盖。
所述高压电源的正向输出电压范围为0至+3kV,反向输出电压范围为0至-5kV。
一种基于极性反转电压策略的纳喷雾离子源的操作方法,包括如下步骤:
S1,从纳喷雾喷针的尾端注入样品溶液;
S2,将金属电极从纳喷雾喷针尾端插入到纳喷雾喷针内,直至金属电极与样品溶液接触到;
S3,用绝缘端盖封住纳喷雾喷针的尾端并连通高压电源和金属电极;
S4,打开高压电源先对金属电极输出-2.5kV至5.0kV电压,持续输出3s至12s;然后对金属电极输出+1.5kV至+2.0kV电压,用于产生纳喷雾。更具体的,在打开高压电源后,先对金属电极输出-3kV电压,持续输出6s;然后对金属电极输出+1.75kV电压。与此同时,打开质谱检测器进行数据采集。
使用时在纳喷雾喷针的尖端对正质谱仪的质谱进样口。
下面通过具体的实施例验证基于极性反转电压策略的纳喷雾离子源的检测效果。
(1)蛋白质细胞色素c的检测
细胞色素c纯品(来源于马心脏,分子量约为12.4kDa)溶解于超纯水中得到浓度为10μM待测样品溶液。分别使用普通nano-ESI和本发明的方法对该溶液进行检测,结果如图2所示。
从普通nano-ESI的检测结果(图2a)可以看出,所得质谱图呈现出细胞色素c特有的峰簇,主峰带有8+电荷数,显示出细胞色素c分子处于折叠状态。对其中带有8+电荷数的主峰进行放大(图2b)可以看到明显的Na+离子加合物峰,并且加合物的峰强度远强于质子化分子的峰强度。此外,从图中能观察到加合不同Na+个数的加合物峰,包括1至6个Na+离子。其中,带有3个Na+离子的加合物分子具有最高的信号强度。
为了对检测效果进行量化,特此对带有8+电荷的质子化细胞色素c分子的信噪比(S/N)进行计算,具体的计算方式如下:
S1,对质量范围在m/z=1480至1500的噪音信号取平均值,得到目标信号峰左端噪音的平均值。
S2,对质量范围在m/z=1690至1710的噪音信号取平均值,得到目标信号峰右端噪音的平均值。
S3,对左、右两端噪音进行平均,得到整体噪音的平均值。
S4,将目标信号峰的信号强度除以整体噪音的平均值,得到最终的S/N。
图2b中,普通nano-ESI所得的带有8+电荷的质子化峰的S/N为111。
本发明的检测效果如图2c所示。所得质谱图呈现出细胞色素c特有的峰簇,主峰带有8+电荷数,表明细胞色素c分子的折叠并未受到破坏。对其中带有8+电荷数的主峰进行放大(图2d)后,并未观察到明显Na+加合物的峰。这表明本发明能够有效地抑制盐离子加合物对检测带来的干扰,对盐基质具有更高的耐受性。从定量结果可以看出(图2d),本发明所得的带有8+电荷的质子化峰的S/N为2180。与普通nano-ESI相比,本发明所得的S/N提高了20倍。
(2)低浓度细胞色素c的检测
在较低浓度下,本发明对待测分子信号的增强作用更加显著。我们使用低浓度的细胞色素c样品对此特性进行了考察。结果如图3所示。
从普通nano-ESI的检测结果(图3a,c和e)可以看出,当细胞色素c的浓度为100nM时,普通nano-ESI能够勉强完成检测,S/N为3。并且有明显Na+离子加合物的峰出现。当细胞色素c的浓度降低到10nM时,已经无法检出细胞色素c的信号。进一步降低细胞色素c的浓度至1nM时,亦无检出信号。
对于上述三种浓度的细胞色素c样品,本发明均能顺利地完成检测(图3b,d和f)。当细胞色素c的浓度为100nM时,所得信号的S/N为156,与普通nano-ESI的S/N相比增强了53倍。没有Na+加合物的峰出现。当细胞色素c的浓度降低至10nM时,所得信号的S/N为58。没有Na+加合物的峰出现。当细胞色素c的浓度进一步降低至1nM时,本发明仍能完成检测。所得信号的S/N为5。依然没有Na+加合物的峰出现。
(3)蛋白质胰岛素的检测
胰岛素纯品(来源于牛胰腺,分子量约为5.6kDa)溶解于超纯水中得到浓度为10μM待测样品溶液。分别使用普通nano-ESI和本发明的方法对该溶液进行检测,结果如图4所示。
从普通nano-ESI的检测结果可以看出(图4a),所得质谱图呈现出胰岛素特有的峰簇,主峰带有5+电荷数。从主峰的放大图(图4b)可以看到明显的Na+离子加合物峰。加合了不同Na+个数的加合物峰均能被辨认出来,包括1至9个Na+离子。其中加合5个Na+离子的谱峰具有最高强度。由于带有5+电荷数的主峰峰簇中并没有观察到质子化峰,全为Na+离子加合物的峰,所以无法与本发明的检测结果进行比较。这也体现出普通nano-ESI在进行胰岛素的检测时,对盐基质的抗干扰能力较为有限。考虑到在带有4+电荷的峰簇中,能观察到一定强度的质子化谱峰,因而选用带有4+电荷的质子化峰计算S/N,并与本发明的检测结果进行比较。具体的计算方式如下:
S1,对质量范围在m/z=1400至1420的噪音信号取平均值,得到目标信号峰左端噪音的平均值。
S2,对质量范围在m/z=1560至1580的噪音信号取平均值,得到目标信号峰右端噪音的平均值。
S3,对左、右两端噪音进行平均,得到整体噪音的平均值。
S4,将目标信号峰的信号强度除以整体噪音的平均值,得到最终的S/N。带有4+电荷的质子化峰的S/N为6。
本发明有效地改善了对胰岛素的检测结果。从检测结果可以看出(图4c),所得质谱图呈现出胰岛素特有的峰簇,主峰带有5+电荷数。在主峰的放大图中(图4d)几乎观察不到Na+离子加合物峰。这说明本发明对盐基质具有较强的额耐受性。带有4+电荷的质子化峰的S/N为2252。与普通nano-ESI的检测结果相比而言,S/N增强了375倍。
(4)对盐基质耐受性的考察
为进一步考察本发明对盐基质的耐受性,分别使用普通nano-ESI和本发明对含有NaCl的胰岛素样品进行检测,并将检测结果进行对比。首先,将NaCl固体溶解于超纯水中得到浓度为1mM的NaCl基质溶液。之后,将胰岛素固体溶解于NaCl基质溶液中得到浓度为10μM胰岛素样品溶液,用于检测。
从普通nano-ESI的检测结果中(图5a)可以看到明显的NaCl团簇离子。这些团簇离子的出现,导致严重的离子抑制效应,使得胰岛素的信号被极大地抑制了。虽然胰岛素的信号能够从图中能够勉强辨认出来,但是信号强度较弱,并且有严重的Na+加合峰出现。
本发明的检测效果则有明显的改善。从本发明的检测结果中(图5b)可以观察到胰岛素特有的峰簇,主峰带有5+电荷数。没有NaCl团簇离子的出现,这说明在本发明的检测过程中,高浓度NaCl所带来的离子抑制效应被有效地消除了。这也验证了本发明对mM级别的盐基质具有较强的耐受性。
(5)机理考察
为进一步了解本发明的特性,我们对本发明的信号增强和除盐机理进行了深入探讨。机理考察以细胞色素c作为检测对象。细胞色素c固体溶解于超纯水得到浓度为10μM的样品溶液,直接用于检测。检测完成后,分别考察带有8+电荷的质子化的细胞色素c离子[M+8H]8+的EIC(Extracted ion chromatograms萃取离子色谱图)和带有8+电荷的Na+加合离子[M+5H+3Na]8+的EIC(图6)。
需要说明的是,图6a和图6b的坐标图中的竖线左边为第一区域,竖线右边为第二区域。
在本发明的检测过程中,溶液首先经过6s的-3.0kV的负高压处理(时间从0min开始)。然后,电压被调至+1.75kV以产生纳喷雾。从此时开始,[M+8H]8+离子的信号迅速增强,直至达到峰值(图6a)。之后,[M+8H]8+离子的信号逐渐减弱。
带有8+电荷的Na+加合离子[M+5H+3Na]8+的EIC则具有不同的规律。该离子代表了溶液中Na+的行为。当电压被调至+1.75kV以产生纳喷雾后,[M+5H+3Na]8+离子的信号在较长时间内保持了较为缓慢的增长,直至在时间上到达红色区域后,[M+5H+3Na]8+离子的信号迎来了较为迅速的增长。与图a中[M+8H]8+离子的EIC相比可以看出,两种离子的峰值出现在不同的时候。质子化离子[M+8H]8+的峰值在较早的时候出现,而Na+加合物[M+5H+3Na]8+的信号则在一开始处于较低水平,时间上进入第二区域之后才逐渐增强。
从上述结果可以看出本发明的内在机理。由于溶液中的待测分子与基质盐离子在溶液中具有不同的电迁移速率,因而在6s时间的负高压电场的驱动下所迁移的距离也不一样。具有较高迁移速率的基质盐离子迁移了较大的距离(向远离nano-tip尖端的方向),而待测分子则迁移了较小的距离。当使用正高压触发正常电喷雾之后,待测分子便先与基质盐离子产生较强信号。这便实现了对基质盐离子的去除,增强了本发明对样品中基质离子的耐受性。同时,由于基质盐离子与待测分子的分离,使得待测分子在离子化的过程中受到的离子抑制相应降低,从而也增强了待测分子的离子化效率,进而增强了待测分子的检出信号。
从图6中第一时间段所采集到的质谱图(图6c)可以看出,待测分子具有较强的信号强度,谱峰具有较高的信噪比。在图中没有观察到盐基质离子的加合物峰。而在第二时间段所采集到的质谱图(图6d)可以看到待测分子的信号受到了明显的干扰。图中有明显的盐离子Na+离子加合物的峰,并且细胞色素c的整体信号减弱了,谱峰具有较低的信噪比。图6c和图6d两张质谱图的显著差异进一步佐证了上述对EIC的考察中所得到的结论。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!