一种可充镁电池正极材料及其制备方法和应用与流程
本发明涉及材料技术领域,尤其涉及一种可充镁电池正极材料及其制备方法和应用。
背景技术:
自上世纪90年代以来,锂离子电池技术逐渐在储能领域占据统治地位。但是随着锂离子电池的能量密度逐渐接近嵌入式化学的理论极限,其能量密度很难获得进一步提高。近年来锂金属电池的研究获得了大量的关注,因其能够结合锂金属和高容量的无锂正极,理论上可以取得更高的能量密度。但是锂金属负极的应用受限于较低的沉积溶解库伦效率和枝晶引发的安全问题。而镁金属具有高容量(特别是体积容量为3833mah/cm3),低还原电位(-2.4vvs.she),储量丰富,且易于加工等优点。更重要的是,镁金属负极可以实现库伦效率接近100%的沉积和溶解,且没有枝晶产生,安全性能高。所有这些优点使镁电池体系成为很有前景的下一代储能技术。
但是镁电池的发展受限于缺乏合适的正极材料。一般地,寻找高能量密度的镁电池正极材料主要有两个方向:高工作电位的氧化物和高容量的硫化物。高度极化的镁离子和氧化物正极材料之间有强烈的相互作用,这导致了缓慢的反应动力学和较低的镁离子嵌入程度。另外,镁离子倾向于从氧化物中提取氧进而形成包含氧化镁的非晶界面。这种非晶化来自于镁嵌入产物的热力学不稳定性,从而阻止了镁离子深入正极材料的体相。目前,不含镁的硫化物正极材料,如层状和尖晶石tis2,以及尖晶石zrs2,被大量用作镁电池正极材料,然而其受限于低容量和不够理想的动力学。传统的嵌入式化学基于单纯的过渡金属阳离子的氧化还原,在大多数情况下每个过渡金属只能发生一个电子转移,这本质上限制了其容量释放。除此之外,阳离子氧化还原过程中局域化的电子不容易容纳镁离子所带的电荷,损害了镁离子扩散的动力学。
如果能够找到一种能够克服以上缺陷的正极材料,将对可充镁电池的广泛应用起至关重要的作用。
技术实现要素:
本发明实施例提供了一种可充镁电池正极材料及其制备方法和应用。可充镁电池正极材料包括的黄铁矿型化合物能够同时实现阳离子和阴离子的氧化还原变价,不仅提高正极材料的容量和电压,而且有利于提升电极反应的动力学性能。
第一方面,本发明实施例提供了一种可充镁电池正极材料,所述可充镁电池正极材料包括黄铁矿型化合物,化学通式为mtx;其中,m为过渡金属阳离子,包括:fe、co、ni、mn、zn、w、nb、zr、mo、ti、cu、v中的一种或多种;t为阴离子,包括o、s、se、te、as、cl、br、i中的一种或多种;1<x<3,且所述阴离子不处于最低价态;
所述黄铁矿型化合物中,过渡金属阳离子的d轨道和阴离子的p轨道杂化形成共价键,使得在镁电池充放电过程中所述可充镁电池正极材料中的过渡金属和阴离子共同参与氧化还原过程,产生阴阳离子的共同变价。
优选的,所述黄铁矿型化合物的晶体结构属于等轴晶系,
第二方面,本发明实施例提供了一种第一方面所述的可充镁电池正极材料的制备方法,所述制备方法包括:
根据需要称取适量的过渡金属盐和阴离子源,置于反应釜中,加入一定量的溶剂,在100-300摄氏度下保持1-72个小时,将反应产物水洗,并且在真空烘箱中干燥,得到黄铁矿型化合物可充镁电池正极材料。
优选的,所述过渡金属盐包括m的乙酸盐、硫酸盐、硝酸盐或卤化盐中的至少一种;其中m为过渡金属阳离子,包括:fe、co、ni、mn、zn、w、nb、zr、mo、ti、cu、v中的一种或多种;
所述阴离子源包括t单质或含t的无机化合物;其中t为阴离子,包括o、s、se、te、as、cl、br、i中的一种或多种;
所述溶剂为二甲基甲酰胺dmf和/或乙二醇eg。
第三方面,本发明实施例提供了一种上述第一方面所述的可充镁电池正极材料的制备方法,所述制备方法包括:
根据需要称取适量的过渡金属单质和阴离子源,置于球磨罐中,密封球磨1-72小时,得到黄铁矿型化合物可充镁电池正极材料。
优选的,所述过渡金属单质包括:fe、co、ni、mn、zn、w、nb、zr、mo、ti、cu、v中的一种或多种;
所述阴离子源包括t单质或含t的无机化合物;其中t为阴离子,包括o、s、se、te、as、cl、br、i中的一种或多种。
第四方面,本发明实施例提供了一种可充镁电池的正极,包括:上述第一方面所述的可充镁电池正极材料;所述正极中,黄铁矿型化合物占质量百分比为40%-95%。
优选的,所述正极还包括导电添加剂和粘结剂;
所述导电添加剂在所述正极中的质量百分比为1%-30%;所述导电添加剂具体包括:石墨烯、科琴黑、碳纳米管、乙炔黑、super-p炭黑中的一种或多种;
所述粘结剂在所述正极中的质量百分比为1%-10%;所述粘结剂具体包括:聚四氟乙烯ptfe、羟甲基纤维素cmc、海藻酸钠、聚偏氟乙烯pvdf、聚丙烯酸paa、丁苯橡胶sbr中的一种或者多种。
第五方面,本发明实施例提供了一种可充镁电池,所述可充电镁电池包括:上述第四方面所述的正极。
优选的,所述可充镁电池还包括镁离子电解液和镁金属负极;
所述镁离子电解液的浓度为0.01~2mol/l;溶质包括mgcl2、alcl3、phmgcl、mg(tfsi)2、mg(bh4)2、mg(otf)2的一种或多种,溶剂包括四氢呋喃、二甲醚、乙二醇二甲醚、二乙二醇二甲醚、三甘醇二甲醚的一种或多种;
所述镁金属负极包括金属镁箔、镁粉、镁网、镁合金中的一种或多种。
本发明实施例提供的可充镁电池正极材料,采用黄铁矿型化合物作为正极材料,能够取得高容量,长循环和较好的动力学性能。首先由于黄铁矿型化合物过渡金属的d轨道和阴离子的p轨道能量接近,形成很强的共价键,因此可以实现过渡金属和阴离子的共同变价,提高容量。过渡金属d轨道和阴离子p轨道的杂化导致高度离域的电子云,该电子云有利于容纳镁离子带来的电荷,提高反应的动力学性能。此外,形成黄铁矿化合物的过渡金属元素主要来自于viii(fe,co,和ni)族,一般具有较低的d轨道,能够取得更高的工作电压,从而有利于可充镁电池能量密度的提升。
附图说明
下面通过附图和实施例,对本发明实施例的技术方案做进一步详细描述。
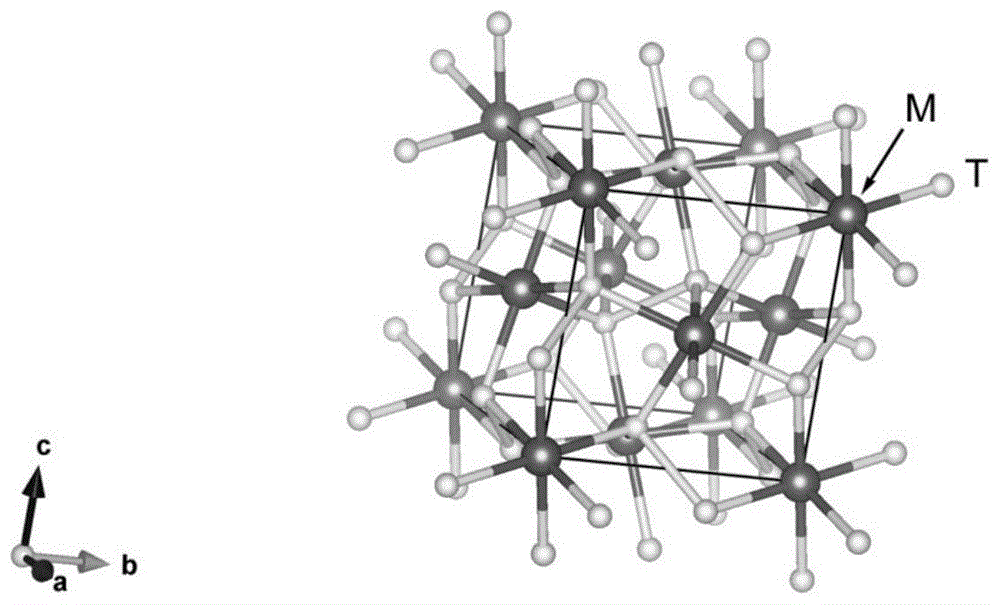
图1为本发明实施例提供的黄铁矿型化合物的空间结构示意图;
图2为本发明实施例1-5提供的黄铁矿型化合物的x射线衍射图;
图3为本发明实施例1提供的fe0.5co0.5s2的扫描电子显微镜图;
图4为本发明实施例1提供的fe0.5co0.5s2的透射电子显微镜图;
图5为本发明实施例1提供的fe0.5co0.5s2的透射电子显微镜元素分布图;
图6为本发明实施例1提供的fe0.5co0.5s2为正极材料的镁电池的恒流充放电曲线;
图7为本发明实施例1提供的fe0.5co0.5s2为正极材料的镁电池的循环性能示意图;
图8为本发明实施例1提供的fe0.5co0.5s2为正极材料的镁电池的倍率性能图;
图9为本发明实施例1提供的fe0.5co0.5s2为正极材料的镁电池的恒流充放电曲线以及i,ii,iii,iv,v的标记标识;
图10为本发明实施例1提供的fe0.5co0.5s2在图9标记处收集的fel3的电子能量损失谱;
图11为本发明实施例1提供的fe0.5co0.5s2在图9标记处收集的col3的电子能量损失谱;
图12为本发明实施例1提供的fe0.5co0.5s2在图9标记处收集的sl3的电子能量损失谱;
图13为本发明实施例1提供的fe0.5co0.5s2在图9标记处收集的s2p的x射线光电子能谱;
图14为本发明实施例1提供的恒流间歇滴定法(gitt)测量fe0.5co0.5s2/mg软包电池的准平衡电压分布图;
图15为本发明实施例1提供的从gitt得到的fe0.5co0.5s2/mg软包电池在充放电过程中的过电位;
图16为本发明实施例1提供的gitt测量期间电流切断后的动态电位响应图;
图17为本发明实施例1提供的第一个循环的gitt测量中的每2个小时弛豫之后获得交流阻抗谱;
图18为本发明实施例2提供的fe0.7co0.3s2的扫描电子显微镜图;
图19为本发明实施例2提供的fe0.7co0.3s2为正极材料的镁电池的恒流充放电图;
图20为本发明实施例2提供的fe0.7co0.3s2为正极材料的镁电池的循环性能示意图;
图21为本发明实施例3提供的fe0.9co0.1s2的扫描电子显微镜图;
图22为本发明实施例3提供的fe0.9co0.1s2为正极材料的镁电池的恒流充放电图;
图23为本发明实施例3提供的fe0.9co0.1s2为正极材料的镁电池的循环性能示意图;
图24为本发明实施例4提供的fes2的扫描电子显微镜图;
图25为本发明实施例4提供的fes2为正极材料的镁电池的恒流充放电图;
图26为本发明实施例4提供的fes2为正极材料的镁电池的循环性能示意图;
图27为本发明实施例5提供的cos2的扫描电子显微镜图;
图28为本发明实施例5提供的cos2为正极材料的镁电池的恒流充放电图;
图29为本发明实施例5提供的cos2为正极材料的镁电池的循环性能示意图。
具体实施方式
下面通过附图和具体的实施例,对本发明进行进一步的说明,但应当理解为这些实施例仅仅是用于更详细说明之用,而不应理解为用以任何形式限制本发明,即并不意于限制本发明的保护范围。
本发明的可充镁电池正极材料包括黄铁矿型化合物,化学通式为mtx;其中,m为过渡金属阳离子,包括:fe、co、ni、mn、zn、w、nb、zr、mo、ti、cu、v中的一种或多种;t为阴离子,包括o、s、se、te、as、cl、br、i中的一种或多种;1<x<3,且阴离子不处于最低价态;
黄铁矿型化合物是指与黄铁矿fes2具有相同晶体结构的化合物材料,或者,因为掺杂引起晶格扭曲的与黄铁矿fes2具有相近晶体结构的化合物材料。图1为本发明提供的黄铁矿型化合物的空间结构示意图。黄铁矿型化合物的晶体结构属于等轴晶系,
黄铁矿型化合物中,过渡金属阳离子的d轨道和阴离子的p轨道杂化形成共价键,使得在镁电池充放电过程中所述可充镁电池正极材料中的过渡金属和阴离子共同参与氧化还原过程,产生阴阳离子的共同变价。
以fexco1-xs2(0≤x≤1)为例,过渡金属的d轨道和硫元素的价带在能量上有部分重叠。初始空的d轨道会被硫元素价带的电子填充,导致其价带顶端出现空穴。高浓度的空穴使两个硫离子凝聚成(s2)2-,产生黄铁矿型化合物。也就是说,s的3p轨道上的电子填充到铁和钴的d轨道,生成具有氧化还原活性(s2)2-;而过渡金属也具有氧化还原活性,我们称之为联合阴阳离子氧化还原化学,即在氧化还原中,过渡金属阳离子和阴离子都参与氧化还原过程并实现变价。
除了由阴阳离子共同变价贡的可预期的高容量,在黄铁矿型化合物中过渡金属的d轨道和硫的3p轨道高度杂化,在金属和硫上产生高度离域的电子,有利于容纳镁离子的电荷,提高反应的动力学性能。另外,形成黄铁矿型化合物的过渡金属元素fe、co等具有较低的d轨道能够输出更高的工作电压。
本发明的可充镁电池正极材料可以通过水热法或球磨法得到。
具体制备方法为:根据需要称取适量的过渡金属盐和阴离子源,置于反应釜中,加入一定量的溶剂,在100-300摄氏度下保持1-72个小时,将反应产物水洗,并且在真空烘箱中干燥,得到黄铁矿型化合物可充镁电池正极材料;或者,根据需要称取适量的过渡金属单质和阴离子源,置于球磨罐中,密封球磨1-72小时,得到黄铁矿型化合物可充镁电池正极材料。
以上制备方法中,过渡金属单质,包括:fe、co、ni、mn、zn、w、nb、zr、mo、ti、cu、v中的一种或多种;阴离子源包括t单质或含t的无机化合物;t为阴离子,包括o、s、se、te、as、cl、br、i中的一种或多种;溶剂为二甲基甲酰胺(dmf)和/或乙二醇(eg)。
可充镁电池正极材料可用作可充镁电池正极,当然可充镁电池正极还可以添加导电添加剂和粘结剂。
具体的,在正极中,黄铁矿型化合物占质量百分比为40%-95%。
导电添加剂在正极中的质量百分比为1%-30%;导电添加剂具体包括:石墨烯、科琴黑、碳纳米管、乙炔黑、super-p炭黑中的一种或多种;粘结剂在正极中的质量百分比为1%-10%;粘结剂具体包括:聚四氟乙烯(ptfe)、羟甲基纤维素(cmc)、海藻酸钠、聚偏氟乙烯(pvdf)、聚丙烯酸(paa)、丁苯橡胶(sbr)中的一种或者多种。
所得正极可以与镁离子电解液和镁金属负极一起组成可充镁电池。
具体实施中,选用镁离子电解液的浓度为0.01~2mol/l;溶质包括mgcl2、alcl3、phmgcl、mg(tfsi)2、mg(bh4)2、mg(otf)2的一种或多种,溶剂包括四氢呋喃、二甲醚、乙二醇二甲醚、二乙二醇二甲醚、三甘醇二甲醚的一种或多种。镁金属负极可以选自金属镁箔、镁粉、镁网、镁合金中的一种或多种。
为更好的理解本发明提供的技术方案,下述以多个具体实例分别说明应用本发明可充镁电池正极材料的具体组成及其特性。
实施例1
本实施例提供了一种黄铁矿型fe0.5co0.5s2正极材料的制备及性能测试。
(1)fe0.5co0.5s2的合成:称取1mmolfeso4,1mmolcoso4和10mmol尿素,溶解到30ml二甲基甲酰胺(dmf)和40ml乙二醇(eg)中,然后加入25mmol的硫粉;搅拌一个小时之后,将该悬浊液转移到反应釜中,180摄氏度保持12个小时。将获得的产物用去离子水和乙醇反复清洗三次,然后在60摄氏度真空烘箱中干燥,得到黄铁矿型fe0.5co0.5s2。
(2)以7:1:1:1的质量比分别称取fe0.5co0.5s2,科琴黑,碳纳米管和聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为2mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及0.4mol/lmgcl2-alcl3溶于二甲醚的电解液组装成软包电池。对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为20ma/g。
图2为本发明实施例1-5提供的黄铁矿型化合物的x射线衍射图。图3为本发明实施例1提供的fe0.5co0.5s2的扫描电子显微镜图。图4为本发明实施例1提供的透射电子显微镜图。图5为本发明实施例1提供的透射电子显微镜元素分布图。图6为本发明实施例1提供的fe0.5co0.5s2为正极材料的镁电池的恒流充放电曲线。图7为本发明实施例1提供的fe0.5co0.5s2为正极材料的镁电池的循环性能示意图。图8为本发明实施例1提供的fe0.5co0.5s2为正极材料的镁电池的倍率性能图。图9为本发明实施例1提供的fe0.5co0.5s2为正极材料的镁电池的恒流充放电曲线以及i,ii,iii,iv,v标识,在每个标识处分别进行电子能量损失谱以及x射线光电子能谱的测试,结果如图10-13所示。图10为本发明实施例1提供的fe0.5co0.5s2在图8标记处收集的fel3的电子能量损失谱。图11为本发明实施例1提供的fe0.5co0.5s2在图8标记处收集的col3的电子能量损失谱。图12为本发明实施例1提供的fe0.5co0.5s2在图8标记处收集的sl3的电子能量损失谱。图13为本发明实施例1提供的fe0.5co0.5s2在图8标记处收集的s2p的x射线光电子能谱。从图2可以看出,本发明实施例1-5提供的化合物都具有跟标准黄铁矿fes2和cos2相同的晶体结构,且随着fe含量的增加,x射线衍射峰的位置向右移动,说明晶格间距逐渐变大。从图3可以看出,fe0.5co0.5s2为纳米尺寸的小球颗粒,粒径分布均匀。从图4可以看出,fe0.5co0.5s2的颗粒直径在100-200nm。从图5可以看出,fe0.5co0.5s2中各个元素的分布均匀。通过图6可以看出,放电容量为206mah/g,充电容量为200mah/g。充放电过程没有明显的电压平台,说明黄铁矿fe0.5co0.5s2在镁电池中进行的是一种嵌入式反应。通过图7可以看出,前100圈的容量保持在154mah/g,库伦效率接近100%,说明fe0.5co0.5s2材料具有优异的循环稳定性。从图8可以看出,即使在50ma/g和100ma/g的电流密度下,fe0.5co0.5s2正极仍然能够分别取得154mah/g和101mah/g的容量,说明其具有较好的倍率性能。通过图10可以看出,在放电过程中,fe的价态逐渐降低,在充电过程中逐渐升高,在充电结束时几乎回到初始状态。通过图11可以看出,co的价态在放电过程中逐渐降低,在充电过程中逐渐升高,最后回到初始状态。通过图12可以看出,s的价态在放电过程中逐渐降低,在充电过程中逐渐升高,最后回到初始状态。通过图13可以看出,s的价态在放电过程中逐渐降低,在充电过程中逐渐升高,最后回到初始状态。从图10-13可以看出,镁在嵌入和脱出黄铁矿型fe0.5co0.5s2过程中,阳离子fe和co,以及阴离子s都发生了变价,即阴阳离子共同变价。
下面进一步讨论动力学性能。为了进一步了解黄铁矿型fe0.5co0.5s2样品的反应动力学,使用恒电流间歇滴定技术(gitt)测试样品准平衡态的过电位。在第一个循环中,在每1小时以20毫安/克的放电周期或充电周期后,允许电池在开路下松弛2小时以达到准平衡。恒流间歇滴定法(gitt)测量fe0.5co0.5s2/mg软包电池的准平衡电压分布如图14所示,在20ma/g和室温条件下,每1小时放电或充电后使电池松弛2小时,图中空心点代表平衡开路电位。累积容量在放电时为272毫安时/克,在充电时为258毫安时/克,两者都超过了恒流放电/充电时的容量。在图14的空心点上可以得到一条斜线,图15示出了从gitt得到的fe0.5co0.5s2/mg软包电池在充放电过程中的过电位。在充放电过程中,fe0.5co0.5s2的过电位没有发生很大的变化,说明在镁离子嵌入和脱出过程中,fe0.5co0.5s2的动力学保持稳定。
为了探讨过电位的来源,仔细分析了gitt测量期间电流切断后的动态电位响应,如图16。在放电过程中,可以看到一旦电流被移除,由于电荷转移和欧姆电阻,电压首先跳跃一个小值(0.09伏)。然后它逐渐增加0.29伏,对应于通过离子扩散消除浓度极化,直到它在2小时的弛豫后接近准平衡条件;相反的情况发生在充电过程中。显然,放电和充电过程中的大部分过电位来自于浓差极化,这可能是因为mg2+和主体晶格之间的强共价键作用。
通过图17所示的在第一个循环的gitt测量中的每个2小时弛豫之后获得交流阻抗谱,可以进一步研究黄铁矿型fe0.5co0.5s2的氧化还原机理。在放电和充电过程中,不同氧化程度下的rct值在3k欧姆和3.5k欧姆之间,表明反应过程是高度可逆的。在我们的fe0.5co0.5s2/mg体系中,对称rct是嵌入反应的特征。此外,充电过程中的rct略高于放电过程中的rct,这与gitt脱镁过程的较大过电位相一致。
实施例2
本实施例提供了一种黄铁矿型fe0.7co0.3s2正极材料的制备及性能测试。
(1)fe0.7co0.3s2的合成:称取1.4mmolfecl2,0.6mmolcocl2和10mmol尿素,溶解到30mldmf和40mleg中,然后加入25mmol的硫粉;搅拌一个小时之后,将该悬浊液转移到反应釜中,180摄氏度保持12个小时。将获得的产物用去离子水和乙醇反复清洗三次,然后在80摄氏度真空烘箱中干燥,得到黄铁矿型fe0.7co0.3s2。
(2)以8:1:1的质量比分别称取fe0.7co0.3s2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为1mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及0.25摩尔每升phmgcl-alcl3溶于四氢呋喃的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为20ma/g。
图18为本发明实施例2提供的fe0.7co0.3s2的扫描电子显微镜图。图19为本发明实施例2提供的fe0.7co0.3s2为正极材料的镁电池的恒流充放电曲线。图20为本发明实施例2提供的fe0.7co0.3s2为正极材料的镁电池的循环性能示意图。通过图21可以看出,fe0.7co0.3s2为球状颗粒,尺寸分布在一个较大的范围,从100nm到1000纳米之间。通过图19可以看出,fe0.7co0.3s2放电容量为170mah/g,充电容量为167mah/g。通过图20可以看出,前60圈的容量保持在114mah/g,库伦效率接近100%,说明fe0.7co0.3s2材料具有较好的循环稳定性。
实施例3
本实施例提供了一种黄铁矿型fe0.9co0.1s2正极材料的制备及性能测试。
(1)fe0.9co0.1s2的合成:称取1.8mmolfe(no3)2,0.2mmolcocl2和10mmol尿素,溶解到30mldmf和40mleg中,然后加入25mmol的硫粉;搅拌一个小时之后,将该悬浊液转移到反应釜中,180摄氏度保持12个小时。将获得的产物用去离子水和乙醇反复清洗三次,然后在120摄氏度真空烘箱中干燥,得到黄铁矿型fe0.9co0.1s2。
(2)以6:3:1的质量比分别称取fe0.9co0.1s2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为3mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及0.25摩尔每升phmgcl-alcl3溶于四氢呋喃的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为10ma/g。
图21为本发明实施例3提供的fe0.9co0.1s2的扫描电子显微镜图。图22为本发明实施例3提供的fe0.9co0.1s2为正极材料的镁电池的恒流充放电曲线。图23为本发明实施例3提供的fe0.9co0.1s2为正极材料的镁电池的循环性能示意图。通过图21可以看出,fe0.9co0.1s2大部分为球状颗粒,尺寸在200-500nm之间。通过图22可以看出,fe0.9co0.1s2放电容量为110mah/g,充电容量为107mah/g。通过图23可以看出,前60圈的容量保持在60mah/g。
从实施例1到3,随着钴含量的降低,黄铁矿型硫化物铁钴固溶体的容量逐渐降低,且循环稳定性也在逐渐降低,说明在一定范围内钴含量的增加对于电化学性能有促进作用。
实施例4
本实施例提供了一种黄铁矿型fes2正极材料的制备及性能测试。
(1)fes2的合成:称取2mmolfe(ac)2和10mmol尿素,溶解到20mldmf和50mleg中,然后加入25mmol的硫粉;搅拌一个小时之后,将该悬浊液转移到反应釜中,170摄氏度保持14个小时。将获得的产物用去离子水和乙醇反复清洗三次,然后在100摄氏度真空烘箱中干燥,得到黄铁矿型fes2。
(2)以7:2:1的质量比分别称取fes2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为2mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及1摩尔每升mg(tfsi)2-alcl3溶于乙二醇二甲醚的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为10ma/g。
图24为本发明实施例4提供的fes2的扫描电子显微镜图。图25为本发明实施例4提供的fes2为正极材料的镁电池的恒流充放电曲线。图26为本发明实施例4提供的fes2为正极材料的镁电池的循环性能示意图。通过图24可以看出,fes2呈现分布不均的微米球状颗粒,尺寸在1-5微米之间。通过图25可以看出,fes2的放电容量为35mah/g,充电容量为34mah/g。通过图26可以看出,前60圈的容量保持在18mah/g,说明黄铁矿型fes2的电化学活性较低。
实施例5
本实施例提供了一种黄铁矿型cos2正极材料的制备及性能测试。
(1)cos2的合成:称取2mmolcoso4和10mmol尿素,溶解到10mldmf和60mleg中,然后加入20mmol的硫粉;搅拌一个小时之后,将该悬浊液转移到反应釜中,200摄氏度保持24个小时。将获得的产物用去离子水和乙醇反复清洗三次,然后在100摄氏度真空烘箱中干燥,得到黄铁矿型cos2。
(2)以8.5:0.5:1的质量比分别称取cos2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为5mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及1摩尔每升mg(otf)2-mgcl2溶于二乙二醇二甲醚的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为10ma/g。
图27为本发明实施例5提供的cos2的扫描电子显微镜图。图28为本发明实施例5提供的cos2为正极材料的镁电池的恒流充放电曲线。图29为本发明实施例5提供的cos2为正极材料的镁电池的循环性能示意图。通过图27可以看出,cos2为粒径分布不均的微米球,颗粒尺寸在2微米左右。通过图24可以看出,cos2的放电容量为75mah/g,充电容量为74mah/g。通过图25可以看出,前60圈的容量保持在58mah/g,说明黄铁矿型cos2的电化学活性较低。
实施例6
本实施例提供了一种黄铁矿型fe0.5ni0.5s2正极材料的制备及性能测试。
(1)fe0.5ni0.5s2的合成:称取1mmolfeso4,1mmolnicl2和10mmol尿素,溶解到30mldmf和40mleg中,然后加入20mmol的硫粉;搅拌一个小时之后,将该悬浊液转移到反应釜中,180摄氏度保持24个小时。将获得的产物用去离子水和乙醇反复清洗三次,然后在50摄氏度真空烘箱中干燥,得到黄铁矿型fe0.5ni0.5s2。
(2)以8:1:1的质量比分别称取fe0.5ni0.5s2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为3mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及0.25摩尔每升phmgcl-mgcl2溶于四氢呋喃的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.2-3vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为10ma/g。
实施例7
本实施例提供了一种黄铁矿型mn0.5ni0.5s2正极材料的制备及性能测试。
(1)mn0.5ni0.5s2的合成:称取100mmolmn粉,100mmolni粉,和400mmol的硫粉,置于球磨罐中,密封球磨48小时,得到mn0.5ni0.5s2。
(2)以8:1:1的质量比分别称取mn0.5ni0.5s2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为2mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及0.25摩尔每升phmgcl-mgcl2溶于四氢呋喃的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.2-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为10ma/g。
实施例8
本实施例提供了一种黄铁矿型fe0.9cr0.1s2正极材料的制备及性能测试。
(1)fe0.9cr0.1s2的合成:称取180mmolfe粉,20mmolcr粉,和400mmol的硫粉,置于球磨罐中,密封球磨24小时,得到fe0.9cr0.1s2。
(2)以8:1:1的质量比分别称取fe0.9cr0.1s2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为2mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及1摩尔每升mg(tfsi)2-alcl3-mgcl2溶于四氢呋喃的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为50ma/g。
实施例9
本实施例提供了一种黄铁矿型cu0.5cr0.5s2正极材料的制备及性能测试。
(1)cu0.5cr0.5s2的合成:称取100mmolcu粉,100mmolcr粉,和400mmol的硫粉,置于球磨罐中,密封球磨24小时,得到cu0.5cr0.5s2。
(2)以8:1:1的质量比分别称取cu0.5cr0.5s2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为2mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及1摩尔每升mg(tfsi)2-alcl3-mgcl2溶于四氢呋喃的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为50ma/g。
实施例10
本实施例提供了一种黄铁矿型cu0.5cr0.5se2正极材料的制备及性能测试。
(1)cu0.5cr0.5se2的合成:称取100mmolcu粉,100mmolcr粉,和400mmol的se粉,置于球磨罐中,密封球磨24小时,得到cu0.5cr0.5se2。
(2)以9:0.5:0.5的质量比分别称取cu0.5cr0.5se2,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为2mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及1摩尔每升mg(tfsi)2-alcl3-mgcl2溶于四氢呋喃的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为50ma/g。
实施例11
本实施例提供了一种黄铁矿型zn0.5ti0.5se1.5i0.5正极材料的制备及性能测试。
(1)zn0.5ti0.5se1.5i0.5的合成:称取100mmolzn粉,100mmolti粉,300mmol硒粉,和100mmol碘粉,置于球磨罐中,密封球磨24小时,得到zn0.5ti0.5se1.5i0.5。
(2)以7:2:1的质量比分别称取zn0.5ti0.5se1.5i0.5,科琴黑,聚四氟乙烯,研磨均匀后擀成膜,烘干得到正极极片。其中活性物质的含量为2mg/cm2。
(3)在充满氩气的手套箱中,将正极片,镁箔,以及1摩尔每升mg(otf)2-mgcl2溶于二甲醚的电解液组装成软包电池。并对该电池进行循环伏安测试,扫描电压范围为0.5-2.5vvs.mg/mg2+。然后对该电池进行恒流充放电测试,电流密度为50ma/g。
本发明的黄铁矿型化合物正极材料,利用了过渡金属的d轨道和阴离子的3p轨道杂化,具有很强的共价键,可以同时实现过渡金属阳离子和硫阴离子共同变价,能够取得超过200mah/g的正极容量,且具有较好的容量保持率。
黄铁矿型化合物具有稳定的配体空穴化学,这源于s的3p轨道电子部分进入过渡金属的d轨道,导致硫配体具有比s2-更高的氧化态。初始空的d轨道会被过渡金属价带的电子填充,导致价带顶端出现空穴。高浓度的空穴使两个硫离子凝聚成(s2)2-,产生黄铁矿型化合物。其中过渡金属和硫都具有氧化还原活性,产生阴阳离子共同变价。
除了由阴阳离子共同变价贡献的可预期的高容量,在黄铁矿结构中过渡金属的d轨道和硫的3p轨道高度杂化,在金属和配体单元产生高度离域的电子,有利于容纳镁离子的电荷和提高反应动力学。另外,viii(fe,co,和ni)主族的黄铁矿尤其具有较低的d轨道能够输出更高的工作电压。
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!