正极材料及其制备方法、碱性二次电池与流程
1.本发明涉及化学电池材料领域,特别是涉及一种正极材料,该正极材料的制备方法,以及包括该正极材料的碱性二次电池。
背景技术:
2.碱性二次电池包括镍-镉二次电池、镍-锌二次电池和镍-氢二次电池等,碱性二次电池的正极活性物质为球型氢氧化镍。碱性二次电池的性能在很大程度上受正极活性物质的影响。但氢氧化镍粉末是电绝缘体(也称为低导电性p型半导体),因而缺乏导电性,氢氧化镍颗粒之间以及氢氧化镍与集流体之间存在较大接触电阻,致使氢氧化镍在充放电过程中不能充分反应,影响正极活性物质的利用率和电池正极的放电容量。
3.针对上述技术问题,现有的技术方案包括在氢氧化镍中加入适量的添加剂来提高正极的性能。例如,为了改善高温下的利用率而使钴固溶于氢氧化镍粉末中,或者,为了改善寿命特性而使锌或镁固溶于氢氧化镍粉末中等。出于同时改善高温下的利用率、寿命特性和倍率特性的观点,使用钴或钴的化合物(例如coo、co2o3、co3o4、co(oh)2等)作为添加剂是有效的,所添加的钴或钴的化合物溶解于作为碱性二次电池的电解液的高浓度碱金属氢氧化物溶液中,在充电时被氧化而形成为羟基氧化钴,并包覆在氢氧化镍粒子的表面,由此,体现导电性,形成氢氧化镍粒子间的导电网络。
4.在碱性二次电池的正极添加钴类添加剂的方式主要包括物理掺杂和表面修饰两种。
5.其中,物理掺杂的方法是指直接将钴或钴的化合物与氢氧化镍混合制备正极材料,由于氢氧化镍与钴或钴的化合物均为颗粒状物质,且颗粒大小不均,使得氢氧化镍与钴或钴的化合物的颗粒不容易混合均匀,导致钴或钴的化合物分布不均匀,不能在氢氧化镍颗粒表面形成均匀的导电网络而有效降低氢氧化镍颗粒之间及颗粒与集流体之间的接触电阻,活性材料的利用率较低,不能较大程度地改进电极性能。
6.其中,表面修饰的方法是指在球形氢氧化镍表面均匀包覆一层金属钴或钴的化合物,现有的包覆方法主要有两种:1.利用化学镀的方法在球形氢氧化镍表面包覆钴膜;2.在球形氢氧化镍表面共沉淀包覆co(oh)2,该方法包括调制含钴离子的水溶液及苛性碱水溶液,把氢氧化镍固溶体粒子投入含钴离子的水溶液中,然后缓缓加入苛性碱水溶液,并保持恒定的ph值,同时不断搅拌。其结果是在氢氧化镍固溶体粒子表面析出了co(oh)2,再经过水洗、真空干燥得到包覆有co(oh)2的氢氧化镍固溶体粒子。
7.但现有的表面修饰的方法存在如下技术问题:
8.1.化学镀的方法操作条件非常苛刻,并且需要使用贵金属作为催化剂;
9.2.共沉淀的方法反应条件苛刻,如ph值等条件均需要严格控制,并且在球形氢氧化镍表面包覆的二价钴化合物若不进行后续处理则由于二价钴化合物自身没有导电性且较易溶解,因此需要通过电池的初期充电将其电化学氧化为具有有效的导电网络功能的三价钴氧化物(即β-coooh)才能导电,但是由于电池内的电化学氧化反应不能使二价钴氧化
物完全转变为三价钴氧化物,从而使这种导电网络的导电性能并不完善,氢氧化镍的利用率不高;
10.3.采用共沉淀的方法在球形氢氧化镍表面包覆氢氧化钴后,再在高浓度碱性溶液和氧气条件下通过固体-气体氧化反应将表面包覆的氢氧化钴层氧化为羟基氧化钴(β-coooh和/或γ-coooh),在球形氢氧化镍表面包覆羟基氧化钴后,氢氧化镍电极内阻减小,正极极化减小,从而提高了电极的充电效率、放电深度、以及活性物质的利用率。但该方法存在如下技术问题:(1)包覆氢氧化钴的球形氢氧化镍颗粒需要和碱性溶液进行物理混合成浆液后在氧气氛围中被氧化,因此存在氧化不均匀、以及氧气作为氧化剂难以精确控制氧化程度的问题;(2)细小的颗粒会通过其表面co(oh)2的溶出和羟基氧化钴的再沉积而粘结团聚在一起形成较大的球形氢氧化镍颗粒聚集体,而且碱性溶液还能与空气中的二氧化碳反应生成碳酸盐,碳酸盐在覆羟基氧化钴的球形氢氧化镍的干燥过程中起到粘接剂的作用,也会导致一些球形氢氧化镍细小的颗粒发生团聚,团聚的产生使被羟基氧化钴包覆的球形氢氧化镍颗粒的流动性下降,不容易填充进发泡镍孔隙中,制作的电池极片厚度较厚并且发脆,电池卷绕时容易断片,造成电池短路,不能够装配高容量电池;
11.4.采用共沉淀的方法在球形氢氧化镍表面包覆氢氧化钴后,再通过和碱性溶液以及含有氧化剂的溶液进行混合反应从而在球形氢氧化镍表面包覆羟基氧化钴。但该方法存在如下技术问题:(1)得到的被羟基氧化钴包覆的球形氢氧化镍颗粒作为电池正极存在高温下不稳定的问题,在高温下进行充放电过程中颗粒的包覆层容易还原为可溶的co(oh)2而使得β-ni(oh)2裸露出来,而β-ni(oh)2在高温下过充反应更活跃容易形成不可逆相γ-niooh;(2)该方法容易导致氢氧化镍的包覆层不均匀;(3)通过含有氧化剂的溶液来氧化由氢氧化钴包覆的氢氧化镍时,作为芯材的氢氧化镍的一部分也被容易氧化,生成比较不稳定的氧化氢氧化镍,因此,氢氧化钴包覆的粘合性变得不稳定。
技术实现要素:
12.针对现有技术中存在的技术问题,本发明的目的在于,提供一种正极材料时,该正极材料的包覆层在均匀性、导电性和稳定性上表现优异,该正极材料适宜作为碱性二次电池的正极活性物质。
13.第一方面,本发明提供一种正极材料,该正极材料包括芯材和包覆在芯材表面的包覆层。所述芯材包括氢氧化镍。所述包覆层包括四价钴化合物,并且基于包覆层的重量,所述四价钴化合物的含量不小于45wt%。包覆层中的四价钴化合物具有更高的导电性,且较不易被还原到+2价的钴离子,因为+2价的钴离子在碱液中极易溶解,从而导致导电网络被破坏。因此以本发明提供的正极材料做正极活性材料制作的碱性二次电池的容量更高并且内压更小,该碱性二次电池即使长期过放电、于短路状态下放置,也能够通过充电方式使其容量很好的得到恢复。
14.进一步地,基于所述正极材料的重量,所述正极材料的钴含量优选为2-10wt%的范围。当正极材料的钴含量小于2wt%时,存在包覆层的包覆量不足、包覆效果不佳的问题;当正极材料的钴含量超过10wt%,包覆层对于正极材料的性能提升不明显。
15.进一步地,为了改善用于电池的正极时的电池特性,所述正极材料的包覆层中可以添加作为添加元素的钙(ca)、镁(mg)、锌(zn)等,但是,当包覆层中钴含量小于90wt%时,
无法充分获得包覆带来的导电性的改善。
16.在一实施例中,本发明提供的一种正极材料的包覆层中,除了四价钴化合物以外的钴化合物中钴的化合价为3以上,可获得良好的粘合性和导电性。
17.在一实施例中,芯材为通式:ni
1-x-y
co
x
ny(oh)2(其中,x为0.005-1,y为0.005-1,n为ca、mg、zn中的一种)所表示的氢氧化镍。正极材料的包覆层中包括四价钴化合物,并且基于包覆层的重量,所述四价钴化合物的含量不小于60wt%。
18.相比于现有的包覆有γ-coooh和/或β-coooh的氢氧化镍,本发明提供的正极材料更稳定并且具有较高的电导率。发明人意外发现,本发明提供的正极材料作为碱性二次电池的正极活性物质可以显著抑制碱性二次电池在高温下的容量衰减问题,虽然具体原理尚不清楚,但发明人猜测,原因包括:(1)具有不小于45wt%的四价钴化合物的包覆层扩大了正极材料在在高温下的析氧电位(e
oe
)和氧化电位(eo)的差值(δe
oe
–o);(2)具有不小于45wt%的四价钴化合物的包覆层减缓了正极材料在在高温下的析氧反应速率;(3)具有不小于45wt%的四价钴化合物的包覆层缩小了正极材料在在高温下的氧化电位(eo)和还原电位(er)的差值(δeo–r),以增加反应可逆性,从而减少容量衰减;(4)具有不小于45wt%的四价钴化合物的包覆层含有更多微孔来吸附水,从而减少游离水量。
19.第二方面,本发明提供制备所述正极材料的方法,所述方法包括如下工序:
20.使用共沉淀方法制备前驱体工序,配置含有m离子(m为ca、mg、zn中的一种)、钴离子、镍离子和铵离子的第一溶液,配置含有氢氧根离子的第一碱性溶液,将第一碱性溶液和第一溶液均匀混合,然后收集沉淀物,将沉淀物进行清洗和高温干燥后得到前驱体;
21.包覆工序,配置含有铵离子的第二碱性溶液,配置含有钴离子的第二溶液,将前驱体分散于第二溶液中形成第一悬浮液,然后第一悬浮液在搅拌状态下添加第二碱性溶液,收集沉淀物,将沉淀物进行清洗和高温干燥后得到具有包覆层的颗粒材料,所述包覆层包括α-co(oh)2;
22.氧化工序,配置次氯酸钠溶液,将所述颗粒材料分散于水中形成第二悬浮液,然后第二悬浮液在保持恒温和搅拌状态下边添加次氯酸钠溶液,收集沉淀物,将沉淀物进行清洗和干燥后得到所述正极材料。
23.在制备前驱体工序中,所述第一溶液和所述第一碱性溶液混合,使低浓度的m离子、钴离子以及高浓度的镍离子在碱性条件下转变成为氢氧化物从而得到富集,表面存在由铵离子、水分子和表面氢氧根离子络合反应生产的相关表面化合物。m离子、钴和镍沉淀速度相似。进一步的,所述第一碱性溶液为强碱配置得到的溶液,例如为氢氧化钠溶液,氢氧化钾溶液中的一种,用于沉淀第一溶液中的金属离子。出于降低成本的观点,第一溶液中的金属离子优选来自于硫酸盐(钴离子来自于硫酸钴,m离子来自于硫酸m,镍离子来自于硫酸镍),铵离子优选来自于硫酸铵。若第一溶液中的金属离子来自于氯化盐会导致前驱体中会残留少量的氯离子,氯离子的存在会最终不利于正极材料的电化学性能。第一碱性溶液和第一溶液混合后收集的沉淀物为m、钴、镍富集的氢氧化物沉淀,其主要成分为氢氧化镍。所制备的前驱体中的氢氧化镍具有高的结晶度,因此在所述氧化工序中能显著抑制氧化剂对氢氧化镍进行氧化。
24.进一步的,若m离子为zn离子,所述第一溶液和所述第一碱性溶液混合过程中,通过控制第一碱性溶液加入至第一溶液中的速度以及最终混合液的ph值,来抑制沉淀的氢氧
化锌溶于强碱生成锌酸盐或氢氧化锌和氨水反应生成锌氨络离子。
25.进一步的,所制备的前驱体更能充分发挥掺杂离子改善氢氧化镍固相电子导电性、固相结构稳定性以及固相质子传导特性的功能。采用本发明提供的方法所制备的正极材料,由于显著提高了正极材料中的氢氧化镍的反应性能,能够使之在析氧副反应发生前完成材料的充电反应,有效避免了析氧反应导致的充电库仑效率降低、电池内压升高以及电池发热严重等不良结果的出现,使电池更加安全,能效更高。
26.在所述包覆工序中,能够稳定地确保以α-co(oh)2作为主要成分的包覆的均匀性和粘合性。向所述第一悬浮液供给第二碱性溶液,在机械搅拌作用下使第二碱性溶液呈高度分散状态,从而使第二碱性溶液能够快速地与第一悬浮液均匀混合,实现均匀缓慢地调节混合液的ph值的目的,也使得钴离子生产的氢氧化钴的沉淀反应能够在溶液的三维空间尺度上非常均匀地进行而形成纳米氢氧化钴,不仅有效地控制了氢氧化钴颗粒的大小、氢氧化钴在前驱体(掺杂m和钴的氢氧化镍)表面附着的均匀度,而且非常有利于氢氧化钴快速形成晶体结构。
27.意外发现,包覆工序中得到的表面包覆α-co(oh)2呈现出控制的微晶形貌,将可以使后续的氧化工序过程更易控制、氧化速度更快、氧化更彻底。
28.进一步地,第二溶液中的钴离子来自于钴盐,对于钴盐并不特别限制,只要能够根据ph控制生成α-co(oh)2的水溶性钴盐化合物即可。具体地,优选硫酸钴、氯化钴,更加优选没有卤素引起的污染的硫酸钴。
29.进一步的,向所述第一悬浮液供给第二碱性溶液的过程中,在溶液相中首先生成的是纳米尺度氢氧化钴一次粒子,氢氧化钴粒子在前驱体表面附着后形成的复合材料颗粒为二次纳米颗粒。通过控制第二碱性溶液加入至第一悬浮液中的速度实现了在整个反应溶液中缓慢均匀地调整ph值的目的,使氢氧化钴均匀地包覆在前驱体表面,并且确保生成的氢氧化钴主要包括α-co(oh)2。
30.在所述氧化工序中,通过使用次氯酸钠溶液将所述颗粒材料表面的α-co(oh)2进行氧化得到更高价态的钴化合物,能够显著改善正极材料的电子导电性,并且所得的正极材料的包覆均匀并且包覆层的粘合性更好。通过控制次氯酸钠溶液中次氯酸钠的含量和次氯酸钠溶液加入至第二悬浮液中的速度,来间接控制所获得的正极材料的包覆层中四价钴化合物的含量。
31.进一步的,采用本发明提供的方法所制备的正极材料的包覆层具有多孔结构,使正极材料在充放电过程中具有快速的固相质子传导特性,而且固体多孔正极材料内的液相具有快速离子传导能力,使正极材料在高倍率充放电过程中,既有低的欧姆降,也具有低的反应阻抗,能满足高倍率快速反应的要求。包含该正极材料的碱性二次电池,由于该正极材料的包覆层具有多孔结构使得包覆层含有更多微孔来吸附水,从而减少碱性二次电池的电解液中的游离水量,有利于抑制碱性二次电池在高温下的容量衰减问题。
32.发明人发现,使用上述方法制备的正极材料,其包覆层中四价钴化合物的含量不小于45wt%。
33.本发明提供的制备方法可通过连续方式实施以提高生产效率,但是,为了实现对氢氧化镍实施均匀的包覆,优选通过间歇方式实施。
34.第三方面,本发明提供一种碱性二次电池,所述碱性二次电池的正极活性物质包
括所述正极材料。所述正极材料具有高的导电性和稳定性因此适宜用作要求高输出特性的电动汽车用或混合动力车用的电源所采用的碱性二次电池的正极活性物质,并且所述正极材料通过改善导电性来提高利用率,因此作为要求高容量的便携式电子设备用的电源所使用的碱性二次电池的正极活性物质也极其有效。
附图说明
35.附图对本发明作进一步说明,但附图中的实施例不构成对本发明的任何限制。
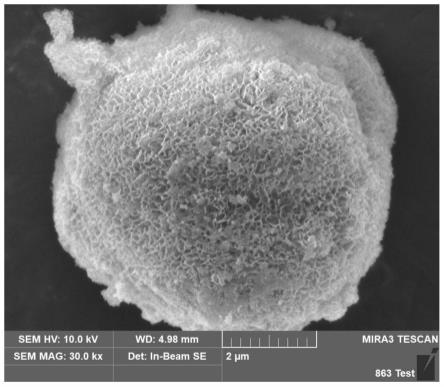
36.图1为实施例1的ftc4的sem图。
37.图2为实施例1的sj18p的sem图。
38.图3为实施例1的ftc4的eds分层图像。
39.图4为ftc4、b04-40-a-b和b05-250-a在10.00k的放大倍数下的sem图。
40.图5为ftc4、b04-40-a-b和b05-250-a在70.00k的放大倍数下的sem图。
41.图6为ftc4、b04-40-a-b、b05-250-a、sj18p、sj18np和sj18的xps分析价态图。
42.图7(a)和图7(b)为循环伏安测试图。
43.图8为半电池(half-cell)常温下的放电容量示意图。
具体实施方式
44.应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
45.发明人对现有的制备氢氧化镍正极材料的技术方案进行研究,得到如下知识:
46.1.现有的制备氢氧化镍的方法主要为液相沉积法,通过在含镍溶液中加入碱使氢氧化镍沉积出来。如果进行掺杂,则是采用镍离子和掺杂离子的混合溶液进行共沉积反应。但在沉积过程所采用的滴加碱液或者是使碱液连续流入反应溶液中的加料方法容易使溶液中局部碱浓度过高,导致因局部沉积速度过快而形成不均匀的不定形体的团聚物颗粒,这种团聚物需要靠后续较高温度及较长时间的陈化过程来说明形成β型晶体结构。而对于掺杂的氢氧化镍材料的制备而言,局部过高的碱浓度也容易造成掺杂元素的沉积分布不均匀,因而掺杂具有的稳定晶体结构、提高固相电子导电性和提高固相质子传导能力的功能特性得不到发挥。制备的氢氧化镍材料存在颗粒大、电子导电性较差、固相质子传导率较低的问题,使得材料的实际利用效率较低,而且高倍率充放电性能差,严重制约了其在高功率型碱性二次电池中的应用;
47.2.现有的共沉淀的方法在氢氧化镍表面制备氢氧化钴包覆层的过程中,当钴离子浓度急剧增大而超过钴离子所存在的悬浮液的ph区域中的临界过饱和度时,即使附近不存在氢氧化镍粒子,在水中也会单独析出氢氧化钴。但是,上述悬浮液的ph值低时,具体地,当ph小于8时,氢氧化钴的析出速度变慢,因此,即使钴离子浓度超过临界过饱和度也可会单独析出氢氧化钴。一方面,当上述钴离子所存在的悬浮液的ph值为8以上时,由于钴离子浓度的临界过饱和度降低,因此,若增加钴离子浓度会容易超过临界过饱和度,其结果,氢氧化钴不附着于氢氧化镍粒子的表面而单独析出。单独析出的氢氧化钴附着于氢氧化镍粒子的表面会导致均匀性差;
48.3.球形氢氧化镍表面包覆有2价钴化合物(主要为氢氧化钴)后使用现有技术进行氧化处理,使得包覆层的2价钴化合物氧化形成现有更高价态的羟基氧化钴,得到的包覆层
的主要成分为β-coooh(β-coooh中钴的+3价的化合价),使用这种正极活性物质碱性二次电池在大电流放电、深度放电、短路等状态下时,往往有正极容量的不可恢复问题,其中的主要原因主要是在进行氢氧化镍的深度放电时,氢氧化镍表面的导电网络物质β-coooh也会进行部分的还原反应,其还原后的2价钴在电池的电解液中会形成钴的络合离子造成钴的溶解,从而引起β-coooh导电网络的不完整;
49.4.球形氢氧化镍表面包覆有2价钴化合物(主要为氢氧化钴)后使用现有技术进行氧化处理,为了使得包覆层的2价钴化合物氧化形成高于+3价的状态的γ-coooh(γ-羟基氧化钴中钴的化合价具有+3价和+4价两种变价,平均价态会大于+3价,其理论化合价高达+3.67价),需要在碱性的条件下使用氧气对氢氧化镍表面包覆的氢氧化钴层进行氧化。但是,氢氧化钴的直接氧化反应会根据周围存在的碱性成分的浓度、粒子细微的受潮和处理时粒子自身的温度、周围的湿度和氧的浓度等条件的不同有较大的变化,存在复杂的反应轨迹,致使部份覆钴层中的钴不会被充分氧化。特别是反应过程中的生成水,会导致氧化中的覆钴球镍易于结块,在后续的洗涤过程中,覆钴层因为粘连而出现破损;
50.5.氢氧化镍的表面包覆氢氧化钴层的氧化反应,不仅受到氧化过程的控制影响;同时,也会受氢氧化钴形成时的技术控制影响,特别是会与和包覆层的表面结晶状态(微晶形貌)密切相关。也就是说,氢氧化钴的微晶形貌对最终氧化生成的包覆层的组分、包覆层的均匀性、完整性以及与基体的结合紧密度有直接影响,进而影响正极材料的大电流放电性能、过放电的恢复性能和循环使用寿命等。
51.6.现有的技术方案中,使用氧气作为氧化剂对表面包覆的氢氧化钴层进行氧化来得到γ-coooh的过程中,存在重新溶解和再重新结晶聚集的过程,具体包括以下反应式:
52.co(oh)2+oh-→
hcoo
2-+h2o(溶解反应)
53.hcoo
2-+1/2h2o+1/4o2→
coooh+oh-(氧化析出反应)
54.如果重新结晶聚集的γ-coooh并没有发生在氢氧化镍粒子的表面,而单独游离在球形氢氧化镍粒子以外,则会直接影响氢氧化镍粒子表面的钴包覆量,进而影响导电网络的均匀性、完整性粒子的电导性。
55.6.现有的技术方案中,有使用其它氧化剂例如次氯酸钠、过硫酸盐等来替代氧气将氢氧化钴氧化成羟基氧化钴,但是,这些氧化剂相较于氧气更容易和氢氧化镍反应生成比较不稳定的氧化氢氧化镍,因此,氢氧化钴包覆的粘合性变得不稳定。
56.现结合具体实施例说明本发明提供的技术方案区别于上述知识的改进处。
57.[实施例1]
[0058]
本实施例提供一种正极材料,该正极材料芯材和包覆在芯材表面的包覆层。所述芯材包括氢氧化镍,所述包覆层包括四价钴化合物,并且基于包覆层的重量,所述四价钴化合物的含量为67wt%。
[0059]
本实施例提供的正极材料的制备方法包括如下步骤:
[0060]
s100,将3.50g的znso4·
7h2o、43.00g的niso4·
6h2o、0.95g的coso4·
7h2o和5.00g的(nh4)2so4溶解在250ml的去离子水中得到第一溶液,配置1n naoh溶液作为第一碱性溶液,以3ml/min的速度将第一碱性溶液添加至第一溶液中,将混合溶液的ph调整至12并且在常温下保持24h(如有必要,使用10n naoh来调整ph值),收集沉淀物,将沉淀物进行清洗后在80℃下干燥12h得到前驱体,标记为sj18p;
[0061]
s200,将10g的(nh4)2so4溶于60ml的去离子水中得到溶液a,将100ml的nh3·
h2o与100ml的去离子水充分混合得到溶液b,将溶液a和溶液b混合得到第二碱性溶液;将37.80g的coso4·
7h2o溶于1000ml的去离子水中得到第二溶液,将约250g的sj18p投入第二溶液中进行搅拌分散15min,形成第一悬浮液;在保持搅拌的状态(搅拌速度为460rpm)下,以1.0ml/min的速度将第二碱性溶液添加至第一悬浮液中,当混合溶液的颜色从绿色变为蓝绿色后控制混合溶液的ph值在8.1
±
0.1范围内,并且控制第二碱性溶液的添加总量为约47ml;老化60min后停止搅拌,收集沉淀物,将沉淀物进行清洗后,在约55℃下干燥12h,得到具有α-co(oh)2作为包覆层的颗粒材料,标记为sj18np;
[0062]
s300,将约3.50g的sj18np投入200ml的去离子水中,在边水浴加热(水浴温度为约55℃)边搅拌(搅拌速度控制在250rpm)下形成第二悬浮液,第二悬浮液保持恒温约55℃的状态;将1.3ml的naclo溶液(naclo的含量为4.5wt%)用9ml的去离子水稀释后,逐滴加入至第二悬浮液中,该添加过程约3min;然后在250rpm的搅拌速度下保持搅拌1h,收集沉淀物,沉淀物进行清洗后在约55℃下干燥12h,得到正极材料,标记为ftc4,产量约为3.5g。
[0063]
ftc4的sem图如图1所示,sj18p的sem图如图2所示,根据图1和图2的对比可以判断,包覆层完全覆盖了sj18p的表面,所制备的正极材料ftc4上看不到sj18p的任何表面结构。ftc4的eds分层图像如图3所示,包覆层的钴元素呈现均匀分布状态,因此ftc4作为电池的正极活性物质时,导电性钴化合物均匀地存在的状态可以充分形成正极材料颗粒间的导电网格,提升正极的利用效率。
[0064]
在步骤s100中,通过控制第一碱性溶液的添加速度,避免了混合溶液中局部碱浓度过高,通过限定第一碱性溶液的添加速度来限定沉积速度从而形成沉积分布均匀的前驱体颗粒,制备的前驱体颗粒大小均匀。通过控制第一溶液中金属离子的组成,并将混合溶液的ph调整并恒定至12,得到的前驱体中氢氧化镍为β型晶体结构并且通过掺杂锌和钴获得稳定晶体结构,该前驱体作为芯材在氧化工序能显著抑制被次氯酸钠氧化。
[0065]
在步骤s200中,第二碱性溶液添加至第一悬浮液的过程中,在混合溶液的ph值低的区域中钴以离子状态存在,但是,随着混合溶液的ph值的上升开始逐渐析出氢氧化钴,此时,若附近存在氢氧化镍粒子时则在能量上更稳定的氢氧化镍粒子的表面上析出氢氧化钴。对混合液的持续搅拌能防止混合溶液中出现钴离子浓度极度变高的区域的状态,控制第二碱性溶液的加入速度和总量能抑制混合溶液中高ph区域的形成。通过控制混合溶液的ph值可以调节氢氧化钴的析出速度,并且发现当混合溶液的ph值在8.1
±
0.1范围内时,前驱体粒子的存在会抑制氢氧化钴的单独析出,并且在前驱体粒子表面上会均匀析出粘合性高的α-co(oh)2,通过ph值范围控制和前驱体粒子的协同作用下影响析出氢氧化钴的微晶形貌.
[0066]
在步骤s300中,第二悬浮液保持恒温约55℃的状态下添加次氯酸钠溶液,其原因在于,当温度小于约50℃时,氧化反应速度降低;当超过60℃时,氧化反应速度过快,因此,对于包覆层的α-co(oh)2氧化不均匀。另外,第二悬浮液的温度,优选在55℃温度范围内保持固定值,且变化幅度是
±
1℃。当温度超过上述变化幅度时,形成的正极材料的包覆层中四价钴化合物的含量会发生变动,因此,可能会使用于电池时的特性不稳定。次氯酸钠作为氧化剂将α-co(oh)2氧化成高价态的钴化合物。次氯酸钠相比于氧气为高价的氧化剂,再基于前驱体包覆α-co(oh)2的特殊结构,因此次氯酸钠能将α-co(oh)2氧化成具有67wt%的四
价钴化合物的包覆层。通过控制次氯酸钠溶液的添加速度,再结合后续的搅拌使α-co(oh)2的氧化变得充分。
[0067]
本实施例所得的正极材料的包覆层中,除了四价钴化合物,还可能含有γ-coooh(其含有的钴为非+4价态)和β-coooh中的至少一种。
[0068]
[实施例2]
[0069]
本实施例提供一种正极材料,该正极材料芯材和包覆在芯材表面的包覆层。所述芯材包括氢氧化镍,所述包覆层包括四价钴化合物,并且基于包覆层的重量,所述四价钴化合物的含量为76wt%。
[0070]
本实施例提供的正极材料的制备方法包括如下步骤:
[0071]
s100,与实施例1中的步骤s100相同,制备sj18p;
[0072]
s200,与实施例1中的步骤s200相同,制备sj18np;
[0073]
s300,将约40g的sj18np投入1200ml的去离子水中,在边水浴加热(水浴温度为约25℃)边搅拌(搅拌速度控制在280rpm)下形成第二悬浮液,第二悬浮液保持恒温约25℃的状态;将1.8ml的naclo溶液(naclo的含量为18wt%)用20ml的去离子水稀释后,逐滴加入至第二悬浮液中,该添加过程约20min;然后在280rpm的搅拌速度下保持搅拌1h,收集沉淀物,沉淀物进行清洗后在约55℃下干燥12h,得到正极材料,标记为b04-40-a-b,产量约40g。
[0074]
[实施例3]
[0075]
本实施例提供一种正极材料,该正极材料芯材和包覆在芯材表面的包覆层。所述芯材包括氢氧化镍,所述包覆层包括四价钴化合物,并且基于包覆层的重量,所述四价钴化合物的含量为74wt%。
[0076]
本实施例提供的正极材料的制备方法包括如下步骤:
[0077]
s100,与实施例1中的步骤s100相同,制备sj18p;
[0078]
s200,与实施例1中的步骤s200相同,制备sj18np;
[0079]
s300,将约250g的sj18np投入3000ml的去离子水中,在边水浴加热(水浴温度为约25℃)边搅拌(搅拌速度控制在260rpm)下形成第二悬浮液,第二悬浮液保持恒温约25℃的状态;将10ml的naclo溶液(naclo的含量为18wt%)用100ml的去离子水稀释后,逐滴加入至第二悬浮液中,该添加过程约20min;然后在260rpm的搅拌速度下保持搅拌1h,收集沉淀物,沉淀物进行清洗后在约55℃下干燥12h,得到正极材料,标记为b05-250-a,产量约250g。
[0080]
图4和图5为ftc4、b04-40-a-b和b05-250-a在在不同放大倍数下的sem图,根据图4和图5可以判断,三种正极材料的包覆层均完全覆盖了sj18p的表面,并且三种正极材料的包覆层均为多孔结构,这使得包覆层含有更多微孔来吸附水,从而减少碱性二次电池的电解液中的游离水量,有利于抑制碱性二次电池在高温下的容量衰减问题。
[0081]
[对比例1]
[0082]
本实施例提供一种正极材料,该正极材料的制备方法包括如下步骤:
[0083]
s100,将约10g的sj18np和约10ml的10n naoh溶液混合得到浆液;
[0084]
s200,将向所述浆液中以3.5l/min的流量吹入4小时的空气,由此将析出的氢氧化钴氧化成羟基氧化钴。此时,相对于包覆中的钴摩尔量,氧供给量的总量为52.0l/mol;
[0085]
s300,使用压滤机进行固液分离,水洗所回收的粉末,再次进行过滤。接着,对于所获得的粉末,通过真空干燥机以120℃温度干燥20小时,由此获得了正极材料,标记为sj18。
[0086]
对实施例1-3提供的正极材料和对比例1提供的正极材料的包覆层进行xps分析,得到的结果如表1所示。
[0087]
表1
[0088][0089]
根据表1的结果可以判断,采用现有的技术方案对包覆有氢氧化钴的氢氧化镍颗粒材料进行氧化处理,得到的包覆层中4价钴化合物含量为24wt%远低于45wt%。因此本发明提供的方法制备的正极材料能获得更高的导电性和更优异的稳定性。
[0090]
对ftc4、b04-40-a-b、b05-250-a、sj18p、sj18np和sj18这些材料的包覆层进行xps分析价态,结果如图6所示(其中b05-250-a材料进行了两次xps分析价态,为了区分,将第二次xps分析价态标记为b05-250-a-2),靠近780.5ev的co 2p3/2峰可以分解成两个拟合峰,分别为780.03ev和781.19ev,结合能为780.03ev的峰可以归于3价钴,而781.19ev的峰可以归于4价钴,co
4+
/co
3+
的比率可以通过整合相应的峰面积来估计。由图6可以判断,本发明提供的方法能获得含有不同co
4+
/co
3+
的比率的包覆层。
[0091]
将ftc4、b04-40-a-b、b05-250-a和sj18这些材料分别作为活性材料制备成工作电极,该过程可通过任一现有技术实现。采用三电极体系(包括hg/hgo作为参比电极、泡沫镍作为对比电极和所述工作电极,电解液采用30wt%的koh溶液),并且采用maccor 4000系列对所述工作电极进行80℃下的循环伏安测试,结果如图7(a)和图7(b)所示。根据图7(a)和图7(b)所示:sj18材料在在80℃下的氧化电位和还原电位的差值的δe
oe
–o=18mv;ftc4材料在在80℃下的氧化电位和还原电位的差值的δe
oe
–o=20mv;b04-40-a-b材料在在80℃下的氧化电位和还原电位的差值的δe
oe
–o=20mv;b05-250-a材料在在80℃下的氧化电位和还原电位的差值的δe
oe
–o=21mv。δe
oe
–o越大则表明该材料在高温下的稳定性越好。
[0092]
将相同质量的ftc4、b04-40-a-b、b05-250-a和sj18这些材料分别作为正极活性材料制备成规格相同的半电池(half-cell),该过程可通过任一现有技术实现。将所述半电池启动(以57.8mah/g的速度充电6小时;以57.8mah/g的速度放电,直到1v的截止电压;重复充电和放电,直到正极被完全启动并达到其最大容量)后测试其在常温(25-30℃)下的放电容量(截止电压为1v),结果如图8所示。根据图8所示,本发明提供的正极材料具有更高的容量,这是因为正极材的包覆层中具有高含量的四价钴化合物,使芯材的ni(oh)2的利用率更高。
[0093]
将相同质量的b05-250-a和sj18分别作为正极活性材料制备成相同规格的500mah的全电池(电池型号为aaa电池)。全电池的负极材料采用储氢材料,全电池的正极为正极活
性材料、氧化钴(coo)和三氧化二镱(yb2o3)按品质比98:1:1配置而成,全电池的电解液为包括氢氧化钠(naoh)和氢氧化锂(lioh)的碱性溶液。将全电池活化后,在室温环境下标定容量(即初始容量),再将满电状态的全电池的两端接2奥姆内后阻置入60℃的高温烘箱中进行14天的高温短路测试,最后再将全电池置于室温下放掉剩余电量后进行充电并测量容量(即高温短路测试后容量)。容量恢复率=(高温短路测试后容量)/(初始容量),容量恢复率越高越好。测试结果如表2所示,说明本发明提供的正极材料提供了较高的电量恢复,使用本发明提供的正极材料的全电池能显著提升高温性能。
[0094]
表2
[0095]
全电池的正极活性材料60℃14天短路测试后电量恢复b05-250-a66%sj1853%
[0096]
由于本发明的正极材料具有高导电性,因此,作为碱性二次电池的正极活性物质的利用率高且适宜作为要求高容量的便携式电子设备用的电源。另外,也适宜作为要求高输出特性的电动汽车用。
[0097]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0098]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1