杂交种马铃薯育种的制作方法
本申请是申请日为2012年04月20日,申请号为201280031056.2,发明名称为“杂交种马铃薯育种”的分案申请。本发明涉及农业领域,尤其涉及新型植物及用于获得该新型植物的工序。本发明还涉及用于改善农作物的基因组成的方法,且涉及由该方法获得的植物。本发明进一步涉及用于生产杂交种子的方法,且涉及由该方法生产的杂交种子,且涉及使用本发明的杂交种子生产作物的方法。
背景技术:
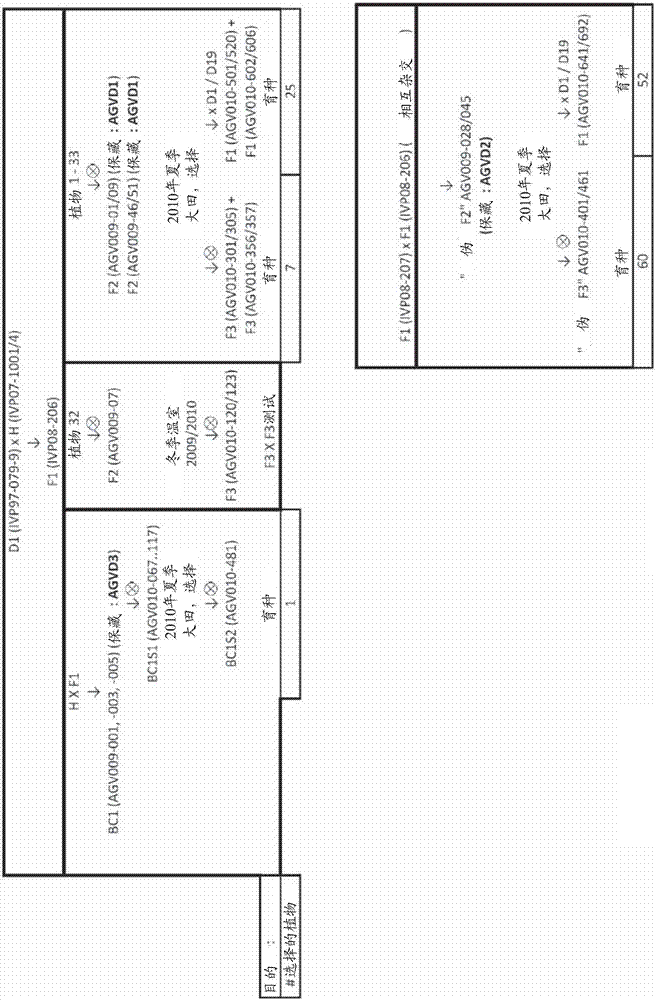
:马铃薯(solanumtuberosuml.)是全球粮食系统的基本部分。它是世界上第一位的非谷物粮食商品,在2007年具有达记录325000000吨的产量。与其它主要的大田作物不同,马铃薯是从其它马铃薯繁殖生长的。因此,留出每年一部分的作物(从5%至15%的范围,依赖于收获的块茎的质量)用于在下一种植季节中使用。在发展中国家,大部分农民选自且储存他们自己的种子块茎。在发达国家,农民更有可能从制定供应商处购买无病的“合格种子”。种用马铃薯比谷物或脉冲种子(pulseseed)更难以生产和供应。与玉米的1:400或番茄的1:10000相比,马铃薯的种子:收获量的比率为1:20被认为是好的。因此,与玉米的18kg相比,一公顷可能需要两顿的种料以最大化可收获的产物的产量。为了打破休眠,种用马铃薯应在它们可以种植之前储存几个星期。在储存过程中的正确条件(如光量、温度和湿度)对确保良好的“种子”质量起到至关重要的作用。除了不理想的种子:收获量的比率之外,种用马铃薯引起且转运害虫(pest)和疾病。这包括(其中包括)晚疫病菌、安第斯马铃薯甲虫、线虫、块茎蛾和病毒。后者在田间通过蚜虫传递,且然后在种子被一代接一代地携带。这样的病毒感染可以降低高达20%的产量。因为在主要种子生产区至主要消费品生产区之间的距离遥远,且各种用马铃薯块茎具有较沉的重量,因此种用马铃薯具有高转运费用。为了满足现在和将来逐渐增长的世界人口,马铃薯产业必须保持增殖以满足消费者的需要。基础研究和开发工作致力于使大田种植和收获及马铃薯的加工现代化,且开发经济有利的马铃薯品种。通过马铃薯杂交,研究者希望获得具有用于新鲜消费以及用于产业用途的良好加工、高可溶的固体含量、高产量、对疾病和害虫具有抗性及能够适应各种生长地区和条件的期望特征的马铃薯。导致产生与上述有利特征结合的马铃薯品种的研究主要以经验为依据。该研究需要投入大量的时间、人力和金钱。马铃薯栽培品种的开发可以经常花费八年或更长的时间,然后进行至少五年的培植以得到足以用于商业用途的数量。育种从仔细选择较好的植物以将最重要的特征并入后代中。由于所有期望的性状通常不显现在一世代中,因此育种是连续选择最佳结合(结合原种的良好性状)的过程。当理解了马铃薯的遗传学时,能最好理解产生马铃薯新型品种的艰苦工作。商品化马铃薯具有四倍体的基因组。二倍体的块茎对于重要的商业应用来说通常太小。此外,四倍体基因组是极端杂合型的,每一基因座均含有多个等位基因。据信主要在二倍体水平上经历的自交不亲和性,及近交衰退是造成维持在马铃薯中发现的高遗传变异性的原因,且据信杂合的等位基因的超显性(杂种优势)产生茁壮的植物。在两个无关的亲本之间的杂交所获得的典型的马铃薯后代中,有害的同位基因由此可能在纯合性的情况下有助于适合度下降,或在杂合性的情况下有助于增强活力。很明显,培植者需要大量种群以最大化发现携带相对大量的杂合性基因座及少量纯合性基因座,同时还显示出农艺学上所期望的性状的有益组合的个体的机会。现在的马铃薯育种技术依赖于自身是综合预杂交开发的结果的亲本克隆(parentalclone)的受控杂交,在该过程中除了其它技术之外,还应用了特定的技术(如染色体加倍、种胚挽救(embryorescue)及体细胞融合)以将例如野生型和原生型茄属植物的有益特征引入这些克隆中。然后,使在表型选择程序之后发现适用于进一步育种的亲本材料相互杂交,且得到的不一致的杂交种子被大量播种在温室中。从成千上万的个体f1中收获幼苗块茎,且保持该幼苗块茎用于下一年栽培。下一年,来自每一得到的幼苗的单个“种子”块茎被种植在大田中。必须极其谨慎以避免引入病毒和疾病,因为材料在它几年后被卖给个体消费者之前仅被无性繁殖(clonally)(植物性)扩增。在第二年后,取出块茎的样品进行密度测量和初步油炸测试(preliminaryfrytest)以确定块茎用于商业用途的适合性。然后,已经从选择过程中幸存下来至这一点的众多植物的块茎被种植三年,用于综合性更高的系列油炸测试和密度测定。在开发的第四年阶段,递减数量的幸存的选择以始终扩增的量进行生长,且对其植物进行几个阶段的大田试验以确定它们对不同生长条件的适合性。最后,具有优秀农业学质量的品种被转移至其它农场,且“种子”(以块茎的形式)被增加至商业规模。由于一个“种子”块茎可产生6至20个之间的收获的块茎,该放大的过程可能花费几年以产生足够的“种子”。通常,到这个时候,已经在尝试开发新型和改良的马铃薯栽培品种中投入了8年或更长时间进行种植、收获和测试。为了降低近交衰退,培植者可以引入来自遗传学上相隔更远的具有从四倍体至六倍体范围的多倍性的亲本(如从野生型和原生型品种)的新基因。但是,当两株遗传学上没有联系的马铃薯植物杂交时,杂合性水平可以增加,但同时还引入了更加有害的基因。因此,培植者应典型地与更商品化的种质进行杂交以富集含有利等位基因的种群。同时,这样的多次杂交育种的程序可能进行几十年,如在每一世代中选择有利基因型可能已经进行了五年。因此,当前马铃薯育种是以经验为主的活动,特别具有试验和错误的特征。马铃薯及其有联系的野生型品种(结出块茎的茄属植物)是最多的远交交配,因为配子体自交不亲和系统阻碍了自受精。自交不亲和(si)是被子植物中几种遗传机制的通用名称,si防止了自受精和近亲交配。在具有si的植物中,当在植物中产生的花粉粒达到同一植物或具有相似基因型的另一植物的柱头时,花粉萌发、花粉管生长、胚珠受精和种胚发育在它一个阶段处被停止,且随后不会产生种子。在四倍体马铃薯中没有发现自交不亲和。这样的自交亲和的克隆的供应可以促进马铃薯的自花传粉的后代的产生,且由此产生(高)纯合的马铃薯品系。这样可以提供极好的机会以在马铃薯中开发纯合的优秀育种品系。但是,到目前为止,开发具有遗传固定的农艺学上期望性状的纯合的优秀育种品系还没有成功,该优秀育种品系将能够产生遗传上一致的杂交马铃薯种子。提供纯合的良种品系被未知的原因阻碍。偶尔遇到的自交亲和克隆的自交导致杂合度比理论上所预期的更慢的速度降低。在显示更高活力、能育性和种子萌发的后代中,杂合度更慢的下降可以是在杂合植物的自交过程中的无意但不可避免的选择结果。这暗示,如杂合度通过自交降低,能育性和活力也降低,且植物可变得弱小且完全不育。该情况可能由于隐性有害基因的纯合配置的建立而变得更坏。这种现象(通常被称为近亲交配衰退)已经大大阻碍了纯合马铃薯品系的开发,且由此阻碍了一致杂交马铃薯种子的产生。由于近交衰退,具有不利于在马铃薯中产生纯合育种品系的损害。uijtewaal等.(euphytica36(1987)745-753)示出归因于不育的问题,纯合马铃薯克隆对于实际育种不是很重要。考虑了开发纯合近交品系,但在马铃薯中不可能(umaerus,1987,第10届欧洲马铃薯研究协会的会议记录(proceedingofthe10thtriennialconferenceoftheeuropeanassociationofpotatoresearch),奥尔堡,丹麦,pp72–103,如在almekinders等.2009potatoresearch52:275–293中所引用的)。涉及单倍体加倍的途径已经长时间推测为是有希望的。但是,直到今天,流行的观点是双倍体马铃薯中的近亲衰退太强大,从而不能得到有活力的纯化植物。birhman和hosaka(genome43:495–502(2000))已经建议利用来源于s.chacoense的sli基因用于开发高度纯合真实的马铃薯种子(tps)品系和进行马铃薯杂种优势育种的可能性。但是,到目前为止,还没有报道来自该研究的推荐品系的具有良好农艺学性状(如良好的块茎产量)的纯合品系。准确地说,已经产生的那些纯合体不显示任何农艺学相关的块茎产量。由于努力改善该作物的产量和质量被近交衰退所阻碍的事实,rommens在2010年(植物的遗传修饰(geneticmodificationofplants),kempen&jung,编辑在biotechnologyinagricultureandforestry64(1):61-77(2010)中)主张遗传转化的途径。简单讲,认为产生马铃薯的真实的育种品系是不可能的。由于这个事实,马铃薯育种不可能逃脱基于四倍体杂合体杂交的传统方案。结果,挑战被认为是难以克服使各种利用性状(与新型和加工使用(processinguse)有关)、对病原体和害虫具有抗性、及在产量上具有改善的其它相关的农艺学性状与商业上可接受的栽培品种相组合(douches等.1999,cropscience36(6):1544-1552)。本发明的目标是提供用于产生马铃薯优秀育种品系和用于产生从中可以生长显示农艺学上相关块茎产量的植物的一致的杂交马铃薯种子的手段和方法。技术实现要素:本发明人曾试图通过多条路线实现用于马铃薯生殖增殖的纯合亲本育种品系,但没有一条路线成功。这些失败路线包括雄核发育、雌核发育、使单倍体加倍和连续自交。只有使包括来源于s.chacoense的sli基因的自交亲和的植物重复自交并使用时,发明人才得到了本发明的产品。现在本发明提供了如在所附权利要求中所引用的方法和植物。本发明在第一方面提供了一种二倍体、能育的、自交亲和且基本纯合的马铃薯品系,该马铃薯品系包括具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物。具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物在本文中也被一般地称为有活力(vigorous)的植物。在优选实施方案中,所述品系除所述块茎产量之外还包括至少一个、更优选至少2、3、4、5或6个(附加的)农艺学期望的性状。优选地,所述农艺学期望性状选自由昆虫耐性、线虫抗性、疾病抗性(包括但并不限于对粉痂病(powderyscab)、丝核菌(rhizoctonia)、银屑病(silverscurf)、晚疫病菌(phytophthorainfestans)、链霉菌(streptomycesspp)导致的疮痂病(scab)的抗性)、除草剂耐性、耐寒性、耐旱性、耐湿性、耐干腐和湿腐性、耐盐性及对低温糖化的抗性所组成的组。在本发明所述马铃薯品系的另一优选实施方案中,所述品系的植物成熟时达到枝叶和芽的平均鲜重为单株植物至少500克。枝叶和芽的平均鲜重达到单株植物至少500克的植物在此也被一般地称为有活力的植物。另一方面,本发明提供一种如上所述的根据本发明的品系的植物。优选地,所述植物是二倍体、能育的、自交亲和且基本上纯合的植物,且具有以每株植物至少200克鲜重的克数表示的平均块茎产量。另一方面,本发明提供一种如上所述的植物的种子。所述种子可以是纯合的(即表示自交的种子),对亲本不同的等位基因来说也可以是杂合的。在一个实施方式中,所述种子优选为一致的杂种马铃薯种子。该一致的杂种马铃薯种子是如上所述的根据本发明的品系(优选两个不同品系)中的两个纯合的、自交亲和的、能育且有活力的植物之间杂交的结果,其中所述品系包含通过分子标记物检验可确定的至少20%的相对的纯合的基因座(contrastinghomozygousloci)。另一方面,本发明提供一种用于产生二倍体、能育的、自交亲和且基本纯合的马铃薯品系的方法,所述马铃薯品系包括具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物,所述方法包括:(a)提供第一马铃薯植物,所述第一马铃薯植物是二倍体、自交亲和的、能育的且基本纯合的第一马铃薯品系的植物;(b)提供第二马铃薯植物,其中所述第二马铃薯植物是可具有任何纯合水平的二倍体或四倍体马铃薯品系的植物,所述第二马铃薯植物的品系包括具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物;(c)使所述第一马铃薯植物和第二马铃薯植物异花授粉以提供种子,且收集所述种子从而提供杂种后代种子形式的后代;(d)使所述杂种后代种子长成杂种后代马铃薯植物的种群,且从以每株植物至少200克鲜重的克数表示的产量产生块茎的所述种群的植物中进行选择;以及(e)使所述杂种后代马铃薯植物自交或使所述杂种后代马铃薯植物与所述第一马铃薯植物的品系的马铃薯植物回交,进行1至8次自交或回交,从而提供二倍体、自交亲和且基本纯合的马铃薯育种品系,该二倍体、自交亲和且基本纯合的马铃薯育种品系具有以每株植物至少200克鲜重的克数表示的平均块茎产量。本文所述方法中的第一马铃薯植物优选为二倍体、自交亲和、能育且基本纯合的第一马铃薯品系的植物,其中所述自交亲和性受到s基因座(自交不亲和基因座)抑制基因(s-locusinhibitorgene,sli)的显性等位基因存在的控制,其中sli基因座抑制基因是如hosaka和hanneman(1998euphytica,99:191–197)描述的s基因座的非等位基因。当以足够大的规模(至少超过10000株植物)且使用适当的第二马铃薯植物实施上述方法时,且该第二马铃薯植物优选为基本不纯合的二倍体马铃薯克隆,所述第二马铃薯植物的品系包括具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物,优选如在下文实例中所述的ivpaa-096-18(d2)的品系,该第二马铃薯植物的品系会生产出基本纯合的、能育的、有活力且自交亲和的育种品系,其中所述活力尤其以每株植物至少200克鲜重的克数表示的平均块茎产量表示。提供这样的育种品系是提供基因上纯合的真正马铃薯种子(tps)过程中的关键步骤。当第一育种品系和第二育种品系均包括农艺学期望特征,具有良好的一般配合力(generalcombiningability),且优选具有通过分子标记物检验可确定的至少20%的相对的纯合的基因座时,第一育种品系和第二育种品系随后可用于产生tps。在根据本发明的产生二倍体、能育、自交亲和且基本纯合的马铃薯品系的所述方法的优选实施方案中,重复所述步骤a-e,其中步骤b包括提供第三(或其它的)马铃薯植物,其中所述第三马铃薯植物是具有任意纯合性水平的二倍体或四倍体马铃薯品系的植物,其中所述第三马铃薯植物是额外的农艺学期望性状的供体。优选地,所述性状选自由昆虫耐性、线虫抗性、疾病抗性(包括但并不限于对粉痂病、丝核菌、银屑病、晚疫病菌、链霉菌导致的疮痂病的抗性)、除草剂耐性、耐寒性、耐旱性、耐湿性、耐干腐和湿腐性、耐盐性及对低温糖化的抗性,或本文所述的任何其他农艺学有益的性状或期望的特征所组成的组中。上述第二马铃薯植物或第三马铃薯植物可适当地选自下列实例3的表6中所列的植物d1~d21的二倍体马铃薯克隆。技术人员应理解也可使用其它二倍体马铃薯克隆。非常优选的是使用马铃薯克隆ivpaa-096-18(d2),其可从荷兰瓦赫宁根大学的植物育种实验室(laboratoryofplantbreeding(ivp),wageningenuniversity,droevendaalsesteeg1,6708pbwageningen,thenetherlands)的irronaldb.c.hutten博士处获取。四倍体栽培品种的适当(商品化)来源是欧洲栽培马铃薯数据库(europeancultivatedpotatodatabase,ecpd)(http://www.europotato.org/menu.php),和/或专家组植物育种的马铃薯谱系数据库(与荷兰瓦赫宁根大学植物育种实验室(laboratoryofplantbreedingofwageningenur,thenetherlands)之间的合作),以及荷兰瓦赫宁根国际植物研究所的生物多样性及育种业务单位(pri)(http://www.plantbreeding.wur.nl/potatopedigree)。在所述方法的另一优选实施方式中,所述第一马铃薯植物是马铃薯品系ncimb41663、ncimb41664、ncimb41665或ncimb41765的植物,所述品系的代表性种子保藏于苏格兰阿伯丁的英国食品工业与海洋细菌菌种保藏中心(ncimb)。在所述方法的另一优选实施方式中,所述第二马铃薯植物是二倍体、能育、自交亲和且基本纯合的第二马铃薯品系的植物。在所述方法的再一优选实施方式中,所述第二马铃薯植物是二倍体、能育且自交亲和的第二马铃薯品系的植物。用于产生二倍体马铃薯育种品系的方法可进一步包括:通过互交、自交及回交增强二倍体马铃薯育种品系的育种价值,并针对农艺学期望性状进行连续选择的步骤。进行试验杂交以评价一般配合力(互交能力)。另一方面,本发明提供了一种通过上述本发明的方法获得的二倍体马铃薯育种品系,更优选为良种品系。另一方面,本发明提供了一种杂种马铃薯种子,所述杂种马铃薯种子是由上述根据本发明的第一二倍体马铃薯育种品系的植物和第二二倍体马铃薯育种品系的植物杂交获得,其中通过分子标记物检验确定所述第一二倍体马铃薯育种品系和所述第二二倍体马铃薯育种品系的植物包含至少20%的相对的纯合的基因座。另一方面,本发明提供了一种用于产生一致的杂种马铃薯种子的方法,包括:(a)提供第一马铃薯植物,其中所述第一马铃薯植物是二倍体、能育、自交亲和且基本纯合的第一马铃薯品系的植物,(b)提供第二马铃薯植物,其中所述第二马铃薯植物是二倍体、能育、自交亲和且基本纯合的第二马铃薯品系的植物,其中通过分子标记物检验确定所述第一植物和第二植物包含至少20%的相对的纯合的基因座,(c)使所述第一马铃薯植物和第二马铃薯植物进行异花授粉,且允许所述亲本植物中的一株产生具有种子的浆果,并从所述浆果中收集所述种子以提供杂种后代种子形式的后代。在用于产生杂种种子的方法的优选实施方式中,所述第一马铃薯植物和第二马铃薯植物源自包括具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物的马铃薯品系,优选其中所述第一马铃薯植物和第二马铃薯植物是块茎产量为每株植物至少200克鲜重的植物。在产生杂种种子的方法的另一优选实施方式中,所述第一马铃薯植物和第二马铃薯植物中的至少一个包括至少一种农艺学期望的性状,所述农艺学期望的性状优选选自由昆虫耐性、线虫抗性、疾病抗性(包括但并不限于对粉痂病、丝核菌、银屑病、晚疫病菌、链霉菌导致的疮痂病的抗性)、除草剂耐性、耐寒性、耐旱性、耐湿性、耐干腐和湿腐性、耐盐性及对低温糖化的抗性所组成的组中。在根据本发明的用于产生杂种种子的方法的另一优选实施方式中,所述第一马铃薯品系是含有sli基因的、二倍体、自交亲和且基本纯合的后代马铃薯植物,优选其中所述第一马铃薯植物是马铃薯品系ncimb41663、ncimb41664、ncimb41665或ncimb41765的植物,或是所述植物的二倍体、自交亲和且基本纯合的后代马铃薯植物,所述品系的代表性种子保藏于苏格兰阿伯丁的ncimb。在根据本发明的用于产生杂种种子的方法的另一优选实施方式中,所述第二马铃薯植物是二倍体、自交亲和且基本纯合的第二马铃薯品系的植物,优选包括至少两个农艺学期望的性状,所述农艺学期望的性状选自由昆虫耐性、线虫抗性、疾病抗性(包括但并不限于对粉痂病、丝核菌、银屑病、晚疫病菌、链霉菌导致的疮痂病的抗性)、除草剂耐性、耐寒性、耐旱性、耐湿性、耐干腐和湿腐性、耐盐性及对低温糖化的抗性所组成的组中。另一方面,本发明提供了一种马铃薯品系ncimb41663、ncimb41664、ncimb41665或ncimb41765的种子,所述品系的代表性种子保藏于苏格兰阿伯丁的ncimb。另一方面,本发明提供了一种通过本文所公开的用于产生一致的杂种马铃薯种子的方法所产生的种子。另一方面,本发明提供了一种由本发明的种子长成的杂种马铃薯植物或其一部分。另一方面,本发明提供了一种本发明的杂种马铃薯植物的花粉或胚珠,或其一部分。另一方面,本发明提供了一种来自本发明的杂种马铃薯植物的块茎。另一方面,本发明提供了一种具有由本发明的种子长成的杂种马铃薯植物的所有生理和形态特征的马铃薯植物。另一方面,本发明提供了一种本发明的杂种马铃薯植物的组织培养物。另一方面,本发明提供了一种由本发明的组织培养物再生得到的马铃薯植物,其中所述再生得到的马铃薯植物具有由本发明的种子长成的杂种马铃薯植物的所有生理和形态特征。另一方面,本发明提供了一种用于产生杂种马铃薯种子的方法,其中所述方法包括使第一马铃薯植物与第二马铃薯植物杂交,并收获得到的杂种马铃薯种子,其中所述第一亲本马铃薯植物和/或第二亲本马铃薯植物是根据本发明的二倍体、能育、自交亲和且基本纯合的植物,该植物具有以每株植物至少200克鲜重的克数表示的平均块茎产量。另一方面,本发明提供了一种产生杂种马铃薯植物的方法,所述方法包括根据本发明的方法产生种子并使所述种子长成马铃薯植物。另一方面,本发明提供了一种通过本发明的方法产生的马铃薯植物,或其块茎。另一方面,本发明提供了至少4种可互交的、纯合的、二倍体、能育、自交亲和且基本纯合的马铃薯品系的方法组,所述马铃薯品系包括根据本发明的具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物,其中每个所述品系与所述组中的另一个品系的不同之处在于具有根据分子基因标记物检验可确定的至少20%的相对的纯合基因座。本发明还提供了作为本发明上述方法的实施方式的方法,包括以下步骤:(a)提供第一马铃薯植物,所述第一马铃薯植物是二倍体、自交亲和且基本纯合的第一马铃薯品系的植物,且所述第一马铃薯品系的植物携带具有要在后代中表现出来的农艺学期望性状的等位基因的染色体,(b)提供第二马铃薯植物,其中所述第二马铃薯植物是二倍体、自交亲和且基本纯合的第二马铃薯品系的植物,且所述第二马铃薯品系的植物携带具有要在后代中表现出来与所述第一植物的性状不同的农艺学期望性状的等位基因的染色体,(c)使所述第一马铃薯植物和第二马铃薯植物进行异花授粉,使得所述亲本植物中的一个亲本植物产生具有种子的浆果,并从所述浆果中收集所述种子以提供杂种后代种子形式的、携带具有所述等位基因的染色体组合的后代。因此,在可选择的实施方式中,第一马铃薯品系的植物可携带具有要在后代中表现出来的农艺学期望性状的等位基因的染色体,在这种情况下,第二马铃薯品系的植物的农艺学期望性状可不同于所述第一植物的性状。另一方面,本发明提供了一种产生抗除草剂、抗线虫、抗昆虫和/或抗病的马铃薯植物的方法,所述方法包括根据上述的本发明方法通过使抗除草剂、抗线虫、抗虫和/或抗病的亲本品系杂交从而产生种子,并使所述种子长成马铃薯植物。另一方面,本发明提供了一种通过上述的本发明方法所产生的抗除草剂,抗线虫,抗昆虫和/或抗病的马铃薯植物。另一方面,本发明提供了一种防止病毒感染在马铃薯的世代之间传播的方法,包括:(a)提供第一马铃薯植物,其中所述第一马铃薯植物是第一二倍体、自交亲和且基本纯合的马铃薯品系的植物;(b)提供第二马铃薯植物,其中所述第二马铃薯植物是具有任意倍性和/或任意纯合水平的马铃薯品系的植物,所述第二马铃薯植物携带具有要在后代中表现出来的农艺学期望性状的等位基因的染色体;(c)使所述第一马铃薯植物和第二马铃薯植物进行异花授粉,使得所述亲本植物中的一个亲本植物产生具有种子的浆果,并从所述浆果中收集所述种子以提供杂种后代种子形式的携带具有所述等位基因的染色体的后代;(d)使所述杂种后代种子长成携带具有所述等位基因的染色体的杂种后代马铃薯植物;(e1)从所述杂种后代马铃薯植物收获块茎以提供表现出所述性状的块茎;(e2)使所述杂交后代马铃薯植物自交或使所述杂交后代马铃薯植物与所述第一马铃薯植物的品系的马铃薯植物回交,从而进一步提供携带具有所述等位基因的染色体的后代植物,其中所述后代植物在每次回交或自交步骤之后逐渐增加纯合性。另一方面,本发明提供了一种二倍体、能育、自交亲和且基本纯合的马铃薯品系,所述马铃薯品系包括具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物,所述植物通过以下方式获得:(a)提供第一马铃薯植物,其中所述第一马铃薯植物是第一二倍体、能育、自交亲和且基本纯合的马铃薯品系的植物,(b)提供第二马铃薯植物,其中所述第二马铃薯植物是具有以每株植物至少200克鲜重的克数表示的平均块茎产量的二倍体马铃薯品系的植物,(c)使所述第一马铃薯植物和第二马铃薯植物进行异花授粉,允许所述亲本植物中的一个亲本植物产生具有种子的浆果,并从所述浆果中收集所述种子以提供杂种后代种子形式的后代,(d)使所述杂种后代种子长成杂种后代马铃薯植物,(e)使所述杂种后代马铃薯植物与所述第一马铃薯植物的品系的马铃薯植物回交,且从后代植物中进行选择,从而生成二倍体、自交亲和且有活力的植物,因为该植物以每株植物至少200克鲜重的克数表示的产量产生块茎,(f)使所述二倍体、自交亲和且有活力的植物自交1至8次,同时针对(e)中所述的自交亲和和活力进行选择。另一方面,本发明提供了一种杂交马铃薯种子,播种时该马铃薯种子产生具有以每株植物至少200克鲜重的克数表示的平均块茎产量的二倍体、能育、自交亲和且基本纯合的马铃薯植物,所述植物通过以下方式获得:(a)提供二倍体、能育、自交亲和且基本纯合的第一马铃薯品系,所述第一马铃薯品系包括具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物,(b)提供二倍体、能育、自交亲和且基本上纯合的第二马铃薯品系,所述第二马铃薯品系包括具有以每株植物至少200克鲜重的克数表示的平均块茎产量的植物,其中通过分子标记物检验确定所述第一植物和第二植物包含至少20%的相对的纯合的基因座,(c)使所述第一马铃薯植物和第二马铃薯植物进行异花授粉,允许所述亲本植物中的至少一个亲本植物产生具有种子的浆果,并从所述浆果中收集所述种子以提供杂种后代种子形式的后代。选择或提供纯合植物的步骤,或选择或提供含有本文所定义的至少20%的相对基因座的植物的步骤,可以包括利用本文提供的分子基因标记物进行标记物辅助选择。附图说明图1示出了利用本发明的方法和植物来开发杂种马铃薯栽培品种的开发方案的示意图,其中示出了获得商品化规模的马铃薯杂交种的各个步骤:0,马铃薯种质:起源原则上包括种植的马铃薯物种(solanumtuberosum)及相关的可杂交物种中的所有马铃薯基因型;1,自交亲和的二倍体马铃薯:种植的马铃薯(solanumtuberosum)通常为自交不亲和马铃薯。从相关物种引入自交亲和性(例如参见hermsen,j.g.th.1978,euphytica27,1-11);2,纯合、能育、自交亲和的二倍体马铃薯:可通过花药培养(jacobsen和sopory,1977,theor.appl.genet.52,119-123),通过胚珠培养或通过重复自交(phumichai&hosaka,2006,euphytica149,251-258)使单倍体加倍(uijtewaal等,1987,theor.appl.genet.73,751-78),来获得纯合二倍体,本文阐述了重复自交的实例;3,有活力的、能育、纯合、自交亲和的二倍体马铃薯:通过与其他二倍体马铃薯杂交、自交及回交并选择较高活力的个体,来提高活力;4,二倍体马铃薯育种品系:通过与其他二倍体马铃薯杂交、自交及回交并选择具有农艺学期望性状的个体,来引入这些性状;5,优秀的二倍体马铃薯育种品系:通过互交、自交及回交并连续选择具有农艺优良性状的个体,来提高育种价值。进行试验性杂交以评价一般配合力;6,马铃薯杂交栽培品种:对良好的配合育种品系进行杂交,获得的种子为一致的杂种真正马铃薯种子。图2示出了实例中所述种群,保藏及植物的系谱的示意图,从二倍体、基本纯合且自交亲和的马铃薯植物(“h”)与三种不同二倍体克隆(d1、d2和d3)之间的杂交开始,其中所述二倍体克隆基本上非纯合且自交不亲和且充当一个或多个期望农艺学性状的供体品系。从回交品系至全自交克隆产生一系列基本纯合的品系,每个品系均具有一个或多个源自供体品系的期望性状,从而提供一组用于产生一系列杂种种子形式的杂种马铃薯栽培品种的优良育种品系。表示自交。如图可看出,并如实例中详细描述的,只有供体品系d2得到了表现如本文所述活力的自交亲和植物的大量产生。有活力的植物可从其他杂交组合获得,但频率会很低(0.1-1%)。图3显示了二倍体育种克隆rh89-039-16的基因组的超密基因连锁图谱(ultra-densegeneticlinkagemap)。连锁群左边的数字是从顶部开始计算的重组事件的累积次数。每个框(bin)中的aflp(随机扩增长度多态性)标记物的数量用根据图例的灰色阴影表示。推定的着丝粒位置用染色体旁边的“cen”表示(vanos等,2006genetics173(2):1075-1087)。连锁群右边的数字表示本文所用的对应的potsnp标记物的大体位置,其中参照下列实例3中的表5b获取标记物的注解。附图清楚地显示提供信息的标记物在该克隆的马铃薯基因组上的分布。利用本文所用的另一克隆sh83-92-488观察这些标记物的类似分布。图4示出了100种标记物在20种不同二倍体马铃薯基因型上的标记物数据,表示二倍体马铃薯育种的种质(实例2)。图5示出了对一组六个f3种群及各自的亲本进行如在实例3中描述的snp标记物检验的结果。具体实施方式定义本文使用的术语“马铃薯”指基本是solanumtuberosum种类的材料,但可包括其它结出块茎的茄属植物(如solanumchacoense、solanumphureja、solanumandigena、solanumdemissum)的基因渗入的部分。本文使用的术语“马铃薯植物”指如在细胞培养或种子生长的幼苗或成熟的植物。本领域技术人员应识别当术语“马铃薯植物”用于本发明的上下文中时,还包括保持为本发明主题的例如马铃薯品种的基本区别特种的衍生品种,如该种类的单基因转化的植物(singlegeneconvertedplant)或具有一个或多个并入其中的增值基因(如除草剂或害虫抗性)的转基因衍生物。回交方法可以与本发明一起使用以改善品种或将特征引入品种。如本文使用的术语“杂交”指雌株(或配子)被雄株(或配子)受精。术语“配子”指在植物中通过有丝分裂从配子体产生的且参与有性繁殖的单倍体生殖细胞(卵子或精子),在有性繁殖过程中异性的两个配子融合以形成双倍体合子。该术语通过包括花粉(包括精子细胞)和胚珠(包括卵)。因此,“杂交”通常指一个个体的胚珠经来自另一个体的花粉受精,然而“自交”指一个个体的胚珠经来自相同个体的花粉受精。杂交广泛用于植物育种中,且导致杂交的两株植物之间的基因组信息的混合,一个染色体来自母亲而另一染色体来自父亲。这将导致基因遗传性状的重新组合。杂交的后代一般被定名为“f1”。如果f1不是一致的(分离的),则一般被定名为“f1种群”。纯合植物的“自交”一般将导致基因一致的植物,因为没有基因变异。f1的“杂交”将导致在f1中具有杂合基因座的所有性状分离的后代。这样的后代被定名为“f2”或“f2种群”。当在实现基因组区或段的基因渗入的环境中提到“杂交”时,技术人员应理解由于在亲本品系中的配子产生中发生的交换事件,为了实现一株植物的仅染色体的一部分基因渗入另一植物的染色体中,需要两个亲本品系的基因组的随机部分在杂交过程中均进行重组。因此,两个亲本的基因组必须通过杂交组合在一个细胞中,之后,来自所述细胞的配子的产生及它们在受精中的融合将导致基因渗入事件发生。如本文所使用的术语“可互交的”指在亲本植物之间杂交之后产生后代植物的能力。如本文所使用的术语“基因渗入中(introgressing)”、“基因渗入”和“基因渗入的”指天然和人工的过程,借此单个基因或整条染色体通过使个体、物种、品种或栽培品种进行杂交而从一个个体、物种、品种或栽培品种被移入另一个体、物种、品种或栽培品种的基因组中。在植物育种中,该过程一般包括自交或回交至回归亲本以提供基本具有除了基因渗入的机或性状之外的回归亲本的特征的渐增的纯合植物。术语“基因渗入”指基因渗入事件的结果。术语“回交品种(backcross)”指“回交”过程的结果,其中,从在两个亲本品系之间的杂交所得到的植物(重复)与它的亲本品系之一杂交,其中在回交中使用的亲本品系指为回归亲本。重复回交导致给方亲本(donorparent)的基因组片段被回归哪些基因组片段所取代。杂交后代被定名位“bcx”或“bcx种群”,其中“x”表示回交的次数。如本文所使用的术语“回交”指杂交后代后退与回归亲本的重复杂交。把为期望特征贡献基因的亲本马铃薯植物叫做非回归亲本或给方亲本。该术语指非回归亲本在回交方案中使用一次且因此不会重现的事实。来自非回归亲本的单个基因或多个基因被转移至其中的亲本马铃薯植物已知为回归亲本,因为它在回交方案中被使用几个循环。在典型的回交方案中,感兴趣的原始品种(回归亲本)与携带要被转移的感兴趣的单个基因的第二品种(非回归亲本)杂交。然后,从该杂交所得到的后代再次与回归亲本杂交,且重复该过程直至获得马铃薯植物,其中除了从非回归亲本转移的单个基因或有限数量的基因之外,在被转变的植物中基本恢复了回归亲本的所有期望的表型和生理特征。选择适合的回归亲本对于成功的回交程序是重要的步骤。回交方案的目标是改变或取代原始品种中的单个性状或特征。为了实现这一目的,通过来自非回归亲本的期望基因对回归品种的单个基因进行修饰、取代或补充,同时基本保持所有剩余的期望基因,且因此保持原始品种的期望的生理和形态构成。具体的非回归亲本的选择将依赖于回交的目的。其中一个主要的目的是向回归亲本中加入一些商业上期望的、农艺学上重要的性状。精确的回交方案将依赖于要改变或加入的特征或性状以确定适合的测试方案。虽然当时被转移的特征是显性等位基因时简化了回交方法,但还可能转移隐性等位基因。在这种情况下,可能需要引入后代的测试以确定期望的特征是否已经被成功转移。优选地,通过诊断的分子标记物监控这样的基因。同样地,可以使用本领域技术人员已知的各种已建立的重组方法中的任何方法将转基因引入植物中。已经鉴定出很多单个基因的性状,这些性状在新型品种的开发中不是定期选择的,但通过回交和基因工程技术是可以改善的。单个基因性状可以或可以不是转基因的,例如这些性状包括但并不限于:除草剂抗性,对细菌性疾病、真菌性疾病或病毒性疾病的抗性,昆虫抗性,淀粉和其它碳水化合物浓度的均匀性或淀粉和其它碳水化合物浓度的增加,增强的营养品质,降低块茎易于碰伤的倾向,及降低淀粉转变为糖的比率。术语“自交”指自受精的过程,其中,个体被自己的花粉授粉或受精。重复自交最终导致纯合的后代。如本文所使用的术语“品系”指来源于单次杂交、回交或自交的植物的种群。个体后代植物不会必然与另一个相同。个体后代植物由于变异可能没有活力、不能育的或不可自交。但是,预见到可以在品系中容易地鉴定出有活力的、能育的或可自交的适合的植物,且将该适合的植物用于额外的育种目的。如在本文中所使用的,术语“等位基因”意味着基因的一个或多个可选择形式中的任意一个,所有这些等位基因均涉及至少一个性状或特征。在双倍体细胞或有机体中,两个拷贝的基因占据一对纯合染色体上的对应的基因座。每一拷贝可以是有区别的等位基因。本文中的“基因”被定义为遗传单位(常常由dna序列表示),该遗传单位占据染色体上的特定定位,且包含用于对植物中的潜在表型特征或性状作贡献的基因指令。本文中的“基因座”被定义为给定基因在给定植物物种的染色体上占据的位置。如本文所使用的,术语“纯合的”意味着当相同的等位基因存在于同源染色体上的对应基因座上时存在的基因条件。术语“基本纯合的”指当测试100、优选1000、更优选至少10000个基因座时,具有至少25%,优选至少50%,更优选至少75%,还更优选至少76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%的纯合性的水平。技术人员应理解植物的平均(level)纯合性由植物的整个基因组所显示出的纯合性水平来定义,且如通过基因座的随机选择所获得的(但该测试可能依赖于所使用的标记物)测试100、优选1000、更优选至少10000基因座反映出整个植物基因组的纯合性水平。纯合性水平是种群的平均值,且优选指其中亲本不同的那些基因座。如在本文中所使用的,术语“杂合性”意味着当不同的等位基因存在于同源染色体上的对应基因座上时存在的基因条件。术语“重组(recombination)”或“重组(recombine)”指在有丝分裂的过程中两个同源染色体之间的信息交换。在“重组”的植物中,最初呈现在染色体内的具体定位上的dna(例如联接至一基因/基因座)与来自另一植物(即亲本中的母性或反之亦然)的dna进行交换。为了仅交换所需的材料且在染色体上尽可能多的维持有价值的原始信息,通常需要两次侧面交叉(flankingcrossover)或重组事件。在双重重组(doublerecombination)中,该交换已经发生在基因/基因座的两侧。发现这样的双重重组的方式是筛选f2-植物的种群。该种群已经是大量的,因为仅以有限的频率出现双重重组。可选择地,在基因单位内的双重重组可以是连续回交的结果。双重重组的频率是单次重组的频率的产物。(例如在10cm区域中的重组可以发现为10%的频率,双重重组发现为10%x10%=1%的频率)。如在本文中所使用的,术语“子代(progeny)”意味着基因子孙或后代。如在本文中所使用的,术语“种群”意味着分享共同基因起源的植物的基因异种集合。“重组事件”指有丝分裂或减数分裂的交叉事件,包括gmo事件。如在本文中所使用的,术语“杂种”意味着在两个基因上不相似的个体之间杂交的任何后代,更优选地该术语指两个(优秀或近交的)将不真正从种子繁殖至亲本的育种品系之间的杂交。如在本文中所使用的,术语“分离”指成对的等位基因在减数分裂过程中的分开,以便每对等位基因的成员出现在不同的配子中。该术语包括提及该基因现象的结果,其中,在至少一个亲本对一个等位基因来说是杂合的杂交中的后代种群相对于所述基因的表型性状是不一致的。如在本文中所使用的,术语“育种品系”指具有商业上有价值或农艺学上期望的特征的栽培的马铃薯的品系,与野生型品种或作物地方品种形成对照。该术语包括体积优秀的育种品系或优秀的品系,该品系表现出基本纯合、通常为近交的用于产生商品化f1杂种植物品系。通过育种及对包括众多农艺学上期望性状的优良农艺性能的选择获得优秀的育种品系。优秀植物是来自良种品系的任何植物。优良农艺性能指如本文所定义的农艺学上期望的性状的期望组合,其中期望与非优秀育种品系相比,大部分、优选所有的农艺学上期望性状在优秀育种品系中均得到改善。优秀育种品系基本是纯合的,且优选是近交品系。如在本文中所使用的,术语“良种品系”指从育种和对优良农艺性能进行选择所得到的任何品系。良种品系优选是具有众多,优选具有至少3、4、5、6或更多本文所定义的期望农艺性状(的基因)的品系。术语“栽培品种”和“品种”在本文可互换使用,且指示具有通过为了商业化的目的经农民和栽培者进行育种、杂交和选择而谨慎开发出的植物,以产生农业产物用于自己消费或用于商用(新鲜消费、处理、喂养等)。术语“育种种质”指示具有除了“野生型”状态植物的生物状态的植物,该“野生型”状态指植物或近似物(accession)的原始未经栽培或天然的状态。术语“育种种质”包括,但并不限于:半天然、半野生型、杂草类的、传统的栽培品种、作物地方品种、育种材料、研究材料、培植者的品系、人造种群、杂种、创造者原种(founderstock)/基础种群、近交品系(杂种栽培品种的亲本)、分离的种群、突变体/基因原种、高级市场和先进/改善的栽培品种。栽培品种的实例包括栽培的品种,如bintje、russetburbank、eigenheimer和nicola。如在本文中所使用的,术语“纯种的”、“纯种近交”或“近交”可以互换,且指通过重复自交和-或回交获得的基本纯合的植物或植物品系。如在本文中所使用的,术语“分子基因标记物”或短的“标记物”指在用于使在核酸序列特征中的差异可视化的方法中使用的指示物。这样的指示物的实例是限制性片段长度多态性(rflp)标记物、扩增片段长度多态性(aflp)标记物、单核苷酸多态性(snp)、插入/缺失(indel)突变、微卫星标记物(ssr)、序列特异扩增区域(scar)、剪切扩增多态性序列(caps)标记物或同功酶标记物或本文所描述的限定特定基因和染色体定位的标记物的组合。如在本文中所使用的,术语“植物部分”指示马铃薯植物的一部分,包括细胞器、单个细胞和细胞组织,如植物中完整的植物细胞、细胞团和组织培养物,从该部分中可以再生出马铃薯植物。植物部分的实例包括,但并不限于:来自花粉、胚珠、叶子、胚、根、根尖、块茎、花药、花、浆果、茎杆(stemshoot)和种子的单个细胞和组织;以及花粉、胚珠、叶子、胚、根、根尖、花药、花、浆果、茎、芽(shoot)、穗木、根茎、种子、块茎、原生质体、愈伤组织等类似物。除非特别声明,术语“种子”在本说明书中均指从中长出新型植物的物体(或一些植物中的籽粒),包含通常与一些储存的食物在一起的、包在种皮覆盖(seedcoatcovering)中的小的胚性植物。该种子(被称为植物的或“真正”的种子)是裸子植物和被子植物的成熟胚珠的产物,在受精且在母性植物内生长一段时间后出现。如在本文中所使用的,术语“活力”和“有活力的”指植物的地上组织或地下组织的相对量,该相对量可以是彼此或多或少地不互相依赖。地上组织的相对量可以表示为按照以等级分类评定的植物高度、茎的数量、叶子的数量,和/或按照鲜重或干物质的枝叶的量的可视化观察结果。该性状在植物生长周期的第一阶段的过程中具有关联,该植物生长周期在五月至八月的季节中欧洲西北部普遍为在正常生长条件下具有100天的平均种植时间(75~130天的范围)。在这些条件下,本发明的植物获得以鲜重或干重(克)表示的枝叶和芽(地上植物)的重量,该重量为(基本杂合的)二倍体育种克隆rh89-039-16的至少50%、更优选为至少60%、70%、80%、90%或更多,反过来该重量具有基于九年测试的四倍体马铃薯品种的块茎产量的68%(44~86%的范围)。克隆rh89-039-16可用于irronaldb.c.hutten博士(植物育种实验室,瓦格宁根大学,droevendaalsesteeg1,6708pb瓦赫宁恩,荷兰)的目的。可选择地或额外地,术语活力可以与特定最小块茎产量相连使用。如在本文所使用的,术语“块茎产量”将一般指在五月至八月的季节中在欧洲西北部流行的具有正常生长条件的100天栽培时间段的条件下获得的以鲜重(克)表示的块茎产量,该块茎产量在根据本发明的植物收获时为(基本杂合的)二倍体育种克隆rh89-039-16的至少30~50%、更优选为至少60%、70%、80%、90%或更多,反过来该块茎产量具有基于九年大田测试的四倍体马铃薯品种的块茎产量的68%(44~86%的范围)。如上所示,克隆rh89-039-16可用于irronaldb.c.hutten博士(植物育种实验室,laboratoryofplantbreeding,瓦格宁根大学,droevendaalsesteeg1,6708pb瓦赫宁恩,荷兰)的目的。除非有特别表示,与从块茎生长的植物形成的块茎形成对照,块茎产量是基于从种用植物形成的块茎,该产量可以比种用产量高50~200%。可选择地或额外地,术语活力可以指以鲜重或干重(克)表示的块茎产量,该块茎产量在收获时是二倍体育种克隆rh89-039-16的至少30~50%、更优选为至少60%、70%、80%、90%或更多。这意味着在粘质土中在正常欧洲西北部夏天的条件下,(在本发明的植物中)以鲜重(克)表示的块茎产量在每株从植物种子生长的植物中可以达到至少200克、更优选至少300克、400克或500克,且当所述植物从块茎种植且在粘质土中在正常欧洲西北部夏天的条件下生长时,甚至达到每株植物中为400克、500克、600克、700克、800克或更多,如900克或1000克的新鲜块茎重量或更多。术语“包括植物的品系”中所述植物指为具有特定特征(如块茎产量),且术语“包括植物的品系”应优选理解为指基本由具有所述性状、但允许一些生物变异的植物所组成的品系。如在本文中所使用的,术语“二倍体”指其中每一营养细胞(vegetativecell)均包含两组染色体(2x=2n,其中n是染色体的数量)的植物。染色体中的一组来自各自的亲本。如在本文中所使用的,术语“四倍体”指其中每一营养细胞均包含四组染色体(2x=4n)的植物。如在本文中所使用的,术语“线虫抗性”指已经基因渗入功能抗性基因以预防至少一种线虫种群或隔离种群的增殖的植物。如在本文中所使用的,术语“疾病抗性”指示出使发病叶面或块茎体积的量,或昆虫或病原微生物(包括但并不限于链霉菌属(streptomycesspp)、丝核菌(rhizoctonia)、银屑病(silverscurf)和晚疫病菌(phytophthorainfestans))增殖的量降低高于50%的能力。如在本文中所使用的,术语“除草剂耐性”指比在应用规定剂量的除草剂所通常导致的损害示出低于50%的枝叶损害的植物。如在本文中所使用的,术语“耐寒性”指示出霜冻害的植物叶面的平均量,在耐寒植物中的损害低于相对冷敏感的参照品种(如caribe和/或kennebec)在零下3℃的温度下所观察到的平均损害。如在本文中所使用的,术语“耐旱性”指与相对干旱敏感的参照品种(如caribe和/或carlton)相比,在限制性水条件下示出低于平均损害的植物。如在本文中所使用的,术语“耐涝性”指在洪水泛滥时受影响的块茎(厌氧降解)的比例相对于示出的平均损害的植物低50%。如在本文中所使用的,术语“耐湿腐性”指对欧文氏菌属(erwinia)(目前被叫做果胶杆菌属(pectobacteriumspp.))具有最低水平的抗性的植物。如在本文中所使用的,术语“耐干腐性”指对镰刀菌属(fusarium)具有最低水平抗性的植物。如在本文中所使用的,术语“耐盐性”指在盐性条件下示出比平均损害较低的损害的植物。如在本文中所使用的,术语“生长率”指每一时间单位植物生物量的增加。如在本文中所使用的,术语“块茎发育缺陷”(例如畸形或受损的块茎)指在植物发育和/或块茎收获的过程中示出块茎的看得见及内部的变形。如在本文中所使用的,术语“块茎产量”指通常以鲜重(克)表示的植物块茎或植物种群的总重量。如在本文中所使用的,术语“块茎大小”指块茎的绝对宽度、高度和长度。有益的块茎大小包括每个块茎大约80~160克的植物平均块茎大小。商业可用的植物的平均块茎数是每株植物大约8~12个块茎。如在本文中所使用的,术语“块茎皮的颜色”指由于块茎皮组织中花色素苷的积累而导致块茎皮在收获后的颜色。如在本文中所使用的,术语“芽眼深度(eyedepth)”指块茎的皮表面和芽原基之间的相对距离。如在本文中所使用的,术语“块茎形状”指:长度/宽度的比率,以指示从圆形、椭圆形至长块茎形状的持续变异;以及高度/宽度的比率,以指示块茎从圆柱形至扁平量的持续变异。如在本文中所使用的,术语“块茎果肉的颜色”指由于缺失或存在类胡萝卜素化合物分别引起白色或黄色果肉颜色,以及缺失或存在花色素苷化合物分别引起果肉颜色的红色、蓝色、紫色阴影所造成无论颜色是否以部分或全部的模式存在的块茎果肉在收获后的内部的颜色。如在本文中所使用的,术语“块茎味道”指通过吃蒸煮的马铃薯块茎消费者的评价。如在本文中所使用的,术语“块茎保存期限”和“块茎储存能力”是同义的,且指块茎在储存时外貌没有变化。如在本文中所使用的,术语“块茎休眠期”指在块茎播种和发芽之间的时间段,同时在正常条件下播种。如在本文中所使用的,术语“块茎脱水抗性”指示出比在湿度低的条件(见保存期限)下块茎的平均脱水低的块茎脱水的植物。如在本文中所使用的,术语“块茎淀粉含量”指淀粉重量比块茎总鲜重。如在本文中所使用的,术语“块茎干物质含量”指马铃薯的干组分的重量除以总鲜重。如在本文中所使用的,术语“块茎蒸煮品质”指块茎在蒸煮后从坚硬至粉状的持续变异。如在本文中所使用的,术语“块茎油炸品质”指消费者对块茎在油炸后的评价。如在本文中所使用的,术语“块茎制片的品质”指消费者对块茎被制片后的评价。如在本文中所使用的,术语“块茎的一致性”指块茎性状的标准偏差,从而低标准偏差指高度不一致且反之亦然。如在本文中所使用的,术语“对低温糖化的抗性”指当块茎块茎储存在低于8℃的温度下,对产生葡萄糖和/或果糖的抗性。如在本文中所使用的,术语“四倍体”指其中每一营养细胞均包含四套染色体(4n)的植物。术语“能育的”和“能育性”宽泛地指繁殖能力,即怀孕(conceive)和产生后代、优选能育后代的能力。因此,术语能育性指可以杂交以产生能育后代的个体,因为当授粉后,花粉产生包含种子的浆果,种子播种后会产生自身携带能育花等的植物。术语“能育的后代”或“能育的种子”在本文被定义为能够长成产生花的马铃薯植物的种子,其中,花是雌性和雄性能育的。因此,该术语优选指植物或种子,该植物或种子当长成植物时能够借助能育胚珠和能育花粉(即雄性和雌性花均是能育的)的存在产生作为雄性和雌性亲本的后代。术语“能育的植物”在本文被定义为携带浆果的能够产生种子的植物。优选地,每一所述浆果携带至少5、更优选至少15~20、甚至更优选至少50个能育的种子,仍然更优选携带50至500个之间的种子。可选择地,植物被称为能育的,当每一浆果产生的种子数量是在二倍体育种克隆rh89-039-16的浆果中发现的数量的至少10%、更优选至少30%、40%、50%、60%、70%、80%、90%、100%、150%、200%或更高。该术语还(或可选择地)指具有多于25%、优选多于90%的能育植物的植物品系。术语“自交亲和的”指使种子在浆果中发育的能力,是自授粉、自受精的结果且产生能育后代。术语“能够回交/自交/杂交且得到(自交)能育的后代和自交亲和的后代”指作为回交、自交或杂交的结果产生一个或多个具有种子的浆果的能力,其中在所述一个或多个浆果中超过60%、优选超过70%、80%、85%、90%或更多的种子能够发育成(自交)能育的和自交亲和的植物。对于本文中的其它术语,参考allard,r.w.的《植物育种原理(principlesofplantbreeding)第二版》(威利纽约(wileynewyork),1999),且特别参考里面的术语表。优选实施方式的描述本发明人发现可以成功产生用于马铃薯育种的优选育种品系。两个优秀育种品系的杂交提供了f1杂种种子,这样的f1杂种种子当长成植物时得到具有优良的农艺学性能的植物。更重要地,所有种子从基因方面均是基本相同的,这意味着除了偶然交换或突变事件,所有种子均是一致的。本发明人已经发现能够供应优秀的马铃薯育种品系的方法,当相互杂交时该方法提供了一致的f1杂种马铃薯种子,该f1杂种马铃薯种子当长成植物时得到具有优良农艺学性能的植物。优秀的马铃薯育种品系可具有互补的性状,且作为它们纯合性的结果,从f1杂种种子长成的f1植物是一致的,但当这些f1植物随后自授粉或异花授粉,所得到的f2植物将因不同性状而被分离。因此,与从现有技术的传统途径产生的以及从浆果中收获的目前可用的真正马铃薯种子(tps)形成对照,其中在该浆果中每一个种子从基因方面与其它种子都是不同的,从马铃薯品系和根据本发明各方面的优秀马铃薯育种品系的杂交所获得的种子从基因方面基本是相同的。现有技术的tps品种来源于选择的但杂合的亲本之间的杂交,且由此期望到植物和块茎中的变异性。本文中提出的杂种马铃薯育种与tps的传统生产的不同在于,现在的tps是两个纯育种品系杂交的结果,产生一致的栽培品种,而现有技术的tps品种是两个遗传方面非纯合且常常是四倍体的育种品系之间开放授粉或杂交的结果,得到不一致的栽培品种。现在提供的植物不仅在它们组合了迄今为止从来没有在单个马铃薯品系中一起获得的众多性质方面是新颖的,而且它们还实现了新颖且非常有利的育种方法。因此,本发明的植物是产生新型马铃薯栽培品种的中间物,该栽培品种可以通过本文所公开的方法产生。有利的育种方法实现了消除本文上面提到的传统马铃薯育种的许多缺点,包括消除克隆的耗时选择以得到新型马铃薯品种,以及提供一致的杂种马铃薯种子的可能性。此外,新型植物和方法还实现了消除与克隆增殖和产生相关的缺点,包括消除高转运费用及害虫和疾病的克隆持久性的可能性。新型马铃薯植物亲本的育种品系本发明提供了基本纯合、二倍体、有活力的、能育的且自交亲和的马铃薯植物。优选地,本发明的植物已经在它们的基因组内固定了编码给予植物农艺学期望的性状的基因的核酸序列。这样的核酸序列可以是来源于具有农艺学期望的性状的马铃薯种质、优选来自二倍体种质的基因渗入或转基因。基本纯合性在育种中,植物通过有性繁殖,通常通过具有期望性状的所选择亲本的杂交进行增殖,以产生改善的子代。子代从两个亲本中遗传得到期望性状和不期望性状的基因。从每一世代(将作为下一世代的亲本)中重复选择有价值的个体将保存期望的特征,且消除不期望的特征。植物育种中的最终亲本是纯种的高度纯合的品系,该最终亲本在与其它纯种杂交中使用时得到在单一世代内及在从相同亲本的其它杂交中获得的连续世代之间表型和基因型均相同的后代。可以通过示出基因一致性或纯合性的程度增加的每一连续世代自交或近交(接近的亲缘植物的杂交,如兄弟植物对姐妹植物(brothertosisterplant)或后代对亲本(回交))几代后获得纯种或纯的近交品种。作为育种亲本的纯合近交的使用得到在单一世代内及在这些亲本的其它杂交中获得的连续世代之间表型和基因型均相同的后代。因此,纯的近交品种可重复使用以产生相同的后代植物。在马铃薯中,自交和近交导致严重的近交衰退或有害隐性基因的表达,该表达通过活力丧失和能育性丧失而显现出来。因此,迄今已经不可能在马铃薯中产生纯合的纯的近交品种,因为直至本发明,不能在具有足够活力的马铃薯中获得高水平纯合性。现在,本发明第一次提供了具有高于25%且优选高于75%的纯合性水平,且组合有能育性、自交亲和性和植物活力的植物。二倍体本发明的植物是二倍体植物,与为四倍体的商品化马铃薯品种形成对照。应注意,在本发明的植物中,明确设想了较高倍性水平,因为在育种品系的发育过程中初步使用了二倍体阶段。一旦纯种已经建立,则品系可以变成四倍体。因此,本发明的植物还可以是四倍体。四倍体植物可以从四倍体细胞或组织培养物获得,反过来该四倍体细胞或组织培养物可以通过本身已知的方法使二倍体细胞或组织培养物的基因组加倍而产生,例如通过使用barandalla等.(barandalla等.potatoresearch(2006)49:143-154)描述的黄草消。四倍体植物可以具有提供较高产量的优点。有活力的虽然商品化四倍体马铃薯品种是能育的、自交亲和的且是有活力的,因为它们生长良好,不产生变形的植物或浆果,但与具有高块茎产量的健康植物相比,它们的自交子代示出严重的近交衰退,即得到具有变形块茎的生长衰弱和低产量的植物。现有技术的二倍体和基本纯合的品系(如在本文引用的phumichai等所报道的那些品系)也不仅生长非常不良,且显示为非常弱小的具有不良的结实率(seedset)的植物。事实上,近交得到的且在等位基因上达到至少25%或50%纯合性的二倍体马铃薯植物总是弱的生长物。本发明的植物不是弱势和脆弱的,且虽然它们不是必然与现今商品化四倍体品种具有相同的活力,但它们没有示出近交衰退。因此,在本发明的上下文中,它们是有活力的。块茎形成例示了本发明的植物的活力。虽然所有商品化(四倍体和种子块茎来源的)马铃薯品种产生大的块茎,或至少具有足够大小的块茎,但现有技术的二倍体品系和基本纯合的植物仅产生小的块茎,该小的块茎例如在生产薯片或炸薯条中是没有用的。现有技术的二倍体品系和疾病纯合的植物还产生非常少的块茎,这样每株植物的块茎产量比杂合的二倍体植物和商品化四倍体马铃薯品种的块茎产量低至少十倍。相反,本发明的植物显示出有益的块茎形成特征,包括有益大小外形(sizeprofile)的块茎和块茎产量,其块茎产量可以是在本文中描述的实例中用作供体(d1、d2和/或d3)的二倍体杂合植物的至少50%。如本文所发现的,二倍体f1的块茎产量平均为每株植物为443克,具有高达600克和634克的值。与f1:“ivp08-06”回交平均出产155克和209克;而与f1:“ivp08-07”回交平均出产209克和259克。“伪f2”每株植物平均出产172克和332克,且偶尔产生高于二倍体f1的产量。f2每株植物平均出产69克和252克。几株植物与二倍体f1的产量值部分重叠。能育的本发明的植物虽然基本是纯合的,但还是能育的。这意味着它们可以在育种程序中使用,因为它们的后代也将是能育的。自交亲和的本发明的植物是自交亲和的。引入该特征以允许植物的自交和纯合品系的产生。自交亲和性的优选基础是来源于显性s基因座的抑制基因(sli)(hosaka和hanneman,1998,euphytica,99:191–197)。本发明的基本纯合的马铃薯植物具有如下优点:它们可以与其它基本纯合的马铃薯植物杂交,从而所述杂交的杂种后代从遗传方面基本是一致的,且将不会分离。在优选实施方式中,本发明提供了基本纯合的、二倍体、有活力的、能育的且自交亲和的具有农艺学期望性状的马铃薯植物。本发明的新型马铃薯植物能够:与基本纯合的回归亲本回交,且得到(自交)能育的和自交亲和的后代;自交(1个后代个体的自受精),且得到(自交)能育的和自交亲和的后代;互相杂交(在两个后代个体之间受精),且得到(自交)能育的和自交亲和的后代。根据本发明的植物包括具有培植者编号agvd1的品系,所述品系的代表种子已经于2009年10月23日保藏在苏格兰阿伯丁郡的ncimb中,登录号为ncimb41663,且培植者编号为agvd1;该品系代表通过亲本ivp07-1001/4的植物与亲本d1的植物杂交(见实例1),且使得到的f1后代植物自交所获得的f2,其中亲本ivp07-1001/4的植物为基本纯合的、二倍体、能育的且自交可亲和的但没有活力的马铃薯品系,亲本d1的植物为基本不是纯合的,且不是自交亲和的优秀的二倍体育种克隆,但亲本d1的植物具有黄色果肉颜色的期望农艺学性状且显示出良好的蒸煮性质(因为果肉在蒸煮后不变成灰色)。估计agvd1大约50%纯合,意味着致使亲本不同的基因座的大约50%是纯合的。根据本发明的植物还包括具有培植者编号agvd2的品系,所述品系的代表性种子已经于2009年10月23日保藏在苏格兰阿伯丁郡的ncimb中,登录号为ncimb41664,且培植者编号为agvd2;该品系代表通过如上所示的亲本ivp07-1001/4植物与如上所示的亲本d1植物杂交,且使个体f1后代植物互相杂交所获得的(f1xf1)品系(或伪f2),该(f1xf1)品系共享ivp07-1001/4亲本但具有不同的d1亲本的个体。估计agvd2对于致使亲本不同的基因座大约25%是纯合的。根据本发明的植物还包括具有培植者编号agvd3的品系,所述品系的代表性种子已经于2009年10月23日保藏在苏格兰阿伯丁郡的ncimb中,登录号为ncimb41665,且培植者编号为agvd3;该品系代表通过如上所示的亲本ivp07-1001/4的植物与如上所示的亲本d1的植物杂交,且使得到的f1后代植物与ivp07-1001/4亲本回交所获得的bc1种群。估计agvd3对于致使亲本不同的基因座大约75%是纯合的。根据本发明的植物还包括具有培植者编号agvd17的品系,所述品系的代表性种子已经于2010年10月5日保藏在苏格兰阿伯丁郡的ncimb中,登录号为ncimb41765,且培植者编号为agvd17;该品系代表通过如上所示的亲本ivp07-1001/4的植物与如上所示的亲本d2的植物杂交,且使得到的f1后代植物与ivp07-1001/4亲本回交,然后再进行两步自交所获得的f3种群。估计agvd3对于致使亲本不同的基因座大约80%是纯合的。本发明的植物可以非常适用于用作回归亲本,其中额外的农艺学期望性状是通过杂交基因渗入的,或通过其它如转基因的方式引入的。一旦一些农艺学期望性状已经被堆叠进入根据本发明的基本纯合的、有活力的、二倍体、能育的且自交亲和的植物中,则该植物可以被用作用于产生商品化f1杂种马铃薯种子的优秀育种品系。同样地,可以提供第二优秀育种品系用作相对性别的亲本,这样两种植物均可杂交以产生新型马铃薯品种的商品化f1种子。一致的杂种种子的育种依赖于一些技术条件。实现一致的杂种种子的先决条件是:i)可以在基本纯合的、二倍体、能育的且自交亲和的植物与作为农艺学期望性状的供体的植物之间进行初始基因渗入的杂交;ii)可以在该初始杂交的后代与基本纯合的、二倍体、能育的且自交亲和的植物之间进行回交;以及,iii)其后代可以自交。马铃薯品系agvd1、agvd2和agvd3显示出这些特征,且这些品系的个体植物可以在额外的基因渗入的杂交、回交和自交中使用以得到优秀育种品系,该优秀育种品系适用作用于可以长成新型马铃薯品种的杂种马铃薯植物的商品化f1杂种种子的亲本。根据本发明的高度优选植物是品系agvd2的植物或其具有品系agvd2植物的所有生理和形态特征的后代。作为本发明实施方式的实例保藏的另一品系是agvd17(ncimb41765,保藏于2010年10月5日)。agvd17的优点是它是高度纯合的品系(>80%的纯合性),且将有活力和能育性与每株植物平均300克(鲜重)的块茎产量相结合。相关种群的个体植物甚至示出每株植物500克的块茎产量。这些数据由幼苗种植的大田生长的植物产生。从克隆种植的马铃薯植物通常产出比从幼苗种植的植物高50%~100%的块茎重量。因此,预计在正常欧洲西北部夏天的条件下,如本文所述的植物经克隆性增殖,且从块茎种植,并生长在粘质土中时,由该植物产生的以鲜重的克数表示的块茎产量达到每株植物至少大约1000克鲜重的水平。因此,品系agvd17尤其证实使本发明的个体良种品系(即自交可亲和的、能育的且基本纯合的)互交以得到为本发明的目的的杂种种子的可能性。因此,根据本发明的另一高度优选的植物是品系agvd17的植物或其具有品系agvd17的植物所有生理和形态特征的后代植物。杂种通过如在图1中例示的本发明的方法产生本发明的杂种植物。通过两个基本纯合的优秀马铃薯亲本的育种品系的杂交产生本发明的杂种植物,所述优秀马铃薯亲本的育种品系中包括选自由以下性状所组成的组中的一些农艺学期望的性状:昆虫耐性、线虫抗性、疾病抗性(包括,但并不限于对粉痂病、丝核菌、银屑病、晚疫病、由链霉菌属引起的疮斑病的抗性)、除草剂耐性、耐寒性、耐旱性、耐湿性、耐干腐性和耐湿腐性、耐盐性、对低温糖化的抗性和对块茎脱水的抗性。除了这些农艺学期望的性状之外,亲本育种品系可显示出如在特定使用市场中期望的那些特征,如期望的块茎皮的颜色、期望的块茎形状、期望的块茎果肉的颜色、期望的块茎的味道、期望的块茎淀粉含量、期望的块茎干物质含量、期望的块茎蒸煮品质或期望的块茎油炸品种。除了这些市场特定的特征之外,亲本育种品系当杂交时优选得到显示出如下有益性状的杂种:有益的生长率、有益的块茎产量、有益的块茎大小、有益的块茎储存能力、有益的块茎休眠期、有益的块茎保存期限、有益的块茎制片的品质及有益的块茎一致性。现在本发明提供了一种马铃薯植物的组或一种马铃薯植物品系的组,该植物或植物品系是:二倍体(2n);基本纯合的(优选在所有同位基因上的纯合性超过60%);自交亲和的;能育的;及有活力的。迄今已经证明了不可能在单株马铃薯植物(品系)中提供所有这些特征的组合。本发明的该马铃薯植物的组可以用以产生新型品种或栽培品种。本发明尤其涉及至少两个二倍体的(2n)、基本纯合的(优选在所有同位基因上的纯合性超过60%)、自交亲和的、能育的且有活力的植物的组,该至少两个植物能够杂交以产生根据本发明的杂种品种。马铃薯种子育种的新方法新型马铃薯植物的供应现在第一次提供了本发明的方法的实现。本发明人已经得到基本纯合的、二倍体的、有活力的、能育的且自交亲和的,且在它们的基因组内固定有编码来源于适合的二倍体供体品系的赋予植物农艺学期望性状的基因的核酸序列的马铃薯植物。所述核酸序列是从具有农艺学期望性状的马铃薯种质的基因渗入的结果。传统上,至少在除了马铃薯之外的大部分物种中,原则上可以在仅仅两个世代中通过已知为双单倍体(dh)技术的方法使从未受精的生殖细胞(如卵或花粉细胞)得到的单倍体加倍来获得纯合的植物。这在马铃薯中是不可能的,因为由于(被认为是)隐性有害基因的表达使迄今所得到的植物示出是不能生殖的。dh方法经本发明人进行广泛测试,但均发现不能成功。本发明人使用单个自交亲和的马铃薯品系的马铃薯种质和一个或多个含有农艺学性状的自交不亲和的马铃薯品系的重复自交、回交和杂交的策略。通过二倍体马铃薯植物的持续自交且选择能育的后代(除了对自交亲和的固定选择之外)来获得本发明的纯合植物。这完全是一种新的途径,因为在现有技术的方法中,是通过选择农艺学性状(如后代植物块茎形成或一般生长特征)而不是通过从自交中选择能育的后代来获得植物。此外,与现有技术的方法不同的是,该程序是使用二倍体植物品系而不是使用四倍体植物进行的。该完全新的途径意外地证实能够成功地获得纯合性增加的二倍体后代植物,且该获得的后代植物是自交亲和的且是能育的。而且,当与含有有益性状(如抗性或白色块茎颜色)的二倍体品系的植物(异型)杂交时,这些性状可以被引入基本纯合的种质中,且不会丢失自交亲和性和能育性。用于获得所述植物的方法基本如下:起始点是二倍体自交亲和的马铃薯品系(适合的品系的实例已经被保藏在保藏编号agvd1、agdv2、agdv3和agvd17下)。由于存在sli基因而自交亲和的品系通常可被用作起始点。该二倍体自交亲和品系的植物自交,且从携带种子的浆果中获得的种子被播种且长成后代植物。携带花的后代植物再次自交,且从携带种子的浆果中获得的种子再次被播种且长成后代植物。没有(或至少很少)注意到在这一阶段的植物的农艺学外貌。它们可能开上去是干枯和脆弱的,仅有少量的花。但是,自交至少重复三次,但优选是四次或五次或甚至六至八次。通过这种方式,基本通过自交和选择产生能育后代的植物来获得基本纯合的、能育的、自交亲和的、二倍体的植物品系。接下来,通过使该品系的植物与无关联的基本杂合的二倍体马铃薯品系、优选包含农艺学期望性状的品系的植物杂交,将农艺学期望的性状加入基本纯合的、能育的、自交亲和的且二倍体的马铃薯基因型中。该基本杂合的品系(该术语仅仅反应不是如本文使用的基本纯合的品系的品系)起到农艺学期望性状(在这种情况中是活力)的供体的作用。得到的杂种自交和/或回交至自交亲和的品系,同时选择较高的活力。这样,增强了基本纯合的、能育的、自交亲和的、二倍体的马铃薯植物品系的活力,且同时农艺学上改善了该品系。因此这些步骤将得到有活力的能育的纯合自交亲和的二倍体马铃薯。该活力可进一步通过与其它基本杂合的二倍体马铃薯品系杂交来得到增强,该额外的品系用作额外农艺学期望性状的供体,然后通过自交和/或回交至自交亲和的品系,同时选择这些额外的性状,该额外的步骤将得到二倍体马铃薯育种品系的供应。为了产生优秀的二倍体马铃薯育种品系,通过互交、自交和回交,同时持续选择提供给育种品系的农艺学期望性状,且通过建立显示出与其它品系的良好组合能力的品系,来进一步增强育种品系的育种值。通过使用实验杂交来评估这样的组合能力。最后,可以通过使显示出良好组合能力的个体优秀二倍体马铃薯育种品系杂交产生杂种马铃薯栽培品种。从该纯合亲本的杂交得到的种子是一致的杂种真正的马铃薯种子。使用本发明的方法,通过大约7至8个自交循环将得到基本纯合的植物,但技术人员应理解还可使用更多世代的自交。另外,较少的世代(如六个世代)可用以提供本发明的基本纯合的植物。回交世代的数量可甚至降低至3,以当应用分子基因标记物时达到超过95%的纯合性。产生杂种马铃薯栽培品种的新方法基本提供了在大约五年内产生新型马铃薯品种的可能性。在实例5中提供了用于从agvd17(f3品系)起始产生杂种马铃薯的详细过程。该品系>80%的纯合性,这样需要非常少量的自交以获得大约95%~100%纯合性的植物。此外,agvd17已经如本文所定义的是有活力的。本发明现在提供了一种用于产生基因同质或一致的真正马铃薯种子(tps)的方法。该方法尤其用于在防止病毒感染在马铃薯各世代之间传播的方法中,还用于克服很多与经典马铃薯育种、“种子”马铃薯生产和运输和种植相关联的其它问题。此外,可以以种子的形式保持用于杂种种子生产的当前亲本材料,而不是以如通过传统tps生产所需的植物材料的形式保持。本发明一方面提供了一种用于产生杂种马铃薯栽培品种的方法,该方法包括本文中作为起始材料提供的保藏的植物材料的使用。可选择地,可以开发与本文中提到的保藏不同的其它基本纯合的、二倍体、能育的、有活力且自交亲和的植物品系,且杂种马铃薯栽培品种的生产可以从通过使用本文提供的教导的早期阶段水平开始,因为本发明人已经证实该途径虽然费力,但是成功的。这样,可选择的育种材料也是有活力、基本纯合、二倍体、能育且自交亲和的。作为第一步骤,这样的早期阶段开发可包括提供第一种植的马铃薯物种(solanumtuberosum)或相关可交配的物种(通常是结出solanum物种的块茎)的植物。接下来,所述植物发育成自交亲和的二倍体马铃薯植物的品系,优选为solanumtuberosum。二倍体马铃薯常常自交不亲和。可适当地从相关物种引入自交亲和性(例如见hermsen,j.g.th.1978,euphytica27,1-11)。然后,自交亲和的二倍体马铃薯植物的所得品系发育成纯合的、能育且自交亲和的二倍体马铃薯品系。可以通过花药培养(jacobsen和sopory,1977,theor.appl.genet.52,119-123),通过胚珠培养或通过重复自交(phumichai&hosaka,2006,euphytica149,251-258)通过使单倍体加倍(uijtewaal等.,1987,theor.appl.genet.73,751-78)获得纯合的二倍体。使用后一种方法用于产生形成本文所述的有活力植物的基础的纯合能育自交亲和的二倍体马铃薯品系。接下来,纯合能育自交亲和的二倍体马铃薯品系发育成有活力的能育纯合自交亲和的二倍体马铃薯品系。可以通过与其它二倍体马铃薯植物杂交,自交和回交同时选择更高的活力来增强活力。必须注意需要高种群,且甚至对于一些用作农艺学期望性状的供体的无关联的基本杂合的二倍体马铃薯品系,可以在1000株植物的种群中发现非常少量的自交亲和的植物。通常,这样的尝试结束,且仅当大约10~50%的后代植物是自交亲和(如在下面实例2中的d2的情况中)时,供体品系显示出这样良好的一般配合力,从而能够预见到农艺学性状在自交亲和世系中的成功引入。接下来,有活力的、纯合的、能育的、自交亲和的二倍体马铃薯品系发育成二倍体马铃薯育种品系。最优选地,产生至少两种分离的有活力能育纯合的自交亲和的二倍体马铃薯品系,且发育为至少两种不同的二倍体马铃薯育种品系。这样的育种品系包括大量的农艺学期望性状。通过与其它二倍体马铃薯植物杂交、自交和回交,同时选择这些性状来引入农艺学期望性状。该育种程序可包括测试疾病,如芽或块茎是否没有疾病,或它们是否对疾病具有抗性。接下来,二倍体马铃薯育种品系发育成优秀的二倍体马铃薯育种品系。这使用通过互交、自交和回交,同时持续选择农艺学期望性状以增强育种值来完成的。在该阶段,进行实验杂交以评估一般配合力。现在,优秀的二倍体品系还可通过自身已知的方法发育成优秀的四倍体(4x)品系,如通过使用例如秋水仙碱进行化学处理,或通过使用组织培养使基因组“自发”加倍。最后,通过良好的结合育种品系(combiningbreedingline)的杂交,从这些优秀的二倍体或四倍体马铃薯育种品系产生马铃薯杂种栽培品种。获得的种子是一致的杂种真正马铃薯种子。本发明的用于产生马铃薯杂种栽培品种的方法包括产生二倍体马铃薯育种品系的步骤。所述方法包括以下步骤:(a)提供第一马铃薯植物,所述第一马铃薯植物是二倍体、自交亲和的且基本纯合的马铃薯品系的植物,优选是有活力的、能育、纯合的且自交亲和的二倍体马铃薯品系的植物,更优选是二倍体马铃薯育种品系;(b)提供可具有任何水平的多倍性(优选二倍体)和/或任何水平的纯合性的马铃薯品系的第二马铃薯植物,其中所述第二马铃薯植物用作农艺学期望性状的供体,所述性状被基因渗入进入所述第一马铃薯植物的所述基本纯合的品系中,或至少进入由所述第一植物和所述第二植物之间杂交所得到的后代植物中,其中所述性状选自由昆虫耐性、线虫抗性、疾病抗性(包括,但并不限于对粉痂病、丝核菌、银屑病、晚疫病、由链霉菌属引起的疮斑病的抗性)、除草剂耐性、发根力、耐寒性、耐旱性、耐湿性、耐干腐性和耐湿腐性、耐盐性、生长率、块茎发育缺陷(例如畸形或受损块茎)、块茎产量、块茎大小、块茎皮的颜色、芽眼深度、块茎形状、块茎肉的颜色、块茎味道、块茎储藏能力、块茎休眠期、块茎保存期限、对块茎脱水的抗性、块茎淀粉含量、块茎干物质含量、块茎蒸煮品质、块茎油炸品质、块茎制片的品质、块茎的一致性和对低温糖化的抗性所组成的组中。在提供了这两种植物之后,该方法又包括以下步骤:(c)所述第一马铃薯植物和第二马铃薯植物异花授粉,以便所述亲本植物中的一种亲本植物产生携带种子的果实(浆果),且从所述果实中收集所述种子以提供杂种后代的种子。然后,种子长成植物,且直接或在额外的自交和回交步骤之后从供体植物中选择包括农艺学期望性状的植物,如在植物育种领域中公知的。在这些方法中,可以使用标记物以辅助育种过程。杂种后代种子优选长成植物,该植物随后与植物回交至回归亲本品系。后面的步骤对于上述方法中的任一种不是必需的。但是,这些额外的步骤可以通过使本发明的种子生长提供消费块茎的产生,和/或可提供新型纯合、自交亲和的二倍体优秀育种品系的产生,该新型纯合、自交亲和的二倍体优秀育种品系可用作使进一步的性状包含进入后代中的亲本。本发明的植物是能育的和有活力的。这些额外的益处通过下面进一步的步骤获得:(d)使所述后代种子长成杂种后代马铃薯植物,且(e1)从所述杂种后代马铃薯植物中收获块茎以提供携带所述性状的块茎,或(e2)使所述杂种后代马铃薯植物自交或使所述杂种后代马铃薯植物与所述第一马铃薯植物的所述品系的马铃薯植物回交,以提供进一步的携带所述性状的后代植物,且其中所述后代植物在每次回交或自交步骤之后纯合性增加。优选地,在如上所述的方法中使用的所述第二马铃薯植物是如在上面步骤(d)中定义的杂种后代马铃薯植物,且通过如上所述的方法获得。更优选地,在如上所述的方法中使用的所述第二马铃薯植物是如在上面步骤(e2)中定义的杂种后代马铃薯植物,且通过如上所述的方法获得。优选地,所述步骤(e2)包括2~7次回交,使用品系agvd1、agvd2、agvd3或agvd17的植物作为回归亲本,且测试后代植物中性状的存在(例如造成性状的等位基因以纯合或杂合形式存在),然后通过一次或两次(或更多次)自交,以提供基本纯合的植物,该基本纯合的植物在基因方面相当于种群agvd1、agvd2、agvd3或agvd17的植物,但其中造成性状的等位基因杂合存在,优选纯合存在。该植物具有至少一个在种群agvd1、agvd2、agvd3或agvd17中没有的额外的等位基因。现在上述方法提供了一种用于基于种群在种群agvd1、agvd2、agvd3或agvd17的背景产生纯合育种品系或优秀育种品系的育种过程,在该背景中先后加入额外的等位基因,从而提供其中堆叠有期望性状的优秀的育种品系。本发明的方法现在第一次提供了一种用于防止病毒感染在马铃薯世代之间传播的方法,同时还解决了现有技术中很多其它与新型马铃薯品种育种和消费用马铃薯的商品化生产相关的问题。通过提供真正马铃薯种子(即植物学种子)使得该方法成为可能,该种子可以长成产生用于消费的块茎的马铃薯植物,且该种子来自至少一个亲本是二倍体、自交亲和且基本纯合的马铃薯品系的杂交中,优选所述种子来自其中两个亲本均是二倍体、自交亲和且基本纯合的育种品系的杂交中。该新方法的重要优点是以这种方法病毒感染的传播不会通过配子体散布,且种子可以有效地防止被病毒感染。本发明人现在提供了一种用于进一步培育容易操作且显示出改善的能育性和植物活力的纯合品系的方法,当与现有技术的近交相比,该方法同时维持自交亲和性和高水平的纯合性。应理解正如在番茄中一样,并总是需要100%的纯合性以提供有效的育种程序。只要维持自交亲和性,则这不是问题。现在,已经第一次成功示出农艺学期望或有益的性状进入纯合马铃薯品系中的基因转移。基于本文提供的手段和方法,技术人员应能够基于他自己的种质成功产生纯合的马铃薯育种品系。此外,技术人员应理解他通过提供的手段和方法能够例如将额外的性状堆叠进入目前提供的自交亲和和基本纯合的品系中,以建立富含农艺学期望性状且可在他们的权利中的商品化育种中用作种质的品系的种群。实例实例1.育种程序和谱系的一般描述作出很多尝试以产生马铃薯的纯合、能育、自交纯合的二倍体基因型,但没有成功。这些尝试包括使单倍体加倍,及随后筛选能育花的形式。利用了几种方法,像花药培养以再生单倍体且最终使单倍体纯合植物加倍、重复自交以逐渐增加在现存的二倍体种质中的纯合性水平,且通过使用s.phureja作为花粉供体进行皮刺授粉(pricklepollination)以诱导从未受精的卵细胞形成种胚。特别是通过分析超过两百万的后代大规模地实施了后一种方法,但没有获得期望的成功。这些测试没有得到有活力的自交亲和的植物。通过来源于公开的种质的品系的植物多个世代的自交获得基本纯合的马铃薯品系,该植物具有控制自交亲和性的sli基因(phumichai等.euphytica(2006)148:227–234)。这些植物(在本文中被定名为“h”或ivp07-1001/4)生长不良,具有非常少量的花且每个浆果仅包含少量的种子。此外,上述植物非常小(最大60cm)。这些植物几乎不产生块茎,且形成的块茎也非常小(平均块茎重量大约为5克/块茎)。总之,这些植物没有用作商品化马铃薯育种的价值,如它们显示出植物重量和块茎产量小于二倍体育种克隆rh89-039-16的20%。上述植物仅在它们的基因组中的很多基因座上含有纯合的等位基因,是自交亲和的且是二倍体。在2008年的夏天,该ivp07-1001/4品系的植物与不同的二倍体供体品系(d1、d2和d3,见完整谱系图2)杂交。d1是早期,具有长尺寸的椭圆形块茎、浅黄色果肉和良好蒸煮油炸制作品质和良好的蒸煮品质,且用作雄性亲本(表6)。得到的子代在该实例中被称作f1(d1)。以相似方式但使用供体d2作为雌性亲本获得其它f1后代植物。d2是基本非纯合但不是自交亲和的优秀的二倍体育种克隆,但d2具有早期蒸煮、椭圆形块茎、黄色果肉和制片的良好品质。这样得到被定名为f1(d2)的品系。上面的是d1的f1自交以产生f2(d1)。该品系被保藏在培植者编号agvd1下。估计agvd1为大约50%的同源性,意味着致使亲本不同的基因座中有大约50%是纯合的。f1(d1)与f1(d2)杂交以产生伪f2。该品系(f2(d1/2))被保藏在培植者编号agvd2下。估计agvd2含有大约25%的源自ivp07-1001/4的同源等位基因。是d1的f1还与ivp07-1001/4回交以产生bc1品系。该品系(bc1(d1)和bc1(d2))被保藏在培植者编号agvd3下。估计agvd3对于致使亲本不同的基因座为大约75%的同源性。通过使用供体d3作为雌性亲本以相似方式获得其它f1后代植物。d3是具有黄色果肉且具有抗性基因r3、h1、gpa2、rxadg的二倍体育种克隆。这样得到定名为f1(d3)的品系。与上面描述的相似,f1(d3)自交以产生f2(d3),且与sli基因供体回交以产生bc1(d3)后代。f1(d1)与f1(d2)杂交以产生伪f2。该品系(f2(d1/2))被保藏在培植者编号agvd2下。估计agvd2对于致使亲本不同的基因座为大约25%的同源性。f1(d1)还与ivp07-1001/4回交以产生bc1品系。该品系(bc1(d1))被保藏在培植者编号agvd3下。估计agvd3对于致使亲本不同的基因座为大约75%的同源性。bc1在冬季苗圃中自交,得到bc1s1种群。下一个夏天(2010年),f2、伪f2和bc1s1被播种在苗圃中的苗床上,且被移植在小的泥炭盆中。在2010年6月,幼苗被移植至荷兰的粘土和沙质土壤处的大田中。总计从幼苗生长出超过15000株植物,且对这些植物选择自交亲和性和良好的块茎品质和产量。大部分f2和bc1s1种群示出非常低频率的自交亲和性。选择具有合理的良好浆果和结实率的罕见植物,用于子代测试,而不进行进一步地农艺学评价。仅有两个源自d2xh杂交的f2种群示出大约25%的自交亲和性。对于自交亲和最强的种群的每一个种群,选出最多15株具有最佳块茎品质和数量的植物用于子代测试。伪f2的植物比其它种群示出更强的活力,可能这些植物不含有任何具有供体亲本的纯合等位基因的基因座。这些种群中的一个种群示出超过50%自交亲和性。与上面描述类似,还选出自交亲和最强的种群中的最多15株植物用于子代测试。此外,在供体d1~d19的两株或十二株植物(实例3)上,进行与来自大田作为花粉供体的自交亲和的植物杂交。在评价块茎品质和数量之后,如果缺少足够数量的杂交,则仅选择与所选择的植物或它们的全同胞(fullsib)杂交的用于子代测试。这样,在每一世代中,选择自交亲和且具有良好农艺学性能的植物。为了产生纯合的品系,收集这些所选择植物的自交浆果的种子用于进一步地测试。此外,所选择的植物与其它二倍体供体或其它育种品系杂交以增强基因变异。这些f1种子是杂合的,且需要几轮近交以产生具有期望性状的纯合的后代。这样,每年可以进行两个世代的选择、自交和杂交。甚至通过使用对特定性状的诊断标记物及随机标记物以选择回归亲本的基因组,利用标记物辅助育种增强该过程。当已经获得优秀亲本时,可以通过两代至三代的回交及两代自交制成这些品系的衍生物。实例2.培植自交亲和的二倍体马铃薯1.引言二倍体马铃薯的共有特征是自交不亲和性(si);当自受精时不会产生有生机的子代。已经描述了源自solanumtuberosum的s-基因座的抑制基因(sli)(euphytica99,191-197,1998)以抑制该自交不亲和性,且使二倍体马铃薯变成自交亲和(sc)。当重复自交时,已经产生接近纯合的自交亲和的二倍体马铃薯克隆(genome48,977-984,2005)。这些克隆的农业学品质非常差,实际上反映了不良的萌芽、植物生长、块茎品质和块茎产量。2.实验2.1材料为了开发具有更高水平的农业学性状的自交亲和的马铃薯克隆,我们使sli基因供体与定名为ivp97-079-9、ivpaa-096-18和sh83-92-488的不同的马铃薯克隆杂交。这些克隆可以在r.c.b.hutten博士(植物育种实验室,瓦格宁根大学,荷兰)处获得。如在本文在所使用的,这些克隆被分别定名为克隆d1、d2和d3。子代(f1)自交且与sli基因供体回交,分别产生f2和bc1种群。bc1自交以产生bc1s1种群。在除了植物的自交亲和性之外没有任何其它的选择的情况下,进行所有这些杂交和自受精。2.2在冬季试验中对子代的评价在预实验(pilotexperiment)中,几个随机的bc1和f2子代生长在热的温室中达接近三个月,该热的温室具有16小时人造光,而外部温度低于零度。我们以人工授粉之后具有浆果的植物的数量评价了自交亲和的百分比,并以每株植物的块茎的重量评价了产量(表2)。结果sli供体是自交亲和的(sc),且大部分f1和bc1植物也是自交亲和的,而少数f2植物是自交亲和的。sli供体示出极低的块茎产量,而bc1和一个f2是f1块茎产量的大约50%。一些bc1植物的块茎产量接近f1植物的块茎产量,且一些(未选择的)f2植物好于最弱的f1植物。表2.二倍体马铃薯育种程序以引入sli基因的冬季生长植物的一些特征*来自块茎**来自幼苗2.3大田中子代的评价在2010年的夏天,在大田中测试f2和bc1s1种群的子代植物以选择具有良好农业学性能的自交亲和的子代植物(表3)。表3.将自交亲和性(sc)引入二倍体马铃薯中的育种模式。粗体指示为最有希望的材料。*足够的结实率结果我们测试了包括30至840株植物的52个f2种群,及包括1至390株植物的62个bc1s1种群,总计分别有9660株f2植物和3901株bc1s1植物。大部分种群示出弱的植物生长和低频率的自交亲和性。仅有来源于d2亲本的两个f2种群示出大约25%的自交亲和的植物。基于块茎产量和块茎品质,选择这些种群中的最佳植物。3.结论在52个f2种群中仅有两个种群且没有bc1s1种群示出合理水平的自交亲和性。但是,可以从要不然已经被培植者忽略的材料起始出人意料地获得期望的植物。本发明的植物的与现有技术的那些植物的主要不同给出在下面的表4中。表4.建议用于产生杂种(真正)马铃薯种子的本发明的亲本马铃薯品系的特征。实例3.分子标记物平台的开发引言能够获得很多标记物系统以支持基因研究。对于本发明,开发了马铃薯中的分子标记物平台,且将该分子标记物平台用于评价二倍体马铃薯中的纯合性比杂合性的水平。用于snp检验的大部分提供信息的序列的选择为了分析马铃薯中的snp,之前已经使用了illuminastandardgoldengate方案(shen等.2005.mutationresearch573:70–82)(anithakumari等.2010.mol.breeding,26:65-75)。该平台包括384个snp,且后面使用768个snp进行扩充。已经使用est序列开发了这些384个和768个snp,est代表没有内含子序列的mrna。由于本发明人已经获取了马铃薯基因组的第一序列草图(www.potatogenome.net),因此能够将mrna与包含间插序列的基因组dna序列进行对比。使用本地序列基本搜索工具(basiclocalalignmentsearchtool)(blast;altschul等.1990.j.mol.biol.215:403-410)进行该与马铃薯基因组序列的对比。这样分别得到538和1681个搜索结果(hit)。多个blast搜索结果的出现被认为反映间接同源(paralog)或内含子跨越序列(intronspanningsequence)。将这些搜索结果从为goldengate分析首次开发的snp初始集合(anithakumari等.2010)中去除。得到279个和453个唯一的blast搜索结果,代表迄今已知的solanumtuberosum的phurejadm1-3516r44(cip801092)组的马铃薯基因组序列(马铃薯基因组测序协会(potatogenomesequencingconsortium),www.potatogemome.net)中仅有的一个拷贝的出现。从具有唯一blast搜索结果的总共732个snp中,由于高水平的序列错配(101bp内有3~6个snp)仅排除少量的snp(31个事例,平等地分布在384和768的组(set)中)。应预期一个错配,且容忍第二个snp以将其包含在所选择的snp-跨越序列中。对于现在的snp设计,将最小的序列长度设置为101bp。因此,81个序列因为它们较短而被去除。得到的553个序列具有至少101bp的长度。然后因为在经加倍的单倍体的支架(scaffold)内具有仅35个直到94个核苷酸的不完全匹配而去除总共100个序列(dm-3516r44;www.potatogenome.net)。还去除了具有引入的对比空位(alignmentgap)的序列及具有其它潜在错配问题的序列。虽然有25个序列没有满足上述标准,但仍然保留了它们,因为这些序列已知在goldengatesnp检验中是有高度信息量的。这些snp甚至允许区分在四倍体(voorrips等,eapr-eucarpiacongress“potatobreedingaftercompletionofthednasequenceofthepotatogenome”,27-30june2010,wageningen,thenetherlands,e-publicationathttp://edepot.wur.nl/143559,pg42)中出现的五种基因类别。最后,选择出515个序列。最终根据马铃薯基因图谱上的(515个标记物中的)237个标记物的已知图谱位置选择出100个序列(anithakumari等,2010和vanos等,genetics173:1075-1087,2006)。这些选择的标记物均匀分布在马铃薯12条染色体上,包括最远端端粒以及着丝粒标记物,该选择的标记物对在克隆rh(rh89-039-16;www.potatogenome.net)中是杂合的snp有偏向性,因为克隆rh是本研究中使用的材料的祖先。或者换句话说,克隆rh的等位基因也存在于在本研究使用的材料中(见表2和图3)。标记物的测试如上所述的选择的100个snp序列用于kasparsnp基因分型系统(kbioscience有限公司,hoddesdon,uk:http://www.kbioscience.co.uk/lab%20services/snp%20genotyping/genotyping_chemistry.html)。在包括用于本研究的三种二倍体亲本的20种二倍体马铃薯基因型的组(见图4)上测试标记物,且进一步在sli基因的供体(克隆07-1004-1)(同样参见本文中的实例2)上测试标记物。结果所有snp序列均在kasparsnp基因分型系统(见图4)中产生多态性,对应于100%的成功率。总共测试了100种标记物x20种基因型,包括2000个数据点。我们观察到有29个缺失数据(低于2%)。作为对照,对一种基因型测试两次,据此使用不同位置的植物样本(图4,第4列和第7列)。所有数据都相同。这些结果表明kasparsnp基因分型系统是一种用于二倍体马铃薯的有效、可靠且可重复的标记物平台。这也表明kasparsnp基因分型系统对二倍体马铃薯来说是有效、可靠且可重复的。所有标记物均示出在该实验中使用的二倍体马铃薯种质的出现频率较高(附录iii)。通过要求这100种标记物使得种质中的杂合子频率在26%至77%的范围内变化,同时sli基因供体为100%的纯合性,这与期望值一致(phumichai等,2005genome48:977-984)。在本研究中使用的sli供体以及三个亲本之间的提供信息的标记物的数量分别为54、52和62。这表明kasparsnp基因分型系统同样能够为二倍体马铃薯提供信息。基于上述情况,得出的结论是本文所述的基于本文开发的标记物的kasparsnp基因分型系统对描述二倍体马铃薯中的纯合性/杂合性来说是有效、可靠、可重复的,且能够提供大量信息。表5a.马铃薯100种snp标记物的序列表5b.potsnp标记物及其在图3的sh和rh图谱上的位置注释的列表表6用于snp标记物开发和测试的二倍体马铃薯基因型早熟:早期开花(周期短);qcook:良好的蒸煮品质;qfry:良好的油炸品质;phyt表示晚疫病抗性基因实例4.纯合二倍体马铃薯植物的开发及杂合f1杂种子代的生成引言该实例的目的在于开发自交亲和性(sc)且具有良好农艺学性能的纯合二倍体马铃薯品系。上述实例2中描述了以结合自交亲和性以及良好农艺学性能的育种程序。本次实验的目的在于证明可通过近交生成纯合的二倍体自交亲和的马铃薯基因型,且包含散布在马铃薯基因组上的相对的纯合的基因座的二倍体马铃薯植物可以进行杂交(互交)以生成杂合f1杂种子代。材料与方法在上面实例中描述的含有sli-基因的自交亲和的二倍体纯合的马铃薯基因型与定名为d1和d2的两个马铃薯克隆杂交(见实例1和2)。f1子代自交,且由两株随机的scf1植物生成两种f2子代。这两个f2种群的随机自交亲和植物自交,且对于每个f2种群,测试三个f3种群的纯合性水平以及snp标记物的分离。测试6株f2植物的倍性水平(通过dna的荧光定量),且发现该6株f2植物都是二倍体。应用涵盖马铃薯所有24条染色体臂(见图5)的kasparsnp基因分型系统(见实例3),将一组36个标记物用于265株个体f3植物上。结果在总共265株植物中,对于每对亲本对使用至少24种提供信息的标记物测试来自六个f3种群的35~56株植物的子集。总共使用了36种标记物(见图5)。标记物在马铃薯基因组上的位置见上述实例3。sli供体对测试的这些标记物来说是100%纯合的,同时对于每对亲本对,d1和d2亲本在24种提供信息的标记物中分别包含杂合的20和19个基因座,而其他五个和六个基因座包含来自供体亲本(d1或d2)的纯合等位基因。六株纯合的f3植物如所预料的那样,f3种群因f2中杂合的标记物而不是因在f2中固定的标记物而分离(图5)。平均杂合子水平在84%至95%的范围,同时个体植物的杂合性在71%至100%的范围内(表7)。表7.六个f3种群的纯合子频率(%)f3种群供体亲本平均值范围126d18574-96126bd18874-100127d18471-96121d28571-96122d28979-100123d29488-100使用超过100种提供信息的标记物确定从育种程序选择的一组f2、f3和f4植物的表型和基因型。根据自交亲和性、良好植物性能(活力)和良好块茎品质和产量来选择这些植物。通过应用如上所述的kasparsnp基因分型系统进行基因分型(见:用于snp检验的大部分提供信息的序列的选择;表5)。>100种标记物均匀分布在12条马铃薯染色体上。这样提供了比上面使用24种标记物甚至更好的覆盖率。在重复试验中,f2植物的产量在50克/植物至2500克/植物的范围,同时一些其它二倍体杂交得到在对照四倍体栽培品种的平均值之上的高达3100克/植物的产量。如在表9中所示,基于图5中的数据,分析d1xh及hxd2杂交得到的三个f3种群的纯合基因座的频率。期望这些频率给出亲本等位基因的频率。三个种群中有六株植物已是100%纯合的。这些植物主要含有具有sli供体等位基因的纯合基因座。这被认为是sli供体含有纯合等位基因的缘故,同时对于每个杂合的标记物而言,其他亲本包含一个与sli供体共有的等位基因。所以,来源于sli-供体的等位基因在全部后代种群中都很丰富。被定名为122-34、123-6、123-20、123-23、123-24和126b-17的这六株纯合f3植物分别包含具有来自供体亲本的纯合等位基因的两个、五个、四个、三个、五个和七个基因座。所以,代表24条染色体臂的24种标记物基因座已经在两个自交世代中达到100%的纯合性。类似地,在选择的f2、f3和f4植物上使用>100种标记物的基因分型数据示出个体植物的纯合性百分比的增加,f2的27~70%至f3的58~87%至最高纯合性的f4种群的85~99%。无绝对致死的等位基因常有报告指出二倍体马铃薯中的重复自交由于近交衰退缘故只会产生衰弱的植物。这应归因于纯合存在的降低植物适合度的大量有害等位基因。因此,我们在提到的六个f3种群中测试了36种标记物的分离(见图5)。还测试了这些标记物在19种选择作为育种程序的供体的二倍体马铃薯基因型中的频率(见实例3,图4和表9),选择这些标记物是因为它们能为本研究中的亲本对提供信息。如果存在致死基因,则不应存在具有纯合等位基因的基因座。实际上,七种标记物(定名为potsnp165、potsnp205、potsnp753、potsnp238、potsnp700、potsnp100及potsnp607)没有示出不同于该二倍体种质中的sli-供体等位基因的纯合等位基因。这些标记物大部分已固定在f2中,它们中的大部分因sli供体等位基因而在亲本中更加丰富,但同样观察了固定有针对非sli亲本的等位基因(种群126b和127中的potsnp753)的f3种群的实例。这七种标记物中的三种(potsnp205、potsnp753及potsnp100)在f3种群中分离,从而potsnp753正常分离,而potsnp205及potsnp100表现为偏(distorted)分离。这些可代表有害等位基因。只鉴定出一种具有纯合potsnp100供体的等位基因的植物。在不希望受理论约束的情况下,认为这可能代表非常有害的等位基因。由于已经鉴定出单株具有供体亲本的纯合等位基因的植物,因此不能充分证明为绝对致死等位基因。f3×f3杂交2010年的夏天,将测试的265株f3植物种植在不加热的温室中。此外,将大约600株另外的f3植物种植在粘土土壤的大田中(同样见实例2)。所有这些植物均来自荷兰冬季苗圃中生长的未经选择的f2植物(见实例2)。通过在温室生长的自交亲和的f3植物的柱头上涂覆来自温室及大田生长的自交亲和植物的花粉来进行杂交。仅在具有不同曾祖代亲本的f3植物之间进行杂交(种群121-123的f3植物与种群126-127的f3植物杂交)。定名为126-24、126-31、126b-2及127-21的温室植物作为雌性自交亲和亲本与来自种群123的自交亲和f3植物作为雄性亲本成功杂交。f3雌株的纯合性大于80%,而不测试大田中的f3植物,但种群平均纯合性水平为94%,范围在88%至100%之间。对比f3xf3杂交的亲本中已固定在f3种群中的基因座(见表8)。鉴定出在九条染色体上的十个纯合基因座,该十个纯合基因座在用于f3xf3杂交的四个雌性亲本中的一个和一个雄性亲本之间至少有明显差异。因此,f1杂种子代对于这些有相对(contrasting)的基因座来说至少是杂合的。由于每一个体亲本对包含至少五个有明显差异的基因座,因此每个个体子代植物将含有至少五个有明显差异的染色体区域。表8.对比f3xf3杂交的亲本之间的固定的基因座代码126-24、126-31、126b-2及127-21是指在与定名为“123”(见上文)的f3种群的一个大田生长的植物杂交中用作母本的个体f3植物。按照纯合基因座占所有测试基因座的百分比计算纯合性水平(图5)。“x”是指在四株雌性植物及种群123的一株植物之间的明显不同的等位基因的纯合标记物。结论发现自交两代后,获得纯合的二倍体马铃薯植物,包括来自两个亲本的等位基因。测试的36种标记物中没有一个标记物提供致死等位基因的证据。此外,具有大于84%纯合基因座的植物可成功杂交以获得具有至少五个杂合染色体区域的杂种植物。这意味着现已经生产出了基本上一致的且代表真正马铃薯种子的杂种种子。表9.在二倍体种质和f3种群中的全基因组snp标记物的等位基因频率#:植物的数量;hh:纯合的sli-供体基因座;dd:纯合的供体基因座;hd:杂合的基因座;%是杂合植物的百分比,数量小表示f3中的纯合性水平高。实例5.商品化马铃薯品种的育种模式从上述实例2和4中所述的sli供体和另一二倍体马铃薯之间的杂交获得的f3材料起始,开始下面阐述用于生产商品化马铃薯品种的育种模式。该模式由多个连续步骤组成,结合本文所述教导,允许技术人员获得与现有商品化杂种一样优质、或更优质,且在五年内比传统育种品种繁殖快得多的二倍体或四倍体的杂种马铃薯品种。1.产品品种定义根据本文所述的本发明,基于商品化杂种的生产,新型马铃薯品种的生产并不是机遇问题,而是一个由该品种产品的连接起始的直接设计的过程。本文中,必须定义用于特定市场(马铃薯片、淀粉产业、消费的马铃薯)的期望产品的概况(目标产品概况)。此外,必须定义产品概况中对相关性状的评价方法。优选地采用诊断标记物评价相关性状的存在。这样的标记物在传统马铃薯育种领域是熟知的。2.大田试验根据开发过程开始的季节,选择合适的试验田。当在九月或十月开始时,优选选择位于南半球的合适的试验田。大田试验可起始于至少2个、优选更多的f3种群,所述f3种群选自二倍体sli供体与另一充当农艺学性状供体、优选活力性状供体的二倍体马铃薯基因型杂交种的至少一个、但优选多个,其中f3种群代表如本发明的实例2中例示的二倍体、能育的、自交亲和且基本纯合且有活力的马铃薯品系。除了这些f3种群之外,f1子代取自至少两株,优选多株经选择的f2植物(如上述实例2中所例示的),所述f2植物与经选择的f2植物的祖代不同的至少两种、优选多种二倍体马铃薯基因型杂交。然后让这些f3和f1种群的至少50株、优选更多的个体植物在选择的马铃薯大田中生长,且自交。3.评价与选择在大田中生长的过程中,对开花后2~6周之内带有浆果的自交亲和植物的频率进行评价,且选择具有至少10%、优选更多的自交亲和植物的至少两个、优选更多的f3和f1种群。进一步地,在生长季节中,对所选种群中的自交亲和植物的产品概况中所述的农艺学特征进行评价。采集所选种群的所有自交亲和植物的叶片样本用于dna标记物的测试。在生长季节结束时,对所选种群中的自交亲和植物的块茎品质和数量进行评价,且利用诊断且随机的标记物对dna标记物基因型进行评估。基于该评价及评估,在下列条件的基础上在每个种群中选择至少五株、优选更多的自交亲和的植物:(i)最接近目标产品概况的性状组合;(ii)最高纯合性水平;及(iii)最大数量的相对纯合的基因座。经选择并自交的f3和f1植物分别提供种子形式的f4和f2子代。4.块茎和种子的收获及运输开花后在至少六周、优选六周以上的时间段内收获所选的f3和f1植物的块茎以及这些所选植物的浆果中的f2和f4种子。采集f4种子用于进一步的包括测试由此长出来的f4植物之间的一般配合力的大田试验,且f2种子为育种提供额外的基因库,并采集f2种子用于进一步的大田试验。根据季节,且为了保证时间,可适当将种子运输至北半球以在温室中生长,但条件是要满足所有涉及的国家植物检疫法规。5.块茎储藏及评价所选的f1和f3植物的块茎优选储藏在种植地区以免不希望的病原体和害虫的传播,且评价这些储藏块茎的在产品概况中定义的储藏块茎的某些相关内在的块茎性状。6.1年后块茎的增殖及评价在下一季种植所选的f1和f3植物的块茎,优选种植在与原来马铃薯田相同的区域,以免不希望的病原体或害虫的传播。每个地块使用至少两种、优选更多种马铃薯块茎,且每一克隆优选使用一个、优选多个复制本。使用至少一种、优选多种有关的商品化栽培品种作为对照。优选使用具有商品化栽培品种的边行(side-row)以避免边缘效应。对产品概况中定义的有关植物特征(例如蒸煮、油炸、制片、淀粉含量等)进行评价。进一步评价每个地块的块茎产量以及如在产品概况中定义的内在相关的块茎特征。这样的评价用于家族特征化及子代选择。每年都重复进行这些试验,优选在南北半球位置都进行以便连续选择在大田中生长的植物的祖先性质。在生长后期,当获得杂种时,进行商品化引入的测试,将评价试验推广到针对在至少一平方米、优选多个平方米的地块大小上的至少两个、优选更多个复制本,且推广至至少两个、优选更多个位置上进行,但不限于目标市场。7.与f4种子测交及大田试验采集所选的自交f3植物的f4子代种子之后不久,播种这些种子中的至少五十、优选更多个种子。如果需要,可以在加热温室中进行该播种。播种后大约1个月后优选将幼苗移植到小盆(pot)中,然后在几个星期之后被移植到合适位置的大田中。继续进行上述评价和选择,且每个种群中的至少两株、优选更多株所选的f4植物与具有最大数量的相对基因座的两个、优选更多个所选亲本的至少两株、优选更多株其他的所选f4子代植物测交,以生产测试杂种(f4xf4→杂种)。另外,每个种群中的至少两株、优选更多株所选f4植物与具有所选植物所没有的期望特征或性状的至少一种、优选更多种的二倍体基因型杂交,以提高育种种质的基因多样性。进一步地,每个种群中的至少两株、优选更多株所选f4植物自交以生产f5种子。更进一步地,对每个种群中的至少两株、优选更多株所选f4植物的植物的一部分进行灭菌,体外增殖,并用合适的化学品(秋水仙素/俄瑞扎林(oryzaline))进行处理,以产生四倍体f4基因型,且利用四倍体f4植物在与上述相同的亲本之间进行测交。每年重复进行上述育种模式,由此实现了产品概况中定义的植物性状的持续提高。由测交得到的块茎的评价有助于确定亲本的一般配合力。一般配合力在本文被定义为一系列杂交中品系的平均性能。针对每个市场实现至少两个、优选更多个产生商品化杂种种子的优秀亲本品系。预计在五年内生成与现有商品化杂种一样优质或更优质,且比传统育种品种增殖快得多的二倍体或四倍体杂种品种。实例6.期望性状的引入为了产生根据本发明的新型杂种品种,产生基本纯合的育种品系,从该育种品系可以通过两个基本纯合的亲本育种品系衍生出f1商品化杂种。这些基本纯合的亲本育种品系是由一致的二倍体、自交亲和且有活力的植物组成的品系,该一致的二倍体、自交亲和且有活力的植物具有每株植物多于200克、优选500克的新鲜块茎产量。依赖于亲本的一般配合力,这些亲本品系的每一株均携带被转移入后代f1中的性状。亲本品系是本发明的一个方面。相对于在早期共同待决的申请pct/nl2010/050716中描述的植物,这些植物包括额外的性状。这些额外的性状可包括任何农艺学期望的性状,优选地选自在表10中提供的性状。为了产生本发明的亲本品系,可使用下面的方法。a.从已知来源并入农艺学期望的性状在性状已知,但唯一的可用信息是关于可用作性状来源的供体加入物(accession)或供体品种的知识的情况下,可适当地使用下面的方法以产生本发明的植物。提供包括期望性状的(野生型)加入物或品种的植物,且在所述性状供体品系的植物和来自基本纯合的育种品系的植物(本文指受体育种品系的植物)之间进行杂交。根据本发明的基本纯合的育种品系是二倍体、自交亲和、有活力、基本纯合且具有相当于超过200克、优选超过500克新鲜块茎重量的块茎产量的品系,在该品系中引入了额外的期望性状。从通过上述杂交产生的杂种后代植物中,通过进行对性状存在进行表型筛选(如生物检验)选择显示出所述性状的植物。使用基本纯合的受体育种品系作为回归亲本,且再次通过使用表型筛选选择显示出所述性状的后代植物,进行重复回交以监控导致期望性状产生的基因从性状供体至受体育种品系的成功转移,其中所述回交步骤用以保持受体育种品系的基因组背景。进行重复的回交和选择过程,以便留下供体的不期望的性状而使感兴趣的基因转移至受体育种品系中。然后,这些步骤提供在其基因组中收集有农艺学期望性状的额外基因的马铃薯育种品系。最后,从这些回交和选择步骤得到的植物自交以提供具有并入其中的期望性状的纯合的受体育种品系。在性状遗传(显性对隐性;单基因对多基因)上的基因信息是已知的情况下,可以对回交和选择步骤进行优化以使性状从供体转移至基本纯合的受体育种品系中。技术人员应意识到需要各种步骤以优化该转移。例如,在隐性性状的情况中,为了确定杂种是否包含以杂合形式存在的性状的等位基因,表型筛选应涉及杂种的额外自交。包含等位基因的植物用于进一步地回交。在包括期望性状的来源加入物或品种不能与来自基本纯合的受体育种品系的植物杂交的情况下(即如果它们是不可杂交的物种),可使用下面的用于种胚挽救的方法。一株植物的花粉用以使另一植物的胚珠受精(其中任意一株可以是供体或受体),受精后形成种胚,且通过从胚珠分离来挽救得到的种胚。可以使合子种胚与它们的种皮分离,然后被能够增强它们生长和生存能力的辅助剂封包,然后培养该种胚,优选在无菌受控的条件下培养该种胚,以通过组织培养技术提供种间杂种(见例如m.monnier,"cultureofzygoticembryos,"frontiersofplanttissueculture,t.a.thorpe,ed.theinternationalassociationforplanttissueculture,universityofcalgary,alberta,canada,pp.277-280,1978;ramonandhanneman,2002,introgressionofresistancetolateblight(phytophthorainfestans)fromsolanumpinnatisectumintos.tuberosumusingembryorescueanddoublepollination.euphytica127(3):421-435)。可选择地,可以对来自性状供体的基因进行克隆,且通过如下面所述的转化技术将克隆的基因引入受体植物中。能预见可以开发基因标记物用于监控后代植物中的性状的存在。可以通过发现与性状相关联的基因组序列(如通过连锁作图研究)来进行所述标记物的开发。连锁图谱是示出其已知基因或基因标记物就重组频率而言相对于彼此的位置的物种或实验种群的基因图谱,而不是已知基因或基因标记物沿每一条染色体的具体物理距离。连锁图谱是基于在同源染色体的交叉的过程中标记物之间重组频率的图谱。两个基因标记物之间重组(分离)频率越高,则假定它们相距越远。相反,标记物之间的重组频率越低,则它们之间的物理距离越小。可使用确认或假定的非编码dna序列(如微卫星或那些生成限制性片段长度多态性(rflp)、aflp、snp、caps、rapd、est、ssr或issr标记物)作为标记物,且可共同鉴定一条染色体上示出与感兴趣的表型性状相连锁的多个相邻标记物以定义该性状的定量性状基因座(qtl)。技术人员应意识到这些技术。b.通过标记物辅助的育种的基因渗入在可用作性状来源的供体加入物或供体品种是已知的,且可辅助选择那些可能包含新型性状的等位基因的后代植物的基因标记物是可用的情况下,使用下面的方法。提供包括期望性状的(野生型)加入物或品种的植物,且在所述性状供体品系的植物和来自根据本发明的基本纯合的育种品系的植物之间进行杂交。通过进行标记物辅助选择的步骤从杂种后代植物中选择可能显示出所述性状的植物。至此,测试后代(其中所述后代可以为种子、种胚或植物的形式)的核酸(优选dna)是否存在与所述性状有联系的标记物,以便确认所述后代中是否潜在存在所述性状的等位基因。标记物可以是微卫星、rflp、aflp、snp、caps、rapd、est、ssr或issr标记物,或技术人员可用的任何其它标记物。然后使用根据本发明的基本纯合的受体育种品系作为回归亲本进行重复回交,且通过标记物辅助选择来选择可能包含上述性状的等位基因的后代植物,以监控包含产生期望性状的基因的基因组片段从性状供体至受体育种品系的成功转移,其中所述回交步骤用以保持或增加子代中受体育种品系的基因组背景或基因贡献(geneticcontribution)。进行重复回交和选择的过程,以便留下供体品系的不期望的性状而使感兴趣的基因转移至受体育种品系中。可以通过选择对回归亲本(基因组)特异性的(随机)标记物来降低需要基本恢复回归亲本基因组的世代的数量。最后,通过选择与期望等位基因联系最紧密的重组事件,可限制基因累赘(geneticdrag)。然后,这些步骤提供了具有使农艺学期望性状的额外基因并入其基因组中的马铃薯育种品系。最后,由这些回交和选择步骤所得到的植物自交以提供其中并入额外期望性状的纯合育种品系。在由回交步骤所得到的所有后代植物中和/或优选在纯合育种品系中,可以通过表型筛选(例如生物检验)确认期望性状的存在。在性状遗传(显性对隐性;单基因对多基因)的基因信息是已知的情况下,可以对回交和选择步骤进行优化以实现性状从供体至基本纯合的受体育种品系的成功转移。技术人员应意识到优化前面所述的转移所需要的各种步骤。在包括期望性状的加入物不能与来自根据本发明的基本纯合的受体育种品系的植物杂交的情况下(即如果它们是不可杂交的物种),可使用上述的种胚挽救方法。可选择地,可以对来自性状供体的基因进行克隆,且通过如本文下面所述的转化技术将克隆的基因引入受体植物中。可通过本发明的该方面产生的植物(其中进行使用已知的性状供体进行标记物辅助育种)包括如下性状:对晚疫病菌的抗性,在如vandervossen等.(plantj.36(6):867-882,2003)中所述的标记物ct88-ct64之间的solanumbulbocastanum染色体7上的基因座rpi上;对晚疫病菌的抗性,存在于solanumdemissum染色体11上的基因座r6-r11上,如在el-kharbotly等.1996;black等.,(1953);和huangs(2005)中所述;及进一步如在表10中示出的。因此,本发明涉及由两个基本纯合的亲本育种品系之间杂交所得到的杂种植物,该两个基本纯合的亲本育种品系中的至少一个已经在其基因组中并入且提供给f1杂种以下性状:对来自solanumbulbocastanum或solanumdemissum的晚疫病菌的抗性;对来自solanumtuberosum的亚种andigenacpc1690或1673的g.rostochiensisro1的抗性;对来自solanumtuberosum亚种andigena的g.pallida的抗性;对来自solanumtuberosum登录号78-3778的globoderarostochiensisro5-22和g.pallidapa2-d383的抗性;对g.pallidapa2和pa3vanwelkeaccessie????的抗性;对来自solanumtuberosum登录号3704-76的g.pallidapa3的抗性;对来自solanumbulbocastanum的m.chitwoodi的抗性;对来自solanumfendlerii和solanumhougassii的m.chitwoodi/m.fallax的抗性;对来自solanumchacoense和solanumtarijense的m.hapla的抗性;对来自solanumtuberosumcvpentlandivory的pvx的抗性;以及对来自solanumtuberosumdw83-3121的pvs的抗性。c.已知基因进入二倍体、基本纯合且自交亲和的育种品系在可用作性状来源的供体加入物或供体品种是已知的,且在该来源中产生所述性状的基因序列是可用的情况下,可使用下面的方法用于将该基因并入受体育种中。可开发基于核酸检测的测试,用于确定植物部分中的基因的存在,包括例如用于以序列特异性方式(例如pcr)扩增所述基因(的一部分)的扩增引物。这样的测试可以用在如上所述的标记物辅助育种的方法中,作为基于连锁图谱研究检测与所述形状相关联的标记物的替代方式。基因检测的优点是可以以单一的检验明确确认基因的存在,因为基因序列可以提供具有100%可靠性的诊断标记物。因此,提供包括期望的额外性状的(野生型)加入物或品种的植物,且在所述性状供体品系的植物和来自基本纯合的受体育种品系的植物之间进行杂交。通过在后代植物中进行确定赋予性状的基因存在的步骤,从后代植物中选择显示出所述基因的植物。至此,通过使用用于序列特异性检测的方法(如pcr检测)测试后代(其中所述后代可以为种子、种胚或植物的形式)的核酸(优选dna)是否存在产生所述性状的基因。然后使用基本纯合的育种品系作为回归亲本进行重复回交,且通过使用如上所述的序列特异性检测的方法从由此产生的后代中选择包含所述基因的后代,以监控产生期望性状的基因从性状供体至基本纯合的育种品系的成功转移,其中所述回交步骤用以保持基因组背景或增加子代基因组中育种品系的基因贡献。然后,这些步骤提供了具有受体品系关于农艺学期望性状的所有特征,且进一步包括新的期望基因的马铃薯育种品系。最后,由这些回交和选择步骤所得到的植物自交以提供其中以纯合形式并入期望基因的纯合育种品系。在由回交步骤所得到的所有后代植物中和/或优选在纯合育种品系中,可以通过表型筛选(例如生物检验)确认期望性状的存在。可选择地,可以使用基因转化的方法,其中从供体加入物或供体品种的染色体中分离基因,或其中产生合成的基因,且其中通过基因转化技术将所述分离或合成的基因随后引入根据本发明的受体品系中。根据本发明的一个方面,包括本文中定义的及下面表10的性状中的一个或多个基因的核酸(优选dna)序列可以用于产生具有额外农艺学期望性状的马铃薯育种品系的植物。在这个方面,本发明提供了本文定义的农艺学期望性状的基因用于产生本文定义的基本纯合的受体育种品系的用途,该用途包括将包括所述基因的核酸序列引入所述基本纯合的受体育种品系的适当受体植物中。如上所述,所述核酸序列可以来源于适当的供体植物,且可以通过基因渗入(杂交)或通过转化引入所述核酸序列。对于转移包括农艺学期望性状的期望基因的核酸序列的转基因方法,可以通过本领域已知的方法从所述供体植物中分离,因此通过用于植物转化的转基因方法(例如通过载体的方式)将在配子中或在任何其它适当的转移元件(如被所述核酸序列包裹颗粒进行的轰击)中的分离的核酸序列转移至受体植物。植物转化通常包括具有将在植物细胞中行使功能的表达盒载体的构建。在本发明中,这样的载体由包括期望基因的核酸序列组成,该载体可包括在调节元件(如启动子)控制下的或与调节元件可操作地连接的基因。表达载体可包含这样的一个或多个可操作地连接的基因/调节元件的组合,但前提是组合中包含的至少一个基因赋予农艺学期望性状。所述载体可以是质粒的形式,且所述载体可以单独使用或与其它质粒组合使用,以使用本领域已知的转化方法(如农杆菌(agrobacterium)转化系统)提供包含所述基因的转基因植物。还以转基因方法的形式,可以从供体植物中分离包括农艺学期望性状的期望基因的核酸序列,该供体植物可以与种植的马铃薯(s.tuberosum)杂交。这样的核酸序列被定名为同源基因(cisgene)(jacobsen&schouten,2008,pot.res.51:75-88)。同源基因经由本文所述的转化技术引入马铃薯(定名为“同源转基因(cisgenesis)”或“基因内途径”)被认为是基因转化技术,由此生成的产物的安全性与传统育种或突变育种相似(rommens等.,2007,plantscience12:397-403;jacobsenandschouten,2008,pot.res.51:75-88;rommens,2010,biotechnologyinagricultureandforestry64,61-77)。现今,同源转基因已经应用在马铃薯中(jacobsenandschouten,2008,pot.res.51:75-88;www.cisgenesis.com)。表达载体可包括可操作地连接至调节元件(如启动子)的至少一个标记物基因,从而允许通过负选择(通过抑制不包含可选择的标记物基因的细胞的生长),或通过正选择(通过筛选由标记物基因编码的产物)来找回包含标记物的转化的细胞。很多普遍使用的用于植物转化的可选择的标记物基因在本领域是已知的,且包括例如:编码新陈代谢地除去选择性化学试剂的毒性的酶的基因,该化学试剂可以是抗生素或除草剂;或编码改变的目标的基因,该改变的目标对抑制剂不敏感。几种正选择方法在本领域是已知的,如甘露糖选择。可选择地,可以使用标记物-较少的转化以获得没有提到的标记物的基因的植物,用于该过程的技术在本领域是已知的。一种用于将表达载体引入植物中的方法是基于农杆菌的天然转化系统(见例如horsch等.,1985,science227:1229-1231)。a.tumefaciens和a.rhizogenes是基因转化植物细胞的植物致病性土壤细菌。a.tumefaciens和a.rhizogenes的ti和ri质粒分别携带用于植物基因转化的基因。将表达载体引入植物组织的方法包括直接感染或植物细胞与agrobacteriumtumefaciens共培养。在美国专利号5,591,616中提供了农杆菌载体系统的描述和用于农杆菌介导的基因转移的方法。可以在gruber和crosby,1993(见gruber和crosby,1993.vectorsforplanttransformation.in:b.r.glick和j.e.thompson,编辑methodsinplantmolecularbiologyandbiotechnology,crcpress,bocaraton,第89-119页中发现植物表达载体和报告基因和转化方案的普通描述及农杆菌载体系统和用于农杆菌介导的基因转移的方法的描述。例如miki等,1993(见miki等,1993.procedureforintroducingforeigndnaintoplants.in:methodsinplantmolecularbiologyandbiotechnology,ed.glickandthompson,crcpress,bocaraton,pages67-88)提供了培养植物组织的普通方法。用于分子克隆技术和适当的表达载体的适当的参考书是sambrook和russell的《分子克隆实验指南(molecularcloning:alaboratorymanual)(第三版)》(冷泉港实验室出版社,2001)。另一用于将表达载体引入植物中的方法是基于微粒介导的转化(微粒轰击),其中,dna被携带在微粒的表面。表达载体经生物枪装置(biolisticdevice)被引入植物组织中,该生物枪装置使微粒加速至足以穿透植物细胞壁和膜的300~600m/s的速度。另一用于将dna引入植物中的方法是经由目标细胞的超声波处理(sonication)。可选择地,脂质体或原生质球融合可用以将表达载体引入植物中。也可以使用经cacl2沉淀、聚乙烯醇或多聚鸟氨酸将dna直接摄取入原生质体,如可以是原生质体及整个细胞和组织的电穿孔。其它基于在大肠杆菌中发现的天然存在的f-因子的质粒的公知的技术(如使用bac)可例如被用于与bibac系统组合以产生转基因植物,其中马铃薯基因组的一部分被引入细菌人工染色体(bac)中,细菌人工染色体(bac)即为用以在大肠杆菌(escherichiacoli)细胞中克隆dna片段(100-bp至300-kb插入大小;平均,150kb)的载体。马铃薯目标组织转化之后,上述可选择的标记物基因的表达允许使用本领域中现在公知的再生和选择方法优选选择被转化的细胞、组织和/或植物。可以通过本发明的该方面产生的植物,其中被引入受体育种品系中的已知的马铃薯基因包括那些含在表10中示出的黄色果肉颜色、橙色果肉颜色、直链淀粉/支链淀粉、制片品质、低温糖化、淀粉含量和炸薯条品质(frenchfryquality)、黑斑瘀伤、酚类抗氧化剂、丙烯酰胺水平、淀粉磷酸盐含量和油炸品质、对晚疫病菌的抗性、对g.rostochiensisro1的抗性及对马铃薯病毒y(pvy)和马铃薯病毒x(pvx)的抗性的性状,及由genbank登录号hm013963.1、hm013964.1、hm013965.1、x58453.1、x70368.1、eu684230.1、x73477.1、aj133765、hq110081、hq197977、ay341425.1、ay864819.1、ay864820.1、fj810205.1、fj810206.1、fj810207.1、fj810208.1、fj810209.1、ay864821.1、gu980593.1、gu980594.1、gu980595.1、u22921.1、u22922.1、u22923.1、ay205302.1、eu310399.1、ck278037.1、ck271149.1、af143202.1、y09533.1、fj536325.1、fj536323.1、gu563971.1、gu563972.1、gu563973.1、fj536324.1、fj423045.1、fj423046.1、ay336128.1、dq122125.1、fj188415.1、ay196151.1、af195939.1、y15297.1和aj300266.1的基因赋予的性状。在本文中使用的所有genbank登录号指ncbi-genbankflatfilerelease183.0在2011年4月21日的基因序列数据库(geneticsequencedatabank)。因此,本发明涉及由两个基本纯合的亲本育种品系之间杂交得到的杂种植物,该两个基本纯合的亲本育种品系中的至少一个已经在其基因组中并入且提供给f1杂种:β-胡萝卜素羟化酶2(chy2)的基因、玉米黄质环氧化酶(zep)的基因、颗粒结合淀粉合成酶的马铃薯基因、β-呋喃果糖苷酶或马铃薯酸性转化酶的基因、蔗糖磷酸合成酶的基因、假定转化酶抑制剂前体(putativeinvertaseinhibitorprecursor)(inh1/inh2)的基因、块茎多酚氧化酶ppo的基因、蔗糖合成酶的基因、绿原酸诱导因子(chlorogenateinducer)的基因、天冬酰胺合成酶的表达序列标签est724115和est717227、磷酸化酶-l基因、r1蛋白或葡聚糖水二激酶(glucanwaterdikinase)的基因,这些基因均来自solanumtuberosum;s.demissum的r2和r2-样蛋白基因,.hjertingii的r2晚疫病抗性蛋白(rpi-hjt1.3)的基因,abptrpi蛋白基因,s.venturii晚疫病抗性蛋白,s.bulbocastanum假定的疾病抗性蛋白rga2的基因,s.bulbocastanum晚疫病抗性蛋白rpi的基因,s.bulbocastanum晚疫病抗性蛋白rpi-blb2(rpi-blb2)的基因,s.bulbocastanum的nbs-lrr抗性蛋白(rpi-bt1)的基因,s.tuberosum线虫抗性蛋白(gro1-4)的基因,s.tuberosum的疾病抗性蛋白gpa2的基因,s.tuberosum亚种andigena的adg2/2x(v-2)7a基因控制的对马铃薯y和a马铃薯y病毒属(potyviruses)的抗性,和/或s.tuberosum亚种的抗性基因-样、外显子1~6、剪接变体c38和c19的andigenary-1基因。d.可用的转基因植物的用途根据本发明,可以使用之前已经整合入马铃薯基因组中的转基因序列。可以通过与携带期望性状的基因的转基因植物进行杂交来生成本发明的植物。可选择地,可以经由转化技术将转基因直接引入育种品系的植物中。可以在本发明的该方面中使用的转基因马铃薯植物包括:包含如在表10中示出的红色花青素、蓝色或紫色色素,块茎皮的色素沉着,对晚疫病菌的抗性的那些转基因的性状;及由genbank登录号ay289924.1、ay675561.1、ay675560.1、ay675558.1、ay675559.1、ay841129.1、af447489.1、ay849382.1和fj188415.1的基因所赋予的性状。所有在本文中使用的genbank登录号指ncbi-genbankflatfilerelease183.0在2011年4月21日的基因序列数据库。因此,本发明涉及由两个基本纯合的亲本育种品系之间杂交得到的杂种植物,该两个基本纯合的亲本育种品系中的至少一个已经在其基因组中并入且提供给f1杂种:二氢黄酮醇4-还原酶基因、类黄酮3’,5’-羟化酶基因和/或花青素-1产生途径的r2r3myb转录调节因子的基因,这些基因均来自s.tuberosuml.;s.demissum的晚疫病抗性蛋白(r1)基因,来自s.tuberosuml.的马铃薯晚疫病抗性蛋白r3a的基因,及s.bulbocastanumnbs-lrr抗性蛋白(rpi-bt1)的基因。为了制得纯的或近交增加的品系,如上所述的均具有所述基因渗入或转化的马铃薯育种品系的所有植物可以通过与回归亲本连续回交的步骤产生良种品系。因此,在本文所述的本发明的所有方面中,本发明还提供了优秀的或近交的马铃薯品系。包含额外期望性状的本发明的基本纯合的育种品系的植物是二倍体,且可以通过本领域已知的方法开发成四倍体植物。实例8包含额外期望性状的本发明的基本纯合的育种品系的植物是二倍体,且可以在杂交中用作亲本以产生商品化的f1杂种(或品种)。包含额外期望性状的的本发明的基本纯合的育种品系的植物包含如在表10中所述性状或基因中的至少一种、优选至少两种或三种、更优选至少四种、仍然更优选至少五种。包含额外期望性状的的本发明的基本纯合的育种品系的植物优选包含选自表10中与块茎性状相关的基因中的至少一个基因,优选与选自表10中与处理或块茎品质性状相关的基因中的至少一个基因组合,优选进一步与选自表10中的与晚疫病菌抗性有关的基因中的至少一个基因组合,优选进一步与选自表10中的与线虫抗性相关的基因中的至少一个基因组合,优选进一步与选自表10中的与病毒抗性相关的基因中的至少一个基因组合。可选择地,根据本发明的基本纯合的育种品系的植物包含至少两个基因,该两个基因中的一个选自表10中与块茎性状相关的基因,且另一个选自表10中与处理或块茎品质性状相关的基因,或选自表10中与晚疫病菌抗性相关的基因,或选自表10中与线虫抗性相关的基因,或选自表10中与病毒抗性相关的基因。在又一可选择的方式中,根据本发明的基本纯合的育种品系的植物包含至少两个基因,该两个基因中的一个选自表10中与处理或块茎品质性状相关的基因,且另一个选自表10中与晚疫病菌抗性相关的基因,或选自表10中与线虫抗性相关的基因,或选自表10中与病毒抗性相关的基因。在又一可选择的方式中,根据本发明的基本纯合的育种品系的植物包含至少两个基因,该两个基因中的一个选自表10中与晚疫病菌抗性相关的基因,且另一个选自表10中与线虫抗性相关的基因,或选自表10中与病毒抗性相关的基因。在又一可选择的方式中,根据本发明的基本纯合的育种品系的植物包含至少两个基因,该两个基因中的一个选自表10中与线虫抗性相关的基因,且另一个选自表10中与病毒抗性相关的基因。可选择地,根据本发明的基本纯合的育种品系的植物包含至少三个基因,该三个基因中的第一个选自表10中与块茎性状相关的基因,第二个选自表10中与处理或块茎品质性状相关的基因,且第三个选自表10中与晚疫病菌抗性相关的基因,或选自表10中与线虫抗性相关的基因,或选自表10中与病毒抗性相关的基因。在又一可选择的方式中,根据本发明的基本纯合的育种品系的植物包含至少三个基因,该三个基因中的第一个选自表10中与处理或块茎品质性状相关的基因,第二个选自与晚疫病菌抗性相关的基因,且第三个选自表10中与线虫抗性相关的基因,或选自表10中与病毒抗性相关的基因。在又一可选择的方式中,根据本发明的基本纯合的育种品系的植物包含至少三个基因,该三个基因中的第一个选自表10中与晚疫病菌抗性相关的基因,第二个选自表10中与线虫抗性相关的基因,且第三个选自表10中与病毒抗性相关的基因。表10.适用于并入二倍体马铃薯育种品系的性状。技术人员使用根据本发明的上述任何基本纯化的亲本育种品系均能够创建多样的可能的亲本品系组合。因此,在杂交中使用这些亲本品系中的两个以产生f1马铃薯品种可得到同等多样的可能f1杂种。通过筛选以下三种特征中任一种可容易地将本发明的杂种植物(f1杂种)与现有技术的马铃薯杂种区分开:(基因)一致性、低等位基因频率,和提供有活力的加倍的(双)单倍体。基因一致性根据本发明的杂种品系显示出一致性,意味着在通过使两个基本纯合的育种品系(至少其中一个是根据本发明的纯合的育种品系)杂交所产生的品系或品种内植物特征从植物至植物是一致的。相反,现有技术的杂种马铃薯品系没有示出一致性。事实上,在现有技术的马铃薯品系中,相同品系的不同植物的特征是不同的。虽然生长增殖的传统马铃薯品种也是基因一致的,但是当这样传统的品种由种子开始种植(真正的马铃薯种子,tps)时,植物不是基因一致的。因此,与真正的马铃薯种子相比,根据本发明各方面的马铃薯品种是基因一致的且独特的。因此,可以通过测试植物相对于该品系的其它植物是否是一致的来识别根据本发明的杂种植物。低等位基因频率在传统四倍体马铃薯品种和育种克隆中超过80%的基因座是四基因的,意味着四个不同的等位基因存在于四倍体基因组的基因座上。3~5%是三基因的,且少于1%是二基因的。因此,存在显著高频率的三基因和四基因的基因座。本发明的二倍体马铃薯杂种可以进行染色体加倍,从而得到四倍体杂种。由此产生的四倍体杂种没有三基因或四基因的基因座,且因此容易使用分析等位基因频率的标记物分析与现有技术的四倍体相区分。有活力的加倍的(双)单倍体本发明人已经从二倍体马铃薯品系生成四倍体品系和杂种。有一些关于从四倍体马铃薯生成双单倍体和加倍的双单倍体的文献。结果是从来没有从加倍的(双)单倍体植物生成出有活力且能育的子代。这很可能是因为可频繁出现在传统马铃薯品种中的有害的隐性基因。由于有害等位基因已经在育种过程中被去除的事实,如本文所述的来自新型马铃薯品系的加倍(双)单倍体是有活力的。因此,本发明各方面的杂种(f1)马铃薯品系容易与现有技术的二倍体品系相区分,显现为有活力且能育的加倍的(双)单倍体。表10的参考文献1.bakker,e.,butterbach,p.,rouppevandervoort,j.,vandervossen,e.,vanvliet,j.,bakker,j.&goverse,a.(2003).geneticandphysicalmappingofhomologuesofthevirusresistancegenerx1andthecystnematoderesistancegenegpa2inpotato.theor.appl.genet.106:1524-15312.ballvora,a.,ercolano,m.r.,weiss,j.,meksem,k.,bormann,c.a.,oberhagemann,p.,salamini,f.&gebhardt,c.(2002).ther1geneforpotatoresistancetolateblight(phytophthorainfestans)belongstotheleucinezipper/nbs/lrrclassofplantresistancegenes.plantj.30:361-3713.bendahmane,a.,kanyuka,k.&baulcombe,d.c.(1999).therxgenefrompotatocontrolsseparatevirusresistanceandcelldeathresponses.plantcell11:781-7924.black,w.,mastenbroek,c.,mills,w.r.&peterson,l.c.(1953).aproposalforaninternationalnomenclatureofracesofphytophthorainfestansandofgenescontrollingimmunityinsolanumdemissumderivatives.euphytica2:173-1795.bonierbale,m.w.,plaisted,r.l.&tanksley,s.d.(1988).rflpmapsbasedonacommonsetofclonesrevealmodesofchromosomalevolutioninpotatoandtomato.genetics120:1095-11036.bradshaw,j.e.,meyer,r.c.,milbourne,d.,mcnicol,j.w.,phillips,m.s.&waugh,r.(1998).identificationofaflpandssrmarkersassociatedwithquantitativeresistancetogloboderapallida(stone)intetraploidpotato(solanumtuberosumsubsp.tuberosum)withaviewtomarker-assistedselection.theor.appl.genet.97,202-2107.brown,c.r.,yang,c-p.,mojtahedi,h.,santo,g.s.&masuelli,r.(1996).rflpanalysisofresistancetocolumbiaroot-knotnematodederivedfromsolanumbulbocastanuminabc2population.theor.appl.genet.92:572-5768.brown,c.r.,mojtahedi,h.,&santo,g.s.(2003).characteristicsofresistancetocolumbiaroot-knotnematodeintrogressedfromseveralmexicanandnorthamericanwildpotatospecies.actahort.619:117-1259.brown,c.r.,kim,t.s.,ganga,z.,haynes,k.,dejong,d.,jahn,m.,paran,i.&dejong,w.(2006).segregationoftotalcarotenoidinhighlevelpotatogermplasmanditsrelationshiptobeta-carotenehydroxylasepolymorphism.amer.j.potatores.83:365-37210.brummell,d.a.,chen,r.k.y.,harris,j.c.,zhang,h.,hamiaux,c.,kralicek,a.v.&mckenzie,m.j.(2011).inductionofvacuolarinvertaseinhibitormrnainpotatotuberscontributestocold-inducedsweeteningresistanceandincludessplicedhybridmrnavariants.j.exper.bot.,advancedaccessmarch10,2011pg1-16(doi:10.1093/jxb/err043)11.champouret,n.(2010).functionalgenomicsofphytophthorainfestanseffectorsandsolanumresistancegenes.phdthesis.wageningenuniversity12.dejong,h.(1987).inheritanceofpigmentedtuberfleshincultivateddiploidpotatoes.amer.potatoj.64:337-34313.dejong,w.,forsyth.a.,leister.d.,gebhardt,c.&baulcombe,d.c.(1997).apotatohypersensitiveresistancegeneagainstpotatovirusxmapstoaresistancegeneclusteronchromosome5.theor.appl.genet.95:246-25214.dejong,w.s.,dejong,d.m.,dejong,h.,kalazich,j.&bodism.(2003).analleleofdihydroflavonol4-reductaseassociatedwiththeabilitytoproduceredanthocyaninpigmentsinpotato(solanumtuberosuml.).theor.appl.genet.107:1375–138315.draaistra,j.(2006).geneticanalysisofroot-knotnematoderesistanceinpotato.phdthesiswageningenuniversity,thenetherlands.http://edpot.wur.nl/4390216.el-kharbotly,a.,leonards-schippers,c.,huigen,d.j.,jacobsen,e.,pereira,a.,stiekema,w.j.,salamini,f.&gebhardt,c.(1994).segregationanalysisandrflpmappingofther1andr3allelesconferringracespecificresistancestophytophthorainfestansinprogeniesofdihaploidpotatoparents.mol.gen.genet.242:749-754.17.el-kharbotly,a.,paloino-sánchez,c.,salamini,f.,jacobsen,e.&gebhardt,c.(1996).r6andr7allelesofpotatoconferringrace-specificresistancetophytophthorainfestans(mont.)debaryindentifiedgeneticlociclusteringwithther3locusonchromosomexi.theor.appl.genet.92:880-884.18.ewing,e.e.,i,simko,c.d.smart,m.w.bonierbale,e.s.g.mizubuti,g.d.may&w.e.fry(2000).geneticmappingfromfieldtestsofqualitativeandquantitativeresistancetophytophthorainfestansinapopulationderivedfromsolanumtuberosumandsolanumberthaultii.mol.br.6:25-36.19.fan,c.y.,yin,j.-m.,wang,b.,zhang,y.f.&yang,q.,(2010).molecularcloningandexpressionanalysisofafthomologousgenefromsolanumtuberosum.agricult.sci.china9:1133-113920.foster,s.j.,park,t.h.,pel,m.,brigneti,g.,j.,jagger,l.,vandervossen,e.&jones,j.d.g.(2009).rpi-vnt1.1,atm-22homologfromsolanumventurii,confersresistancetopotatolateblight.mol.pl.microb.inter.22:589-60021.gebhardt,c.,mugniery,d.,ritter,e.,salamini,f.&bonnel,e.(1993).identificationofrflpmarkerscloselylinkedtotheh1geneconferringresistancetogloboderarostochiensisinpotato.theor.appl.genet.85:541-54422.j.h.,watanabe,k.n.,valkonen,j.p.t.,arihara,a.,plaisted,r.l.,pehu,e.,miller,l.&slack,s.a.(1997).mappingandmarker-assistedselectionforageneforextremeresistancetopotatovirusy.theor.appl.genet.94:192-197.23.huang,s.,vleeshouwers,v.g.a.a.,werij,j.s.,hutten,r.c.b.,vaneck,h.j.,visser,r.g.f.&jacobsen,e.(2004).ther3resistancetophytophthorainfestansinpotatoisconferredbytwocloselylinkedrgeneswithdistinctspecificities.mol.pl.micr.interact.17:428-43524.huang,s.(2005).discoveryandcharacterizationofthemajorlateblightresistancecomplexinpotato.thesis,wageningenuniversity,thenetherlands.25.huang,s.,vandervossen,e.a.,kuang,h.,vleeshouwers,v.g.,zhang,n.,borm,t.j.,vaneck,h.j.,baker,b.,jacobsen,e.&visser,r.g.(2005).comparativegenomicsenabledtheisolationofther3alateblightresistancegeneinpotato.plantj.42:251-26126.jung,c.s.,griffiths,h.m.,dejong,d.m.,cheng,s.,bodis,m.&dejong,w.s.(2005).thepotatoplocuscodesforflavonoid3’,5’-hydroxylase.theor.appl.genet.110:269-27527.jung,c.s.,griffiths,h.m.,dejong,d.m.,cheng,s.,bodis,m.,kim,t.s.&dejong,w.s.(2009).thepotatodeveloper(d)locusencodesanr2r3mybtranscriptionfactorthatregulatesexpressionofmultipleanthocyaninstructuralgenesintuberskin.theor.appl.genet.120:45-5728.kanyuka,k.,bendahmane,a.,rouppevandervoort,j.n.a.m.,vandervossen,e.a.g.&baulcombed.c.(1999).mappingofintra-locusduplicationsandintrogresseddna:aidstomap-basedcloningofgenesfromcomplexgenomesillustratedbyphysicalanalysisoftherxlocusintetraploidpotato.theor.appl.genet.98:679-689.29.kasai,k.,morikawa,y.,sorri,v.a.,valkonen,j.p.t.,gebhardt,c.&watanabe,k.n.(2000).developmentofscarmarkerstothepvyresistancegeneryadgbasedonacommonfeatureofplantdiseaseresistancegenes.genome43:1-8.30.kim,h.s.,jeon,j.h.,choi,k.h.,joung,y.h.,lee,b.i.&joung,h.(2000).regulationofstarchcontentsinpotato(solanumtuberosuml.)bymanipulationofsucrosesynthasegene.j.jap.soc.hort.sci.69:243-249.31.kreike,c.m.,dekoning,j.r.a.,vinke,j.h.,vanooijen,j.w.&stiekema,w.j.(1994).quantitativelyinheritedresistancetogloboderapallidaisdominatedbyonemajorlocusinsolanumspegazzinii.theor.appl.genet.88:764-76932.kuhl,j.c.,hanneman,r.e.&havey,m.j.(2001).characterizationandmappingofrpi1,alateblightresistancelocusfromdiploid(1ebn)mexicansolanumpinnatisectum.mol.gen.genet.265:977-98533.leonards-schippers,c.,gieffers,w.,r.,ritter,e.,knapp,s.j.,salamini,f.&gebhardt,c.(1994).quantitativeresistancetophytophthorainfestansinpotato:acasestudyforqtlmappinginanallogamousplantspecies.genetics137:67-77.34.li,l.,m.j.paulo,strahwald,j.,lubeck,j.,hofferbert,h.r.,tacke,e.,junghans,h.,wunder,j.,draffehn,a.,vaneeuwijk,f&gebhardt,c.(2008).naturaldnavariationatcandidatelociisassociatedwithpotatochipcolor,tuberstarchcontent,yieldandstarchyield.theor.appl.genet.116:1167-118135.lokossou,a.a.,park,t.h.,vanarkel,g.,arens,m.,ruyter-spira,c.,morales,j.,whisson,s.c.birch,p.r.j.,visser,r.g.f.,jacobsen,e.&vandervossen,e.a.g.(2009).exploitingknowledgeofr/avrgenestorapidlycloneanewlz-nbs-lrrfamilyoflateblightresistancegenesfrompotatolinkagegroupiv.mol.pl.micr.interact.22:630-64136.malcolmson,j.f.&black,w.(1966).newrgenesinsolanumdemissumlindl.andtheircomplementaryracesofphytophthorainfestans(mont.)debary.euphytica15:199-20337.marano,m.r.,malcuit,i.,dejong,w.&baulcombe,d.c.(2002).high-resolutiongeneticmapofnb,agenethatconfershypersensitiveresistancetopotatovirusxinsolanumtuberosum.theor.appl.genet.105:192-200.38.marczewski,w.,hennig,j.&gebhardt,c.(2002).thepotatovirussresistancegenensmapstopotatochromosomeviii.theor.appl.genet.105:564-567.39.moloney,c.,griffin,d.,jones,p.w.,bryan,g.j.,mclean,k.,bradshaw,j.e.&milbourne.d.(2010).developmentofdiagnosticmarkersforuseinbreedingpotatoesresistanttogloboderapallidapathotypepa2/3usinggermplasmderivedfromsolanumtuberosumssp.andigenacpc2802.theor.appl.genet.120:679-68940.oosumi,t.,rockhold,d.r.,maccree,m.m.,deahl,k.l.,mccue,k.f.&belknap,w.r.(2009).generpi-bt1fromsolanumbulbocastanumconfersresistancetolateblightintransgenicpotatoes.amer.j.potatores.86:456-46541.paal,j.,henselewski,h.,muth,j.,meksem,k.,menendez,c.m.,salamini,f.,ballvora,a.&gebhardt,c.(2004).molecularcloningofthepotatogro1-4geneconferringresistancetopathotypero1oftherootcystnematodegloboderarostochiensis,basedonacandidategeneapproach.plantj.38:285-29742.park,t.h.,foster,s.,brigneti,g.&jones,j.d.g.(2009).twodistinctpotatolateblightresistancegenesfromsolanumberthaultiiarelocatedonchromosome10.euphytica165:269-27843.pel,m.a.,foster,s.j.,park,t.h.,rietman,h.,vanarkel,g.,jones,j.d.,vaneck,h.j.,jacobsen,e.,visser,r.g.&vandervossen,e.a.g.(2009).mappingandcloningoflateblightresistancegenesfromsolanumventuriiusinganinterspecificcandidategeneapproach.mol.plantmicrob.interact.22:601-61544.pineda,o.,bonierbale,m.w.,plaisted,r.l.,brodie,b.b.&tanksley,s.d.(1993).identificationofrflpmarkerslinkedtotheh1geneconferringresistancetothepotatocystnematodegloboderarostochiensis.genome36:152-15645.rauscher,g.m.,smart,c.d.,simko,i.,bonierbale,m.,mayton,h.,greenland,a.&fry,w.e.(2006).characterizationandmappingofrpi-ber,anovelpotatolateblightresistancegenefromsolanumberthaultii.theor.appl.genet.112:674-687.46.ritte,g.,lloyd,j.r.,eckermann,n.,rottmann,a.,kossmann,j&steup,m.(2002).thestarch-relatedr1proteinisanα-glucan,waterdikinase.proc.natl.acad.sci.usa99:7166-7171.47.ritter,e.,debener,t.,barone,a.,salamini,f.&gebhardt,c.(1991).rflpmappingonpotatochromosomesoftwogenescontrollingextremeresistancetopotatovirusx(pvx).mol.gen.genet.227:81-8548.rommens,c.m.,ye,j.,richael,c.&swords,k.(2006).improvingpotatostorageandprocessingcharacteristicsthroughall-nativednatransformation.j.agric.foodchem.54:9882-988749.rommens,c.m.,richael,c.m.,yan,h.,navarre,d.a.,ye,j.,krucker,m.&swords,k.(2008a).engineerednativepathwaysforhighkaempferolandcaffeoylquinateproductioninpotato.plantj.6:870-88650.rommens,c.m.,yan,h.,swords,k.,richael,c.&ye,j.(2008b).low-acrylamidefrenchfriesandpotatochips.plantbiotech.j.6:843-853.51.rouppevandervoort,j.,lindeman,w.,folkertsma,r.,hutten,r.,overmars,h.,vandervossen,e.,jacobsen,e.&bakker,j.(1998).aqtlforbroad-spectrumresistancetocystnematodespecies(globoderaspp.)mapstoaresistancegeneclusterinpotato.theor.appl.genet.96:654-66152.rouppevandervoort,j.n.a.m.,janssen,g.j.w.,overmars,h.,vanzandvoort,p.m.,vannorel,a.,scholten,o.e.,janssen,.r,&bakker,j.(1999).developmentofapcr-basedselectionassayforroot-knotnematoderesistance(rmc1)byacomparativeanalysisofthesolanumbulbocastanumands.tuberosumgenome.euphytica106:187-19553.rouppevandervoort,j.,vandervossen,e.,bakker,e.,overmars,h.,vanzandvoort,p.,hutten,r.,klein-lankhorst,r.&bakker,j.(2000).twoadditiveqtlsconferringbroad-spectrumresistanceinpotatotogloboderapallidaarelocalizedonresistancegeneclusters.theor.appl.genet.101:1122-113054.salanoubat,m.&belliard,g.(1987).molecularcloningandsequencingofsucrosesynthasecdnafrompotato(solanumtuberosuml.):preliminarycharacterizationofsucrosesynthasemrnadistribution.gene60:47-5655.sattarzadeh,a.,achenbach,u.,lübeck,j.,strahwald,j.,tacke,e.,hofferbert,h.-r.,rothsteyn,t.&gebhardt,c.,(2006).singlenucleotidepolymorphism(snp)genotypingasbasisfordevelopingapcr-basedmarkerhighlydiagnosticforpotatovarietieswithhighresistancetogloboderapallidapathotypepa2/3.molec.breed.4:301-31256.song,j.,bradeen,j.m.,naess,s.k.,raasch,j.a.,wielgus,s.m.,haberlach,g.t.,liu,j.,kuang,h.,austin-phillips,s.,buell,r.,helgeson,j.p.&jiang,j.(2003).generbclonedfromsolanumbulbocastanumconfersbroadspectrumresistancetopotatolateblight.proc.natl.acad.sci.usa100:9128-913357.song,y.-s.,hepting,l.,schweizer,g.,hartl,l.,wenzel,g.&schwarzfischer,a.(2005).mappingofextremeresistancetopvy(rysto)onchromosomexiiusinganther-culture-derivedprimarydihaploidpotatolines.theor.appl.genet.111:879-887.58.song,y.-s.&schwarzfischer,a.(2008).developmentofstsmarkersforselectionofextremeresistance(rysto)topvyandmaternalpedigreeanalysisofextremelyresistantcultivars.amer.j.potatores.85:159-17059.sorri,v.a.,watanabe,k.n.&valkonen,j.p.t.(1999).predictedkinase-3amotifofaresistancegeneanalogueasauniquemarkerforvirusresistance.theor.appl.genet.99:164-17060.tan,m.y.a.,hutten,r.c.b,celis,c.,park,t.h.,niks,r.e.,visser,r.g.f.&vaneck,h.j.(2008).therpi-mcd1locusfromsolanummicrodontuminvolvedinresistancetophytophthorainfestans,causingadelayininfection,mapsonpotatochromosome4inaclusterofnbslrrgenes.mol.pl.micr.interact.21:909-91861.tan,m.y.a.,park,t.h.,alles,r.,hutten,r.c.b.,visser,r.g.f.&vaneck,h.j.(2009).gpaxitarloriginatingfromsolanumtarijenseisamajorresistancelocustogloboderapallidaandislocalisedonchromosome11ofpotato.theor.appl.genet.119:1477-148762.tan,m.y.a.,hutten,r.c.b,visser,r.g.f.&vaneck,h.j.(2010).theeffectofpyramidingphytophthorainfestansresistancegenesr(pi-mcd1)andr(pi-ber)inpotato.theor.appl.genet.121:117-12563.thygesen,p.w.,dry,i.b.&robinson,s.p.(1995).polyphenoloxidaseinpotato.amultigenefamilythatexhibitsdifferentialexpressionpatterns.pl.physiol.109:525-53164.vanderleij,f.r.,visser,r.g.,ponstein,a.s.,jacobsen,e.&feenstra,w.j.(1991).sequenceofthestructuralgeneforgranule-boundstarchsynthaseofpotato(solanumtuberosuml.)andevidenceforasinglepointdeletionintheamfallele.mol.gen.genet.228:240-24865.vandervossen,e.a.g.,rouppevandervoort,j.n.a.m.,kanyuka,k.,bendahmane,a.,sandbrink,h.,baulcombe,d.c.,bakker,j.,stiekema,w.j.&klain-lankhorsty,r.m.(2000).homologuesofasingleresistance-geneclusterinpotatoconferresistancetodistinctpathogens:avirusandanematode.plantj.23:567-57666.vandervossen,e.,sikkema,a.,hekkertbt,b.l.,gros,j.,stevens,p.,muskens,m.,wouters,d.,pereira,a.,stiekema,w.&allefs,s.(2003).anancientrgenefromthewildpotatospeciessolanumbulbocastanumconfersbroad-resistancetophytophthorainfestansincultivatedpotatoandtomato.plantj.36:867-88267.vaneck,h.j.,jacobs,j.m.,vandenberg,p.m.m.m.,stiekema,w.j.&jacobsen,e.(1994).theinheritanceofanthocyaninpigmentationinpotato(solanumtuberosum1.)andmappingoftuberskincolourlociusingrflps.heredity73:410-42168.vidal,s.,cabrera,h.,andersson,r.a.,fredriksson,a.&valkonen,j.p.t.(2002).potatogeney-1isanngenehomologthatconferscelldeathuponinfectionwithpotatovirusy.mol.pl.-micr.interact.15:717-72769.wolters,a.-m.a.,uitdewilligen,j.g.a.m.l.,kloosterman,b.a.,hutten,r.c.b.,visser,r.g.f.&vaneck,h.j.(2010).identificationofallelesofcarotenoidpathwaygenesimportantforzeaxanthinaccumulationinpotatotubers.pl.molec.biol.73:659–671.70.zhangy.,jung,c.s.&dejong,w.s.(2009).geneticanalysisofpigmentedtuberfleshinpotato.theor.appl.genet.119:143–150.71.zrenner,r.,salanoubat,m.,willmitzer,l.&sonnewald,u.(1995).evidenceofthecrucialroleofsucrosesynthaseforsinkstrengthusingtransgenicpotatoplants(solanumtuberosuml.).plantj.7:97-107.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1