评价杀虫蛋白对异色瓢虫幼虫影响的方法与流程
本发明属于植物保护技术领域,具体地说,涉及一种评价杀虫蛋白对异色瓢虫幼虫影响的方法。
背景技术:
异色瓢虫(harmoniaaxyridis)属鞘翅目(coleoptera)瓢虫科(coccinellidae),除能捕食蚜虫、盲蝽、粉虱等刺吸式昆虫外,还能捕食鳞翅目害虫卵和低龄幼虫。因其具有个体大、移动能力强和食量大等特点,相较其他瓢虫,其捕食能力在农田生态系统中占有显著优势,是一种非常重要的天敌资源。因此,异色瓢虫常被作为评价生态环境安全性的重要指示性物种。
转基因抗虫植物对一些重要农林害虫有很好的控制作用,但其潜在的环境安全性问题也一直是大家关注的问题,如转基因植物对非靶标生物和天敌的可能的潜在影响等。异色瓢虫的幼虫和成虫在田间通过捕食取食抗虫植物的害虫而能够间接接触到植物中表达的杀虫蛋白。因此,如果转基因抗虫植物中表达的杀虫蛋白对异色瓢虫幼虫存在显著影响,那么该种抗虫植物的推广种植就会削弱异色瓢虫对农田害虫的控制作用。在田间可以通过种群调查等可以评价杀虫蛋白的影响,但田间种群的变化受多种因素的影响,且不能进行定量评价。因此,室内建立适合的准确评价杀虫物质对异色瓢虫幼虫影响的方法具有十分重要的意义。
以往评价有毒物质对异色瓢虫幼虫毒性的方法,如浸液接虫法、滤纸接触法、药膜法等,对于具有胃毒作用的杀虫物质如bt杀虫蛋白的毒性测定则具有一定的局限性,由此这些方法不能保证供试瓢虫幼虫能够接触到足够剂量的有毒物质。且这些方法适合用于评价速效的杀虫蛋白的影响,对于评价毒性不大、见效慢的杀虫蛋白对异色瓢虫幼虫的长期影响不适用。因此亟待开发一套科学、系统且准确性高的评价杀虫蛋白对异色瓢虫幼虫影响的方法。
技术实现要素:
本发明的目的是提供一种评价杀虫蛋白对异色瓢虫幼虫影响的方法。
为了实现本发明目的,第一方面,本发明提供一种评价杀虫蛋白对异色瓢虫幼虫影响的方法,该方法采用生物测定结合解毒酶和保护酶的活性测定,构建评价体系。包括以下步骤:
1)将待测杀虫蛋白以一定浓度添加到异色瓢虫幼虫的人工饲料中作为实验组,以不含其它添加成分的人工饲料作为阴性对照组,以含有对异色瓢虫幼虫生长具有明显抑制作用的物质的人工饲料作为阳性对照组;各组饲料分别用封口膜包裹好,形成密封的饲料囊;
2)将各组饲料囊分别置于含有水源的养虫箱内,然后将初孵异色瓢虫幼虫放入各养虫箱内,第一天用养虫箱内的饲料囊饲喂异色瓢虫幼虫,第二天用养虫箱内的饲料囊和蚕豆蚜混合饲喂,之后照此方法交替进行饲喂;
3)饲喂14-15天(优选15天)后,分别统计各组的存活幼虫数,称量存活幼虫体重,并测定虫体的蛋白酶活力;
4)对步骤3)获得的统计数据进行分析,根据分析结果判定待测杀虫蛋白对异色瓢虫幼虫的影响。
前述的方法,步骤1)中所述对异色瓢虫幼虫生长具有明显抑制作用的物质为半胱氨酸蛋白酶抑制剂或砷酸二氢钾(kh2aso4,pa)。
优选地,所述半胱氨酸蛋白酶抑制剂为n-[反式-环氧丁二酰基]-l-亮氨酸-4-胍基丁基酰胺(e-64)。
更优选地,以含有400μg/g半胱氨酸蛋白酶抑制剂的人工饲料作为阳性对照组。
前述的方法,步骤2)中将浸水的棉球作为水源。
前述的方法,异色瓢虫幼虫的饲养条件为:温度27℃±2℃,湿度75%±5%,光照14h,黑暗10h。
前述的方法,步骤3)中所述蛋白酶选自总蛋白酶、羧酸酯酶、谷胱甘肽-s-转移酶、过氧化物酶、超氧化物歧化酶等中的至少一种。
前述的方法,步骤4)中结果判定如下:如果实验组幼虫死亡率与对照组存在显著差异,说明待测杀虫蛋白对异色瓢虫幼虫存在显著影响;如果实验组幼虫死亡率与阴性对照组差异不显著,但实验组幼虫的平均体重显著低于阴性对照组,或蛋白酶的活力显著低于阴性对照组,也表明待测杀虫蛋白对异色瓢虫幼虫有显著影响。
本发明中,异色瓢虫幼虫的人工饲料可参照草蛉的人工饲料配制方法进行配制(参见lee,k.s.等,2005;li,y.等,2014)。
本发明中,所述杀虫蛋白可以是对瓢虫等天敌生存或生长有明显影响的杀虫蛋白,也可以是对其只有微弱影响的蛋白。
本方法同样适用于其他捕食性瓢虫的杀虫蛋白对其幼虫影响的评价。
借由上述技术方案,本发明至少具有下列优点及有益效果:
本发明提供一种评价杀虫蛋白对异色瓢虫幼虫影响的新方法,该方法适用范围广,对能够溶于异色瓢虫幼虫人工饲料的具有胃毒、内吸作用的杀虫蛋白或其他化学组分均能够进行有效测定,幼虫可以通过直接取食人工饲料而接触到不同剂量的有害物质。明确评价杀虫蛋白对异色瓢虫幼虫影响的评价指标,除比较幼虫存活率、幼虫体重外,还将总蛋白酶、羧酸酯酶、谷胱甘肽-s-转移酶、过氧化物酶、超氧化物歧化酶等重要解毒和保护酶的酶活力作为评价指标,可以更加全面的评价杀虫蛋白对幼虫的影响。此外,该生测方法还同时确定了阳性对照物质,保证了生测体系评价结果的有效性,因此能够准确地评价杀虫蛋白对异色瓢虫幼虫的影响。
附图说明
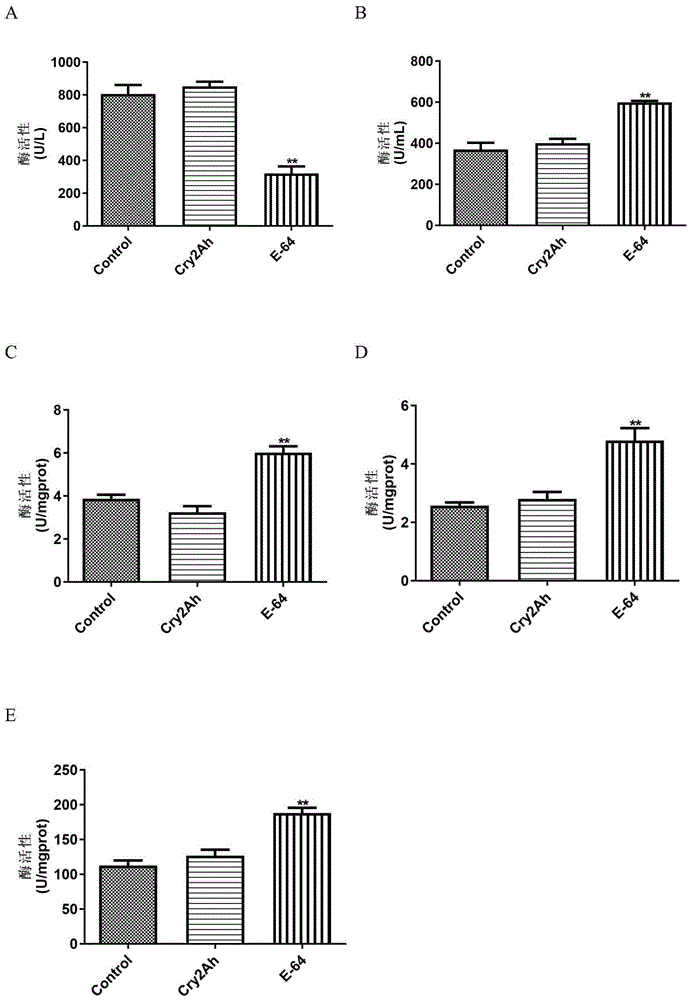
图1为本发明实施例1中取食cry2ah对异色瓢虫幼虫体内主要酶活性的影响。
图2为本发明实施例2中取食cry1ac对异色瓢虫幼虫体内主要酶活性的影响。
图1~图2中,a:总蛋白酶活性,b:羧酸酯酶,c:谷胱甘肽-s-转移酶,d:过氧化物酶,e:超氧化物歧化酶。
具体实施方式
本发明提供一种评价杀虫蛋白对异色瓢虫幼虫影响的方法,包括如下步骤:
1、将异色瓢虫幼虫人工饲料准备好后,与一定浓度的待测杀虫蛋白混合均匀,用拉伸至原来尺寸2-3倍的封口膜包裹0.2ml人工饲料,之后将封口膜对折并将边缘捏紧包裹成大小一致的饲料胶囊提供给幼虫;以不添加其他任何化学成分的人工饲料作为阴性对照,以含有400μg/g半胱氨酸蛋白酶抑制剂(n-[反式-环氧丁二酰基]-l-亮氨酸-4-胍基丁基酰胺,e-64)的异色瓢虫处理饲料作为阳性对照;
2、在塑料养虫皿中接入一头异色瓢虫初孵幼虫,皿中放置一个浸有水的脱脂棉球作为水源,盖上养虫皿盖子,置于温度27℃±2℃,湿度75%±5%,光照14h,黑暗10h的环境条件下进行培养;试验开始第一天,幼虫用不同处理饲料囊饲喂,第二天用饲料囊和蚕豆蚜混合饲喂,之后照此方法重复交替进行;
3、饲喂14-15天后,统计各处理的存活幼虫数、称量存活幼虫体重,测定总蛋白酶、羧酸酯酶、谷胱甘肽-s-转移酶、过氧化物酶、超氧化物歧化酶的活力;
4、对各处理的幼虫存活率、幼虫平均体重、酶活力等数据进行方差分析,根据结果判定杀虫蛋白对异色瓢虫幼虫是否存在影响。如果处理组幼虫死亡率与对照存在显著差异,说明杀虫蛋白对异色瓢虫幼虫存在显著影响;如果幼虫死亡率差异不显著,但处理组幼虫的平均体重显著低于对照,或总蛋白酶、羧酸酯酶、谷胱甘肽-s-转移酶、过氧化物酶、超氧化物歧化酶等重要解毒酶和保护酶的酶活力显著低于对照,也表明杀虫蛋白对异色瓢虫幼虫有显著影响。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
实施例1评价杀虫蛋白cry2ah对异色瓢虫幼虫影响的方法
半胱氨酸蛋白酶抑制剂(n-[反式-环氧丁二酰基]-l-亮氨酸-4-胍基丁基酰胺,e-64)购自sigma-aldrich(st.louis,mo,usa),用去离子水溶解,配制成5mg/ml的溶液,储存于-20℃冰箱备用。
制备异色瓢虫人工饲料约200ml,分成3等份,其中一份加入cry2ah蛋白,使其终浓度为500μg/g;一份加入e-64作为阳性对照处理,使其终浓度为400μg/g;以不添加其他成分的人工饲料作为阴性对照。不同处理饲料分别制备成胶囊状饲料囊,储存于-80℃冰箱,使用前在室温下溶解后提供给异色瓢虫。
异色瓢虫初孵幼虫单头饲养在塑料培养皿中(9.0cm×1.5cm),试验开始第一天用各处理人工饲料囊饲喂,第二天采用饲料和蚕豆蚜混合饲养,之后照此方法重复交替进行。蚕豆蚜提供方法为将覆满蚕豆蚜的蚕豆苗每次剪成2cm的小段,置于皿中提供给试验昆虫。此外,培养皿中还放有一个浸了水的脱脂棉球作为水源。养虫皿置于温度27℃±2℃,湿度75%±5%,光照14h,黑暗10h的环境条件下进行培养。
考虑cry2ah蛋白可能存在自然降解的问题,各处理人工饲料囊每2天更换一次。每个处理设置4个重复,每个重复测试25头异色瓢虫幼虫。饲喂15天后,统计各处理的存活幼虫数、称量存活幼虫体重,测定总蛋白酶、羧酸酯酶、谷胱甘肽-s-转移酶、过氧化物酶、超氧化物歧化酶的活力。利用spss(version20)分析试验数据,用dunnett’stest检测进行多重比较。幼虫存活率经反正弦数据转换后进行比较。
结果显示,e-64处理组的异色瓢虫幼虫生长发育与纯人工饲料对照组相比,受到了显著抑制,幼虫存活率仅为60.00±4.32%,取食正常人工饲料组对照的幼虫存活率为86.00±2.58%;异色瓢虫取食含有高剂量cry2ah杀虫蛋白的饲料,其幼虫存活率与纯人工饲料对照组相比没有显著性差异(幼虫存活率为83.00±1.91%)。以上结果表明该生测方法中选择的阳性对照物质能够有效检测到杀虫物质对异色瓢虫的毒性,测定cry2ah杀虫蛋白对异色瓢虫是没有显著影响。
同时,我们测定了处理15天后的幼虫的体重,结果显示,e-64处理组的异色瓢虫幼虫体重显著低于取食正常人工饲料的对照组幼虫,平均体重仅为10.93±0.67mg,对照组幼虫平均体重为16.18±1.15mg;异色瓢虫取食含有高剂量cry2ah杀虫蛋白的饲料,其幼虫体重与纯人工饲料对照组相比没有显著性差异(幼虫平均体重为14.53±0.92mg)。以上结果进一步表明阳性对照物质能够有效检测杀虫物质对异色瓢虫的影响毒性,而测定cry2ah杀虫蛋白对异色瓢虫没有显著影响。
处理15天后,异色瓢虫的总蛋白酶、羧酸酯酶、谷胱甘肽-s-转移酶、过氧化物酶、超氧化物歧化酶的活力测定结果见图1,从结果可以看出,添加高剂量浓度的cry2ah到异色瓢虫的人工饲料中,对异色瓢虫体内的这几种测定主要酶的活性没有显著性影响(dunnett’stest;p>0.05),但与对照组相比,阳性对照e-64处理组的这些酶活性发生了显著改变(dunnett’stest;p<0.05)。其中总蛋白酶活性显著降低(图1,a),而羧酸酯酶(图1,b)、谷胱甘肽-s-转移酶(图1,c)、过氧化物酶(图1,d)、超氧化物歧化酶(图1,e)的活性显著升高。
本方法可以将高剂量杀虫蛋白混合到异色瓢虫幼虫的人工饲料中,再将处理饲料制成饲料胶囊提供给异色瓢虫,既节约了材料,又保证了异色瓢虫幼虫能够接触到足够量的杀虫物质。而且该方法还同时设置了阳性对照物质处理组,可以监测异色瓢虫幼虫是否取食了足量的饲料,保证了生测体系评价结果的准确性和可信度。本方法明确了杀虫蛋白对异色瓢虫幼虫影响的评价指标,除比较幼虫存活率、幼虫体重外,还增加了总蛋白酶、羧酸酯酶、谷胱甘肽-s-转移酶、过氧化物酶、超氧化物歧化酶等重要解毒和保护酶的酶活力为评价指标,可以更加全面的评价杀虫蛋白对幼虫的影响。
实施例2评价杀虫蛋白cry1ac对异色瓢虫幼虫影响的方法
具体实验方法同实施例1,异色瓢虫饲料中的cry1ac终浓度为500μg/g。
结果显示,e-64处理组的异色瓢虫幼虫生长发育与纯人工饲料对照组相比,受到了显著抑制,幼虫存活率仅为51.00±4.73%,取食正常人工饲料组对照的幼虫存活率为88.00±3.65%;而异色瓢虫取食含有高剂量cry1ac杀虫蛋白的饲料,其幼虫存活率与纯人工饲料对照组相比没有显著性差异(幼虫存活率为81.00±1.91%)。
e-64处理15天后的异色瓢虫幼虫体重显著低于取食正常人工饲料的对照组幼虫,平均体重仅为11.10±0.27mg,对照组幼虫平均体重为16.40±0.31mg;异色瓢虫取食含有高剂量cry1ac杀虫蛋白的饲料,其幼虫体重与纯人工饲料对照组相比没有显著性差异(幼虫平均体重为16.42±0.18mg)。
几种主要酶活力测定结果见图2,从结果可以看出,与取食正常人工饲料对照组相比,取食cry1ac处理饲料对异色瓢虫体内的这几种测定主要酶的活性没有显著性影响(dunnett’stest;p>0.05),但取食阳性对照处理饲料(e-64)却使异色瓢虫这些酶活性发生了显著改变(dunnett’stest;p<0.05),总蛋白酶活性显著降低(图2,a),而羧酸酯酶(图2,b)、谷胱甘肽-s-转移酶(图2,c)、过氧化物酶(图2,d)、超氧化物歧化酶(图2,e)的活性显著升高。
实施例3消化酶、解毒酶、保护酶的优选
本发明分别比较了13种不同的消化酶、解毒酶、保护酶的酶活力,包括总蛋白酶、类胰蛋白酶、类凝乳蛋白酶、氨肽酶、羧酸酯酶、α-乙酸萘酯酯酶、谷胱甘肽-s-转移酶、乙酰胆碱酯酶、酸性磷酸酶、碱性磷酸酶、过氧化氢酶、过氧化物酶和超氧化物歧化酶,比较了实施例1和2两次试验中这13种不同酶的变化(表1),发现总蛋白酶、氨肽酶、类胰凝乳蛋白酶、羧酸酯酶、α-乙酸萘酯酯酶、谷胱甘肽-s-转移酶、过氧化氢酶、过氧化物酶、超氧化物歧化酶在两次e-64处理后都发生了极显著变化,但有毒物质更容易引起解毒酶和保护酶的变化,更适合作为评价指标。本发明最终选择了代表处理后总酶活力变化的总蛋白酶、以及羧酸酯酶和谷胱甘肽-s-转移酶两种解毒酶、过氧化物酶和超氧化物歧化酶两种保护酶作为杀虫蛋白对异色瓢虫影响的生化评价指标,这5种酶的酶活力在e-64处理后与对照组差异达到极显著,且多次试验结果稳定,重复间误差较小。
表1实施例1和2中e-64处理后各种酶活力变化差异显著性比较
注:*表示差异显著,**表示差异极显著。
实施例4半胱氨酸蛋白酶抑制剂(e-64)作为阳性对照的有效性
具体实验方法同实施例1,在异色瓢虫人工饲料中加入400μg/ge-64作为阳性对照处理,以不添加其他成分的人工饲料作为阴性对照。比较处理后异色瓢虫的多项生命参数,以检查阳性对照的有效性。结果表明,e-64处理后异色瓢虫的4龄幼虫体重、幼虫发育时间、幼虫存活率、蛹重、蛹发育时间、羽化率、雌虫重、雄虫重、单对产卵量等指标都显著升高或降低(dunnett’stest;p<0.001),说明e-64可以有效作为阳性对照(表2)。
由于异色瓢虫成虫期较长,根据试验结果判定,如果处理组的幼虫存活率、幼虫体重与对照存在显著差异,后续的各项指标都会差异显著。因此,选择对初孵幼虫进行处理,选择了以幼虫期各项指标作为评价参数。
表2异色瓢虫取食纯人工饲料或含e-64的人工饲料的生命表参数比较
注:**表示p<0.01。表中所列数值为平均值±标准误。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献:
[1]lee,k.s.andj.h.lee,rearingofchrysopapallens(rambur)(neuroptera:chrysopidae)onartificialdiet.entomologicalresearch,2005.35(3):p.183–188.
[2]li,y.,etal.,useofanartificialdietsystemtostudythetoxicityofgut-activeinsecticidalcompoundsonlarvaeofthegreenlacewingchrysoperlasinica.biologicalcontrol,2014.69(1):p.45-51。
- 还没有人留言评论。精彩留言会获得点赞!