用于使外排体冻干的方法与流程
[0001]
本发明涉及用于使外排体冻干的方法、外排体的冷冻保护剂和用于使外排体冻干的组合物。
[0002]
此外,本发明涉及冻干外排体或包含冻干外排体和稀释剂的组合物,及其应用。
背景技术:
[0003]
冻干是其中在将样品冷冻并置于真空中之后通过升华从含水样品中除去水的干燥过程。冻干用于含水物质的长期保存,所述含水物质例如植物的细胞或组织或者动物细胞以及食品。
[0004]
然而,当冷冻含水物质时,发生冷冻浓缩,其中在冷冻期间水分子形成冰晶,从而导致溶质或污染物在含水物质中的不均匀扩散。为了防止细胞中的冷冻浓缩,使用添加冷冻保护剂(例如二甲基亚砜(dmso)、甘油、乙酰胺、丙二醇、聚乙二醇等)的方法。冷冻保护剂使玻璃化转变温度提高,因此防止由冷冻期间形成的冰晶引起的组织破裂,并使组织的稳定性提高。
[0005]
然而,在真核细胞的情况下,即使使用冷冻保护剂,也会出现难以稳定地保存细胞而在冻干期间不损伤细胞结构(例如细胞膜)的问题,并因此基本上不可能维持活性成分在细胞中的功能。
[0006]
最近,有报道称细胞分泌组(secretome)包含调节细胞行为的多种生物活性分子。特别地,细胞分泌组包含具有胞间信号传导功能的“外排体(exosome)”,并因此已积极地对其组分和功能进行了研究。
[0007]
细胞使多种膜囊泡脱落到其胞外环境,并且这些释放的囊泡通常称为胞外囊泡(extracellular vesicle,ev)。ev也被称为细胞膜来源囊泡、核外颗粒体、脱落囊泡、微粒、外排体等,并且在一些情况下也与外排体区别使用。
[0008]
外排体是尺寸为数十至数百纳米的囊泡,其由与细胞膜的磷脂双层膜具有相同结构的磷脂双层膜组成。该外排体包含蛋白质、核酸(mrna、mirna等)等,其被称为外排体载物。已知外排体载物包括多种信号传导因子,并且这些信号传导因子对细胞类型具有特异性并且取决于分泌细胞的环境而受到不同的调节。已知外排体是细胞分泌的胞间信号传导介质,并且通过其传递的多种细胞信号调节细胞行为,包括靶细胞的活化、生长、迁移、分化、去分化、凋亡和坏死。取决于外排体来源于的细胞的性质和状态,外排体包含特定的遗传物质和生物活性因子。来源于增殖干细胞的外排体调节细胞行为,例如细胞迁移、增殖和分化,并且重现参与组织再生的干细胞的特征(nature review immunology 2002(2)569-579)。
[0009]
即,称为细胞的“化身”的外排体包含类似于细胞的生物活性因子,例如生长因子。然而,当外排体在室温下储存时,出现其稳定性问题,其中包含的生物活性因子的活性降低。另外,当将外排体简单地冷储存时,可能发生外排体的总体物理特性和稳定性的变化,这取决于其储存时间和方法,并因此其中包含的生物活性因子的活性也可能降低。
[0010]
然而,尽管已进行了表明使用外排体来治疗一些疾病的可能性的多种研究,但是,可稳定地维持和储存外排体的方法以及与使外排体制剂稳定有关的技术的开发仍不足。因此,需要开发使得能够稳定地维持和储存外排体以及其中包含的生物活性因子的新的方法和制剂。
[0011]
本发明人已努力开发用于使外排体冻干的方法及其冷冻保护剂,并且作为结果,发现当在特定条件下用特定的糖和氨基酸将外排体冻干时,可获得显示维持多孔海绵形状而不形成冰晶的良好外观的冻干产品,从而完成了本发明。
[0012]
同时,应理解的是,作为背景技术描述的内容仅旨在帮助理解本发明的背景,并不被认为是针对本发明的现有技术。
技术实现要素:
[0013]
技术挑战
[0014]
本发明的一个目的是提供用于使外排体冻干的方法、外排体的冷冻保护剂和用于使外排体冻干的组合物。
[0015]
本发明的另一个目的是提供冻干外排体或包含冻干外排体和稀释剂的组合物,及其应用。
[0016]
然而,如上所述的本发明的目的是举例说明性的并且本发明的范围不受此限制。另外,通过以下描述、所附权利要求书和附图,本发明的其他目的和优点将更加明显。
[0017]
技术方案
[0018]
为了实现以上目的,本发明提供了使用包含甲硫氨酸、甘露醇和海藻糖的冷冻保护剂使外排体冻干的方法。
[0019]
本文中使用的术语“外排体”是指尺寸为数十至数百纳米(优选地,约30至200nm)的囊泡,其由与细胞膜的磷脂双层膜具有相同结构的磷脂双层膜组成(然而,取决于分离外排体的细胞的类型、分离方法和测量方法,外排体的颗粒尺寸是可变的)(vasiliy s.chernyshev等,“size and shape characterization of hydrated and desiccated exosomes”,anal bioanal chem,(2015)doi 10.1007/s00216-015-8535-3)。这些外排体包含蛋白质、核酸(mrna、mirna等)等,其被称为外排体载物。已知,外排体的载物包括广泛多种信号传导因子,并且这些信号传导因子对细胞类型具有特异性且取决于分泌细胞的环境而受到不同地调节。已知,外排体是由细胞分泌的胞间信号传导介质,并且通过其传递的多种细胞信号调节细胞行为,包括靶细胞的活化、生长、迁移、分化、去分化、凋亡和坏死。
[0020]
本文中使用的术语“生物溶液”是指外排体分散、混悬、沉淀、漂浮或混合在其中的具有生物来源的液体溶液。生物溶液的一些实例包括细胞培养物的条件培养基、细胞培养物的上清液、干细胞培养物的条件培养基、干细胞培养物的上清液、全血、血清、脐带血、血浆、腹水、脑液和脑脊液、胎盘提取物和骨髓抽吸物。然而,应理解的是,本发明不限于此,并且不排除来源于多种生物体例如多种动物、植物、细菌、真菌、藻类等的溶液。可将生物溶液在释放和/或分泌外排体的条件下进行培养或孵育,并且也可冷冻和解冻。
[0021]
同时,本文中使用的术语“外排体”旨在包括从多种动物、植物、细菌、真菌、藻类等的细胞分泌并释放到胞外空间中且具有纳米尺寸囊泡结构和与外排体的组成类似的组成的所有囊泡(例如,外排体样囊泡)。
[0022]
作为一个实例,而不是对本发明进行限制,生物溶液可以是干细胞培养物的条件培养基。干细胞不限于其种类,而可优选地是间充质干细胞,例如,脂肪、骨髓、脐带或脐带血来源的干细胞,更优选脂肪来源干细胞。脂肪来源干细胞不限于其种类,只要其没有感染病原体的风险并且不引起免疫排斥即可,但是其可优选地是人脂肪来源干细胞。
[0023]
然而,根据本发明冻干的外排体不限于通过上述外排体,并且当然可使用在本领域中正在使用或可能在未来使用的多种外排体。应当注意的是,根据之后描述的实施例的分离方法分离的外排体应理解为可用于本发明中的外排体的一个实例,并且本发明不限于此。
[0024]
根据本发明一个实施方案的用于外排体的冷冻保护剂包含甲硫氨酸、甘露醇和海藻糖。所述冷冻保护剂可以以含有甲硫氨酸、甘露醇和海藻糖的水溶液形式使用。
[0025]
在根据本发明一个实施方案的用于外排体的冷冻保护剂中,水溶液中甲硫氨酸、甘露醇和海藻糖中的每一种的的浓度可以为约5至15mg/ml,优选为约9mg/ml。
[0026]
根据本发明一个实施方案的用于使外排体冻干的组合物包含:含有甲硫氨酸、甘露醇和海藻糖的冷冻保护剂;以及外排体。冷冻保护剂可添加至包含抗坏血酸和视黄醇的水溶液。水溶液可以是注射用水、生理盐水、磷酸缓冲盐水、纯化水或去离子水。
[0027]
在根据本发明一个实施方案的用于使外排体冻干的组合物中,水溶液中甲硫氨酸、甘露醇和海藻糖中的每一种的浓度可以为约5至15mg/ml,优选为约9mg/ml。另外,水溶液中抗坏血酸和视黄醇中的每一种的浓度可以为例如约0.5mg/ml。
[0028]
根据本发明一个实施方案的用于使外排体冻干的方法包括以下步骤:(a)制备外排体;(b)将制备的外排体用包含甲硫氨酸、甘露醇和海藻糖的冷冻保护剂处理;以及(c)将用冷冻保护剂处理的外排体冻干。
[0029]
在根据本发明一个实施方案的用于使外排体冻干的方法中,步骤(b)可包括将外排体与冷冻保护剂混合。可将冷冻保护剂添加至包含抗坏血酸和视黄醇的水溶液。水溶液可以是注射用水、生理盐水、磷酸缓冲盐水、纯化水或去离子水。
[0030]
在根据本发明一个实施方案的用于使外排体冻干的方法中,水溶液中甲硫氨酸、甘露醇和海藻糖中的每一种的浓度可以为约5至15mg/ml,优选为约9mg/ml。另外,水溶液中抗坏血酸和视黄醇中的每一种的浓度可以为例如约0.5mg/ml。
[0031]
在根据本发明一个实施方案的用于使外排体冻干的方法中,步骤(c)可依次包括:在-50℃下于大气压下冷冻10小时至15小时;在-50℃下于真空下进行第一干燥50小时至60小时;在-20℃下于真空下进行第二干燥1小时至3小时;以及在10℃下于真空下进行第三干燥30分钟至2小时。
[0032]
本发明还提供了外排体的冻干制剂,其包含:作为活性成分的外排体;以及甲硫氨酸、甘露醇和海藻糖。例如,冻干制剂中甲硫氨酸、甘露醇和海藻糖的重量比可以为1∶1∶1。
[0033]
根据本发明一个实施方案的外排体的冻干制剂可还包含抗坏血酸和视黄醇。例如,冻干制剂中甲硫氨酸、甘露醇、海藻糖、抗坏血酸和视黄醇的重量比可以为9∶9∶9∶0.5∶0.5。
[0034]
根据本发明一个实施方案的外排体的冻干制剂可作为通过将其与稀释剂混合而获得的溶液使用。例如,稀释剂可以是注射用水、生理盐水、磷酸缓冲盐水、纯化水或去离子水。另外,稀释剂可还包含透明质酸或透明质酸盐(例如,透明质酸钠)。
[0035]
根据本发明一个实施方案的外排体的冻干制剂或包含所述冻干制剂的组合物可以是药物组合物、化妆品组合物或皮肤外用制剂。例如,可将外排体的冻干制剂或包含所述冻干制剂的组合物制备为可注射制剂。
[0036]
本发明还提供了外排体的混悬剂,其包含:如上所述的冻干外排体;以及稀释剂。作为稀释剂,在此可使用注射用水、生理盐水、磷酸缓冲盐水、纯化水、去离子水、透明质酸,或其组合。另外,可使用本领域已知为稀释剂的那些,包括之后例示的那些。
[0037]
可将根据本发明一个实施方案的冻干外排体或包含所述冻干外排体的组合物制备为药物组合物。当将根据本发明一个实施方案的冻干外排体或包含所述冻干外排体的组合物制备为药物组合物时,根据本发明一个实施方案的组合物可以是用于经口或肠胃外施用的任何制剂。
[0038]
根据本发明一个实施方案的药物组合物可包含可药用的载体、赋形剂、稀释剂等。载体、赋形剂和稀释剂包括但不限于:乳糖、右旋糖、海藻糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、藻酸类、明胶、磷酸钙、碳酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯酸甲酯、羟基苯酸丙酯、滑石、硬脂酸镁和矿物油。对于使用,根据本发明一个实施方案的药物组合物可配制为:经口剂型(例如散剂、丸剂、片剂、胶囊剂、混悬剂、乳液、糖浆剂、颗粒剂、酏剂、气雾剂等)、皮肤外用制剂、栓剂、或无菌注射溶液剂。
[0039]
根据本发明一个实施方案的药物组合物的施用意指通过任何合适的方法将期望的物质引入到患者中,并且药物组合物可通过任何一般途径来施用,只要物质可到达靶组织即可。例如,根据本发明一个实施方案的药物组合物可经口或肠胃外施用。用于肠胃外施用的途径可包括经皮施用、腹膜内施用、静脉内施用、动脉内施用、淋巴内施用、肌内施用、皮下施用、皮内施用、表面施用、直肠内施用等。然而,本发明的范围不限于此,并且不排除本领域中已知的多种施用方法。此外,根据一个实施方案的药物组合物可通过可将活性成分递送到靶组织或细胞中的任何装置来施用。另外,根据本发明一个实施方案的药物组合物的有效量意指为了达到治疗疾病的效果而需要施用的量。
[0040]
根据本发明药物组合物的用于肠胃外施用的制剂可以是经灭菌的水溶液剂、非水溶液剂、混悬剂、乳液、冻干制剂、或栓剂。根据本发明一个实施方案的药物组合物的用于肠胃外施用的制剂还可制备为可注射制剂。根据本发明一个实施方案的可注射制剂可以是水性可注射制剂、非水性可注射制剂、水性混悬注射剂、非水性混悬注射剂、在溶解或混悬之后使用的固体可注射制剂等,但不限于此。根据本发明一个实施方案的可注射制剂根据其类型还可包含以下中的至少一种:注射用蒸馏水、植物油(例如,花生油、芝麻油、山茶油等)、甘油单酯、甘油二酯、丙二醇、樟脑、苯甲酸雌二醇、次水杨酸铋、砷酚胺钠或硫酸链霉素,并且还可任选地包含稳定剂或防腐剂。
[0041]
制剂中根据一个实施方案的药物组合物的含量可根据如上所述的另外组分的种类、量、形式等适当地选择。例如,本发明的药物组合物可以以基于可注射制剂的总重量的约0.1wt%至99wt%、优选约10wt%至90wt%的量包含在内。此外,根据本发明一个实施方案的药物组合物的合适剂量可根据以下进行调整:患者的疾病的种类,疾病的严重程度,制剂的类型,配制方法,患者的年龄、性别、体重、健康状况、饮食、排泄率、施用时间和施用方案。例如,当将根据本发明一个实施方案的药物组合物施用于成人时,其可以以每天
0.001mg/kg至100mg/kg的剂量施用一次至数次。
[0042]
此外,本发明涉及冻干外排体或包含所述冻干外排体的组合物用于皮肤外用制剂和/或化妆品组合物的应用。同时,当将根据本发明一个实施方案的组合物制备为皮肤外用制剂和/或化妆品组合物时,在不损害本发明效果的范围内,根据需要,其可适当地包含在化妆品产品或皮肤外用制剂中通常使用的组分,例如,保湿剂、抗氧化剂、油性组分、uv吸收剂、乳化剂、表面活性剂、增稠剂、醇、粉组分、着色剂、水性组分、水、以及多种皮肤营养素等。
[0043]
此外,在不损害其效果(例如,抗炎和保湿效果)的范围内,除根据本发明一个实施方案的冻干外排体或包含所述冻干外排体的组合物之外,根据本发明一个实施方案的皮肤外用制剂和/或化妆品组合物还可包含在本领域中使用的抗炎剂和/或保湿剂。例如,本发明的冻干“外排体”或包含所述冻干外排体的组合物可包含在以下中的至少一种中或与以下中的至少一种混合:水凝胶、透明质酸、透明质酸的盐(例如,透明质酸钠等)或透明质酸凝胶在根据本发明一个实施方案的皮肤外用制剂和/或化妆品组合物中,水凝胶的种类没有特别限制,但是水凝胶可优选地通过将胶凝聚合物分散在多元醇中来获得。胶凝聚合物可以是选自以下中的至少一种:普朗尼克、纯化琼脂、琼脂糖、结冷胶、藻酸、卡拉胶、肉桂胶、黄原胶、半乳甘露聚糖、葡甘露聚糖、果胶、纤维素、瓜尔胶和槐豆胶,并且多元醇可以是选自以下中的至少一种:乙二醇、丙二醇、1,3-丁二醇、异丁二醇、二丙二醇、山梨糖醇、木糖醇和甘油。
[0044]
根据本发明一个实施方案的皮肤外用制剂和/或化妆品组合物可以以多种形式使用,例如,贴片片装面膜面膜巾霜活肤水软膏混悬剂乳液糊剂化妆水凝胶剂油剂剥撕式面膜喷雾剂气雾剂雾剂粉底粉和油纸例如,皮肤外用制剂和/或化妆品组合物可被施加至贴片、片装面膜或面膜巾的至少一个表面或浸透在贴片、片装面膜或面膜巾的至少一个表面中。
[0045]
当将根据本发明一个实施方案的皮肤外用制剂制备为化妆品组合物时,其用于抗炎、保湿等的目的,并且所述化妆品组合物可制备为本领域中通常制备的任何制剂。例如,其可配制为:贴片、片装面膜、面膜巾、皮肤软化剂、营养品、收敛化妆水、滋养霜、按摩霜、眼霜、清洁霜、精华、眼部精华、清洁化妆水、清洁泡沫、清洁水、防晒霜、唇膏、肥皂、洗发剂、含表面活性剂的清洁剂、浴用制剂、身体乳、身体霜、身体油、身体精华、身体清洁剂、染发剂、生发剂等,但不限于此。
[0046]
根据本发明一个实施方案的皮肤外用制剂和/或化妆品组合物包含通常在皮肤外用制剂和/或化妆品产品中使用的组分。例如,皮肤外用制剂和/或化妆品组合物可包含常规的辅料和载体,例如抗氧化剂、稳定剂、增溶剂、维生素、色素和香料。另外,根据皮肤外用制剂和/或化妆品组合物的类型或预期用途,本领域技术人员可毫无困难地适当选择皮肤外用制剂和/或化妆品组合物的每种制剂中的其他组分。
[0047]
有利效果
[0048]
根据本发明的冻干外排体和包含所述冻干外排体的组合物显示出维持多孔海绵形状而不形成冰晶的良好外观。
[0049]
另外,根据本发明的冻干外排体和包含所述冻干外排体的组合物可应用于药物组合物、皮肤外用制剂和化妆品组合物。例如,本发明的冻干外排体产品可作为通过简单地将其与稀释剂混合而获得的溶液使用。
[0050]
应当理解,本发明的范围不限于上述效果。
附图说明
[0051]
图1a至1e示出了分析根据本发明一个实施方案获得的外排体的物理特性的结果。“图1a”示出了通过纳米颗粒追踪分析(nanoparticle tracking analysis,nta)获得的颗粒尺寸分布和颗粒数目。“图1b”示出了通过透射电子显微术(transmitted electron microscopy,tem)获得的颗粒图像。“图1c”示出了根据本发明一个实施方案获得的外排体的阳性标志物的western印迹分析的结果。“图1d”示出了根据本发明一个实施方案获得的外排体的阴性标志物的western印迹分析的结果。“图1e”示出了根据本发明一个实施方案获得的外排体的标志物的分析中,cd9、cd63和cd81的流式细胞术的结果。
[0052]
图2展示了示出根据本发明一个实施方案的所冻干外排体的良好外观的照片。
[0053]
图3a至3g是各自示出了在使用冷冻保护剂组分的不同组合进行冻干之后,根据冷冻保护剂组分的组合中的每一种获得的冻干外排体的外观的照片。
[0054]
图4至7示出了使用多重组对炎性细胞因子进行分析的结果。在图4至7中,在将raw 264.7细胞用不同浓度(表示为颗粒数目/ml)的实施例2中制备的干细胞来源的外排体(从干细胞的条件培养基中分离和纯化的外排体)处理,并随后用lps处理时,lps诱导的细胞中il-1β、il-6、il-27和ifn-β的产生以依赖于外排体浓度的方式降低。
[0055]
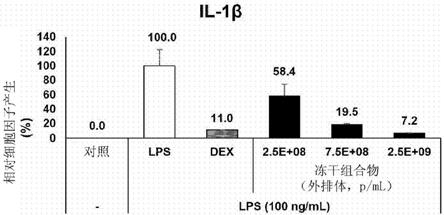
图8至11示出了使用多重组对炎性细胞因子进行分析的结果。在图8至11中,在将raw 264.7细胞用通过将干细胞来源的外排体的冻干制剂(实施例4-1中制备的)与培养基混合而获得和稀释的不同浓度(表示为颗粒数目/ml)的水溶液处理,并随后用lps处理时,lps诱导的细胞中il-1β、il-6、il-27和ifn-β的产生以依赖于冻干制剂浓度的方式显著降低。
具体实施方式
[0056]
在下文中,将参照以下实施例更详细地描述本发明。然而,以下实施例仅是举例说明本发明并且不旨在限制或约束本发明的范围。本领域技术人员可从本发明的详细描述和实施例中容易地推断出的那些被解释为落入本发明的范围内。本发明中提及的参考文献通过引用并入本文。
[0057]
在本说明书通篇,应理解,除非另外指明,否则当任何部分被提及“包含/包括”任何组分时,其不排除其他组分,而是还可包含/包括其他组分。
[0058]
实施例
[0059]
实施例1:细胞培养
[0060]
根据本发明所属技术领域中已知的细胞培养方法,在37℃、5%co
2
下培养脂肪来源干细胞。接下来,将细胞用磷酸缓冲盐水(购自thermofisher scientific)洗涤,并随后
scientific)。用pe-小鼠抗人cd9(购自bd)、pe-小鼠抗人cd63(购自bd)或pe-小鼠抗人cd81(购自bd)对标志物进行染色,并随后使用流式细胞仪(acea biosciences)进行分析。
[0071]
同时,应理解的是,用于本发明的冻干方法中的外排体不限于如上所述实施例的外排体,可使用本领域中正在使用或可在将来使用的多种外排体。另外,应当注意的是,根据以上实施例分离的外排体应理解为可用于本发明的冻干方法中的外排体的一个实例,并且本发明的范围不限于此。
[0072]
实施例4:外排体的冻干
[0073]
实施例4-1:冻干条件
[0074]
为了使外排体冻干,制备了包含甲硫氨酸、甘露醇和海藻糖的冷冻保护剂。通过将冷冻保护剂添加至1ml包含抗坏血酸和视黄醇(由bio-fd&c co.,ltd,hwasun-gun,jeollanam-do,korea)中的每一种的0.5mg/ml的水溶液来制备水溶液。尽管在该实施例中将冷冻保护剂添加至包含抗坏血酸和视黄醇的溶液,但是也可通过将冷冻保护剂添加至注射用水、纯化水、生理盐水或去离子水来制备水溶液。将水溶液中甲硫氨酸、甘露醇和海藻糖中的每一种的浓度调节至9mg/ml。
[0075]
将实施例2中制备的外排体(5
×
10
8
个颗粒/ml)与包含冷冻保护剂的水溶液混合,并随后在示于下表1中的条件下使用冻干系统(由virtis制造,项目no.:344424)冻干。冻干以如示于下表1中条件1、2、3、4、5、6、7和8的顺序进行。
[0076]
表1:冻干条件
[0077][0078]
在用包含甲硫氨酸、甘露醇和海藻糖的冷冻保护剂处理外排体并冻干之后,检查其外观。作为结果,可以看出,外排体为乳白色,并显示出维持多孔海绵形状的良好外观(图2)。即,根据本发明的用于使外排体冻干的方法能够通过延长真空下的干燥时间并使用具有甲硫氨酸、甘露醇和海藻糖的组合的冷冻保护剂来产生具有良好外观的冻干产品。
[0079]
实施例4-2:取决于冷冻保护剂组分的冻干外排体的外观比较
[0080]
同时,对使用包含甲硫氨酸、甘露醇和海藻糖(在下文中,称为冷冻保护剂组分)中的至少一种的多种冷冻保护剂冻干的外排体的外观进行比较。根据以上实施例4-1中描述的方法,通过添加单独的冷冻保护剂组分、两种组分的组合或三种组分的组合来制备七种
不同的水溶液。将每种水溶液中每种冷冻保护剂组分的浓度调节至9mg/ml。根据以上实施例4-1中描述的冻干条件和方法,将以上实施例2中制备的外排体(5
×
10
8
个颗粒)与分别包含每种单独的冷冻保护剂组分、两种组分的组合中的每一种或三种组分的组合的水溶液混合,并随后冻干。
[0081]
对冻干外排体产品的外部外观拍照并进行评价(图3a至3g)。根据冻干外排体产品的蛋糕状形状的状态,对冻干外排体产品的外观进行排序,并以1(最差的蛋糕状外观)至5(最佳的蛋糕状外观)的5分制标尺进行相对评价。下表2示出了根据冷冻保护剂组分的组合,评价冻干外排体产品的外观的结果。
[0082]
表2:根据冷冻保护剂组分的组合,对冻干外排体产品的外观的比较
[0083][0084]
如图3a至3g以及上表2中所示,可以看出,通过使用具有甲硫氨酸、甘露醇和海藻糖的组合的冷冻保护剂使外排体冻干而获得的产品具有最佳的外部外观,然而,通过使用一种组分或两种组分的组合使外排体冻干获得的产品的外部外观差于本发明产品的外部外观。
[0085]
实施例5:降低炎性细胞因子产生的作用的评价
[0086]
如下评价干细胞来源的外排体(实施例2)和干细胞来源的外排体的冻干制剂(实施例4-1)对降低小鼠巨噬细胞raw 264.7细胞中炎性细胞因子产生的作用。
[0087]
将raw 264.7细胞悬浮于包含10%fbs(fetal bovine serum,胎牛血清)和1%青霉素-链霉素的dmem(dulbecco改良的eagle培养基;购自thermofisher scientific)中,并随后将其以2.5
×
10
4
个细胞/孔的密度接种到96孔板中。接下来,将细胞用不同浓度(表示为颗粒数目/ml)的实施例2中制备的干细胞来源的外排体(从干细胞的条件培养基中分离和纯化的外排体)处理,并随后在37℃、5%co
2
下于培养箱中培养24小时。另外,以与用干细胞来源的外排体进行处理的上述方法相同的方式,将raw 264.7细胞用通过将实施例4-1的干细胞来源的外排体的冻干制剂(5
×
10
9
个颗粒/小瓶)与培养基混合而获得和稀释的水溶液处理,并随后将经处理的raw 264.7细胞在37℃、5%co
2
下于培养箱中培养24小时。同时,作为阳性对照,使用地塞米松(在图4至11中表示为dex)。
[0088]
之后,将raw 264.7细胞用100ng/ml的lps(购自sigma)处理,并在37μ,5%co
2
下于培养箱中培养24小时,从而诱导细胞的活化。
[0089]
在培养完成之后,收集raw 264.7细胞的培养上清液,并使用基于legendplex
tm
珠的免疫测定之小鼠炎症组(购自biolegend)以及novocyte流式细胞仪(购自acea)测量培养上清液中il-1β、il-6、il-27和ifn-β的产生以便评价抗炎作用。
[0090]
另外,进行mtt测定以分别测量由本发明的干细胞来源的外排体和干细胞来源的外排体的冻干制剂引起的细胞生存力的变化,并使通过其产生的细胞因子归一化。在培养完成之后,用包含0.5mg/ml的溴化噻唑蓝四唑(thiazolyl blue tetrazolium bromide)(购自sigma)的dmem培养基更换raw 264.7细胞的培养基,并培养1小时。接下来,以不分散形成在细胞培养板底部的甲瓒的这样的方式除去上清液。随后,将甲瓒通过二甲基亚砜(购自amresco)溶解,并在570nm下测量吸光度以确定细胞生存力。另外,通过细胞生存力使每种细胞因子(il-1β、il-6、il-27和ifn-β)的产生归一化。
[0091]
如图4至7中所示,从使用多重组对炎性细胞因子进行分析的结果中可以看出,当用干细胞来源的外排体处理raw 264.7细胞,然后用lps处理细胞时,lps诱导的il-1β、il-6、il-27和ifn-β中的每一种的产生以依赖于外排体浓度的方式降低。另外,如图8至11中所示,从使用多重组对炎性细胞因子进行分析的结果可以看出,当用干细胞来源的外排体的冻干制剂处理raw 264.7细胞,然后用lps处理细胞时,lps诱导的il-1β、il-6、il-27和ifn-β中的每一种的产生以依赖于冻干制剂浓度的方式显著降低。
[0092]
从这些结果可以看出,根据本发明的干细胞来源的外排体的冻干制剂能够稳定地维持其中包含的作为活性成分的干细胞来源的外排体的抗炎效力,并因此在冻干、储存和分配期间外排体的物理特性没有任何可能的变化。因此,根据本发明的干细胞来源的外排体的冻干制剂能够使外排体稳定并使其商业上可用。
[0093]
尽管已经参照实施方案描述了本发明,但是本发明的范围不限于这些实施方案。本领域中的任何技术人员将理解,在不脱离本发明的精神和范围的情况下,可进行多种修改和改变,并且这些修改和改变也落入本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1