生长性被改良的细胞质雄性不育芜菁植物的制作方法
生长性被改良的细胞质雄性不育芜菁植物
1.对相关申请的引用
2.本技术基于作为在先日本专利申请的日本特愿2019-78906号(申请日:2019年4月17日)主张优先权权益,日本特愿2019-78906号的全部公开内容通过引用并入本文。
技术领域
3.本发明涉及生长性被改良的细胞质雄性不育芜菁(brassica rapa)植物。
背景技术:
4.芜菁属于十字花科芸薹属,起源于地中海地区。通过自然杂交,分化为具有各种形态特征的亚种,并延续为白菜、芜菁(turnip)、小松菜、小白菜(pak choi)等多种蔬菜类(非专利文献1)。
5.一般而言,植物品种中存在常规种和杂种第一代(以下记为“f1”)品种,在主要作物中,f1品种是普遍的。f1品种由于杂种优势(heterosis)而具有生长旺盛、生长快、产量能力提高等较大优点。此外,就f1品种而言,由于生长变得旺盛,故而也可期待提高对病害虫的耐性、耐寒
·
耐暑性等环境适应性。另外,由于f1品种的基因型为杂合性并且是相同的基因型,因此表型显示出极高的均一性。因此,农产品的可销售性提高。此外,f1品种的双亲能够整合被显性基因支配的有用性状,因此能实现快速育种。
6.由于具有如上所述的优势,使得f1品种在主要作物中占据了栽培品种的主流。
7.在进行f1品种的制种时,双亲一般使用自交繁殖(近交)株系,并在杂种优势的效果较大的组合等之中,选定种子亲本和花粉亲本。为了防止自交受精,种子亲本必须进行去雄,但基于人力的去雄需要非常多的劳动力。因此,如果能将作为基因上雄性不育性的细胞质雄性不育(cytoplasmic male sterility(以下中记为“cms”))株系用于种子亲本,就可以无需基于人力的去雄操作,经济且大量地生产f1种子。利用了cms的f1种子的生产已经在向日葵、甜菜、马铃薯、小麦、胡萝卜、洋葱、葱、卷心菜、西兰花、花椰菜、萝卜、和大白菜等中确立了商业性的生产系统。
8.在十字花科作物中,被利用最多的cms是ogura cms,其被用于萝卜(raphanus sativus)、甘蓝(brassica oleracea)、芥菜(brassica juncea)、油菜(brassica napus)等中。ogura cms是从品种名称不明的日本型萝卜中发现的,迄今为止被广泛地用于萝卜中的f1品种的开发。另外,ogura cms介由属间杂交和连续回交导入油菜(brassica napus)中,获得了雄性不育株系,但当初具有在低温下呈现褪绿的缺点而未能实用化。为了克服该褪绿,在ogura cms油菜和具有正常的细胞质的油菜之间进行细胞融合。对于得到的再生植物而言,来源于萝卜的叶绿体被置换为来源于油菜的叶绿体,即使在低温下也正常地生长。在油菜中,通过使用细胞融合,繁育出实用的cms株系(非专利文献2)。
9.随后,在甘蓝和萝卜之间也同样地进行了细胞融合,繁育出不引起褪绿的ogura cms甘蓝植物,实际应用于西兰花、卷心菜等的f1品种的开发中(专利文献1)。
10.在芜菁植物中,也以专利文献1的ogura cms甘蓝植物作为种子亲本、以芜菁植物
作为花粉亲本进行连续回交,开发出不引起褪绿的ogura cms芜菁植物,坂田种苗株式会社在进行品种开发。
11.然而,在育种的过程中,在许多亲本株系、f1株系中均观察到生长性的降低。因此,与利用自交不亲和性(self incompatibility(以下中记为“si”))的f1相比,利用现有的cms的f1的生长性降低一般而言是显著的。因此,在芜菁植物中,利用cms的f1化没有进展。
12.例如,对于小松菜、青梗菜等软质蔬菜而言,因为是将种子分期播种、有计划地栽培、并一起收获的,因而从播种至收获为止的成熟期均一性非常重要,其是与农户收益直接相关的特性。这种情况下的生长性降低的问题严重到收获期推迟3天、可销售性即显著降低、丧失作为品种价值的地步。此外,即使是对收获前的生长期较长的大白菜等而言,同样地,收获期相差5天左右即会被视为不同品种,生长性也是重要的特性。
13.如上所述,从幼苗至蔬果为止生长性不降低是对在芜菁中利用cms的f1而言非常重大的问题,因此延误了利用cms的f1的普遍推广。如果能克服该问题,则能够最大限度地享受前述利用cms的f1的优点。由于根据使用的株系,生长性的降低是轻微的,因而存在兼顾利用f1的杂种优势而成功品种化的例子,但能使用的亲本株系、组合有限,且存在不少育种限制,因而强烈要求开发能普遍使用的ogura cms芜菁植物。
14.另外,在芜菁植物中,介由属间杂交和连续回交从ogura cms萝卜植物向芜菁中导入cms,获得了通过有性杂交进行核置换而得的ogura cms芜菁植物,但仍具有与油菜同样地在低温下呈现褪绿的缺点。为了克服该褪绿的问题,在通过有性杂交进行核置换而得的ogura cms芜菁植物和正常细胞质的芜菁之间实施非对称细胞融合,繁育出作为新的ogura cms芜菁植物的“new ogucms”。“new ogucms”显示出不会引起低温下的褪绿、具有发达的蜜腺、其种子生产性与保持系同等等特性(专利文献2、非专利文献3)。
15.然而,在专利文献2和非专利文献3中,没有进行关于“new ogucms”的生长性的定量评价,该cms植物的种子也没有被保藏,因而确认“new ogucms”的生长性是极其困难的。关于这一点,在非专利文献3的图1的照片中,可见“new ogucms”的植物体明显小于“亲本cms(parental cms)”,因此可推知生长性低于具有正常细胞质的芜菁植物。此外,本技术的发明人等推测可能是“new ogucms”的品种“紫罗兰油菜(日文:紫羅蘭油菜)”(注1)、“nihao fung”均为迷你青梗菜的品种,基于这一点也可认为“new ogucms”的生长性低于具有正常细胞质的芜菁植物。
16.(注1)此处的品种名称“紫羅蘭油菜”中文记为“紫罗兰油菜”。
17.在利用cms的f1品种的开发中,重要的是使显示雄性不育性的细胞质尽可能地不对雄性不育性以外的性状产生影响。例如,在玉米中,虽然培育了导入有t型雄性不育细胞质的f1品种,但在1970年,出现了胡麻斑病菌的t小种,t型雄性不育细胞质由于具有特异于该病原菌的感病性而遭受了巨大的打击。因此,t型雄性不育细胞质的利用被立即中止,不得不回归以往的人工去雄方法(非专利文献4)。
18.此外,矮牵牛(petunia)中的cms早已为人所知,作为其因果基因的s-pcf被大量地用作研究材料。然而,利用了该cms的f1品种由于引起开花推迟、花蕾的发育停止等,目前已几乎不再使用(非专利文献4)。
19.如这些例子所示,即使发现了cms,当该cms伴有不良性状时,存在难以利用cms或者利用受限的情况,可以说仍然需要进一步开发cms改良方法,提供改良cms。
20.现有技术文献
21.专利文献
22.专利文献1:日本特开平7-31307号
23.专利文献2:cn1232608a
24.专利文献3:日本专利第3964368号
25.专利文献4:日本专利第5089764号
26.非专利文献
27.非专利文献1:诹访部圭太(2012)育种学研究14:114-120
28.非专利文献2:hiroshi yamagishi and shripad r.bhat(2014)breeding science 64:38-47“cytoplasmic male sterility in brassicaceae crops”29.非专利文献3:xi-lin hou,shou-chun cao,yu-ke he(2004)ishs acta horticulturae 637:75-81“creation of a new germplasm of cms non-heading chinese cabbage”30.非专利文献4:细胞质雄性不育和育种技术(日文:細胞質雄性不稔
と
育種技術),1985年株式会社cmc出版发行
技术实现要素:
31.发明所要解决的课题
32.现有的ogura cms芜菁植物由于核基因组和线粒体基因组的亲和性不充分,因而存在与具有正常细胞质的芜菁植物相比生长性降低的问题。
33.鉴于上述现有的ogura cms芜菁植物的生长性降低的问题,本发明以提供生长性没有降低的ogura cms芜菁植物和提供利用了该ogura cms芜菁植物的、生长性没有降低的芜菁植物的f1种子的生产方法为目的。
34.用于解决课题的手段
35.本技术的发明人本次进行了深入研究,结果发现,通过以现有的ogura cms芜菁植物作为细胞质供体亲本、以具有高再分化能力且具有正常细胞质的芜菁种间杂交植物作为细胞质受体亲本,进行非对称细胞融合,能够实现线粒体基因组的改良,繁育出生长性没有降低的ogura cms芜菁植物,利用该ogura cms芜菁植物,可获得生长性被改良的ogura cms芜菁植物。
36.本发明是基于上述见解而得的发明。即,根据本发明,可提供以下的发明。
37.《1》具有与具有正常细胞质的芜菁植物同等的生长性的细胞质雄性不育芜菁植物或其后代。
38.《2》上述《1》的细胞质雄性不育芜菁植物或其后代,其在线粒体基因组内具有来源于萝卜植物、甘蓝植物和芜菁植物的线粒体基因组的dna。
39.《3》上述《1》或《2》的细胞质雄性不育芜菁植物或其后代,其是通过实施使用具有正常细胞质的芜菁种间杂交植物作为细胞质受体亲本的非对称细胞融合而获得的。
40.《4》上述《1》~《3》中任一项的细胞质雄性不育芜菁植物或其后代,其是通过实施使用具有来源于萝卜植物的细胞质雄性不育基因的细胞质雄性不育芸薹属植物作为细胞质供体亲本的非对称细胞融合而获得的。
41.《5》上述《1》~《3》中任一项的细胞质雄性不育芜菁植物或其后代,其是通过实施使用来源于细胞质雄性不育甘蓝植物的细胞质雄性不育芸薹属植物作为细胞质供体亲本的非对称细胞融合而获得的。
42.《6》上述《1》~《3》中任一项的细胞质雄性不育芜菁植物或其后代,其是通过实施使用来源于细胞质雄性不育甘蓝植物的细胞质雄性不育芜菁植物作为细胞质供体亲本的非对称细胞融合而获得的。
43.《7》上述《1》~《4》中任一项的细胞质雄性不育芜菁植物或其后代,其是通过实施使用现有的细胞质雄性不育芸薹属植物作为细胞质供体亲本、使用具有正常细胞质的芜菁种间杂交植物作为细胞质受体亲本的非对称细胞融合而获得的。
44.《8》上述《3》~《7》中任一项的细胞质雄性不育芜菁植物或其后代,其中,种间杂交植物来源于甘蓝植物和芜菁植物。
45.《9》上述《3》~《8》中任一项的种间杂交植物,其中,种间杂交植物具有高再分化能力。
46.《10》上述《7》的细胞质雄性不育芜菁植物或其后代,其中,现有的细胞质雄性不育芸薹属植物为现有的细胞质雄性不育芜菁植物。
47.《11》上述《7》的细胞质雄性不育芜菁植物或其后代,其中,现有的细胞质雄性不育芸薹属植物来源于细胞质雄性不育甘蓝植物。
48.《12》上述《4》~《11》中任一项的细胞质雄性不育芜菁植物或其后代,其中,细胞质供体亲本具有细胞质雄性不育基因orf138。
49.《13》细胞质雄性不育芜菁植物或其后代,其在线粒体基因组内具有来源于萝卜植物、甘蓝植物和芜菁植物的线粒体基因组的dna,并且
50.其是通过实施使用具有正常细胞质的芜菁种间杂交植物作为细胞质受体亲本的非对称细胞融合而获得的。
51.《14》上述《1》~《13》中任一项的细胞质雄性不育芜菁植物或其后代,其含有来源于由保藏编号ferm bp-22371或保藏编号ferm bp-22372确定的植物的线粒体基因组。
52.《15》上述《1》~《14》中任一项的细胞质雄性不育芜菁植物或其后代,其中,由线粒体基因组标记brmt-13k、brmt-23k、brmt-74k、brmt-120k、brmt-149k、brmt-185k确定的线粒体dna中的至少任一者为芜菁型。
53.《16》上述《1》~《14》中任一项的芜菁植物或其后代,其中,由线粒体基因组标记brmt-119k、brmt-133k、brmt-139k、brmt-171k、brmt-208k确定的线粒体dna中的至少任一者为甘蓝型。
54.《17》上述《1》~《14》中任一项的芜菁植物或其后代,其中,由线粒体基因组标记brmt-13k、brmt-16k、brmt-23k、brmt-28k、brmt-43k、brmt-58k、brmt-63k、brmt-70k、brmt-74k、brmt-88k、brmt-100k、brmt-111k、brmt-120k、brmt-141k、brmt-149k、brmt-157k、brmt-161k、brmt-185k、brmt-199k、brmt-213k和brmt-215k确定的线粒体dna为芜菁型,且由线粒体基因组标记brmt-3k、brmt-4k、brmt-36k、brmt-65k、brmt-80k、brmt-94k、brmt-119k、brmt-133k、brmt-139k、brmt-171k和brmt-208k确定的线粒体dna为甘蓝型。
55.《18》具有由保藏编号ferm bp-22371或保藏编号ferm bp-22372确定的植物的线粒体基因组的细胞质雄性不育芜菁植物或其后代。
56.《19》由保藏编号ferm bp-22371或保藏编号ferm bp-22372确定的细胞质雄性不育芜菁植物或其后代。
57.《20》上述《1》~《19》中任一项的细胞质雄性不育芜菁植物或其后代,其是通过实施非对称细胞融合而获得的,所述非对称细胞融合中,使用具有由保藏编号ferm bp-22371或保藏编号ferm bp-22372确定的植物的线粒体基因组的细胞质雄性不育芜菁植物作为细胞质供体亲本,使用具有正常细胞质的芜菁种间杂交植物作为细胞质受体亲本。
58.《21》上述《1》~《20》中任一项的细胞质雄性不育芜菁植物或其后代的植物体的一部分。
59.《22》上述《1》~《20》中任一项的细胞质雄性不育芜菁植物或其后代的种子。
60.《23》包含于上述《1》~《20》中任一项的细胞质雄性不育芜菁植物或其后代、上述《21》的植物体的一部分、或上述《22》的种子中的线粒体基因组。
61.《24》具有与具有正常细胞质的芜菁植物同等的生长性的细胞质雄性不育芜菁植物或其后代的制造方法,所述方法包括实施使用现有的细胞质雄性不育芜菁植物作为细胞质供体亲本、使用具有正常细胞质的芜菁植物作为细胞质受体亲本的非对称细胞融合。
62.《25》上述《24》的制造方法,其中,具有正常细胞质的芜菁植物为芜菁植物的种间杂交植物或来源于芜菁植物的种间杂交植物。
63.《26》杂种第一代种子的制造方法,所述方法包括:以上述《1》~《20》中任一项的细胞质雄性不育芜菁植物或其后代作为种子亲本、以能与该植物交配的芜菁植物作为花粉亲本,进行交配,从交配后的种子亲本制种杂种第一代种子。
64.《27》通过上述《26》中任一项的方法制造的杂种第一代种子、或者自该种子生长而得的杂种第一代植物、其后代,或它们的植物体的一部分。
65.《28》显示细胞质雄性不育性的芜菁植物的制造方法,所述方法包括:将上述《1》~《20》中任一项的细胞质雄性不育芜菁植物或其后代与任意的芜菁植物进行连续回交,实施细胞质置换。
66.发明效果
67.根据本发明,可以提供生长性被改良的细胞质雄性不育芜菁植物、尤其是生长性被改良的ogura cms芜菁植物。通过将根据本发明的生长性被改良的细胞质雄性不育芜菁植物作为种子亲本、将具有正常细胞质的芜菁植物作为花粉亲本,用于芜菁植物的f1种子的制种,能够实现高效地制种生长性没有降低的芜菁植物的f1种子。
具体实施方式
68.以下,对本发明进行详细说明。
69.生长性被改善的细胞质雄性不育芜菁植物及其后代
70.本发明涉及与现有的细胞质雄性不育芜菁植物相比生长性被改良的细胞质雄性不育芜菁植物或其后代。如上文所述,这可以表现为具有与具有正常细胞质的芜菁植物同等的生长性的细胞质雄性不育芜菁植物、或其后代。
71.本发明中,典型而言,“正常细胞质”以如下含义使用:相对于显示雄性不育性的植物的细胞质(即雄性不育细胞质),未呈现不育性,是正常的。
72.此外,所谓“与具有正常细胞质的芜菁植物同等的生长性”这一情况下的“同等”是
指,在基于植物体的地上部分的重量测量生长性时,与具有正常细胞质的芜菁植物的数值相比,对象植物中的测量值落入可在25%以内(优选为20%以内,更优选为15%以内,进一步优选为10%以内)发生变化的范围的情况。因此,例如相对于“具有正常细胞质的芜菁植物”的地上部分重量的数值,对象植物的测量值为正常植物的数值的90%的数值时,相当于上述变化为10%。同等不排除优于“具有正常细胞质的芜菁植物”的生长性的情况。
73.在本说明书中,所谓“后代”,不仅包括使用了具有正常细胞质的芜菁植物的后代,也包括使根据本发明的生长性被改良的细胞质雄性不育芜菁植物与能与该植物交配的芜菁植物交配而得的杂交种。因此,“后代”也包括例如将根据本发明的生长性被改良的细胞质雄性不育芜菁植物作为种子亲本(母本)、将能与该植物交配的芜菁植物作为花粉亲本(父本)进行交配而得到的后代。此外,“后代”也包括通过例如根据本发明的生长性被改良的细胞质雄性不育芜菁植物与能与该芜菁植物融合的植物之间的细胞融合而得的植物、种属间杂交植物。
74.此处,“芜菁植物”优选为青梗菜(b.rapa var.chinensis)、芜菁(b.rapa var.rapa)、水菜(b.rapa var.laciniifolia)、白菜(b.rapa var.pekinensis)、小松菜(b.rapa var.perviridis)、塌菜(b.rapa var.narinosa),或者它们与近缘物种的种属间杂交植物。
75.根据本发明的优选方式,本发明的生长性被改良的细胞质雄性不育芜菁植物或其后代在线粒体基因组内具有来源于萝卜植物的细胞质雄性不育基因orf138基因,更优选的是在线粒体基因组内具有来源于萝卜植物、甘蓝植物和芜菁植物的线粒体基因组的dna,进一步优选的是具有来源于萝卜植物的orf138基因、和甘蓝植物及芜菁植物的重组线粒体基因组。
76.在本说明书中,非对称细胞融合是指在融合之前预先破坏用于细胞融合的、分离了的原生质体中一方的核基因组,然后使用其进行细胞融合。在该非对称细胞融合中,在融合时破坏核基因组、介由细胞融合将其细胞质供给融合细胞的一方称为细胞质供体亲本。此外,在融合时,维持而不破坏核基因组、并接受来自上述细胞质供体亲本的细胞质的一方称为细胞质受体亲本。
77.当获得本发明的生长性被改良的细胞质雄性不育芜菁植物时,期望在非对称细胞融合中使用具有正常细胞质的芜菁种间杂交植物作为细胞质受体亲本。因此,根据本发明的优选方式,本发明的生长性被改良的细胞质雄性不育芜菁植物可以通过实施使用现有的细胞质雄性不育芜菁植物作为细胞质供体亲本、使用具有正常细胞质的芜菁种间杂交植物作为细胞质受体亲本的非对称细胞融合来获得。
78.此处,现有的细胞质雄性不育芜菁植物意指生长性通过本发明被改良前的细胞质雄性不育芜菁植物。本发明中优选的是,现有的细胞质雄性不育芜菁植物存在改良生长性的余地,即意味着,生长性与具有正常细胞质的芜菁植物相比是降低的。
79.根据本发明的优选的方式,现有的细胞质雄性不育芜菁植物为来源于细胞质雄性不育甘蓝植物的细胞质雄性不育芜菁植物。作为此处所指的细胞质雄性不育甘蓝植物,可以参考日本特开平07-031307号公报进行繁育,作为典型的例子,可举出由坂田种苗株式会社开发、在甘蓝作物中使用的cms株系“卷心菜ms-2”(日本特开平07-031307号公报)。需要说明的是,“卷心菜ms-2”的细胞质在市售的西兰花品种“grandome”、“pixel”等中使用,可
容易地获得。
80.所谓具有来源于萝卜的细胞质雄性不育基因的细胞质雄性不育芸薹属植物是指,如上文所述,典型而言具有ogura cms基因的植物。
81.根据本发明的一个优选的方式,在本发明的芜菁植物或其后代中,由线粒体基因组标记brmt-13k、brmt-23k、brmt-74k、brmt-120k、brmt-149k、brmt-185k确定的线粒体dna中的至任一者为芜菁型。需要说明的是,此处,上述“至少任一者”更优选为“至少任意2个”,进一步优选为“至少任意3个”,更进一步优选为“至少任意4个”。根据进一步优选的方式,在本发明的芜菁植物或其后代中,由线粒体基因组标记brmt-13k、brmt-23k、brmt-74k、brmt-120k、brmt-149k、brmt-185k确定的线粒体dna为芜菁型。
82.根据本发明的一个优选的方式,在本发明的芜菁植物或其后代中,由线粒体基因组标记brmt-119k、brmt-133k、brmt-139k、brmt-171k、brmt-208k确定的线粒体dna的至少任一者为甘蓝型。需要说明的是,此处,上述“至少任一者”更优选是“至少任意2个”,进一步优选是“至少任意3个”,更进一步优选是“至少任意4个”。根据进一步优选的方式,在本发明的芜菁植物或其后代中,由线粒体基因组标记brmt-119k、brmt-133k、brmt-139k、brmt-171k、brmt-208k确定的线粒体dna为甘蓝型。
83.根据本发明的一个优选的方式,在本发明的芜菁植物或其后代中,由线粒体基因组标记brmt-13k、brmt-16k、brmt-23k、brmt-28k、brmt-43k、brmt-58k、brmt-63k、brmt-70k、brmt-74k、brmt-88k、brmt-100k、brmt-111k、brmt-120k、brmt-141k、brmt-149k、brmt-157k、brmt-161k、brmt-185k、brmt-199k、brmt-213k和brmt-215k确定的线粒体dna中的至少任一者为芜菁型,且由线粒体基因组标记brmt-3k、brmt-4k、brmt-36k、brmt-65k、brmt-80k、brmt-94k、brmt-119k、brmt-133k、brmt-139k、brmt-171k和brmt-208k确定的线粒体dna中的至少任一者为甘蓝型。需要说明的是,此处,上述“至少任一者”更优选为“至少任意2个”,进一步优选为“至少任意3个”,更进一步优选为“至少任意4个”。
84.根据本发明的一个进一步优选的方式,在本发明的芜菁植物或其后代中,由线粒体基因组标记brmt-13k、brmt-16k、brmt-23k、brmt-28k、brmt-43k、brmt-58k、brmt-63k、brmt-70k、brmt-74k、brmt-88k、brmt-100k、brmt-111k、brmt-120k、brmt-141k、brmt-149k、brmt-157k、brmt-161k、brmt-185k、brmt-199k、brmt-213k和brmt-215k确定的线粒体dna为芜菁型,且由线粒体基因组标记brmt-3k、brmt-4k、brmt-36k、brmt-65k、brmt-80k、brmt-94k、brmt-119k、brmt-133k、brmt-139k、brmt-171k和brmt-208k确定的线粒体dna为甘蓝型。
85.根据本发明的更优选的方式,根据本发明的生长性被改良的细胞质雄性不育芜菁植物或其后代为具有与保藏编号ferm bp-22371或ferm bp-22372(后述)相同的植物线粒体基因组的芜菁植物或其后代,进一步优选的是与保藏编号ferm bp-22371或ferm bp-22372相同的芜菁植物或其后代。
86.在本说明书中,生长性被改良的细胞质雄性不育芜菁植物或其后代的“植物体的一部分”是包含该植物体的1个以上的细胞或来自1个以上的细胞的细胞质的植物体的一部分,具体而言意指花、叶、茎、根等器官或组织,或者来自这些器官或组织的细胞(包括从细胞制备的原生质体)或细胞质、或者上述细胞或细胞质的聚集体。
87.生长性被改良的细胞质雄性不育芜菁植物的繁育方法
88.根据本发明的生长性被改良的细胞质雄性不育芜菁植物可以按照例如以下步骤进行繁育。
89.(1)具有高再分化能力、且具有正常细胞质的细胞质受体亲本的繁育
90.(2)原生质体的制备
91.(i)具有正常细胞质的芜菁种间杂交植物的原生质体的分离
92.(ii)现有的细胞质雄性不育芜菁植物的原生质体的分离
93.(3)原生质体的融合处理
94.(4)融合杂种细胞的培养
95.(5)具有细胞质雄性不育性的细胞质杂交植物的筛选
96.(6)从愈伤组织再生植物体
97.(7)后代的获得和优良株系的筛选
98.需要说明的是,在本说明书中,“制造方法”也可称之为“繁育方法”。即,此处的术语“繁育”和“制造”的术语可以以同等的含义使用。
99.上述各步骤更具体而言如下所述。
100.(1)具有高再分化能力、且具有正常细胞质的细胞质受体亲本的繁育
101.如前所述,在利用cms的f1品种的开发中,重要的是显示雄性不育性的细胞质尽可能地不对雄性不育性以外的性状产生影响。在使用非对称细胞融合技术繁育细胞质杂种时,由于线粒体基因组的重组是随机(random)发生的,获得未伴有不良性状、且维持雄性不育性的重组线粒体的概率低,因而需要繁育大量细胞质杂种,筛选优良个体。
102.然而,芜菁植物与同为芸薹属植物的甘蓝植物、油菜植物相比,难以从介由非对称细胞融合得到的融合细胞再生植物体,因而尚未报道过芜菁植物的细胞质杂交植物的高效繁育方法。因此,开发高效地繁育大量细胞质杂种的方法是必不可少的。
103.需要说明的是,此处,所谓细胞质杂交植物是指细胞质成为杂种状态的植物,例如,指通过进行细胞融合(此处优选非对称细胞融合)而获得的植物。
104.此外,当实施利用软x射线等放射线的非对称细胞融合时,十字花科植物中,被导入的多为细胞质供体亲本的片段化的核基因组的一部分,存在融合细胞的分裂、从融合细胞再生植物体变得困难的情况。因此,为了高效地繁育细胞质杂种,尽可能地提高细胞质受体亲本的再分化能力变得非常重要。
105.在十字花科植物中,甘蓝植物从培养细胞再分化的能力高是已知的。与之相对,芜菁植物的再分化能力低,从培养细胞成功再生植物体的例子限于特定的品种。因此,为了提高细胞质杂种的繁育效率,期望首先以正常细胞质的芜菁植物作为种子亲本、以甘蓝植物作为花粉亲本繁育种间杂交植物,繁育具有高再分化能力的芜菁植物与甘蓝植物的种间杂交植物,作为细胞质受体亲本。
106.在下文中,“具有高再分化能力的芜菁与甘蓝的种间杂交植物”有时记载为“芜菁种间杂交植物”。得到的芜菁种间杂交植物以正常细胞质的芜菁植物作为种子亲本、细胞质进行母系遗传,从而具有与正常细胞质的芜菁相同的细胞质且再分化能力提高,因而其作为细胞质受体亲本的性质而言是优选的。
107.此处,“高再分化能力”是指从愈伤组织化的细胞再分化为植物体的能力高,指将愈伤组织植于再分化培养基后1个月后的再分化率(再分化的愈伤组织数/植于再分化培养
基的愈伤组织数)为30%以上、更优选为50%以上的情况。
108.进一步期望的是,以将上述芜菁种间杂交植物人为多倍化并繁育而得的双二倍体作为种子亲本、以正常细胞质的芜菁植物作为花粉亲本进行回交,将得到的后代进行组织培养,筛选具有高再分化能力的个体,可获得具有高再分化能力的三倍体的芜菁种间杂交植物。如上所述,重复以正常细胞质的芜菁植物作为花粉亲本的连续回交、和基于组织培养的具有高再分化能力的个体的筛选,最终可获得具有高再分化能力、核基因组接近芜菁的二倍体芜菁种间杂交植物。由于雌性育性随着接近二倍体而提高,因而期望将这些芜菁种间杂交植物作为细胞质受体亲本。
109.(2)原生质体的制备
110.(i)具有正常细胞质的芜菁种间杂交植物的原生质体的分离
111.在本发明中,用作细胞质受体亲本的芜菁植物为上述(1)的芜菁种间杂交植物,更优选使用与芜菁进一步回交而培育的芜菁种间杂交植物。
112.作为为了获得原生质体而使用的细胞组织,期望将产量能力高、分裂活性高的叶肉组织供于试验,但也可以使用胚轴、茎、愈伤组织等其他组织作为材料。
113.分离原生质体的方法可以是该技术领域中已知的常用方法(例如,matsumoto,e,plant cell reports,1991.vol9(10)等中记载的方法),没有特殊限定。以下虽然示出了作为具体例子的步骤,但本发明并非必然受到这些例子的限制。
114.首先,将芜菁植物的细胞组织切碎,使用原生质体分离用酶溶液通过酶处理分离原生质体。该溶液是主要含有细胞壁分解酶、渗透压调节剂的无机盐缓冲液。作为细胞壁分解酶,只要能够用于植物的细胞壁分解即可,没有特殊限定,例如可举出纤维素酶、半纤维素酶、果胶酶等。本发明中,纤维素酶y-c与离析酶r-10(macerozyme r-10)的组合是优选的。
115.作为渗透压调节剂,可以使用常见的糖醇类,例如甘露糖醇、山梨糖醇、葡萄糖等,甘露糖醇是优选的,0.3m~0.7m的浓度的甘露糖醇是特别优选的。另外,为了原生质体膜的稳定化,期望向酶溶液中添加无机盐,例如,添加下表1中记载的组成的cpw盐(cocking and peberdy,1974)是合适的。对于酶处理而言,于25~30℃静置处理8~20小时是合适的。
116.表1:cpw盐溶液的组成
117.kh2po427.2mg/lkno3101.0mg/lcacl2·
2h2o1,480.0mg/lmgso4246.0mg/lki0.16mg/lcuso4·
5h2o0.025.mg/l甘露糖醇0.6mph5.8
118.将通过酶处理分离的原生质体用30~100μm孔径的纳米筛过滤,离心分离并收集原生质体,将酶液去除。之后,将原生质体悬浮于清洗液中,洗涤原生质体。作为洗涤液,可以使用向通常使用的cpw盐溶液中添加糖醇类作为渗透压调节剂而得的液体。
119.之后,为了防止芜菁种间杂交植物原生质体单独的分裂,期望实施失活处理。失活
处理可以通过使原生质体悬浮于溶解有碘乙酸、碘乙酰胺等碘化合物的cpw盐溶液等中来实施。本发明中,悬浮在将碘乙酰胺调节至5mm~30mm的浓度而得的cpw溶液中处理5~20分钟是合适的。
120.之后利用离心分离机,重复1~3次使用cpw盐溶液的洗涤操作是优选的。由于原生质体的悬浮液中还混入了导管、细胞的碎片,因而进一步通过密度梯度离心分离法等来纯化原生质体是优选的。
121.用于纯化的试剂可举出糖类、合成胶体等,但本发明中利用蔗糖液是合适的,利用15%~20%的蔗糖液是特别合适的。原生质体的纯化后,通过血细胞计数板测量细胞密度,以成为适于细胞融合的细胞密度的方式利用cpw盐溶液调节液体量。原生质体的细胞密度优选为1x 105~1x 107个细胞/ml,液体量的调节中优选利用cpw盐溶液。
122.(ii)现有的细胞质雄性不育芜菁植物的原生质体的分离
123.用作细胞质供体亲本的现有的细胞质雄性不育芜菁植物没有特殊限定,期望使用由坂田种苗株式会社开发、在甘蓝作物中使用的cms株系“卷心菜ms-2”(日本特开平07-031307号公报)。“卷心菜ms-2”的细胞质在市售的西兰花品种“grandome”、“pixel”等中使用,可容易地获得。“卷心菜ms-2”的细胞质也可以直接利用,但更期望进一步进行基于惯用的芜菁植物的连续回交的核置换,繁育细胞质雄性不育芜菁植物而使用。
124.现有的细胞质雄性不育植物的原生质体的分离例如可以按照与上述芜菁种间杂交植物的原生质体的分离同样的方法进行。
125.对于分离后的现有细胞质雄性不育芜菁植物的原生质体而言,期望使用通过放射线处理使核失活而得的原生质体。作为为了放射线处理而照射的放射线,可举出x射线、γ射线、紫外线等,但只要能破坏核,则无需特殊限定。对于照射线量而言,在能够破坏核的范围内以尽可能低的照射量进行是优选的。例如,本发明中的软x射线照射的情况下,100gy~900gy的照射量是优选的。
126.(3)原生质体的融合处理
127.之后,混合上述获得的两种原生质体,进行细胞融合。
128.作为融合方法,可举出惯用的方法,例如已知的电融合法(planta,151,26-32,1981)、peg(聚乙二醇)法(planta,120,215-227,1974)、糊精法(jap.j.genet.,50,235,1975)等,但没有特殊限定。本发明中优选的是使用peg法。
129.(4)融合杂种细胞的培养
130.融合处理而得的细胞优选在合适来源于芜菁种间杂交植物的原生质体的培养的培养基中培养。作为来源于具有高再分化能力的芜菁与甘蓝的种间杂交植物的原生质体的培养方法,可基于芸薹(brassica)类的原生质体的培养法进行适宜改变,没有特别限定,在本发明中,优选以使nh4no3减少至200mg/l而得的1/2浓度的ms培养基作为基础培养基,适宜加入植物生长调节物质、各种添加物等而使用。
131.(5)具有细胞质雄性不育性的细胞质杂交植物的筛选
132.进行融合细胞的培养,开始细胞分裂,在愈伤组织已能以目视确认的阶段,将愈伤组织移植至愈伤组织增殖培养基中。愈伤组织增殖培养基可使用惯用的培养基,根据作为材料的植物的基因型、愈伤组织的状态存在反应差异,例如使用含有1.0~5.0mg/l naa和0.1~3.0mg/l 4-cppu的ms培养基等是合适的。
133.ogura cms的细胞质雄性不育性的因果基因被确定为位于线粒体基因组的orf138。因此,为了从得到的愈伤组织中筛选具有细胞质雄性不育性的个体,优选从通过上述的步骤增殖的愈伤组织中提取dna,使用能特异性扩增orf138的标记通过pcr法进行检测。
134.(6)从愈伤组织再生植物体
135.将得到的具有orf138的愈伤组织移植至再分化培养基中使其再分化。
136.再分化培养基可使用惯用的培养基,根据作为材料的植物的基因型、愈伤组织的状态存在反应差异,例如使用含有0.1~1.0mg/l的naa和0.1~1.0mg/l的4-cppu的ms培养基等是合适的。
137.将再生的芽(shoot)移植至添加有3%蔗糖、0.8%琼脂的ms培养基等中使其生根,使植物体再生。再生的植物体进行驯化,并于温室内进行培育。
138.在十字花科植物的非对称细胞融合中,一般而言通过放射线处理使细胞质供体亲本的核破坏,但核基因组的破坏不完全,常有基因组的一部分被摄入细胞质受体亲本中。此外,在非对称细胞融合时,由于还存在来源于细胞质供体亲本的原生质体或细胞质受体亲本的原生质体进行多个融合的情况,因而常产生非整倍体、高倍体。八倍体以上的高倍体难以再分化的可能性高,并且由于雌性育性的降低而难以获得后代,因而期望用流式细胞术测定dna含量,排除八倍体以上的高倍体。
139.由于基于非对称细胞融合的线粒体基因组的重组高频且随机(random)地发生,因而期望繁育50个个体以上的细胞质杂种植物。
140.(7)后代的获得和优良株系的筛选
141.培育得到的细胞质杂交植物并使其开花,筛选具有雄性不育性状的个体,以具有正常细胞质的任意的芜菁植物作为花粉亲本而进行交配。
142.由于细胞质杂交植物在非整倍体、高倍体的情况下难以获得大量后代,因而期望花粉亲本使用遗传上多样的、具有多个正常细胞质的任意的芜菁植物。为了从得到的细胞质杂交植物获得后代,多需要进行胚胎培养。
143.胚培养是在受粉后的胚生长不充分、保持原样会枯死的情况下,摘出胚,使胚在适当的培养基上成长的技术。胚培养的方法可通过惯用的方法进行,而在本发明中,期望从交配后第7天~第10天的胚珠中摘出胚,在添加有3%蔗糖、10%椰子水(sigma-aldrich)、0.8%琼脂的1/2浓度的ms培养基上进行培养。再生的芽移植至添加有3%蔗糖、0.8%琼脂的ms培养基等上使其生根,再生植物体。再生的植物体进行驯化,并于温室内进行培育。再生的植物体开花后,筛选雄性不育性的个体。
144.直到可从雄性不育性的个体得到后代种子为止,持续进行以该具有正常细胞质的任意的芜菁植物为花粉亲本的交配及其后的胚培养。对于已能得到后代种子的个体而言,以特定的具有正常细胞质的芜菁植物作为花粉亲本进行连续回交。此处,当特定的具有正常细胞质的芜菁植物与现有的细胞质雄性不育芜菁植物进行连续回交时,期望预先选定生长性显著降低的、遗传上固定的株系。
145.通过以特定的具有正常细胞质的芜菁植物作为花粉亲本重复交配,核基因组变得与特定的具有正常细胞质的芜菁植物相同,从而可通过比较细胞质的特性进行筛选。对于连续回交而言,为了进行充分的核置换,期望进行7次以上。完成了连续回交的株系与特定
的具有正常细胞质的芜菁植物进行比较,确认具有细胞质雄性不育性的性状,且未伴有其他的不良性状。
146.实施例
147.通过下述的实施例具体地说明本发明,但本发明不受这些实施例的任何限定。
148.实施例1:生长性被改善的ogura cms芜菁植物的繁育方法
149.(1)具有高再分化能力、且具有正常细胞质的细胞质受体亲本的繁育
150.芜菁一般而言再分化能力低,出于赋予高再分化能力的目的,以芜菁“sh”为种子亲本、以花椰菜“wc”为花粉亲本进行交配。在无菌环境下,从交配后第10天的胚珠中摘出胚,植于添加有3%蔗糖、10%椰子水(sigma-aldrich)、0.8%琼脂的1/2浓度的ms培养基中,进行胚胎培养。2周后,将生长的幼植物移植到添加有3%蔗糖、0.8%琼脂的ms培养基中。通过胚培养,获得了6个个体的种间杂种(f1)。
151.将“sh”和各种间杂种的叶柄以5mm长度切断,置床于添加有1mg/l 2,4-d、3%蔗糖、0.8%琼脂的ms培养基,培养3周。将生长至1cm左右大小的愈伤组织切分成1mm的大小,置床于添加有0.3mg/l4-cppu、0.3mg/l naa、3%蔗糖、0.8%琼脂的ms培养基,培养1个月,调查再分化率。
152.结果如表2中所示。
153.表2:各芜菁种间杂交植物(f1)的再分化率
154.株系名称愈伤组织置床数再分化数再分化率(%)sh900sh-wc19556sh-wc29111sh-wc39333sh-wc49667sh-wc59111sh-wc69111
155.再分化数示出再分化而得的愈伤组织的数量。
156.表2中,来源于“sh”的愈伤组织没有再分化,但在种间杂种中得到了具有高再分化能力的个体。通过秋水仙碱处理再分化率最高的株系“sh-wc4”,人为进行多倍化而使其成为双二倍体。此后将双二倍体化的“sh-wc4”标记为“sh-wc4d”。以“sh-wc4d”为种子亲本、以芜菁的“s”为花粉亲本进行交配。在无菌环境下从交配后第10天的胚珠中摘出胚,置床于添加有3%蔗糖、10%椰子水(sigma-aldrich)、0.8%琼脂的1/2浓度的ms培养基中,进行胚培养。2周后,将生长的幼植物移植到添加有蔗糖30g/l的ms培养基中。通过胚培养,获得7个个体的种间杂种(f1bc1)。
157.将各种间杂种(f1bc1)的叶柄同样地以5mm长度切断,植于添加有1mg/l 2,4-d、3%蔗糖、0.8%琼脂的ms培养基,培养3周。将生长至1cm左右大小的愈伤组织切分成1mm的大小,置床于添加有0.3mg/l 4-cppu、0.3mg/l naa、3%蔗糖、0.8%琼脂的ms培养基,培养1个月,调查再分化率。
158.结果如表3中所示。
159.表3:各芜菁种间杂交植物(f1bc1)的再分化率
160.株系名称愈伤组织植入数再分化数再分化率(%)sh-wc4d-s1181161sh-wc4d-s218844sh-wc4d-s3181161sh-wc4d-s418633sh-wc4d-s5181161sh-wc4d-s61800sh-wc4d-s7181161
161.再分化数示出再分化而得的愈伤组织的数量。
162.根据表3的结果,虽然在f1bc1中株系间存在差异,但得到了显示高再分化率的株系。sh-wc4d-s1、sh-wc4d-s3、sh-wc4d-s5、sh-wc4d-s7的再分化率同为61%,选定雌性育性最高的“sh-wc4d-s5”作为种子亲本。期望以“sh-wc4d-s5”作为种子亲本进一步进行芜菁植物的回交(backcross),但“sh-wc4d-s5”是将二倍体与双二倍体进行交配,因而成为异质三倍体,预期其难以得到后代。
163.因此认为,为了得到后代,需要将各种基因型的芜菁植物用于花粉亲本,因而准备“sh”、“os”、“s”、“w”4株系作为花粉亲本并进行交配。但是,人工交配中完全没有得到后代,因而在封闭型温室内将“sh-wc4d-s5”配置为种子亲本,在其旁边配置上述4株系的芜菁植物,进行基于虫媒的交配。种间杂交的后代一般在高温下容易得到,因而将温室的温度控制为昼温32℃、夜温15℃。基于虫媒的交配结果是得到了约100粒种子,但小颗粒的种子多。选出37粒与普通芜菁植物的种子大小接近的种子,在体外(in vitro)进行无菌播种后,成为f1bc2的36个个体的芜菁种间杂交植物发芽。将发芽的个体的株系名称分别设为“sh-wc4d-s5-x1~36”。
164.将各种间杂交(f1bc2)的个体的叶柄以5mm长度切断,置床于添加有1mg/l 2,4-d、3%蔗糖、0.8%琼脂的ms培养基,培养3周。将生长至1cm左右大小的愈伤组织切分成1mm的大小,置床于添加有0.3mg/l 4-cppu、0.3mg/l naa、3%蔗糖、0.8%琼脂的ms培养基,培养1个月,调查再分化率。
165.结果如表4中所示。
166.表4:各芜菁种间杂交植物(f1bc2)的再分化率
167.株系名称愈伤组织置床数再分化数再分化率(%)sh-wc4d-s5-x118211sh-wc4d-s5-x21800sh-wc4d-s5-x318211sh-wc4d-s5-x41800sh-wc4d-s5-x51816sh-wc4d-s5-x618317sh-wc4d-s5-x7181161sh-wc4d-s5-x81800sh-wc4d-s5-x918844sh-wc4d-s5-x101800
sh-wc4d-s5-x1118422sh-wc4d-s5-x12181583sh-wc4d-s5-x131816sh-wc4d-s5-x1418950sh-wc4d-s5-x1518528sh-wc4d-s5-x161800sh-wc4d-s5-x1718528sh-wc4d-s5-x181816sh-wc4d-s5-x191800sh-wc4d-s5-x201800sh-wc4d-s5-x2118844sh-wc4d-s5-x2218739sh-wc4d-s5-x231800sh-wc4d-s5-x241800sh-wc4d-s5-x251800sh-wc4d-s5-x26181372sh-wc4d-s5-x271800sh-wc4d-s5-x28181056sh-wc4d-s5-x291816sh-wc4d-s5-x301800sh-wc4d-s5-x3118422sh-wc4d-s5-x32181689sh-wc4d-s5-x3318211sh-wc4d-s5-x341800sh-wc4d-s5-x3518317sh-wc4d-s5-x3618422
168.再分化数示出再分化而得的愈伤组织的数量。
169.根据表4的结果,虽然f1bc2的株系间差异大,但“sh-wc4d-s5-x12”再分化率为83%,“sh-wc4d-s5-x32”再分化率为89%,显示出高的再分化率。由于“sh-wc4d-s5-x12”雌性育性低,因而以雌性育性高的“sh-wc4d-s5-x32”作为细胞质受体亲本供于试验。
170.(2)原生质体的制备
171.(i)具有正常细胞质的芜菁种间杂交植物的原生质体的分离
172.使用“sh-wc4d-s5-x32”作为具有正常细胞质的芜菁种间杂交植物。将“sh-wc4d-s5-x32”移植至添加有3%蔗糖、0.8%琼脂的ms培养基,培育1个月。采集展开的真叶约1g,切碎成约2mm的大小,然后浸泡在含有0.3%纤维素酶y-c、0.3%离析酶r-10、0.5m甘露糖醇的cpw碱溶液10ml中,25℃静置16小时。
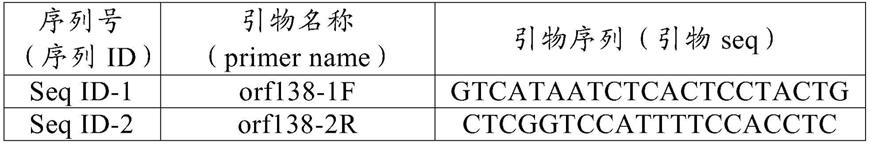
173.用92μm的纳米筛过滤含有叶组织的酶液,除去细胞残渣。将得到的原生质体悬浮液移至离心管,以800rpm进行5分钟离心分离。除去上清液,将得到的原生质体悬浮于含有15mm碘乙酰胺的cpw盐溶液5ml中,4℃孵育15分钟。孵育后,将经碘乙酰胺处理的原生质体
悬浮液于800rpm进行5分钟离心分离,然后除去上清液。向原生质体悬浮液中加入cpw盐溶液10ml,重复3次于800rpm进行5分钟离心分离并除去上清液的操作,洗涤原生质体。
174.将经洗涤而得的原生质体悬浮液于800rpm进行5分钟离心分离,除去上清液,加入2ml的cpw盐溶液,使原生质体悬浮。向新离心管中加入添加有20%蔗糖的cpw盐溶液5ml,在其上覆盖上述原生质体的悬浮液,于800rpm进行5分钟离心分离。细胞残渣沉淀至离心管底部,纯化的原生质体上浮至上层的cpw盐溶液层中,因而用巴氏吸管移至新的离心管中。取少量悬浮液,使用血细胞计数板求出原生质体的细胞密度,加入cpw液制备为1x 106个/ml。
175.(ii)现有的ogura cms芜菁植物的原生质体的分离
176.使用cms株系“ha280”作为现有的ogura cms芜菁植物,所述cms株系“ha280”来源于通过交配使甘蓝核置换为芜菁而得的“卷心菜ms-2”。
177.首先,将灭菌的种子置床于添加有3%蔗糖、0.8%琼脂的ms培养基中,20℃、16小时照明下培育约1个月。采集展开的真叶约1g,切碎成约2mm的大小,然后浸泡在含有0.3%纤维素酶y-c、0.3%离析酶r-10、甘露糖醇的cpw碱溶液10ml中,25℃静置16小时。
178.用92μm的纳米筛过滤含有叶组织的酶液,除去细胞残渣。用巴氏吸管将原生质体移至塑料培养皿,照射软x射线900gy。
179.将得到的原生质体悬浮液移至离心管,以800rpm进行5分钟离心分离,除去上清液,加入2ml的cpw盐溶液使原生质体悬浮。向新离心管中加入添加有20%蔗糖的cpw盐溶液5ml,在其上覆盖上述原生质体的悬浮液,于800rpm进行5分钟离心分离。细胞残渣沉淀至离心管底部,纯化的原生质体上浮至上层的cpw盐溶液层中,因而用巴氏吸管至新的离心管中。取少量悬浮液,使用血细胞计数板求出原生质体的细胞密度,加入cpw盐溶液制备为1x 106个/ml。
180.(3)原生质体的融合处理
181.将经碘乙酰胺处理的芜菁种间杂交植物原生质体悬浮液与经软x射线照射过的现有的ogura cms芜菁植物原生质体悬浮液按1:3的比率混合,向9cm培养皿的底面中央滴加2ml混合液。静置30分钟后,向原生质体混合液的周围滴加500g/l peg溶液(聚乙二醇#6000(nacalai tesque inc.)、1,500mg/l cacl2·
2h2o、100mg/l kh2po4、ph5.5)3ml。
182.1分钟后,向原生质体混合液的周围滴加cpw盐溶液3.5ml。再过2分钟后,向原生质体混合液的周围滴加cpw盐溶液3.5ml。5分钟后,从培养皿的边缘轻轻吸去所滴加的液体,将其除去,从培养皿的边缘加入cpw盐溶液20ml。以5分钟的间隔重复3次使用该cpw盐溶液的洗涤操作。
183.(4)融合杂种细胞的培养
184.除去洗涤液后,添加10ml含有0.5m甘露糖醇、150mg/l酪蛋白氨基酸、100mg/l l-谷氨酰胺、0.03mg/l naa、0.03mg/l 2,4-d、0.1mg/lba和1%蔗糖、并使nh4no3减少至200mg/l而得的1/2浓度的ms培养基10ml(ph5.8),在25℃暗处培养。
185.培养开始5天后,添加含有150mg/l酪蛋白氨基酸、100mg/l l-谷氨酰胺、0.03mg/l naa、0.03mg/l 2,4-d、0.1mg/l ba和1%蔗糖、并使nh4no3减少至200mg/l而得的1/2浓度的ms培养基5ml(ph5.8),使甘露糖醇浓度降低并继续培养。
186.培养开始10天后,将附着在培养皿底部的细胞用镊子尖端以摩擦的方式进行剥离,添加含有0.2m甘露糖醇、4%蔗糖、0.6%结冷胶的溶液7.5ml,通过混合使其形成半固体
化状态的凝胶培养基,继续培养。
187.培养开始约1个月,由于愈伤组织已能够通过肉眼确认,因而将愈伤组织移植至愈伤组织增殖培养基(含有1mg/l 4-cppu、3mg/l naa、3.0%蔗糖、0.8%琼脂的ms培养基,ph5.8)中。愈伤组织通过13次融合处理实验而得到464个个体。
188.(5)具有细胞质雄性不育性的细胞质杂交植物的筛选
189.ogura cms的细胞质雄性不育性的因果基因被确定为存在于线粒体基因组中的orf138。为了通过pcr法检测ogura cms特异性的dna,根据已知的碱基序列信息(genebank登录号ab055435.1)设计orf138基因特异性的引物(表5)。
190.表5:细胞质杂种的筛选中使用的线粒体基因组标记的引物序列
[0191][0192]
在愈伤组织生长至5mm以上的大小的阶段,将愈伤组织的一部分取样,提取dna。以提取的全基因组dna为模板,使用引物orf138-1f和orf138-2r的各组合实施pcr。pcr重复35个如下循环:热变性94℃、1分钟、退火60℃、2分钟、延伸反应72℃、2分钟。
[0193]
将pcr产物在1.8%琼脂糖凝胶进行电泳,浸渍于溴化乙锭溶液,然后在uv照射下拍摄照片,筛选具有所预想的大小(376bp)的条带的个体。将(4)中得到的464个愈伤组织通过上述pcr法调查有无orf138基因,结果,154个愈伤组织具有orf138基因,认为是细胞质杂种细胞。
[0194]
(6)从愈伤组织再生植物体
[0195]
当愈伤组织成为1cm左右的大小时,将愈伤组织切分成2mm左右的尺寸,移植至再分化培养基(含有0.3mg/l 4-cppu、0.3mg/l naa、3.0%蔗糖、0.8%琼脂的ms培养基,ph5.8)中。
[0196]
愈伤组织在移植至再分化培养基2周后开始芽的分化。通过将分化的芽移植至含有3.0%蔗糖、0.8%琼脂的ms培养基(ph5.8)而使其生根。将(5)中具有orf138基因的154个愈伤组织移植至再分化培养基中,通过传代,得到68株系的再分化植物。将细胞质杂交植物移植到50孔穴盘中进行驯化,驯化后在玻璃温室内进行育苗。
[0197]
通过流式细胞仪检测细胞质杂交植物的倍性,结果为包括非整倍性在内的二倍体~八倍体。
[0198]
作为细胞质受体亲本的芜菁种间杂交植物“sh-wc4d-s5-x32”是二倍体,认为细胞质杂交植物成为高倍性的原因为在非对称细胞融合时多个来源于芜菁种间杂交植物的原生质体发生了融合。此外,认为成为非整倍性的原因为导入了照射过软x射线的细胞质提供亲本的基因组的一部分。倍性为八倍体以内的植物有可能得到后代,因而在本实验中继续进行全部个体的育苗。
[0199]
细胞质杂交植物在玻璃温室育苗1个月后,入库设定为4℃的冰库(8小时照明),进行2个月春化处理。春化处理后,将细胞质杂交植物移植到15cm钵。
[0200]
在春化处理后的1~2个月期间,68株系的细胞质杂交植物之中,49株系实现开花,而11株系由于形态异常而未实现开花,8株系由于遗传性弱势而枯死。开花的49株系之中,
显示雄性不育性的株系为29株系,剩余的20株系为雄性可育。雄性可育的20株系之中,1株系的orf138基因消失,19株系尽管保持了orf138基因,但仍显示完全或部分的雄性可育。
[0201]
一般认为,对于通过非对称细胞融合繁育的细胞质杂交植物而言,线粒体基因组重组,异质的状态持续5代以上。因此,认为orf138基因在线粒体从异质的状态转向同质的状态的过程中完全消失。此外,即使导入了orf138基因,还要考虑由于其量不足等而使雄性不育性变得不稳定的情况。
[0202]
以表达雄性不育性的29株系作为种子亲本、以具有正常细胞质的芜菁植物“os”作为花粉亲本,放入温室内进行基于虫媒的交配。
[0203]
其结果是,成功地从17株系雄性不育株系得到后代种子bc1。培育bc1株系后,在17株系之中,10株系部分地恢复雄性育性因而废弃。维持了雄性不育性的7株系进一步以具有正常细胞质的4株系芜菁植物“sh”、“os”、“s”、“w”作为花粉亲本,进行基于虫媒的交配。其结果是,成功地从全部7株系得到了后代种子bc2。
[0204]
由于在bc2代中,种子变得容易获得,因而在bc3以后,决定使用具有正常细胞质的芜菁植物“sh”。已知在以前的试验中,“sh”在与现有的ogura cms芜菁植物进行连续回交时显示出生长性显著降低。即,通过意图性地以生长性容易降低的“sh”作为连续回交的花粉亲本使用,使得细胞质的影响导致的生长性降低变得更容易检测,因而能够实现生长性没有降低的cms株系的筛选。
[0205]
以上述显示雄性不育性的7株系细胞质杂种作为种子亲本、以“sh”作为花粉亲本进行连续回交。在各世代中筛选显示与“sh”同等及以上的生长性的个体,重复直至将“sh”进行7次交配而得的bc7(就芜菁的回交而言为bc9)为止。
[0206]
各细胞质杂种的株系在连续回交的过程中,基于被认为由异质性造成的特性差异而划分为多个支系等,基于生长性、雄性不育性的稳定性、制种性、花型,重复进行筛选,最终筛选出性状最优异的“j1”。“j1”在连续回交的各个世代中分成支系,基于生长性的差异最终筛选出“j1-3”和“j1-7”2株系。即,作为“j1”的支系的“j1-3”和“j1-7”是从相同的融合细胞产生的株系,在细胞融合后线粒体从异质的状态转向同质的状态的过程中的bc4世代成为支系。“j1-3”的生长性超过正常细胞质株系,“j1-7”显示出微微优于或等同于正常细胞质株系的生长性。
[0207]“j1-3”和“j1-7”2株系的bc7的种子已分别于2018年12月12日在独立行政法人制品评价技术基盘结构专利生物保藏中心(千叶县木更津市上总镰足2-5-8 120号室)进行了国际保藏。这些株系的保藏者添加的识别用标示和保藏编号如下所述:
[0208]
《j1-3》
[0209]
保藏者添加的识别用标示:ssc-gcc-18-001
[0210]
保藏编号:ferm bp-22371,
[0211]
《j1-7》
[0212]
保藏者添加的识别用标示:ssc-gcc-18-002
[0213]
保藏编号:ferm bp-22372。
[0214]
实施例2:“j1-3”和“j1-7”的生长性的评价
[0215]
为了确认介由实施例1繁育的改良cms株系的有用性,进行具有正常细胞质、cms细胞质的芜菁植物的生长性的比较试验。
[0216]
如实施例1中记载的,已知“sh”在与现有的ogura cms芜菁植物连续回交时,生长性显著降低。因此,将该具有正常细胞质的芜菁植物“sh”连续回交各细胞质雄性不育株系进行核置换,由此使各细胞质雄性不育株系的核基因组变得与“sh”相同,同时生长性的降低变得容易检测。因此,通过将各细胞质雄性不育株系栽培在同一条件下,可以评价基于细胞质差异的生长性。
[0217]
作为使用ogura cms的芜菁植物,已知有中国的好地种子有限公司培育并在中国销售种子的“紫罗兰油菜”。此外,在日本,渡边农事株式会社也销售“nihao fung”的种子,二者均为青梗菜品种。
[0218]
此外,坂田种苗株式会社中也开发了作为ogura cms的“卷心菜ms-2”,其在甘蓝、芜菁植物中不引起褪绿。
[0219]
针对上述市售的2品种的cms株系、和坂田种苗所持有的1株系的cms株系、以及通过本发明繁育的改良cms株系“j1-3”和“j1-7”,进行“sh”的连续回交。
[0220]
为了正确地评价各cms株系的生长性,在同一环境下从“sh”和上述5株系的cms株系基于虫媒进行制种。
[0221]
将制种而得的“sh”和各cms株系的种子播种于50孔穴盘中,在设定为昼温20℃、夜温10℃、16小时照明的人工气象室内进行栽培。为了定量地评价幼苗的生长性,在播种2周后,于根颈处切取各株系的幼苗的地上部分,测量单株的重量,示于表6中。表中的世代表示连续回交“sh”的次数,例如bc7意味着以“sh”作为花粉亲本,进行7次连续回交。
[0222]
表6:现有的oguracms芜菁植物与被改良的oguracms芜菁植物的幼苗的生长性的比较(人工气象室,播种后2周,昼温20℃、夜温10℃、16小时照明)
[0223][0224]
1)以具有正常细胞质的芜菁植物的地上部分的每1株的平均重量为100时,各cms株系的地上部分的每1株的平均重量的相对值n:正常细胞质
[0225]
s:雄性不育细胞质
[0226]
ss:坂田种苗株式会社
[0227]
hs:好地种子有限公司
[0228]
wn:渡边农事株式会社
[0229]
如表6中所记载的,来源于“紫罗兰油菜”、“nihao fung”、“卷心菜ms-2”的现有的ogura cms株系相对于“sh”的地上部分重量而言的相对值分别为60.7、76.0、63.4,显示出
低生长性。与之相对,改良cms株系“j1-3”相对于“sh”而言的地上部分重量的相对值为130.0,显示出非常高的生长性。此外,改良cms株系“j1-7”相对于“sh”而言的地上部分重量的相对值为105.5,显示出与“sh”同等的生长性。
[0230]
之后,为了评价作为农作物收获的阶段中的生长性,将“sh”和各cms株系的种子播种于9cm硬质钵中,在设定为昼温25℃、夜温15℃的玻璃温室中进行栽培。
[0231]
为了定量地评价苗的生长性,播种46天后,于根颈处切取各株系的苗的地上部分,测量单株的重量,示于表7中。表6的幼苗的生长性的评价试验中,试验包括来源于“nihao fung”的现有的ogura cms株系。但是,基于后述实施例3的线粒体基因组的分析,来源于“紫罗兰油菜”和“nihao fung”的现有的ogura cms株系被认为具有相同的细胞质,因而省略了来源于“nihao fung”的现有的ogura cms株系在收获阶段中的生长性试验。
[0232]
表7:现有的oguracms芜菁植物与被改良的oguracms芜菁植物在收获期的生长性的比较(玻璃温室,播种后46天,昼温25℃、夜温18℃、自然日长)
[0233][0234]
1)以具有正常细胞质的芜菁植物的地上部分的每1株的平均重量为100时,各cms株系的地上部分的每1株的平均重量的相对值
[0235]
*认为来源于nihao fung的cms与来源于紫罗兰油菜的cms是相同的细胞质,因而省略了在收获期中的生长性的比较试验
[0236]
n:正常细胞质
[0237]
s:雄性不育细胞质
[0238]
ss:坂田种苗株式会社
[0239]
hs:好地种子有限公司
[0240]
如表7中所记载的,来源于“紫罗兰油菜”的cms株系相对于“sh”而言的地上部分重量的相对值为77.8,来源于“卷心菜ms-2”的cms株系相对于“sh”而言的地上部分重量的相对值为85.3,观察到生长性的降低。
[0241]
与幼苗中的试验相比,整体上生长性的降低变小,这被认为是经过较长时期的钵栽培,用土内的肥料成分受限而造成的影响。比较表6和表7的结果,各cms株系的生长性降低的顺序存在相关性。因此,对于来源于“紫罗兰油菜”、“nihao fung”、“卷心菜ms-2”的现有的ogura cms株系而言,在“sh”的核基因组的背景中,确认到生长性降低。
[0242]
另一方面,改良cms株系“j1-3”相对于“sh”而言的地上部分重量的相对值为130.0,与幼苗时的试验同样地显示出非常高的生长性。改良cms株系“j1-7”相对于“sh”而言的地上部分重量的相对值为104.4,显示出与“sh”同等的生长性。
[0243]
如上所述,来源于现有的ogura cms芜菁植物的cms株系显示出低于正常细胞质的芜菁植物的生长性,与之相对,本发明的改良cms株系确认到具有与正常细胞质的芜菁植物相比为同等以上的高生长性。
[0244]
实施例3
[0245]
为了分析通过实施例1繁育的改良cms株系“j1-3”和“j1-7”的线粒体基因组,比较已知的芜菁线粒体基因组的碱基序列信息(genebank登录号ap017997)、已知的甘蓝线粒体基因组的碱基序列信息(genebank登录号ap012988)、已知的萝卜线粒体基因组的碱基序列信息(genebank登录号ab694744),基于所鉴定的snps(单碱基多态性)、in-del(插入/缺失)的多态性信息,设计靶向35个区域的标记(表8,序列号1~88(seq id-1~id-88))。此外,基于已知的碱基序列信息(genebank登录号ab055435.1)设计用于检测作为来源于萝卜植物的细胞质雄性不育基因的orf138基因的标记(表8,序列号89,序列号90(seq id-89,id-90))。
[0246]
另外,为了分析叶绿体基因组,基于已知的芜菁叶绿体基因组的碱基序列信息(genebank登录号dq231548),设计表9所示的引物(表9,序列号91~92(seq id-91~id-92))。
[0247]
表8-1:
[0248]
表8:线粒体基因组标记的引物序列
[0249][0250]
表8-2:
[0251][0252]
表8-3:
[0253][0254]
表9:叶绿体基因组标记的引物序列
[0255]
序列id引物名称引物序列seq id-91brcp-rbcl-1fggcagtcagaccaactctcaseq id-92brcp-rbcl-2ratcggtccacacagttgtcc
[0256]
作为供于试验的材料,使用具有正常细胞质的芜菁植物“sh”、具有正常细胞质的甘蓝植物“g”、具有ogura cms细胞质的萝卜植物“kn”、作为现有的cms株系的“紫罗兰油菜”、“nihao fung”、“卷心菜ms-2”、作为改良cms株系的“j1-3”、“j1-7”。
[0257]
从各供于试验的材料中提取全基因组dna作为模板,使用表8、表9中记载的引物组进行pcr。pcr条件为使其反应30或35个如下的循环:热变性94℃、1分钟、退火65℃、60℃或55℃、1分钟、延伸反应72℃、2分钟(表10)。
[0258]
表10-1:各标记的pcr条件及限制性酶
[0259][0260]
表10-2:
[0261][0262]
为了在芜菁植物、甘蓝植物、萝卜植物之间进行检测多态性的pcr-rflp分析,将pcr产物利用记载于表10的限制性酶进行处理。这些pcr产物在1.8%琼脂糖凝胶中进行电泳后,浸渍于溴化乙锭溶液中,在uv照射下拍摄照片,调查多态性。
[0263]
使用pcr-rflp法的线粒体基因组的分析结果示于表11中,叶绿体基因组的分析结果示于表12中。表11、表12中的“br”表示芜菁型,“bo”表示甘蓝型,“rs”表示萝卜型。“0”表示基于该标记未检测到,“1”表示基于该标记已检测出。此外,线粒体基因组的分析结果汇总于表13中。表13的括号内的数字表示各线粒体基因组的类型相对于所使用的总标记数而言的比例。此处的总标记数是指,除表11的标记之中的orf138之外,用于线粒体基因组分析中的表11的no.1~35这35个标记。
[0264]
表11-1
[0265]
表11:各株系的线粒体基因组的分析结果
[0266][0267]
表11-2:
[0268][0269]
(表中的符号
·
值的说明)
[0270]
1:芜菁(正常细胞质)
[0271]
2:甘蓝(正常细胞质)
[0272]
3:萝卜(ogura cms)
[0273]
4:来源于紫罗兰油菜的cms
[0274]
5:来源于nihao fung的cms
[0275]
6:来源于卷心菜ms-2的cms
[0276]
7:j1-3
[0277]
8:j1-7
[0278]
br:芜菁型
[0279]
bo:甘蓝型
[0280]
rs:萝卜型
[0281]
0:基于该标记未检测到
[0282]
1:基于该标记已检测出
[0283]
表12:各cms株系的叶绿体基因组的分析结果
[0284][0285]
表13:各cms株系的线粒体基因组的分析结果汇总
[0286][0287]
()内表示各线粒体基因组类型相对于所使用的总标记数而言的比例。此处的总标记数是指,表11的除orf138之外的用于线粒体基因组分析中的no.1~35这35个标记。
[0288]
来源于“紫罗兰油菜”和“nihao fung”的cms株系具有来源于芜菁的叶绿体,具有芜菁与萝卜的重组线粒体基因组。该重组模式在35个标记中全部相同,因而认为是相同来源的cms细胞质。此外,由于具有orf138基因、来源于芜菁的叶绿体,并具有芜菁与萝卜的重组线粒体基因组,因而认为是通过在具有ogura cms细胞质的萝卜植物与具有具有正常细胞质的芜菁植物的细胞质的植物之间的非对称细胞融合而繁育得到的。这样的细胞质结构从未见于专利文献2的“new ogucms”以外的报道,因而认为“紫罗兰油菜”和“nihao fung”的细胞质很可能是通过专利文献2的方法繁育而得的。
[0289]
在表13的结果中,来源于“紫罗兰油菜”和“nihao fung”的cms株系的重组线粒体基因组具有63%的芜菁型线粒体dna,37%的萝卜型线粒体dna。认为表6和表7中示出的生长性的降低的原因是,由于将orf138与许多萝卜型线粒体基因组一同导入了芜菁植物,因而存在芜菁植物的核基因组与来源于萝卜的线粒体基因组之间的不亲和性。
[0290]“卷心菜ms-2”具有77%的甘蓝型线粒体dna,23%的萝卜型线粒体dna,而其叶绿体来源于甘蓝。对于表6和表7所示出的生长性的降低而言,认为是叶绿体来源于甘蓝,并具有来源于甘蓝和萝卜的线粒体基因组,从而诱发了与芜菁植物的核基因组的不亲和性,生长性降低。然而,其生长性降低的程度介于“紫罗兰油菜”和“nihao fung”之间,不引起褪绿
等明确的生长异常,因此推论甘蓝型线粒体基因组和芜菁型线粒体基因组对芜菁植物的生长性造成的影响没有较大区别。按照本发明繁育的“j1-3”和“j1-7”的线粒体基因组具有60%的芜菁型线粒体dna、31%的甘蓝型线粒体dna,萝卜型线粒体dna的比例仅为9%。
[0291]
根据以上结果,认为本发明的方法通过提高基于非对称细胞融合的芜菁植物的细胞质杂交植物的繁育效率,能够筛选如下的cms株系:其导入细胞质雄性不育基因orf138,并且成为生长性降低的原因的萝卜线粒体基因组的导入被抑制到最小限度。结果,认为得到的cms株系保持细胞质雄性不育性,同时芜菁植物与线粒体基因组的亲和性提高,生长性被改良。
[0292]
如上所述,“j1-3”和“j1-7”的生长性提高的理由尚不清楚,但在cms植物的开发中,如果能够得到1株系的实用的cms植物,就能够通过以该cms植物作为种子亲本、以任意的芜菁植物作为花粉亲本进行连续回交来实施核置换,由此将任意的芜菁植物自由地cms化,因此在实用上没有任何问题。即,如果使用本技术发明中保藏的生长性被改良的ogura cms芜菁植物,就能够实现将任意的芜菁植物自由地cms化。
[0293]
需要说明的是,表11的结果示出的是显示细胞质雄性不育性的个体的分析结果的一例,生长性被改良的ogura cms芜菁植物不限于必须呈现这样的条带模式。
[0294]
实施例4
[0295]
cms株系的种子的生产性直接关系到种子亲本和商品种子的生产性,因此比较了各cms株系的制种性。作为供于试验的材料,使用具有正常细胞质的芜菁植物“sh”、作为现有的cms株系的“紫罗兰油菜”、“nihao fung”、“卷心菜ms-2”、作为改良cms株系的“j1-3”和“j1-7”。
[0296]
在50孔的穴盘中播种各株系10粒,在昼温23℃、夜温15℃的玻璃温室中育苗1个月后,放入设定为4℃的冰库(8小时照明)中2个月,进行春化处理。春化处理结束后,将各株系定植2株至10号钵中,在昼温23℃、夜温15℃的玻璃温室中进行栽培。交配通过虫媒进行,结籽后进行精选,调查每1株的制种量。
[0297]
表14示出了各株系的每1株的平均制种量的结果。
[0298]
表14:各株系的制种量的比较
[0299][0300]
1)以具有正常细胞质的芜菁植物“sh”的每1株的平均制种量作为100时,各cms株系的平均制种量的相对值
[0301]
以具有正常细胞质的芜菁植物“sh”的制种量为100时,来源于“紫罗兰油菜”、“nihao fung”的cms株系的制种量的相对值为70左右。认为这些cms株系由于生长性降低,与“sh”相比植物体的尺寸小,因而对制种量的降低有影响。“卷心菜ms-2”的制种量的相对
值极低,为19.3。对于“卷心菜ms-2”的cms株系而言,春化处理前的生长与来源于“紫罗兰油菜”、“nihao fung”的cms株系为相同程度,但春化处理后的生长暂时变得生长极其不良,认为其易于受到低温导致的阻碍。对于作为改良cms株系的“j1-3”和“j1-7”而言,在整个时期,植物体尺寸增大至与“sh”相比为同等以上,其结果是制种量的相对值分别为149.2、146.7,制种性高,确认到雌性育性没有问题。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1