核桃肽钙螯合物及其制备方法与流程
本发明涉及食品领域,具体涉及一种核桃肽钙螯合物及其制备方法。
背景技术:
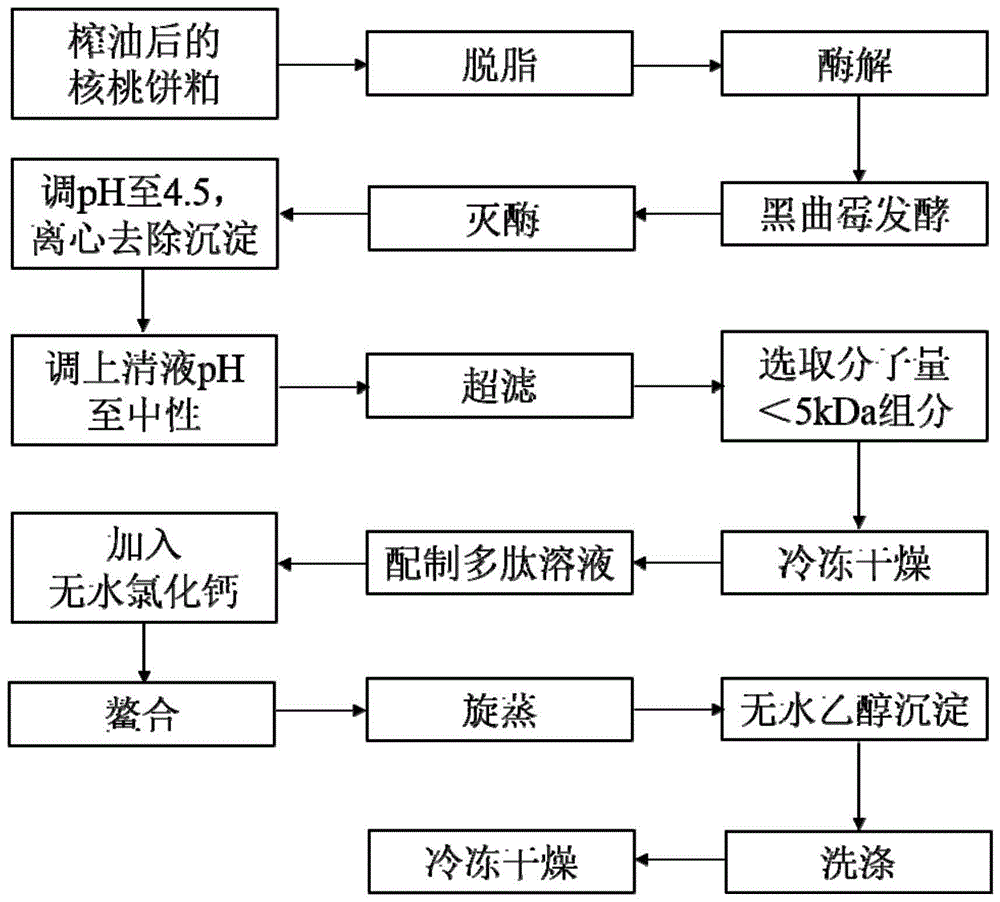
:蛋白资源中含有的丰富的多肽物质,对于人体起着重要的作用。在获取蛋白资源中的多肽物质时,有着不同的处理方式。采用酶解法从蛋白资源中获得多肽具有操作工艺简单、周期短、成本低等优点,但获得的多肽具有苦臭味。采用微生物对蛋白资源进行发酵,所产生的端肽酶可修饰肽链末端的苦味基团,从而可以去除苦味,获得口感风味较佳的多肽,但是操作工艺周期较长,获得的肽链片段较大,活性较低。骨骼中的钙摄入的唯一途径是饮食摄入,通过饮食摄入钙的最常见形式是离子钙、碳酸钙和葡萄糖酸钙。碳酸钙需要借助相关的维生素和酶才能被消化吸收,并且过量摄入碳酸钙可能会导致肠道副作用,如便秘、胀气等;离子钙容易与草酸、植酸等形成氢氧化钙沉淀,吸收利用率低;而以螯合形式存在的钙相较于离子钙具有生物利用率高以及低生物毒性等优点,可运用于功能性食品的开发,也可作为抑菌剂、抗氧化剂、钙补充剂等应用到工业化生产中。技术实现要素:本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的在于提出一种核桃肽钙螯合物及其制备方法。核桃仁经榨油后得到的核桃粕中蛋白质含量丰富,并且富含对人体具有重要功能的氨基酸,因此可以对核桃粕进行开发。通过对核桃粕进行处理,获取核桃仁中的活性多肽物质,然后所获取的核桃多肽与钙离子鳌合形成核桃肽钙螯合物作为钙补充剂,可以进一步提高人体对钙离子的吸收利用,对钙制剂的研发生产具有指导意义,且对核桃高附加值产品的开发也具有重要意义。发明人在研究过程中发现:在获取核桃多肽的过程中,可以通过对核桃粕进行酶解处理,然后结合发酵方法所获得的多肽具有酶解处理和发酵处理的双重优点,分子量小,口感风味俱佳,而且操作可控,工艺简单。例如,在对核桃粕酶解一段时间后,可直接对酶解体系不做任何处理,直接接种微生物进行发酵处理,获得酶解发酵产物。在此过程中不排除酶解和微生物发酵的同时进行,但是经由酶解和发酵,操作工艺简单,而且所获得的多肽口感风味俱佳,分子量小,活性高,提高了核桃粕的利用率。进一步地,经由与钙离子在合适的条件下螯合,可以提高钙离子在人体中的生物利用度。所获得的核桃肽钙螯合物螯合率高,能够作为一种高生物吸收率的钙补充剂和多肽营养剂。具体而言,本发明提供了如下技术方案:在本发明的第一方面,本发明提供了一种核桃肽钙螯合物的制备方法,包括:(1)将核桃粕经蛋白酶进行酶解反应,获得酶解产物;(2)将所述酶解产物进行发酵处理,以便获得发酵产物;(3)对所述发酵产物进行分离处理,以便获得分子量在5kda以下的核桃肽;(4)将所述核桃肽和钙离子进行螯合反应,以便制备得到所述核桃肽钙螯合物。核桃粕进行蛋白酶酶解结合发酵处理后,所获得的产物中分子量小的多肽含量高,而且产物中多肽的口感良好,风味佳。通过与钙离子进行螯合反应,螯合率高,获得的核桃肽钙螯合物可被人体高效的吸收利用,在补钙的同时还可发挥核桃多肽的生物活性功能,具有良好的应用前景。根据本发明的实施例,以上所述的核桃肽钙螯合物的制备方法可以进一步包括如下技术特征:在本发明的一些实施例中,步骤(1)中所述蛋白酶为碱性蛋白酶。碱性蛋白酶能够有效水解蛋白质中的肽键,由此可以快速获得分子量的多肽物质。在本发明的一些实施例中,碱性蛋白酶的质量占所述核桃粕质量的4%-6%,优选为5%。在利用碱性蛋白酶对核桃粕进行酶解的过程中,合适的碱性蛋白酶用量,可以快速将核桃粕酶解。在该含量条件下,可以实现核桃粕的快速酶解,而且不会导致酶解过度,产生不必要的对于人体无益的小分子肽。在本发明的一些实施例中,所述酶解反应的温度为50-60℃,优选为55℃,所述酶解反应的ph为8-9,优选8.7。由此可以实现核桃粕的快速酶解,获得目标多肽。在本发明的一些实施例中,所述酶解反应为在55摄氏度条件下恒温震荡处理3小时。由此可以实现核桃粕的快速酶解,获得目标多肽。在本发明的一些实施例中,步骤(2)中利用黑曲霉菌进行所述发酵处理。黑曲霉菌作为一种常用的微生物,其用作发酵处理,所产生的端肽酶可以修饰肽链末端的苦味基团,去除苦味,能够获得口感风味俱佳的多肽。在本发明的一些实施例中,所述黑曲霉菌以菌悬液的形式接种至所述酶解产物中,所述菌悬液的接种量占所述酶解产物的8~20%,优选为10%,所述发酵处理的温度为30~35摄氏度,优选为30摄氏度,ph为6.0~7.0。在该温度和该ph条件下,进行黑曲霉菌发酵,可以快速获得口感风味俱佳的多肽,且所获得的多肽大小合适。在本发明的一些实施例中,步骤(3)中利用分子量为5kda的超滤膜对所述发酵产物进行分离处理。利用超滤膜进行分离处理,条件温和,不会破坏核桃多肽。在本发明的一些实施例中,步骤(4)中所述钙离子来自于无水氯化钙。利用无水氯化钙作为钙源,提供钙离子,无水氯化钙易溶于水,所形成的核桃肽钙螯合物不易溶于有机溶剂,有利于鳌合反应的进行及所形成的核桃肽钙螯合物与游离态钙的分离。在本发明的一些实施例中,所述螯合反应包括:将所述核桃肽和所述无水氯化钙按照肽源与钙源的质量比(1:1)-(5:1),优选为3:1混合进行所述螯合反应。由此可以获得一种钙离子含量高的核桃肽钙螯合物。在本发明的一些实施例中,所述螯合反应的温度为40-50℃,优选为45℃,所述螯合反应的ph为7.0-9.0,优选8.0,所述螯合反应的时间为30-50分钟,优选40分钟。由此所制备的核桃肽钙螯合物的钙离子的螯合率高,且所制备获得的核桃肽钙螯合物具有显著提高的钙离子的生物利用率,无论是钙离子还是核桃多肽都可以被人体高效吸收。在本发明的一些实施例中,在步骤(1)之前,进一步包括:利用有机溶剂对所述核桃粕进行脱脂处理,所获得的脱脂核桃粕过筛,然后再进行所述酶解反应。经过脱脂处理,能够去除多余的油脂。然后进行过筛处理,例如可以经过60目筛处理,使得脱脂核桃粕均一化,增大后续进行酶解反应以及发酵反应的表面积,快速获得高活性的小分子肽。在本发明的一些实施例中,在步骤(3)之前,进一步包括:将所述酶解产物进行沸水浴处理,水浴处理时间为5-15分钟,优选为10分钟。在此条件下进行灭酶处理可以在灭活酶解以及发酵反应的同时保留最大的多肽活性,防止过度酶解,获得具有一定活性的核桃多肽。在本发明的一些实施例中,步骤(4)进一步包括:经所述螯合反应后的产物利用无水乙醇进行洗涤处理,离心获得沉淀,至上清液加入钙指示剂不变色终止,获得所述核桃肽钙螯合物。由此可以去除游离钙离子和杂质,获得纯度高的核桃肽钙螯合物。在本发明的第二方面,本发明提供了一种核桃肽钙螯合物的制备方法,包括:1)将核桃粕经脱脂处理,脱脂后的核桃粕经碱性蛋白酶进行酶解反应,以便获得酶解产物;2)利用黑曲霉菌所述酶解产物进行发酵处理,以便获得发酵产物;3)利用分子量为5kda的超滤膜对所述发酵产物进行超滤处理,以便获得核桃肽;4)将所述核桃肽和无水氯化钙按照质量比1:1-5:1,优选3:1混合,在温度为40-50℃,ph为7.0-9.0,优选温度为45℃,ph为8.0条件下进行螯合反应,以便制备得到所述核桃肽钙螯合物。在本发明的第三方面,本发明提供了一种核桃肽钙螯合物,所述核桃肽钙螯合物通过本发明第一方面任一实施例所述的制备方法或者本发明第二方面所述的制备方法制备而成。本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。附图说明本发明的上述和/或附加的方面和优点结合下面附图对实施例的描述中将变得明显和容易理解,其中:图1是根据本发明一个实施例提供的核桃肽钙螯合物制备工艺的流程示意图;图2是根据本发明一个实施例提供的肽钙比变化对核桃肽钙螯合物的钙离子鳌合率的影响;图3是根据本发明一个实施例提供的ph变化对核桃肽钙螯合物的钙离子鳌合率的影响;图4是根据本发明一个实施例提供的温度变化对核桃肽钙螯合物的钙离子鳌合率的影响;图5是根据本发明一个实施例提供的螯合反应时间变化对核桃肽钙螯合物的钙离子鳌合率的影响;图6是根据本发明一个实施例提供的各因素交互作用对核桃肽钙螯合物的钙离子鳌合率的响应面图;图7是根据本发明一个实施例提供的核桃肽及核桃肽钙螯合物的紫外光谱图;图8是根据本发明一个实施例提供的核桃肽及核桃肽钙螯合物的红外光谱图;图9是根据本发明一个实施例提供的核桃肽及核桃肽钙螯合物的原子力显微镜图;图10是根据本发明一个实施例提供的核桃肽钙螯合物与无机钙盐在不同ph条件下的溶解度对比。具体实施方式下面参考附图详细描述本发明的实施例,需要说明的是,所描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。本发明提供了一种核桃肽钙螯合物的制备方法,包括:(1)将核桃粕经蛋白酶进行酶解反应,以便获得酶解产物;(2)将所述酶解产物进行发酵处理,以便获得发酵产物;(3)对所述发酵产物进行分离处理,以便获得分子量在5kda以下的核桃肽;(4)将所述核桃肽和钙离子进行螯合反应,以便制备得到所述核桃肽钙螯合物。经由该制备方法在提高核桃粕利用率的同时还能生产出一种具有高生物吸收率的钙补充剂。需要说明的是,本发明所提供的核桃肽钙螯合物的制备方法,所用到的原料为核桃仁经榨油后的核桃粕。该核桃粕可以直接购买获得,也可以通过本领域常规的技术对核桃仁榨油后获得。虽然核桃的品种、品质以及榨油的条件,会对最终产品的品质及钙离子鳌合率产生一些影响,但通过本发明所提供的方法都能得到可与钙离子鳌合且生物利用度较高的肽钙螯合物。在本发明的至少一些实施方式中,为了降低核桃粕中油脂的影响,所用到的核桃粕可以经有机溶剂脱脂,经有机溶剂脱脂后的核桃粕中蛋白的含量约为60%~65%左右,例如蛋白含量约为63%。由此高蛋白含量的核桃粕可以经过酶解结合发酵,获得大量的目标核桃肽。在对核桃粕进行脱脂处理过程中,可以使用常用的一些有机溶剂进行脱脂处理,例如可以使用石油醚对核桃粕进行脱脂处理,除去核桃粕中剩余的油脂。实验或者生产过程中,可以采用榨油后得到的核桃粕或者脱脂后的核桃粕与水混合,得到核桃粕混合液,然后再利用蛋白酶进行酶解反应。当然,为了提高酶解反应和发酵反应的反应面积,可以将榨油后的核桃粕或者脱脂后的核桃粕进行过筛处理,例如可以过60目筛。在利用蛋白酶进行酶解反应时,可以选取酶解核桃蛋白效果较好且易于获得、价格低廉的碱性蛋白酶作为水解酶。酶解条件可以为酶解温度为50-60℃,优选55℃;碱性蛋白酶的加入量占核桃粕质量的4%-6%,优选为5%;酶解ph为8-9,优选ph8.7。在至少一些实施方式中,在利用碱性蛋白酶进行酶解反应时,核桃粕作为酶解底物,其浓度可以为40-60g/1000ml,优选为50g/1000ml,酶解时间为3小时左右。在酶解过程中,为了使得酶解条件均一可控,可以在酶解过程中进行恒温震荡处理并不断用1mol/l的naoh调节ph至8.7恒定。在本发明的至少一些实施方式中,可以选取黑曲霉用于发酵,利用黑曲霉发酵可脱除核桃肽的苦臭味。发酵条件可以为:发酵温度30℃,ph6.5,接种量10%,发酵时间60小时。在利用黑曲霉进行发酵时,可以直接在酶解后的体系中接种黑曲霉菌悬液,使核桃粕继续进行发酵,获得酶解发酵产物。待酶解发酵完成后采用沸水浴对酶解发酵体系进行灭酶处理,防止过度酶解,使体系中含有一定生物活性的核桃多肽。在至少一些实施方式中,沸水浴灭酶的条件为沸水浴5-10min,优选为10min。经沸水浴灭酶处理后,调节溶液的ph至4.5,于4000r/min离心15min后去除蛋白,取上清液获得多肽。然后用于后续的分离处理。调节上清液的ph至中性,温和的中性环境更有利于多肽发挥活性。将中性的上清液通过5kda超滤膜进行超滤,获得分子量小于5kda的核桃肽液。所制备的核桃肽液可以直接用于后续的螯合反应。也可以将核桃肽液进行冷冻干燥,得到核桃肽粉,通过这种方式可以稳定储藏核桃肽粉,核桃肽粉不易分解。在进行后续的螯合反应时,可以将所制得的核桃肽粉加水配制成一定浓度的核桃肽溶液,然后和钙离子进行螯合反应。在本发明的至少一些实施方式中,在进行螯合反应时,核桃肽的浓度可以配制为1%,然后核桃肽与钙源的质量比按照1:1-5:1混合进行螯合反应。鳌合反应结束后,用旋转蒸发仪去除一定体积的水分;将剩余的混合液加入一定体积的有机溶剂静置一定时间,离心后收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色;将所收集的沉淀进行冷冻干燥,获得核桃肽钙螯合物。在本发明的至少一些实施方式中,可以利用旋转蒸发仪去除鳌合体系三分之二的水分,可减少在分离游离态钙和肽钙螯合物时所使用的有机溶剂的量。在本发明的又一些实施方式中,在去除水分后的鳌合体系中加入鳌合体系体积的5-15倍的无水乙醇,优选10倍,静置2-4小时,优选3小时。通过该处理可经济高效地分离游离态钙与肽钙螯合物。静置后的鳌合体系于8000r/min条件下离心15min,收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色;冷冻干燥后可获得高钙螯合率的核桃肽钙螯合物。经测定经由本发明所提供的方法制得的核桃肽钙螯合物钙离子鳌合率达到60%以上,且其生物利用度远高于无机钙盐,可用作钙补充剂。所制备获得的核桃肽钙螯合物可以直接进行包装,作为即食食品,也可以和其他可食用物质混合或者加工,用作食品。在本发明的至少一些实施方式中,本发明提供了一种核桃肽钙螯合物的制备方法,该方法包括:1)利用石油醚浸泡经液压榨油后的核桃粕,去除油脂;2)将脱脂核桃粕过60目筛,获得核桃脱脂粉;3)将核桃脱脂粉配制成溶液,加入碱性蛋白酶,进行恒温震荡酶解,然后接种黑曲霉菌悬液,获得酶解发酵产物;4)利用沸水浴进行灭酶处理,调整溶液ph至4.5,离心后去除沉淀,收集上清液调整ph至中性;5)将上清液通过分子量为5kda的超滤膜进行超滤,获得分子量小于5kda的核桃肽液,6)将核桃肽液和无水氯化钙混合,在水浴中恒温震荡进行螯合反应;7)利用旋转蒸发仪去除鳌合体系三分之二的水分后,加入无水乙醇静置,离心后收集沉淀,利用无水乙醇洗涤至上清液加入钙指示剂不变色,冷冻干燥后获得核桃肽钙螯合物。下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。所用到的碱性蛋白酶购自于北京索莱宝科技有限公司,货号为b8360,所用到的黑曲霉通过商购获得。实施例中所用到的仪器及其厂家如下:ph计,梅特勒-托利多仪器有限公司,dk-98-ii电热恒温水浴锅,天津市泰斯特仪器有限公司,sha-ba水浴恒温振荡器,金坛市荣华仪器制造有限公司,hc-2518r高速冷冻离心机,安徽中科中佳科学仪器有限公司,sartoriusvivaflow切向流膜包,德国赛多利斯集团,scientz-12n冷冻干燥机,宁波新芝生物科技股份有限公司,r-210旋转蒸发仪,瑞士步琦有限公司。实施例1参照图1所示,实施例1提供了一种制备核桃肽钙螯合物的方法,包括如下步骤:(1)选用榨油后的核桃粕为原料,加入5倍体积的石油醚脱脂,挥干后过60目筛,获得核桃脱脂粉。(2)取1000ml蒸馏水于2000ml烧杯中,加入50g核桃脱脂粉,配制成质量浓度为5%的核桃脱脂粉溶液,调整溶液的ph为8.7,利用恒温水浴加热至60℃,加入碱性蛋白酶2.5g(碱性蛋白酶的加入量占核桃脱脂粉的质量的5%)于水浴恒温振荡器中进行酶解反应,期间用1mol/l的naoh不断调节ph值维持8.7恒定,记录所消耗naoh的体积,酶解3小时。(3)酶解完成后向酶解反应体系中接入体积10%的黑曲霉菌种悬液,调整体系ph至6.5,水浴温度至30℃,发酵60小时。(4)酶解发酵完成后利用沸水浴灭酶10分钟,然后1mol/l的hcl调节ph至4.5,离心后去除沉淀,收集上清液调整ph至中性。(5)将上清液通过分子量为5kda的超滤膜进行超滤,获得分子量小于5kda的核桃多肽液后进行冷冻干燥得到核桃肽粉。(6)称取10g核桃肽粉,加入1000ml去离子水,配制成质量浓度为1%的核桃肽溶液,用1mol/l的naoh溶液调节ph至8.0,并至于45摄氏度的水浴中放置一段时间使其达到反应温度,称取3.33g无水氯化钙加入到核桃肽溶液中,迅速搅拌使其溶解,用保鲜膜封口后置于45℃水浴振荡器中反应40分钟。(7)反应结束后利用旋转蒸发仪去除鳌合体系中三分之二的水分,在去除水分后的鳌合体系中加入10倍体积的无水乙醇,静置3小时。(8)将静置后的鳌合体系进行离心,收集沉淀,用无水乙醇洗涤至上清液加入钙指示剂不变色,冷冻干燥后即可获得核桃肽钙螯合物。实施例2实施例2对核桃肽和无水氯化钙进行螯合反应时的反应条件进行了摸索,考察各因素对核桃多肽与钙离子螯合能力的影响。包括如下过程:称取0.3g核桃肽粉,加入30ml去离子水,配制成质量浓度为1%的核桃肽溶液,用1mol/l的naoh溶液调节ph(调节ph值分别为4、6、8、10、12),水浴加热一定时间使其达到反应温度(使得反应温度分别为30℃、40℃、50℃、60℃、70℃),将一定质量的无水氯化钙加入到核桃肽溶液中,配成含有核桃肽和无水氯化钙(其中核桃肽和无水氯化钙的质量比分别为1:2、1:1、2:1、5:1、10:1)的肽钙溶液,迅速搅拌至溶解,用保鲜膜封口,进行水浴反应(反应时间分别为20、30、40、50、60、70分钟)。螯合反应结束后,用旋转蒸发仪去除鳌合体系三分之二的水分,在去除水分后的鳌合体系中加入10倍体积的乙醇沉淀3小时后,收集沉淀,用无水乙醇洗涤至上清液中加入钙指示剂不变色,8000r/min离心15分钟,将下层沉淀冷冻干燥,得到核桃肽钙螯合物。测定所制备得到的核桃肽钙螯合物中钙离子的含量,其中钙离子含量的测定参照国标gb/t5009.92-2016中“食品中钙的测定”中的“edta滴定法”进行测定。edta浓度标定:量取50ml蒸馏水于锥形瓶中,加入5ml钙标准溶液,摇匀。随后加入三乙醇胺溶液3ml,koh溶液1ml,适量钙指示剂。立即用稀释10倍的edta溶液滴定,指示剂从紫红色变为纯蓝色即为终点。记录消耗的edta体积。其中:t:edta的滴定度,即每毫升edta相当于ca的毫克数;v:消耗的edta的体积。钙离子含量计算:量取50ml蒸馏水于锥形瓶中,加入2ml核桃肽钙螯合肽溶液,摇匀。随后加入3ml三乙醇胺溶液,1mlkoh溶液,适量钙指示剂。立即用edta溶液滴定,指示剂从紫红色变为纯蓝色即为终点。记录消耗的edta的体积,钙离子含量计算公式如下:其中,x:试样中的钙含量,mg/100g。t:edta的滴定度,mg/ml。v1:测定试样时所用edta的体积,ml。v0:测定空白时所用edta的体积,ml。v2:试样消化液的定容体积,ml。1000:换算系数。m:试样质量,g。v3:滴定用试样待测液的体积,ml。然后通过利用所消耗的edta的体积计算核桃肽钙螯合物中的钙含量占总钙含量的百分比,从而计算得到螯合率。总钙含量测定:吸取0.2ml的反应液至锥形瓶中,加入蒸馏水50ml,依次加入三乙醇胺3ml,koh1ml,适量钙指示剂,轻轻摇匀,立即用edta滴定,滴定终点为溶液从紫红色变为纯蓝色,记录消耗的edta的体积,总钙含量计算方法如下:核桃肽钙螯合物中钙含量的测定:取2ml反应液,加入10倍体积的乙醇,静置1h后在4000r/min的条件下离心10min,去除上清液。向沉淀中加入20ml蒸馏水,用涡旋振荡器摇匀。吸取2ml液体至锥形瓶中,加入50ml蒸馏水,依次加入三乙醇胺3ml,koh1ml,适量钙指示剂,轻轻摇匀,立即用edta滴定,滴定终点为溶液从紫红色变为纯蓝色,记录消耗的edta的体积,螯合钙含量计算方法如下:钙离子的鳌合率的计算如下:其中,m1:肽螯合钙中的钙含量,g。m0:反应液中的总钙含量,g。实验结果如下:1、以核桃肽溶液的ph调节为8,螯合反应温度为40摄氏度,反应时间为40分钟时为例,计算核桃肽和无水氯化钙的质量比(肽钙比)分别为1:2、1:1、2:1、5:1、10:1条件下所制备的核桃肽钙螯合物中钙离子的螯合率,探究肽钙比对核桃肽钙螯合物中的钙离子螯合率的影响,实验结果如图2所示。其中,图2中横坐标代表核桃肽与无水氯化钙的质量比(肽钙比),纵坐标代表核桃肽钙螯合物中钙离子的螯合率。由图2可以看出,随着肽钙比的增加,钙离子的螯合率迅速增加。当肽钙比为1:2时,螯合率为13.64%,当肽钙比增加至10:1时,螯合率增至91.53%。当肽钙比较低时,即钙离子含量高于多肽,此时钙离子过剩,螯合率很低。当肽钙比增大至10:1时,多肽含量远高于钙离子,此时钙离子被充分结合,螯合率增大。对不同肽钙比条件下制备的核桃肽钙螯合物的钙离子含量进行计算,在肽钙比为1:2时,钙离子含量最高,含量为765.9375mg/l。在此时螯合率较低,且所需氯化钙质量较大。在肽钙比为10:1时钙离子含量为274.125mg/l,此时螯合率较高,但螯合所需的多肽量极大,且所需钙离子较少。所以综合考虑,为了获得钙离子含量高的核桃肽钙螯合物,采用肽钙比为1:1、2:1、3:1进行后续响应面实验。2、以核桃肽溶液的ph分别调节为4、6、8、10、12,然后水浴加热到40摄氏度,将无水氯化钙加入到核桃肽溶液中,配成含有核桃肽和无水氯化钙的质量比为1:1的肽钙溶液,进行螯合反应。研究不同核桃肽溶液ph变化对于核桃肽钙螯合物中的钙离子螯合率的影响,实验结果如图3所示。其中图3中横坐标代表核桃肽溶液的ph值,纵坐标代表核桃肽钙螯合物的钙离子螯合率。由图3可知,当ph在4-6时,螯合率处于较低水平,约为40%。这是因为溶液中h+过多,抑制羧基上h+的电离,且h+会与氨基结合,阻碍氨基和ca2+的配位。当ph为8时,螯合率最高,达到58.29%。不受理论限制,出现以上结果的原因可能是溶液处于一个弱碱性的环境,使得竞争处于一个相对平衡的状态,此时ca2+与供电基团发生反应,羧基与氨基的配位能力处于较强状态。当ph继续增大至10-12时,螯合率降低,并且在反应时瓶内出现白色沉淀,这是由于ph过高,oh-过多,与ca2+形成氢氧化钙沉淀,使得可与多肽进行螯合的ca2+减少,不利于螯合反应的进行。根据结果选取ph为7.0、8.0、9.0进行后续的响应面实验。3、以核桃肽溶液的ph调节为8,核桃肽与无水氯化钙按照质量比为1:1为例,分别在30℃、40℃、50℃、60℃、70℃进行螯合反应,反应时间为40分钟,研究螯合反应温度变化对核桃肽钙螯合物中的钙离子螯合率的影响,实验结果如图4所示。其中图4中横坐标代表螯合反应的温度,纵坐标代表核桃肽钙螯合物的钙离子螯合率。由图4可以看出在温度30-60℃时,钙离子的螯合率先略微上升后逐渐下降,在40℃时螯合率达到最大,为51.54%。当温度继续上升至70℃时,螯合率下降至45.65%。当温度增大时,分子之间的运动剧烈,发生碰撞,ca2+与氨基酸残基结合几率增大,螯合率略微上升。当温度过高时,多肽可能发生降解,结构改变,或分子内部之间发生团聚,可参与螯合反应的基团减少。根据结果,选取螯合温度为30℃、40℃、50℃进行后续的响应面实验。4、以核桃肽溶液的ph调节为8,核桃肽与无水氯化钙按照质量比为1:1为例,在40摄氏度条件下进行螯合反应,反应时间分别为20、30、40、50、60、70分钟,研究螯合反应的反应时间对于核桃肽钙螯合物中的钙离子螯合率的影响,实验结果如图5所示。其中图5中横坐标代表螯合反应的反应时间,纵坐标代表核桃肽钙螯合物中的钙离子螯合率的影响。由图5可知,在所选的时间范围内,螯合率首先逐渐增大,在第30分钟时达到51.75%。当螯合时间为40分钟时,螯合率小幅度下降。不受理论限制,这可能是因为在螯合反应中时间过长,已形成的螯合物不稳定发生分解。当螯合时间继续增大时,螯合率也随之增加,在第60分钟时达到54.4%。随着螯合时间的继续增加,新形成的螯合物的速率大于已形成的螯合物分解的速率,呈现出了螯合率缓慢增大的结果。根据结果,选取螯合时间为40分钟、50分钟、60分钟进行后续的响应面实验。在单因素实验的基础上,选取螯合肽钙比、螯合ph、螯合温度及螯合时间四个因素,以钙离子螯合率为指标,进行四因素三水平的响应面实验。水平编码见表1,分析结果见表2和表3。表1核桃肽螯合钙离子的响应面实验因素水平表表2核桃多肽与钙离子螯合四因素三水平响应面分析实验结果表3回归模型系数及显著性检验结果方差来源平方和自由度均方f值p值显著性模型5189.8614370.7046.46<0.0001**a3271.9513271.95410.09<0.0001**b50.43150.436.320.0248*c6.3816.380.800.3863d5.5515.550.700.4183ab8.4718.471.060.3204ac16.40116.402.060.1736ad13.21113.211.660.2190bc1.3311.330.170.6888bd0.4810.480.060.8092cd0.2210.220.030.8702a2809.311809.31101.43<0.0001**b21176.2611176.26147.42<0.0001**c280.14180.1410.040.0068**d22.0612.060.260.6192残差111.70147.98失拟项91.20109.121.780.3042notsignificant纯误差20.5045.12总和5301.5628注:*代表p<0.05显著水平,**代表p<0.01极显著水平。得到肽钙比(a)、螯合ph(b)、螯合温度(c)、螯合时间(d)的二元多项回归模型:y=60.92+16.51a+2.05b+0.73c+0.68d-1.46ab+2.03ac-1.82ad+0.58bc-0.35bd-0.24cd-11.17a2-13.47b2-3.51c2+0.56d2由表3可知,回归方程显著性检验f值为46.46(p<0.0001),回归方程在试验点上的拟合度达到极显著水平;失拟项的检验f值为1.78(p=0.3042>0.05),差异不显著,拟合的模型方程效果较好;回归模型相关系数r2=0.9789,表明模型成立有效,可使用此模型来分析和预测多肽螯合钙的制备工艺结果。由表3可知,模型的一次项b影响显著,一次项a及二次项a2、b2、c2影响达到极显著水平。各因素对核桃多肽螯合钙离子的螯合率影响程度由大到小为:肽钙比(a)>螯合ph(b)>螯合温度(c)>螯合时间(d)。响应面3d交互图显示了双因素之间的交互作用,如图6所示。模型显示交互作用不显著,因素对响应值未起到二次影响作用。在试验点附近处,温度以及时间对螯合作用不明显,交互作用不显著。通过对回归方程的分析,可得氯化钙与核桃肽螯合的最佳理论工艺参数为肽钙比3:1,ph8.04,温度44.28℃,时间40分钟。在此条件下核桃肽与钙离子螯合的螯合率预测值为68.63%。为检验响应面优化结果的可靠性,在上述条件下进行重复验证实验,得到螯合率为67.21%,与理论预测值的相对误差为1.42%,说明模型优化所得参数有效,适用与螯合反应。实施例3参照实施例2所摸索的条件,即配制核桃肽溶液的ph为8,将核桃肽和无水氯化钙按照质量比为3:1混合,在44摄氏度条件下反应40分钟,制备核桃肽钙螯合物。对所制备获得的核桃肽钙螯合物进行如下结构表征:1、核桃肽钙螯合物鳌合前后紫外光谱分析将核桃肽以及核桃肽钙螯合物分别溶于去离子水中,配制成2mg/ml的溶液,用紫外-可见分光光度计在波长为190-400nm范围内进行紫外吸收光谱扫描,其结果如图7所示。由图7可知在鳌合前后最大吸收波长的位置以及吸收强度均有所改变。核桃肽经过鳌合后在228nm处的吸收峰蓝移至221nm处,这可能是ca2+与肽键上的羰基发生了络合作用,影响了羰基的电子跃迁,吸收谱带发生蓝移;在276nm处的吸收峰红移至283nm处,且吸收强度显著下降。这是由于配体(n-c-o)中的π→π*电子跃迁所导致的。由紫外扫描光谱可知,ca2+与多肽作用后形成了一种不同于多肽的新的化合物生成。2、核桃肽钙螯合物鳌合前后红外光谱分析取少量核桃肽及核桃肽钙螯合物干燥粉末与干燥kbr在玛瑙研钵中进行研磨混合。放入红外光谱仪中测定。扫描范围为4000-400nm-1,分辨率为0.1cm-1。其结果如图8所示。由图8可知核桃肽中的-nh2与钙离子鳌合后伸缩振动,形成铵盐,取代-nh2,3406.11cm-1吸收峰红移至3416.88cm-1,谱带变宽。c=o吸收波长由1657.05cm-1蓝移至1654.01cm-1,核桃肽在1544.85cm-1处的吸收峰也由c=o伸缩振动引起,与钙离子鳌合后红移至1559.82cm-1。核桃肽的coo-的吸收峰在1450.19cm-1至1249.60cm-1处,与钙离子鳌合后发生对称振动,1450.19cm-1吸收峰消失,1398.12、1316.28、1249.60cm-1处的振动引起的吸收峰分别红移至1414.14、1318.80、1253.45cm-1处,coo-参与螯合形成羧酸盐-coo-ca。在指纹区除有单键的伸缩振动外,还有因变形振动产生的复杂的光谱。分子结构略微不同即会引起振动峰的变化。核桃肽的c-o的吸收峰在1109.92和1081.80cm-1处,与钙离子鳌合形成钙鳌合肽后吸收峰移动至1124.45与996.92cm-1处,c-o发生伸缩振动。鳌合后n-h伸缩振动,吸收峰由597.60cm-1蓝移至570.46cm-1。3、核桃肽钙螯合物鳌合前后原子力显微镜分析将核桃肽及核桃肽钙螯合物稀释后滴在云母片上,干燥后即可用原子力显微镜扫描。其结果如图9所示。其中图9中左列两张图代表核桃肽的原子力显微扫描结果,右列两张图代表核桃肽钙螯合物的原子力显微扫描结果。由图9可以看出核桃肽的表面较光滑,表面呈膜状,高度(heightsensor)约为20nm。而核桃肽钙螯合物表面不光滑,有明显颗粒,颗粒高度约为120nm。且核桃肽的粗糙度为0.419nm,核桃肽钙螯合物的粗糙度为17.8nm。这是由于核桃肽间电荷斥力作用较大,多肽间的相互作用减少,由于排斥力减少了聚集体的形成。而核桃肽钙螯合物的氨基和羧基与水溶液中的分子间氢键产生聚集,形成了颗粒或者聚集体,首先转变为颗粒,然后聚集成更大的簇,最终形成了团聚体。4、核桃肽钙螯合物与无极钙盐在不同ph条件下的溶解度对比在室温条件下,调整蒸馏水ph至2.0、3.0、4.0、5.0、6.0、7.0、8.0。将核桃肽钙螯合溶解在水中至饱和,用移液枪移取定量体积溶液至离心管内,8000r/min离心5min后取上清液至称量瓶中。在105℃条件下烘至恒重。溶解度用下列公式进行计算。其中,s:溶解度,g/100g。w1:烘干至恒重的肽钙螯合物的质量,g。w2:上清液的质量,gw:称量瓶的质量,g。由图10可以看出钙的溶解度受到ph变化的负面影响。核桃肽钙螯合物在ph2-6时表现出良好的溶解能力,当ph继续升高时,溶解度轻微下降。碳酸钙随着ph的升高,溶解度显著下降。在酸性条件下,钙离子的溶解度较高,可以提高其在十二指肠中的吸收。当ph升高达到微碱性条件,钙离子与oh-结合形成沉淀,钙离子含量下降,吸收量下降。肽钙螯合物在微碱性条件下的溶解度仍然保持在一个较高的水平,表明钙离子的生物利用度较螯合之前有了大幅的提高。由此通过上述实验不难看出,本发明通过对螯合工艺进行摸索,提高了螯合率,而且经过螯合后,提高了钙离子的生物利用率。所制备的核桃肽钙螯合物可以包装作为即食食品,也可以和其他可食用物质复配或者加工,制备成可食用食品,风味独特,可以用于补充钙离子和多肽物质。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1