一种具有协同抑制胰脂肪酶活性的组合物及其制备方法和应用
1.本发明涉及功能性食品技术领域,更具体的是,本发明涉及一种具有协同抑制胰脂肪酶活性的组合物及其制备方法和应用。
背景技术:
2.近年来,居民膳食结构随着生活水平的提高而发生变迁,由于居民膳食脂肪供能比持续上升,由此引发的超重肥胖问题不断凸显。超重和肥胖是心血管疾病、高血压、糖尿病、癌症等重要的危险因素,与长期膳食结构不平衡和油脂摄入过多密切相关。
3.在膳食脂肪消化吸收过程中,胰脂肪酶是水解脂肪最重要的酶,能够将人体摄入的脂肪逐步水解转化为甘油和游离脂肪酸以便吸收利用,对人体脂肪累积、肥胖形成具有重要意义。奥利司他是一种广泛应用的治疗肥胖的药物,其作用机理即抑制胰脂肪酶活性减少脂质吸收,但奥利司他对胃肠道功能产生不良影响,如胀气、腹泻和油性粪便,因此,寻找天然有效的胰脂肪酶抑制剂引起人们的广泛关注。
4.谷物除了提供碳水化合物等营养成分外,还包含不可忽视的活性物质,如多酚类,酚类物质抑制胰脂肪酶效果及降血脂作用已有文献报道,如黑米花色苷和红豆多酚等,且其中含有的矢车菊素3-o葡萄糖苷和儿茶素等单体抑制胰脂肪酶效果均有报道,因此,基于谷物功能因子协同抑制胰脂肪酶组合物开发,对多谷物协同增效调节高脂饮食诱导的机体脂代谢异常具有重要意义。
5.但针对黑米与红豆多酚提取物协同、矢车菊素3-o葡萄糖苷单体与其他成分协同、以及矢车菊素3-o葡萄糖苷和儿茶素二者协同抑制胰脂肪酶活性的组合物未见报道。
技术实现要素:
6.本发明的目的是设计开发了一种具有协同抑制胰脂肪酶活性的组合物,通过矢车菊素-3-o-葡萄糖苷和儿茶素形成的组合物,以及组合物的数值范围的优化,提高对胰脂肪酶活性的抑制,发挥协同降脂的目的。
7.本发明还设计开发了一种具有协同抑制胰脂肪酶活性的组合物制备方法,提取矢车菊素-3-o-葡萄糖苷和儿茶素形成组合物,实现组合物的数值优化,在协同增效的基础上对胰脂肪酶进行抑制。
8.本发明还设计开发了一种具有协同抑制胰脂肪酶活性的组合物的应用,能够协同抑制肠道胆固醇吸收。
9.本发明提供的技术方案为:
10.一种具有协同抑制胰脂肪酶活性的组合物,所述组合物的组分为:
11.矢车菊素-3-o-葡萄糖苷和儿茶素;
12.其中,所述矢车菊素-3-o-葡萄糖苷与儿茶素的物质的量比为:0.67~1。
13.优选的是,所述矢车菊素-3-o-葡萄糖苷与儿茶素的物质的量比为0.67。
14.一种具有协同抑制胰脂肪酶活性的组合物制备方法,包括如下步骤:
15.步骤一、从黑米粉和红豆皮粉中分别获取黑米花色苷提取物和红豆皮多酚提取物;
16.步骤二、在所述黑米花色苷提取物和红豆皮多酚提取物中分别获取矢车菊素-3-o-葡萄糖苷和儿茶素;
17.步骤三、将所述矢车菊素-3-o-葡萄糖苷和儿茶素按物质的量比为0.67~1进行组合获得协同抑制胰脂肪酶活性的组合物。
18.优选的是,所述步骤一具体包括如下步骤:
19.步骤1、分别称取5g黑米粉和5g红豆皮粉,
20.步骤2、将所述黑米粉依次通过石油醚和乙酸乙酯超声去脂15min,风干后以固液比1:10加入ph为2.0的70%乙醇,70℃水浴回流90min,提取2次后合并提取液获得黑米花色苷提取液,同时将所述红豆皮粉做相同处理获得红豆皮多酚提取液;
21.步骤3、将所述黑米花色苷提取液和红豆皮多酚提取液分别旋转蒸发浓缩至干获得黑米花色苷提取物和红豆皮多酚提取物,冷冻干燥后存储在4℃环境中。
22.优选的是,所述步骤1还包括:
23.将成熟的黑米和红豆皮烘干后,粉碎过筛,获得黑米粉和红豆皮粉。
24.优选的是,所述黑米粉和红豆皮粉与石油醚和乙酸乙酯的固液比为1:10。
25.优选的是,所述步骤二具体包括如下步骤:
26.步骤1、将20μl黑米花色苷提取物与20μl胰脂肪酶和160μl 0.05m pbs缓冲液混合,在37℃孵育30min,同时将20μl红豆皮多酚提取物做相同处理;
27.步骤2、将两种混合液分别转入超滤离心管过滤后,12000g离心20min,用100μl缓冲液冲洗胰脂肪酶配体5次,使用100μl甲醇水溶液变性处理,12000g离心20min获得矢车菊素-3-o-葡萄糖苷和儿茶素。
28.优选的是,所述黑米花色苷提取物的浓度为10mg/ml,所述红豆皮多酚提取物的浓度为10mg/ml,所述胰脂肪酶的浓度为10mg/ml。
29.优选的是,所述超滤离心管的分子量截留值为10kda。
30.一种具有协同抑制胰脂肪酶活性的组合物的应用,使用所述的具有协同抑制胰脂肪酶活性的组合物的制备方法制备的组合物,所述协同抑制胰脂肪酶活性的组合物在协同抑制胆固醇吸收的应用。
31.本发明所述的有益效果:
32.(1)、本发明设计开发的一种具有协同抑制胰脂肪酶活性的组合物,利用黑米和红豆皮中的两种有效抑制胰脂肪酶的单体成分组合,实现在特定的摩尔比范围内,使组合物抑制胆固醇吸收的能力高于二者单独使用,发挥协同降脂的目的,同时减少了单组分使用时的用量,可用于抑制脂质吸收、调节肥胖机体脂代谢。
33.(2)、本发明设计开发的一种具有协同抑制胰脂肪酶活性的组合物,为筛选具胰脂肪酶活性抑制功能的天然活性组合物开辟新途径。
34.(3)、本发明设计开发的一种具有协同抑制胰脂肪酶活性的组合物的制备方法,提取矢车菊素-3-o-葡萄糖苷和儿茶素形成组合物,实现组合物的数值优化,在协同增效的基础上对胰脂肪酶进行抑制。
35.(4)、本发明设计开发的一种具有协同抑制胰脂肪酶活性的组合物的应用,能够抑制肠道胆固醇吸收。
附图说明
36.图1为本发明所述黑米花色苷提取物中胰脂肪酶配体的色谱图。
37.图2为本发明所述黑米花色苷提取物中无胰脂肪酶空白对照组色谱图。
38.图3为本发明所述黑米花色苷提取物中胰脂肪酶失活对照组的色谱图。
39.图4为本发明所述红豆皮多酚提取物中胰脂肪酶配体的色谱图。
40.图5为本发明所述红豆皮多酚提取物中无胰脂肪酶空白对照组色谱图。
41.图6为本发明所述红豆皮多酚提取物中胰脂肪酶失活对照组的色谱图。
42.图7为本发明所述p3g与胰脂肪酶相互作用的色谱图。
43.图8为本发明所述c3g、catechin和orlistat对胰脂肪酶活性的抑制效果图。
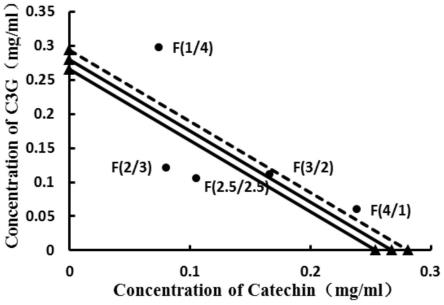
44.图9为本发明所述等辐射分析法评价不同比例c3g与catechin复配抑制胰脂肪酶活性的相互作用关系图。
45.图10为本发明所述胰脂肪酶的可逆性抑制lineweaver-burk曲线图。
46.图11为本发明所述c3g、catechin、orlistat、c3g-catechin对胰脂肪酶的抑制类型图。
47.图12为本发明所述不同浓度的c3g对胰脂肪酶二级结构影响的圆二色谱图。
48.图13为本发明所述不同浓度的catethin对胰脂肪酶二级结构影响的圆二色谱图。
49.图14为本发明所述不同浓度的c3g-catechin对胰脂肪酶二级结构影响的圆二色谱图。
50.图15为本发明所述c3g、catethin、摩尔质量比为0.67的c3g-catechin与fenofibrate对胆固醇溶解度的影响示意图。
51.图16为本发明所述c3g、catethin、摩尔质量比为0.67的c3g-catechin与fenofibrate和胆酸盐结合试验的示意图。
具体实施方式
52.下面结合对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
53.本发明提供的一种具有协同抑制胰脂肪酶活性的组合物,组合物的组分为:
54.矢车菊素-3-o-葡萄糖苷和儿茶素;
55.其中,所述矢车菊素-3-o-葡萄糖苷与儿茶素的物质的量比为:0.67~1。
56.作为优选的是,矢车菊素-3-o-葡萄糖苷和儿茶素的物质的量比为0.67。
57.本发明还提供一种具有协同抑制胰脂肪酶活性的组合物的制备方法,包括如下步骤:
58.步骤一、原料的制备:
59.以成熟的黑米和红豆皮为原料,烘干粉碎过筛,获得实验用黑米粉和红豆皮粉,分别称取5g黑米粉和5g红豆皮粉,将所述黑米粉和红豆皮粉分别先后用石油醚和乙酸乙酯(固液比1:10)超声去脂15min,风干,加入ph为2.0的70%乙醇(固液比1∶10),70℃水浴回流
90min,提取2次后合并提取液,旋转蒸发浓缩至干,然后冷冻干燥获得黑米花色苷提取液和红豆皮多酚提取液,使用前将提取液置于4℃保存进行进一步分析。
60.步骤二、亲和超滤筛选:
61.将20μl黑米花色苷提取物(10mg/ml)、20μl红豆皮多酚提取物(10mg/ml)分别与20μl胰脂肪酶(10mg/ml)和160μl 0.05m pbs缓冲液(ph 7.0)混合,然后在37℃孵育30min,随后转入10kda分子量截留值的超滤离心管过滤(amicon ultra-0.5μm膜),12000g离心20min以截留粗提物中的胰脂肪酶配体,用100μl缓冲液胰脂肪酶配体5次以除去未结合的组分,随后,使用100μl甲醇水溶液(50%,v/v)变性处理,12000g离心20分钟获得与胰脂肪酶结合的配体成分,用于高效液相色谱分析。
62.步骤三、等辐射分析法评价c3g-catechin之间的协同作用:
63.将鉴定后的矢车菊素-3-o-葡萄糖苷(cyanidin-3-o-glucoside,c3g)和儿茶素(catechin)按物质的量比为0.67~1(2:3~2.5:2.5)比例进行组合即为具有协同抑制胰脂肪酶活性的组合物。
64.所述步骤二中的超滤实验包括三个主要步骤:样品与酶结合、洗涤非特异性结合化学物和检测特异性结合化学物。
65.如图1所示,与黑米花色苷提取物的色谱图相比发现,在超滤筛选实验条件下,黑米花色苷提取物中部分化合物能够与胰脂肪酶特异性结合,表明这些化合物可能是潜在的胰腺脂肪酶抑制剂。
66.如图4所示,同样在红豆皮多酚提取物的色谱图中发现,红豆皮多酚提取物中部分化合物能够与胰脂肪酶特异性结合。
67.如图2、图5所示,从空白对照的色谱图来看,可有效避免小分子化合物吸附到超滤膜而造成的假阳性结果。
68.如图3、图6所示,由于灭活的酶与化合物结合能力弱,因此天然构象的酶捕获的配体所对应的峰面积大于其灭活的酶对应的峰面积,峰面积的变化情况可反映化合物与胰脂肪酶的结合率,通过对比结合率,筛选出图1中峰2所对应的结合峰和图4中峰5所对应的结合峰,这两个小分子化合物与胰脂肪酶的结合率分别为25.2%、29.5%,表明黑米花色苷提取物和红豆皮多酚提取物中的活性成分能够与胰脂肪酶酶特异性结合。
69.如图7所示,以阳性对照氯化葡萄糖苷芍药素进行超滤实验,发现其能够与胰脂肪酶特异性结合表明本方法准确性较好。
70.分别鉴定两种化合物的种类为c3g和catechin,并与化学标准品在hplc中的保留时间进行比较,进一步验证这两种化合物为c3g和catechin,采用高效液相色谱法测定了黑米花色苷提取物和红豆皮多酚中c3g和catechin的含量分别为27.6mg/g、247mg/g,因此,通过超滤的方法发现了c3g和catechin可作为胰脂肪酶抑制剂,表明了c3g和catechin显著的降糖和降血脂作用可能与抑制胰脂肪酶这种关键消化酶密切相关。
71.如图8所示,为c3g、catechin和奥利司他(orlistat,胰脂肪酶特异性抑制剂)对胰脂肪酶活性的抑制效果图,图中数值表示为均值
±
标准差(n=3);上标小写字母(a-c)表示在同种胰脂肪酶抑制剂中,不同浓度下存在显著差异,大写字母(a-c)表示在相同浓度下,不同的胰脂肪酶抑制剂存在显著差异(p《0.05)。随着c3g、catechin、orlistat质量浓度增大,其对胰脂肪酶活性抑制率增大;在样品添加量小于2mg/ml时catethin的抑制效果高于
c3g和orlistat,而浓度大于2mg/ml时随着添加物质量浓度的升高三者抑制率为orlistat》c3g》catechin。用spss软件进行多元非线性拟合,利用回归方程分别求出c3g、catechin、orlistat的ic50为(0.268
±
0.043)、(0.28
±
0.045)、(0.25
±
0.04)mg/ml。
72.对本发明的组合物进行试验:
73.表1c3g、catechin单体和不同比例下的c3g-catechin组合剂对胰脂肪酶活性的抑制效果
[0074][0075]
由表1和图9的等辐射分析结果显示,c3g与catechin复配比例在2.5:2.5、2:3时效应点落在相加线95%可信限的左侧,试验ic50mix值均小于理论ic50add值,且相互作用指数均小于1,表现为协同效应,比例为2.5:2.5时,协同作用较好(协同率21.66%),比例为2:3时,协同效果最好(协同率25.43%),表明对胰脂肪酶具有较强的抑制活性,而在复配比为3:2表现为加和作用,同时,也有部分表现为拮抗作用,如比例为4:1时(协同率-11.18%)、比例为1:4时,拮抗作用最强(协同率-37.74%)。
[0076]
确定不同底物浓度对抑制作用的影响:固定胰脂肪酶浓度为5mg/ml,c3g、catechin和c3g-catechin的浓度为ic50值,加入不同浓度(0.1、0.2、0.4、0.8、1.0、1.2、1.4mg/ml)的4-nitrophenyl butyrate,以反应速率倒数(1/v)和底物浓度倒数(1/[s])作图,绘制lineweaver-burk双倒数曲线,确定最大反应速率(vmax)、米氏常数(km)和解离常数(k)。
[0077]
如图10所示为c3g、catechin、orlistat、c3g-catechin(0.67摩尔质量比)对胰脂肪酶的抑制类型图,与对照组比较,加入半抑制浓度的抑制剂后直线斜率变小,说明c3g、catechin、orlistat、c3g-catechin对胰脂肪酶的抑制类型为可逆性抑制。
[0078]
可逆性抑制包括竞争性、反竞争性和非竞争性抑制类型,竞争性抑制主要表现为km增大,vmax不变,非竞争性抑制主要表现为km不变,vmax减小。由图11可知,对照组和加入半抑制浓度的c3g组的2条直线接近交于纵轴,对照组和加入半抑制浓度的catechin组的2条直线接近交于横轴,对照组与c3g-catechin交于第三象限。通过计算得到c3g、catechin的vmax、km、k,由表2可知,加入c3g后km增大,vmax基本不变,由此可判断该反应的抑制类型为竞争性抑制,加入catechin后km不变,vmax变小,由此可判断该反应的抑制类型为非竞争
性抑制,加入c3g-catechin后km增大,vmax变小,由此可判断该反应的抑制类型为竞争性和非竞争性混合型抑制。
[0079]
表二 c3g、catechin、orlistat、c3g-catechin抑制胰脂肪酶的动力学参数
[0080][0081]
如图12-14所示,为不同浓度c3g、catethin、c3g-catechin(0.67摩尔质量比)对胰脂肪酶二级结构影响的圆二色谱图,胰脂肪酶单独存在时的圆二色光谱图在208nm和222nm时存在2个最小值,根据蛋白质的圆二色光谱理论可得:在整个圆二色谱图中全蛋白显示出一个强负带,具有两个峰(在208和222nm)和一个强正带(在191-193nm)。这些带的强度反映了α-螺旋含量,也就说明胰脂肪酶的结构中存在α螺旋结构。在添加胰脂肪酶抑制剂c3g、catechin、orlistat、c3g-catechin之后,随着抑制剂浓度的升高,这两处负峰所表示的摩尔椭圆率逐渐降低,并且这种现象在c3g-catechin中降低的更显著,表明抑制剂与pl结合破坏了其分子内二级结构,由于胰脂肪酶催化活性中心主要由α螺旋组成,这些螺旋对于维持酶活性位点的疏水性及其周围二硫键的稳定性有重要作用。因此,α螺旋的减少减弱了酶活性位点的疏水性和周围二硫键的稳定性,从而降低了胰脂肪酶的催化活性。
[0082]
如图15所示为c3g、catethin、c3g-catechin(0.67摩尔质量比)组合剂和非诺贝特(fenofibrate,胆固醇吸收特异性抑制剂)对胆固醇溶解度的影响,比较了浓度为5mg/ml的四种抑制剂对胆固醇在胶束溶液中溶解度的抑制效果,可以看出c3g-catechin降低胆固醇在胶束溶液中溶解度的效果最好,抑制率为75%。如图16所示,三种多酚均能有效结合三种胆酸盐,并且c3g-catechin(0.67摩尔质量比)组合剂与胆酸盐结合能力优于单体多酚,不同的胰脂肪酶抑制剂与同种胆酸盐的结合律有显著性差异(p《0.05),这表明三种抑制剂结合部分牛黄胆酸钠、猪胆盐、甘氨胆酸钠,使胆酸盐含量降低,促使胆固醇转化为胆汁酸,从而弥补胆酸盐的损失,通过阻止胆固醇进入胶束溶液形成乳化胶粒,从而抑制了机体对食物中胆固醇的吸收。
[0083]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1