使用人乳寡糖、维生素C和抗炎剂减少氧化应激的发病率的方法与流程
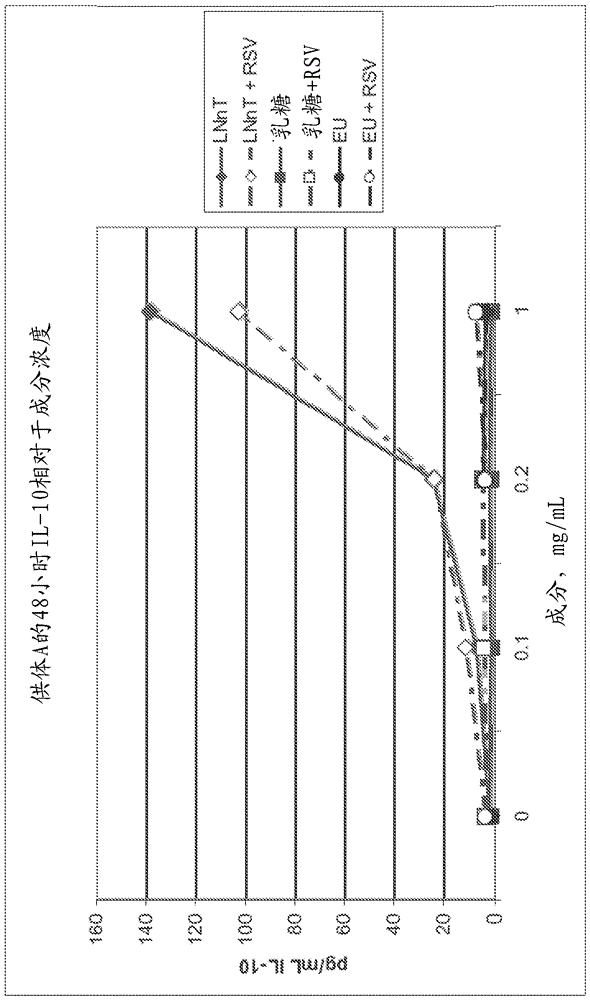
相关申请的交叉引用本申请要求2010年12月31日提交的第61/428,863号美国临时申请;2010年12月31日提交的第61/428,865号美国临时申请的权益,其公开内容以其整体通过引用并入。公开领域本公开涉及用于调节婴儿、幼儿或儿童中的炎症的人乳寡糖(hmos)。更特别地,本公开涉及包含hmos的人乳强化剂、早产儿和足月儿配方食品和小儿配方食品,其可减少炎症且由此预防和/或治疗炎性疾病状态和疾病。公开背景炎性反应是身体在感染物侵袭、抗原攻击或物理、化学或创伤性损伤后试图恢复和维持动态平衡。虽然炎性反应一般视为对损伤所作出的有益健康的反应,但如果免疫系统未得到适当地调节则其可能会出现不良生理反应。具体而言,未经调节的氧化和相关炎症为早产儿和足月儿的组织损伤和临床重要疾病的主要原因。这在很大程度上归因于婴儿,尤其是早产儿的天然免疫系统功能的不成熟。母乳喂养与婴儿呼吸、胃肠和免疫系统的发育增强及生长和成熟平衡相关,由此保护婴儿免于感染和炎性疾病。除外源性抗氧化剂如维生素a、c、e和硒外,母乳似乎还含有内源性抗氧化剂,如超氧化物歧化酶、谷胱甘肽过氧化物酶和触酶,或其他非酶抗氧化剂,如谷胱甘肽、乳铁蛋白和多酚。此外,母乳包括hmos,其不仅充当病原体受体类似物,而且通过婴儿肠道上皮细胞和/或相关免疫细胞群体活化免疫因子。这些充当抗氧化剂和免疫调节剂的母乳组分的功能不仅包括保护母乳脂质免于过氧化,而且可有助于调节针对感染或其他损伤的炎性反应。并非所有婴儿均接受人母乳。此外,目前尚无可用于预防炎性疾病的疫苗。因此,关于安全且有效的预防或治疗方法的开发将是有益的,尤其有益于婴儿。因此,将需要提供营养组合物,尤其合成婴儿配方食品,其可产生包括改善免疫系统生长和发育的营养益处。另外,如果营养组合物可调节炎症并增强针对微生物感染(包括细菌和病毒感染)和其他炎性疾病的免疫性,则将是有益的。公开概述本公开涉及用于减少婴儿、幼儿或儿童中的炎症的营养组合物,包括合成婴儿配方食品、合成小儿配方食品以及合成儿童配方食品,包含单独的至少一种hmo或其与一种或多种长链多不饱和脂肪酸(lcpufas)、抗氧化剂和/或核苷酸的组合,以及使用所述组合物的方法。一个实施方案是减少需要其的婴儿、幼儿或儿童中氧化应激的发病率的方法。所述方法包括给予婴儿、幼儿或儿童包含至少一种选自6'-唾液酸乳糖、2'-岩藻糖基乳糖和乳酰-n-新四糖的人乳寡糖的组合物。另一实施方案是减少需要其的婴儿、幼儿或儿童中氧化应激的发病率的方法。所述方法包括给予婴儿、幼儿或儿童包含6'-唾液酸乳糖、2'-岩藻糖基乳糖和乳酰-n-新四糖的组合物。另一实施方案是增加需要其的婴儿、幼儿或儿童体内的谷胱甘肽水平的方法。所述方法包括给予婴儿、幼儿或儿童包含6'-唾液酸乳糖、2'-岩藻糖基乳糖和乳酰-n-新四糖的组合物。另一实施方案是减少需要其的婴儿、幼儿或儿童中氧化应激的发病率的方法。所述方法包括给予婴儿、幼儿或儿童包含至少一种中性人乳寡糖和至少一种酸性人乳寡糖的组合物。另一实施方案是增加需要其的婴儿、幼儿或儿童体内的谷胱甘肽水平的方法。所述方法包括给予婴儿、幼儿或儿童包含至少一种中性人乳寡糖和至少一种酸性人乳寡糖的组合物。已发现,特定hmos如3'-唾液酸乳糖、6'-唾液酸乳糖和如本文所述的其他hmos高度有效地阻抑婴儿、幼儿和儿童的一般炎症,且具体而言通过减少人类免疫细胞产生一些关键细胞因子而不增加病毒负荷从而可导致从感染较快恢复来阻抑婴儿、幼儿和儿童的病毒诱导性炎症,包括呼吸道融合病毒、人类副流感和a型流感。令人惊讶地是,确定了hmos显示所需阻抑作用,甚至在极低浓度下,包括低于母乳中所发现浓度的浓度。而且,出乎意料地发现,6'-唾液酸乳糖甚至在病毒不存在下也具有免疫调节性,并诱导产生来源于单核细胞的细胞因子。另外还发现,尽管生物反应通常在30至60分钟时段内出现,且因此体外程序一般使用30至60分钟的培育,但24小时预处理细胞将更好地反映每天对母乳喂养的婴儿将从母乳接收的hmos的预暴露。另外,已发现,单独岩藻糖基化hmos(包括3'-岩藻糖基乳糖)或与唾液酸的组合高度有效地抑制呼吸道病毒。甚至在低浓度下,3'-岩藻糖基乳糖和唾液酸仍有效。此外,已发现,当特定hmos与长链多不饱和脂肪酸和/或类胡萝卜素组合时,其以协同方式作用于呼吸道病毒,包括rsv。这些协同作用阻抑病毒诱导性炎性细胞因子,和具体而言干扰素诱导性蛋白10(ip-10)。包括抗氧化剂(如维生素a和维生素e)或核苷酸的其他组分也可添加到hmo与长链多不饱和脂肪酸和/或类胡萝卜素的组合中。另外还发现,包括酸性/唾液酸化(例如,6'-唾液酸乳糖)和/或中性/岩藻糖基化(例如,2'-岩藻糖基乳糖)和/或n-乙酰葡糖基化(例如,lnnt)的hmos组合可预防坏死性小肠结肠炎的发展。而且,发现这些hmos可减少婴儿的氧化应激和增加婴儿的谷胱甘肽水平。附图简述图1为描绘如实施例37中所测试的在各种hmos存在下mdck细胞的h1n1病毒感染力的图。图2为描绘如实施例38中所测量的来自小猪的谷胱甘肽的血浆水平的图。图3为描绘如实施例39中所测量的由给予3'sl和6'sl所产生的ip-10水平的图。图4为描绘如实施例39中所测量的由给予3'sl和6'sl所产生的ip-10水平的图。图5为描绘如实施例39中所测量的由给予lnnt所产生的ip-10水平的图。图6为描绘如实施例39中所测量的由给予lnnt所产生的ip-10水平的图。图7为描绘如实施例39中所测量的由给予3'sl和6'sl所产生的il-10水平的图。图8为描绘如实施例39中所测量的由给予3'sl和6'sl所产生的il-10水平的图。图9为描绘如实施例39中所测量的由给予lnnt所产生的il-10水平的图。图10为描绘如实施例39中所测量的由给予lnnt所产生的il-10水平的图。图11a和图11b为描绘如实施例40中所测量的由在佛波醇十四酸酯乙酸酯(pma)存在或不存在下给予2'fl所产生的化学发光水平的图。公开详述本文所述的营养组合物和方法使用单独hmos或hmos与长链多不饱和脂肪酸和/或抗氧化剂,尤其是类胡萝卜素和/或核苷酸的组合来控制和减少与炎症有关的许多疾病和疾病状态。下文详细描述营养组合物和方法的这些和其他特点,以及许多任选的变化和增加中的一些。术语“蒸煮包装”和“蒸煮灭菌”在本文中可互换使用,且除非另外规定,是指如下常用操作:用营养液填充容器,最通常为金属罐或其他类似包装,然后使该填充有液体的包装经受必要的热灭菌步骤,以形成经灭菌、蒸煮包装的营养液产品。除非另外规定,如本文中所使用,术语“无菌包装”是指不依靠上述蒸煮包装步骤来制造包装产品,其中营养液和包装在填充之前分别进行灭菌,然后在灭菌或无菌处理条件下组合以形成经灭菌、无菌包装的营养液产品。除非另外规定,如本文中所使用,术语“脂肪”和“油”可互换用于指来源于植物或动物或由植物或动物加工的脂质物质。这些术语也包括合成脂质物质,只要这些合成物质适于口服给予人类。除非另外规定,如本文中所使用,术语“人乳寡糖”或“hmo”一般是指存在于人母乳中的许多复杂碳水化合物,其可呈酸性或中性形式,以及是指其前体。示例性非限制性人乳寡糖包括3'-唾液酸乳糖、6'-唾液酸乳糖、3'-岩藻糖基乳糖、2'-岩藻糖基乳糖以及乳酰-n-新四糖。示例性人乳寡糖前体包括唾液酸和/或岩藻糖。除非另外规定,如本文中所使用,术语“贮存稳定”是指营养产品,其经包装然后在18-24℃下储存至少3个月(包括约6个月至约24个月,并且也包括约12个月至约18个月)后保持商业稳定。如本文中所使用,术语“营养制剂”或“营养组合物”可互换使用且除非另外规定,是指合成配方食品,包括营养液、营养粉、营养固体、营养半固体、营养半液体、营养补充剂和如本领域中已知的任何其他营养食品。营养粉可重构形成营养液,其均包含脂肪、蛋白质和碳水化合物中的一种或多种且适于人类口服食用。术语“营养制剂”或“营养组合物”不包括人母乳。除非另外规定,如本文中所使用,术语“营养液”是指呈即饮型液体形式、浓缩形式的营养产品,和通过在使用之前重构本文所述的营养粉所制得的营养液。除非另外规定,如本文中所使用,术语“营养粉”是指呈可流动或可舀取形式的营养产品,其可在食用之前用水或另一水性液体重构且包括喷雾干燥和干混/干掺的粉末。除非另外规定,如本文中所使用,术语“营养半固体”是指性质(如刚性)介于固体与液体之间的营养产品。一些半固体实例包括布丁、明胶和面团。除非另外规定,如本文中所使用,术语“营养半液体”是指性质(如流动性质)介于液体与固体之间的营养产品。一些半液体实例包括奶昔(thickshakes)和液体凝胶。除非另外规定,如本文中所使用,术语“婴儿”是指12个月或12个月以下的人。如本文中所使用,术语“早产儿”是指在妊娠36周前出生的人。除非另外规定,如本文中所使用,术语“幼儿”是指大于一岁至高至三岁的人。除非另外规定,如本文中所使用,术语“儿童”是指大于三岁至高至十二岁的人。除非另外规定,如本文中所使用,术语“新生儿”是指自出生至高至四周龄的人。除非另外规定,如本文中所使用,术语“婴儿配方食品”或“合成婴儿配方食品”可互换使用且是指适于婴儿食用的液体、固体、半固体和半液体人乳替代物或取代物。合成配方食品包括具有半纯化或纯化来源的组分。除非另外规定,如本文中所使用,术语“半纯化”或“纯化”是指已通过纯化天然材料或通过合成制备的物质。术语“婴儿配方食品”或“合成婴儿配方食品”不包括人母乳。除非另外规定,如本文中所使用,术语“合成小儿配方食品”是指适于至多36个月龄(3岁)的婴儿或幼儿食用的液体、固体、半固体和半液体人乳替代物或取代物。合成配方食品包括具有半纯化或纯化来源的组分。除非另外规定,如本文中所使用,术语“半纯化”或“纯化”是指已通过纯化天然材料或通过合成制备的物质。术语“合成小儿营养配方食品”不包括人母乳。除非另外规定,如本文中所使用,术语“合成儿童配方食品”是指适合至多12岁的儿童食用的液体、固体、半固体和半液体人乳替代物或取代物。合成配方食品包括具有半纯化或纯化来源的组分。除非另外规定,如本文中所使用,术语“半纯化”或“纯化”是指已通过纯化天然材料或通过合成制备的物质。术语“合成儿童营养配方食品”不包括人母乳。除非另外规定,如本文中所使用,术语“早产儿配方食品”是指适于早产儿食用的液体和固体营养产品。除非另外规定,如本文中所使用,术语“人乳强化剂”是指适于与母乳或早产儿配方食品或婴儿配方食品混合以供早产儿或足月儿食用的液体和固体营养产品。除非另外规定,如本文中所使用,关于诱导产生来源于单核细胞的细胞因子的术语“病毒不存在(absenceofavirus)”或“不存在病毒(absentavirus)”是指个体(例如,婴儿)无病毒或所具有的病毒量小于引起免疫反应所需的量;即,该量小于身体天然免疫反应增加细胞因子及其他免疫因子产生所需的量。除非另外规定,如本文中所使用,术语“炎性疾病”或“炎性疾病状态”是指特征为炎症的任何疾病、病症或疾病状态。除非另外规定,如本文中所使用,术语“感染介导性炎性疾病”是指与微生物感染(包括病毒和细菌感染)相关或由其诱导的炎性疾病。除非另外规定,如本文中所使用,术语“易患”和“处于风险中”意指对某种疾病状态或疾病具有极小抗性,包括具有该疾病状态或疾病的遗传倾向、具有其家族史和/或具有其症状。除非另外规定,如本文中所使用,术语“调节(modulating)”或“调节(modulation)”或“调节(modulate)”是指对所选特征的目标动作。除非另外规定,如本文中所使用,术语“病毒生长”或“细菌生长”是指病毒或细菌的产生、增殖或复制。除非另外规定,如本文中所使用,所有百分数、份数和比例均以总组合物的重量计。除非另外规定,所有此类重量在其关于所列成分时是指基于活性物水平且因此不包括可包括于市售物质中的溶剂或副产物。如本文中所使用,数值范围意图包括该范围内的每一数目和数目的子集,无论是否特定地公开。此外,这些数值范围应视为对针对该范围内的任何数目或数目的子集的主张提供支持。例如,1至10的公开应视为支持2至8、3至7、5至6、1至9、3.6至4.6、3.5至9.9等范围。除非另外规定或所提及的上下文相反地清楚暗示,所有对本公开数特征或限制的提及均应包括相应复数特征或限制,反之亦然。除非另外规定或提及组合的上下文相反地清楚暗示,如本文中所使用,方法或过程步骤的所有组合均可以任何顺序进行。营养组合物和方法可包含,由下列组成,或基本上由下列组成:如本文所述的组合物和方法的基本要素以及本文所述或另外适于营养产品应用中的任何其他或任选的要素。产品形式本公开的营养组合物可以任何已知或另外适合的口服产品形式调配和给予。任何固体、液体、半固体、半液体或粉末产品形式(包括其组合或变体)适于本文使用,条件为这些形式允许安全和有效地将如本文又定义的基本成分口服递送至个体。本公开的营养组合物包括一种或多种如本文所述的hmos。所述组合物可包括单独一种或多种hmos或其与其他免疫增强因子的组合,所述因子包括但不限于如下文所述的长链多不饱和酸(lcpufas)、核苷酸和抗氧化剂,如类胡萝卜素和维生素。营养组合物可呈包含本文所述的成分的任何产品形式,且其安全和有效地用于口服给予。所述营养组合物可调配成仅包括本文所述的成分,或可修改为含有任选的成分以形成多种不同产品形式。本公开的营养组合物适宜调配成膳食产品形式,其在本文中定义为呈产品形式的包含本公开成分的那些实施方案:含有脂肪、蛋白质和碳水化合物中的至少一种,且优选还含有维生素、矿物质或其组合。营养组合物将包含至少hmos,适宜地与蛋白质、脂肪、维生素和矿物质中的至少一种组合以产生营养组合物。营养组合物可调配成含有足够种类和量的营养物以提供营养的唯一、主要或补充来源,或提供用于患有特定疾病或疾病状态的个体的特定营养产品或如下文所述的目标营养益处。适合与如本文所公开的含有hmo的组合物一起使用的产品形式的特定非限制性实例包括例如适合用于婴儿和儿童的液体和粉状膳食补充剂、液体和粉状人乳强化剂、液体和粉状早产儿配方食品、液体和粉状婴儿配方食品、液体和粉状元素和半元素配方食品、液体和粉状小儿配方食品、液体和粉状幼儿配方食品以及液体和粉状后续配方食品(follow-onformulas)。营养液营养液包括浓缩和即食型营养液。这些营养液最通常调配成悬浮液或乳液,尽管其他液体形式也在本公开的范围内。适合使用的营养乳液可以是包含蛋白质、脂肪和碳水化合物的水性乳液。这些乳液一般在约1℃至约25℃下为可流动或可饮用液体且通常呈水包油、油包水或复杂水性乳液形式,但此类乳液最通常呈具有连续水相和不连续油相的水包油乳液形式。营养乳液可为且通常为贮存稳定的。营养乳液通常含有以营养乳液的重量计至多约95重量%水,包括约50%至约95%,也包括约60%至约90%,且也包括约70%至约85%水。营养乳液可具有各种产品密度,但最通常密度大于约1.03g/ml,包括大于约1.04g/ml,包括大于约1.055g/ml,包括约1.06g/ml至约1.12g/ml,且也包括约1.085g/ml至约1.10g/ml。营养乳液可具有适合最终使用者的营养需求的热量密度,尽管在大多数情况下,乳液一般包含至少19kcal/floz(660kcal/升),更通常为约20kcal/floz(675-680kcal/升)至约25kcal/floz(820kcal/升),甚至更通常为约20kcal/floz(675-680kcal/升)至约24kcal/floz(800-810kcal/升)。一般,22-24kcal/floz配方食品更常用于早产儿或低出生体重婴儿(lowbirthweightinfants),且20-21kcal/floz(675-680至700kcal/升)配方食品更常用于足月儿。在一些实施方案中,乳液的热量密度可为约50-100kcal/升至约660kcal/升,包括约150kcal/升至约500kcal/升。在一些特定实施方案中,乳液的热量密度可为25或50或75或100kcal/升。营养乳液的ph值可在约3.5至约8的范围内,但最宜在约4.5至约7.5的范围内,包括约5.5至约7.3,包括约6.2至约7.2。尽管营养乳液的食用份量(servingsize)可视许多变数而变化,但典型食用份量一般为至少约1ml,或甚至至少约2ml,或甚至至少约5ml,或甚至至少约10ml,或甚至至少约25ml,包括在约1ml至约300ml的范围内,包括约4ml至约250ml,且包括约10ml至约240ml。营养固体营养固体可呈任何固体形式,但通常呈可流动或实质上可流动微粒组合物或至少微粒组合物形式。尤其适合的营养固体产品形式包括喷雾干燥、聚结和/或干掺的粉末组合物。所述组合物可轻易用勺或类似其他装置舀取和测量,且可轻易由欲使用者用适合的水性液体(通常为水)重构,以形成供立即口服或肠道使用的营养组合物。在此情形下,“立即”使用一般意指在约48小时内,最通常在约24小时内,优选在重构后立刻。营养粉可在使用之前用水重构至具有适合最终使用者的营养需求的热量密度,尽管在大多数情况下所述粉末用水重构形成包含至少19kcal/floz(660kcal/升),更通常为约20kcal/floz(675-680kcal/升)至约25kcal/floz(820kcal/升),甚至更通常为约20kcal/floz(675-680kcal/升)至约24kcal/floz(800-810kcal/升)的组合物。一般,22-24kcal/floz配方食品更常用于早产儿或低出生体重婴儿,且20-21kcal/floz(675-680至700kcal/升)配方食品更常用于足月儿。在一些实施方案中,重构粉末的热量密度可为约50-100kcal/升至约660kcal/升,包括约150kcal/升至约500kcal/升。在一些特定实施方案中,乳液的热量密度可为25或50或75或100kcal/升。人乳寡糖(hmos)本公开的营养组合物包括至少一种hmo,且在许多实施方案中包括两种或更多种hmos的组合。寡糖为人母乳主要组分之一,其平均含有每升10克中性寡糖和每升1克酸性寡糖。人乳寡糖的组成很复杂且已知有超过200种不同寡糖样结构。hmos可单独或在一些实施方案中与如本文所述的其他免疫增强因子(例如lcpufas、抗氧化剂、核苷酸等)组合包括在营养组合物中。一种或多种hmo可自哺乳动物分泌的乳中分离或富集,所述哺乳动物包括但不限于:人类、牛、绵羊、猪或山羊物种。hmos也可经由微生物发酵、酶促方法、化学合成或其组合来产生。适合用于营养组合物中的hmos可包括酸性寡糖、中性寡糖、n-乙酰葡糖基化寡糖和hmo前体。可个别地或组合包括在本公开组合物中的hmos的特定非限制性实例包括:唾液酸(即,游离唾液酸、脂质结合唾液酸、蛋白质结合唾液酸);d-葡萄糖(glc);d-半乳糖(gal);n-乙酰葡糖胺(glcnac);l-岩藻糖(fuc);岩藻糖基寡糖(即,乳酰-n-岩藻五糖i;乳酰-n-岩藻五糖ii;2'-岩藻糖基乳糖;3'-岩藻糖基乳糖;乳酰-n-岩藻五糖iii;乳酰-n-二岩藻六糖i;和乳酰二岩藻四糖);非岩藻糖基化、非唾液酸化寡糖(即,乳酰-n-四糖和乳酰-n-新四糖);唾液酸寡糖(即,3'-唾液酸-3-岩藻糖基乳糖;二唾液酸单岩藻糖基乳酰-n-新六糖;单岩藻糖基单唾液酸乳酰-n-八糖(唾液酸lea);唾液酸乳酰-n-岩藻六糖ii;二唾液酸乳酰-n-岩藻五糖ii;单岩藻糖基二唾液酸乳酰-n-四糖);和唾液酸岩藻糖基寡糖(即,2'-唾液酸乳糖;2-唾液酸乳糖胺;3'-唾液酸乳糖;3'-唾液酸乳糖胺;6'-唾液酸乳糖;6'-唾液酸乳糖胺;唾液酸乳酰-n-新四糖c;单唾液酸乳酰-n-六糖;二唾液酸乳酰-n-六糖i;单唾液酸乳酰-n-新六糖i;单唾液酸乳酰-n-新六糖ii;二唾液酸乳酰-n-新六糖;二唾液酸乳酰-n-四糖;二唾液酸乳酰-n-六糖ii;唾液酸乳酰-n-四糖a;二唾液酸乳酰-n-六糖i;和唾液酸乳酰-n-四糖b)。还原端的葡萄糖(glc)经n-乙酰葡糖胺置换的变异体(例如,2'-岩藻糖基-n-乙酰葡糖胺(2'-flnac)为2'-岩藻糖基乳糖的变异体)也适用。这些hmos更全面地描述于美国专利申请第2009/0098240号中,其以全文引用的方式并入本文中。可包括在本公开组合物中的hmos的其他适合实例包括乳酰-n-岩藻五糖v、乳酰-n-六糖、对-乳酰-n-六糖、乳酰-n-新六糖、对-乳酰-n-新六糖、单岩藻糖基乳酰-n-六糖ii、异构岩藻糖基化乳酰-n-六糖(1)、异构岩藻糖基化乳酰-n-六糖(3)、异构岩藻糖基化乳酰-n-六糖(2)、二岩藻糖基-对-乳酰-n-新六糖、二岩藻糖基-对-乳酰-n-六糖、二岩藻糖基乳酰-n-六糖、乳酰-n-新八糖、对-乳酰-n-八糖、异-乳酰-n-八糖、乳酰-n-八糖、单岩藻糖基乳酰-新八糖、单岩藻糖基乳酰-n-八糖、二岩藻糖基乳酰-n-八糖i、二岩藻糖基乳酰-n-八糖ii、二岩藻糖基乳酰-n-新八糖ii、二岩藻糖基乳酰-n-新八糖i、乳酰-n-十糖、三岩藻糖基乳酰-n-新八糖、三岩藻糖基乳酰-n-八糖、三岩藻糖基-异-乳酰-n-八糖、乳酰-n-二岩藻-六糖ii、唾液酸-乳酰-n-四糖a、唾液酸-乳酰-n-四糖b、唾液酸-乳酰-n-四糖c、唾液酸-岩藻糖基-乳酰-n-四糖i、唾液酸-岩藻糖基-乳酰-n-四糖ii和二唾液酸-乳酰-n-四糖及其组合。尤其适合的营养组合物包括以下hmos或hmo前体中的至少一种:唾液酸(sa);3'-唾液酸乳糖(3'sl);6'-唾液酸乳糖(6'sl);2'-岩藻糖基乳糖(2'fl);3'-岩藻糖基乳糖(3'fl);乳酰-n-四糖和乳酰-n-新四糖(lnnt),且尤其6'sl与3'sl的组合;3'fl与sa的组合;2'fl与3'fl的组合;2'fl、3'sl与6'sl的组合;3'sl、3'fl与lnnt的组合;以及6'sl、2'fl与lnnt的组合。其它示例性组合包括:sa、3'sl、6'sl、3'fl、2'fl和lnnt;3'sl、6'sl、3'fl、2'fl和lnnt;sa、6'sl、3'fl、2'fl和lnnt;sa、3'sl,3'fl、2'fl和lnnt;sa、3'sl、6'sl、2'fl和lnnt;sa、3'sl、6'sl、3'fl和lnnt;sa、3'sl、6'sl、3'fl和2'fl;sa和3'sl;sa和6'sl;sa和2'fl;sa和lnnt;sa、3'sl和6'sl;sa、3'sl和3'fl;sa、3'sl和2'fl;sa、3'sl和lnnt;sa、6'sl和3'fl;sa、6'sl和2'fl;sa、6'sl和lnnt;sa、3'fl和2'fl;sa、3'fl和lnnt;sa、2'fl和lnnt;sa、3'sl、6'sl和3'fl;sa、3'sl、6'sl和2'fl;sa、3'sl、6'sl和lnnt;sa、3'sl、3'fl和2'fl;sa、3'sl、3'fl和lnnt;sa、3'sl、2'fl和lnnt;sa、6'sl、3'fl和2'fl;sa、6'sl、2'fl和lnnt;sa、6'sl、3'fl和lnnt;sa、3'fl、2'fl和lnnt;sa、6'sl、2'fl和lnnt;sa、3'sl、3'fl、2'fl和lnnt;sa、6'sl、3'fl、2'fl和lnnt;sa、3'sl、6'sl、3'fl和lnnt;sa、3'sl、3'fl、2'fl和lnnt;sa、3'sl、6'sl、2'fl和lnnt;3'sl、6'sl、3'fl和2'fl;3'sl、6'sl、2'fl和lnnt;3'sl、3'fl、2'fl和lnnt;3'sl、6'sl、3'fl和lnnt;3'sl、6'sl和3'fl;3'sl、3'fl和2'fl;3'sl、2'fl和lnnt;3'sl、6'sl和2'fl;3'sl、6'sl和lnnt;3'sl和3'fl;3'sl和2'fl;3'sl和lnnt;6'sl和3'fl;6'sl和2'fl;6'sl和lnnt;6'sl,3'fl和lnnt;6'sl、3'fl、2'fl和lnnt;3'fl、2'fl和lnnt;3'fl和lnnt;以及2'fl和lnnt。hmos以如下组合物中的hmo总量(hmo的mg/组合物的ml)存在于营养组合物中:至少约0.001mg/ml,包括至少约0.01mg/ml,包括约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml,包括约0.001mg/ml至约10mg/ml,包括约0.01mg/ml至约10mg/ml,包括约0.001mg/ml至约5mg/ml,包括约0.01mg/ml至约5mg/ml,包括约0.001mg/ml至约1mg/ml,包括约0.001mg/ml至约0.23mg/ml,包括约0.01mg/ml至约0.23mg/ml的总hmo于营养组合物中。通常,营养组合物中hmo的量将视营养组合物中存在的特定hmo或hmos和其他组分的量而定。在一个特定实施方案中,当营养产品为营养粉时,营养粉中hmos的总浓度为约0.0005%至约5%,包括约0.01%至约1%(以营养粉的重量计)。在另一特定实施方案中,当营养产品为即食型营养液时,即食型营养液中hmos的总浓度为约0.0001%至约0.50%,包括约0.001%至约0.15%,包括约0.01%至约0.10%,且进一步包括约0.01%至约0.03%(以即食型营养液的重量计)。在另一特定实施方案中,当营养产品为浓缩营养液时,浓缩营养液中hmos的总浓度为约0.0002%至约0.60%,包括约0.002%至约0.30%,包括约0.02%至约0.20%,且进一步包括约0.02%至约0.06%(以浓缩营养液的重量计)。在一个特定实施方案中,营养组合物包括中性人乳寡糖的量约0.001mg/ml至约20mg/ml,包括0.01mg/ml至约20mg/ml,包括约0.001mg/ml至小于2mg/ml,且包括约0.01mg/ml至小于2mg/ml。在一些实施方案中,组合使用hmos以提供所需免疫增强作用。例如,在一个实施方案中,营养组合物包括6'sl与3'sl的组合,hmo的总量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml,包括约0.001mg/ml至约0.23mg/ml,包括约0.01mg/ml至约0.23mg/ml,包括约0.001mg/ml至小于0.15mg/ml,且包括0.01mg/ml至小于0.15mg/ml营养组合物。在另一实施方案中,营养组合物包括6'sl与3'sl的组合,hmo总量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml且包括大于0.65mg/ml至约20mg/ml。在一个特定实施方案中,营养组合物包括单独6'sl或6'sl与其他hmos的组合,其量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml,包括约0.001mg/ml至小于0.25mg/ml,包括约0.01mg/ml至小于0.25mg/ml,包括大于0.4mg/ml至约20mg/ml,包括约0.1mg/ml至约0.5mg/ml,且包括约0.1mg/ml至约0.5mg/ml。在一个实施方案中,当营养组合物包括6'sl时,营养组合物中hmos的总量包括至少约88%(以hmos总重量计)6'sl,包括约88%(以hmos总重量计)至约96%(以hmos总重量计),包括约88%(以hmos总重量计)至约100%(以hmos总重量计),且包括约100%(以hmos总重量计)6'sl。在另一实施方案中,营养组合物包括单独3'sl或3'sl与其他hmos的组合,其量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml,包括约0.001mg/ml至小于0.15mg/ml,包括约0.01mg/ml至小于0.15mg/ml,且包括大于0.25mg/ml至约20mg/ml。在一个实施方案中,当营养组合物包括3'sl时,营养组合物中hmos的总量包括至少约85%(以hmos总重量计)3'sl,包括约85%(以hmos总重量计)至约88%(以hmos总重量计),包括约85%(以hmos总重量计)至约100%(以hmos总重量计)和包括约100%(以hmos总重量计)3'sl。在一个特定实施方案中,营养组合物包括单独lnnt或lnnt与其他hmos的组合,其量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml,包括约0.001mg/ml至小于0.2mg/ml,包括约0.01mg/ml至小于0.2mg/ml,且包括大于0.32mg/ml至约20mg/ml。在另一特定实施方案中,营养组合物包括单独3'fl或3'fl与其他hmos的组合,其量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml,包括约0.01mg/ml至小于1mg/ml,且包括大于1.7mg/ml至约20mg/ml。在一个特定实施方案中,营养组合物包括3'fl与sa的组合,hmo总量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml。在一个实施方案中,营养组合物包括0.001mg/ml至小于1mg/ml,包括0.01mg/ml至小于1mg/ml的量的3'fl和约1mg/ml的量的sa。在另一实施方案中,营养组合物包括单独2'fl或2'fl与其他hmos的组合,其量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml,包括约0.001mg/ml至小于2mg/ml,且包括约0.01mg/ml至小于2mg/ml。在另一实施方案中,营养组合物包括单独2'fl或2'fl与其他hmos的组合,其量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml和包括大于2.5mg/ml至约20mg/ml。在一个特定实施方案中,营养组合物包括2'fl与3'fl的组合,其hmo总量为0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml。在又一实施方案中,营养组合物包括6'sl、2'fl和lnnt的组合,hmo总量为约0.001mg/ml至约20mg/ml,包括约0.01mg/ml至约20mg/ml。长链多不饱和脂肪酸(lcpufas)除上述hmos外,本公开的营养产品可包括lcpufas。lcpufas包括在营养组合物中以提供营养支持,以及减少氧化应激和增强肠道上皮及相关免疫细胞群体的生长和功能发育。在一些实施方案中,营养组合物包括一种或多种hmos与一种或多种lcpufas的组合以使得该组合物向最终使用者提供协同益处,如调节抗病毒免疫反应和阻抑炎症的协同益处。在一些实施方案中,与lcpufas组合使用以提供协同作用的hmo或hmos为酸性hmos。用于营养组合物中的示例性lcpufas包括例如ω-3lcpufas和ω-6lcpufas。特定lcpufas包括二十二碳六烯酸(dha)、二十碳五烯酸(epa)、二十二碳五烯酸(dpa)、花生四烯酸(ara)、亚油酸、亚麻酸(α亚麻酸)和γ-亚麻酸,其源自油源(如植物油、海洋浮游生物、真菌油和鱼油)。在一个特定实施方案中,lcpufas来源于鱼油,如鲱鱼(menhaden)、鲑鱼、鲚鱼、鳕鱼、大比目鱼、鲔鱼或青鱼(herring)油。与hmos一起用于营养组合物中的尤其优选的lcpufas包括dha、ara、epa、dpa及其组合。为了减少营养组合物中高剂量lcpufas的潜在副作用,lcpufas的含量优选不超过营养组合物中总脂肪含量的3重量%,包括低于总脂肪含量的2重量%,且包括低于总脂肪含量的1重量%。lcpufa可以游离脂肪酸形式、甘油三酯形式、甘油二酯形式、甘油单酯形式、磷脂形式、酯化形式或以上述中一种或多种的混合物形式提供,优选以甘油三酯形式提供。如本文所述的营养组合物通常将包含总浓度为约0.01mm至约10mm且包括约0.01mm至约1mm的lcpufa。或者,营养组合物包含总浓度为约0.001g/l至约1g/l的lcpufa。在一个实施方案中,营养组合物包括浓度为约100至约425mg/l或每100kcals约12至约53mg的总长链ω-6脂肪酸和/或另外包括浓度为约40至约185mg/l或每100kcals约5至约23mg的总长链ω-3脂肪酸。在一个特定实施方案中,营养组合物中长链ω-6脂肪酸与长链ω-3脂肪酸的比例在约2:1至约3:1的范围内,优选约2.5:1。在一个特定实施方案中,营养组合物包括浓度为约0.025mg/ml至约0.130mg/ml或每100kcals约3至约16mg的dha。在另一实施方案中,营养组合物包括浓度为约0.080mg/ml至约0.250mg/ml或每100kcals约10至约31mg的ara。在又一实施方案中,营养组合物包括使得dha与ara的比例在约1:4至约1:2的范围内的dha与ara的组合。抗氧化剂另外,营养组合物可包含一种或多种抗氧化剂与hmos的组合(且还任选包含lcpufas和/或核苷酸)以提供营养支持,以及减少氧化应激。在一些实施方案中,营养组合物包括hmos与抗氧化剂的组合以使得该组合物向最终使用者提供协同益处,如调节抗病毒免疫反应和阻抑炎症的协同益处。在一些实施方案中,hmo或hmos与类胡萝卜素(且尤其是叶黄素、β-胡萝卜素、玉米黄素和/或番茄红素)组合使用以提供协同作用。可包括适于口服给予的任何抗氧化剂以用于本公开的营养组合物中,包括例如维生素a、维生素e、维生素c、视黄醇、生育酚和类胡萝卜素(包括例如叶黄素、β-胡萝卜素、玉米黄素和番茄红素及其组合)。如上所述,用于营养组合物中的抗氧化剂可与单独hmos一起使用或与hmos和lcpufas和/或核苷酸的组合一起使用。在一个特定实施方案中,用于营养组合物中的抗氧化剂包括类胡萝卜素,且尤其是类胡萝卜素叶黄素、番茄红素、玉米黄素和/或β-胡萝卜素的组合。如本文所选和所定义的含有这些组合的营养组合物可用于调节早产儿和足月儿的炎症和/或c反应性蛋白的水平。通常优选地,营养组合物包含叶黄素、番茄红素、玉米黄素和β-胡萝卜素中的至少一种以提供类胡萝卜素总量为约0.001µg/ml至约10µg/ml。更具体而言,营养组合物包含叶黄素的量约0.001µg/ml至约10µg/ml,包括约0.001µg/ml至约5µg/ml,包括约0.001µg/ml至约0.0190µg/ml,包括约0.001µg/ml至约0.0140µg/l,且也包括约0.044µg/ml至约5µg/ml的叶黄素。通常也优选地,营养组合物包含约0.001µg/ml至约10µg/ml,包括约0.001µg/ml至约5µg/ml,约0.001µg/ml至约0.0130µg/ml,包括约0.001µg/ml至约0.0075µg/ml,且也包括约0.0185µg/ml至约5µg/ml番茄红素。通常也优选地,营养组合物包含约1µg/ml至约10µg/ml,包括约1µg/ml至约5µg/ml,包括约0.001µg/ml至约0.025µg/ml,包括约0.001µg/ml至约0.011µg/ml,且也包括约0.034µg/ml至约5µg/mlβ-胡萝卜素。应了解,这些量的β-胡萝卜素、叶黄素、玉米黄素和番茄红素的任何组合可包括在本公开的营养组合物中。其他类胡萝卜素可任选包括在本文所述的营养组合物中。本文所述的营养组合物中所包括的类胡萝卜素的任一种或全部可来自天然来源,或经人工合成。所选组合中的每一类胡萝卜素可获自用于营养组合物中的任何已知或另外适合的物质来源,且每一个可个别地或一起提供,或以任何组合提供,且来自许多来源,包括来源如含有其他维生素或矿物质与如本文所述的一种或多种类胡萝卜素组合的多种维生素预混物。叶黄素、番茄红素、β-胡萝卜素或其组合的一些适合来源的非限制性实例包括lycovit®番茄红素(购自basf,mountolive,nj)、呈油、粉末或珠形式的lyc-o-mato®番茄萃取物(购自lycoredcorp.,orange,nj)、β-胡萝卜素、叶黄素或番茄红素(购自dsmnutritionalproducts,parsippany,nj)、floraglo®叶黄素(购自keminhealth,desmoines,ia)、xangold®天然叶黄素酯(购自cognis,cincinnati,oh)和lucarotin®β-胡萝卜素(购自basf,mountolive,n.j)。核苷酸除hmos外,本公开的营养组合物可另外包含选自核苷、嘌呤碱基、嘧啶碱基、核糖和脱氧核糖的核苷酸和/或核苷酸前体。该核苷酸可呈单磷酸盐、二磷酸盐或三磷酸盐形式。核苷酸可为核糖核苷酸或脱氧核糖核苷酸。核苷酸可为单体、二聚或聚合(包括rna和dna)核苷酸。核苷酸可以游离酸形式或以盐(优选为单钠盐)形式存在于营养组合物中。在一些实施方案中,营养组合物包括hmos与核苷酸的组合以使得该组合物向最终使用者提供协同益处,如调节抗病毒免疫反应和阻抑炎症和/或改善肠道障壁完整性的协同益处。核苷酸并入本公开的营养组合物中可改善肠道障壁完整性和/或成熟度,其有益于肠道菌群发育不足并因此肠道障壁成熟较慢的早产儿和足月儿。适合用于营养组合物中的核苷酸和/或核苷包括以下一种或多种:5'-单磷酸胞苷、5'-单磷酸尿苷、5'-单磷酸腺苷、5'-1-单磷酸鸟苷和/或5'-单磷酸肌苷,更优选5'-单磷酸胞苷、5'-单磷酸尿苷、5'-单磷酸腺苷、5'-单磷酸鸟苷和5'-单磷酸肌苷。核苷酸以至少约5mg/l,包括至少约10mg/l,包括约10mg/l至约200mg/l,包括约42mg/l至约102mg/l,且包括至少约72mg/l营养产品的核苷酸总量存在于营养产品中。在一个特定实施方案中,当营养组合物为营养粉时,核苷酸存在的水平可为至少约0.007%,包括约0.0078%至约0.1556%,且包括约0.056%(以营养粉的重量计),或每100克营养粉至少约0.007克,包括约0.0078克至约0.1556克,且包括约0.056克核苷酸。在另一特定实施方案中,当营养组合物为即食型营养液时,核苷酸存在的水平为至少约0.001%,包括约0.001%至约0.0197%,且包括约0.0071%(以营养液的重量计),或每100克即食型营养液至少约0.001克,包括约0.001克至约0.0197克,且包括约0.0071克核苷酸。在另一特定实施方案中,当营养组合物为浓缩营养液时,核苷酸存在的水平为至少约0.0019%,包括约0.0019%至约0.0382%,且包括约0.0138%(以营养液的重量计),或每100克浓缩营养液至少约0.0019克,包括约0.0019克至约0.0382克,且包括约0.0138克核苷酸。宏量营养素包括hmo或hmos的营养组合物可调配成包括蛋白质、脂肪和碳水化合物中的至少一种。在许多实施方案中,营养组合物将包括hmo或hmos及蛋白质、碳水化合物和脂肪。尽管脂肪、蛋白质和碳水化合物的总浓度或量可视产品类型(即,人乳强化剂、早产儿配方食品、婴儿配方食品等)、产品形式(即,营养固体、粉末、即食型液体或浓缩液体)和所欲使用者的目标膳食需求而变化,但这些浓度或量最通常在以下实施范围之一内,包括如本文所述的任何其他基本脂肪、蛋白质和/或碳水化合物成分。对于液体早产儿和和足月儿配方食品,以早产儿或足月儿配方食品的重量计,碳水化合物浓度最通常在约5%至约40%的范围内,包括约7%至约30%,包括约10%至约25%;以早产儿或足月儿配方食品的重量计,脂肪浓度最通常在约1%至约30%的范围内,包括约2%至约15%,且也包括约3%至约10%;和以早产儿或足月儿配方食品的重量计,蛋白质浓度最通常在约0.5%至约30%的范围内,包括约1%至约15%,且也包括约2%至约10%。对于液体人乳强化剂,以人乳强化剂的重量计,碳水化合物浓度最通常在约10%至约75%的范围内,包括约10%至约50%,包括约20%至约40%;以人乳强化剂的重量计,脂肪浓度最通常在约10%至约40%的范围内,包括约15%至约37%,且也包括约18%至约30%;以及以人乳强化剂的重量计,蛋白质浓度最通常在约5%至约40%的范围内,包括约10%至约30%,且也包括约15%至约25%。本文所述的任一液体营养组合物中碳水化合物、脂肪和/或蛋白质的量也可如下表中所示以除占液体营养组合物总卡路里的百分数外的方式或其替代方式来表征。用于本发明液体营养组合物的这些宏量营养素最通常以下表中所述的任一热量范围(实施方案a-f)调配(在每一数值前加上术语“约”)。营养物占总卡路里的%实施方案a实施方案b实施方案c碳水化合物0-982-9610-75蛋白质0-982-965-70脂肪0-982-9620-85实施方案d实施方案e实施方案f碳水化合物30-5025-5025-50蛋白质15-3510-305-30脂肪35-551-202-20在一个特定实施方案中,液体婴儿配方食品(即食型和浓缩液体二者)包括如下那些实施方案,其中蛋白质组分可占配方食品热量含量的约7.5%至约25%;碳水化合物组分可占婴儿配方食品总热量含量的约35%至约50%;且脂肪组分可占婴儿配方食品总热量含量的约30%至约60%。这些范围仅作为实例提供,且不欲加以限制。其他适合的范围如下表中所示(在每一数值前加上术语“约”)。营养物占总卡路里的%实施方案g实施方案h实施方案i碳水化合物:20-8530-6035-55脂肪:5-7020-6025-50蛋白质:2-755-507-40当营养产品为粉状早产儿或足月儿配方食品时,以早产儿或足月儿配方食品的重量计,蛋白质组分存在的量为约5%至约35%,包括约8%至约12%,且包括约10%至约12%;以早产儿或足月儿配方食品的重量计,脂肪组分存在的量为约10%至约35%,包括约25%至约30%,且包括约26%至约28%;和以早产儿或足月儿配方食品的重量计,碳水化合物组分存在的量为约30%至约85%,包括约45%至约60%,包括约50%至约55%。对于粉状人乳强化剂,以人乳强化剂的重量计,蛋白质组分存在的量为约1%至约55%,包括约10%至约50%,且包括约10%至约30%;以人乳强化剂的重量计,脂肪组分存在的量为约1%至约30%,包括约1%至约25%,且包括约1%至约20%;和以人乳强化剂的重量计,碳水化合物组分存在的量为约15%至约75%,包括约15%至约60%,包括约20%至约50%。本公开的粉状营养组合物中脂肪、碳水化合物和蛋白质的总量或浓度可显著视所选组合物和所欲使用者的膳食或医学需求而变化。下文阐述宏量营养素浓度的其他适合实例。在此情形下,总量或浓度是指粉状产品中的所有脂肪、碳水化合物和蛋白质来源。对于粉状营养组合物,此类总量或浓度最通常且优选以下表中所述的任一体现范围来调配(在每一数值前加上术语“约”)。营养物占总卡路里的%实施方案j实施方案k实施方案l碳水化合物1-8530-6035-55脂肪5-7020-6025-50蛋白质2-755-507-40脂肪除上述lcpufas外,本公开的营养组合物可包含其他一种或多种脂肪来源。适合用于本文中的其他脂肪来源包括适合用于口服营养产品中且与此类产品的基本要素和特点相容的任何脂肪或脂肪来源。例如,在一个特定实施方案中,其他脂肪来源于短链脂肪酸。适合用于本文所述的营养产品中的脂肪或其来源的其他非限制性实例包括椰子油、分馏椰子油、大豆油、玉米油、橄榄油、红花油、高油酸红花油、油酸(emersol6313oleicacid,cognisoleochemicals,malaysia)、mct油(中链甘油三酯)、向日葵油、高油酸向日葵油、棕榈和棕榈仁油、棕榈油精(palmolein)、菜籽油、海洋油(marineoils)、鱼油、真菌油、海藻油、棉籽油及其组合。蛋白质本公开的营养组合物可任选进一步包含蛋白质。适合用于口服营养组合物且与此类产品的基本要素和特点相容的任何蛋白质来源适合用于营养组合物中。适合用于营养产品中的蛋白质或其来源的非限制性实例包括水解、部分水解或非水解蛋白质或蛋白质来源,其可来源于任何已知或另外适合的来源,例如乳(例如,酪蛋白、乳清)、动物(例如,肉、鱼)、谷类(例如,稻、玉米)、植物(例如,大豆)或其组合。此类蛋白质的非限制性实例包括乳蛋白分离物、如本文所述的乳蛋白浓缩物、酪蛋白分离物、高度水解酪蛋白、乳清蛋白、酪蛋白钠或酪蛋白钙、全牛乳、部分或完全脱脂乳、大豆蛋白分离物、大豆蛋白浓缩物等。在一个特定实施方案中,营养组合物包括来源于人和/或牛来源的乳蛋白的蛋白质来源。碳水化合物本公开的营养产品可进一步任选包含适合用于口服营养产品中且与此类产品的基本要素和特点相容的任何碳水化合物。适合用于本文所述的营养产品中的碳水化合物或其来源的非限制性实例可包括麦芽糊精、水解或改质淀粉或玉米淀粉、葡萄糖聚合物、玉米糖浆、玉米糖浆固体、来源于稻的碳水化合物、来源于豌豆的碳水化合物、来源于马铃薯的碳水化合物、木薯、蔗糖、葡萄糖、果糖、乳糖、高果糖玉米糖浆、蜂蜜、糖醇(例如,麦芽糖醇、赤藻糖醇、山梨糖醇)、人造甜味剂(例如,蔗糖素、乙酰磺胺酸钾、甜菊)及其组合。尤其所需的碳水化合物为低右旋糖当量(de)麦芽糊精。其他任选的成分本公开的营养组合物可进一步包含其他任选的组分,其可改变产品的物理、化学、美观或加工特征或当用于目标群体时充当药物或其他营养组分。许多这些任选的成分为已知的或另外适合用于医学食物或其他营养产品或药物剂型中且也可用于本文的组合物中,条件是此类任选的成分对于口服给予为安全的且与所选产品形式中的基本和其他成分相容。此类任选的成分的非限制性实例包括防腐剂、乳化剂、缓冲剂、果寡糖、半乳寡糖、聚右旋糖(polydextrose)和其他益生元(prebiotics)、益生菌(probiotics)、药物活性剂、抗炎剂、如本文所述的其他营养物、着色剂、调味剂、增稠剂和稳定剂、乳化剂、润滑剂等。营养组合物可进一步包含甜味剂,优选包括至少一种糖醇,如麦芽糖醇、赤藻糖醇、山梨糖醇、木糖醇、甘露糖醋、异麦芽酮糖醇(isolmalt)和乳糖醇,且也优选包括至少一种人造或高效力甜味剂,如乙酰磺胺酸钾、阿斯巴甜、蔗糖素、糖精、甜菊和塔格糖。这些甜味剂,尤其是糖醇与人造甜味剂的组合,尤其用于调配具有所需有利特性(profile)的本公开液体饮料实施方案。这些甜味剂组合尤其有效掩蔽有时与液体饮料中添加植物蛋白相关的不当味道。以营养产品的重量计,营养产品中任选的糖醇浓度的范围可为至少0.01%,包括约0.1%至约10%,且也包括约1%至约6%。以营养产品的重量计,任选的人造甜味剂浓度的范围可为约0.01%,包括约0.05%至约5%,也包括约0.1%至约1.0%。流动剂或防结块剂可包括于如本文所述的营养组合物中以延缓粉末随时间凝块或结块并使得粉末实施方案容易自其容器流出。已知或另外适合用于营养粉或产品形式中的任何已知流动剂或防结块剂适用于本文,其非限制性实例包括磷酸三钙、硅酸盐及其组合。营养组合物中流动剂或防结块剂的浓度视产品形式、其他所选成分、所需流动性质等而变化,但以营养组合物的重量计,最通常在约0.1%至约4%的范围内,包括约0.5%至约2%。稳定剂也可包括于营养组合物中。已知或另外适合用于营养组合物中的任何稳定剂也适用于本文,其一些非限制性实例包括胶,如黄胞胶(xanthangum)。以营养组合物的重量计,稳定剂可占约0.1%至约5.0%,包括约0.5%至约3%,包括约0.7%至约1.5%。营养组合物可进一步包含各种其他维生素或相关营养物中的任一种,其非限制性实例包括维生素a、维生素d、维生素e、维生素k、硫胺素、核黄素、吡哆醇、维生素b12、类胡萝卜素(例如,β-胡萝卜素、玉米黄素、叶黄素、番茄红素)、烟酸、叶酸、泛酸、生物素、维生素c、胆碱、肌醇、其盐和衍生物及其组合。营养组合物可进一步包含各种其他另外矿物质中的任一种,其非限制性实例包括钙、磷、镁、铁、锌、锰、铜、钠、钾、钼、铬、氯化物及其组合。制造方法本公开的营养组合物可通过用于制备所选产品固体或液体形式的任何已知或另外有效制造技术来制备。已知用于任何给定产品形式(如营养液或营养粉)的许多此类技术且其可容易由本领域普通技术人员应用于本文所述的营养组合物。因此,本公开的营养组合物可通过各种已知或另外有效调配或制造方法中的任一种来制备。在一种适合的制造方法中,例如制备至少三种个别的浆料,包括脂肪包蛋白质(protein-in-fat,pif)浆料、碳水化合物-矿物质(cho-min)浆料和水包蛋白质(protein-in-水,piw)浆料。pif浆料通过加热和混合油(例如,菜籽油、玉米油等),然后在持续加热和搅拌下添加乳化剂(例如,卵磷脂)、脂溶性维生素和一部分总蛋白质(例如,乳蛋白浓缩物等)来形成。cho-min浆料通过在加热搅拌下将以下添加至水中来形成:矿物质(例如,柠檬酸钾、磷酸氢二钾、柠檬酸钠等)、痕量和超痕量矿物质(tm/utm预混物)、增稠剂或悬浮剂(例如微晶粉末纤维素、结冷胶、角叉菜胶)。所得的cho-min浆料在持续加热和搅拌下保持10分钟,然后添加其他矿物质(例如,氯化钾、碳酸镁、碘化钾等)和/或碳水化合物(例如,hmos、果寡糖、蔗糖、玉米糖浆等)。然后piw浆料通过在加热和搅拌下与其余蛋白质(若存在)混合来形成。然后将得到的浆料在加热搅拌下掺合在一起并将ph调至6.6-7.0,随后对组合物进行高温短时(htst)处理,在此期间将组合物热处理、乳化和均质化,然后使其冷却。添加水溶性维生素和抗坏血酸,必要时将ph调至所需范围,添加调味剂,并添加水以达到所需的总固体水平。接着无菌包装组合物以形成无菌包装的营养乳液。然后可进一步稀释、热处理和包装该乳液以形成即食型或浓缩液体,或可将其热处理并随后加工和包装成可重构粉末,例如喷雾干燥、干混、聚结粉末。营养固体如喷雾干燥的营养粉或干混的营养粉可通过适于制备和调配营养粉的任何已知或另外有效技术的集合来制备。例如,当营养粉为喷雾干燥的营养粉时,喷雾干燥步骤可同样包括已知或另外适合用于制造营养粉的任何喷雾干燥技术。已知许多不同喷雾干燥方法和技术用于营养领域,其全部均适合用于制造本文的喷雾干燥的营养粉。一种制备喷雾干燥的营养粉的方法包括形成和均质化预先消化的脂肪和任选蛋白质、碳水化合物和其他脂肪来源的水性浆料或液体,然后喷雾干燥该浆料或液体以产生喷雾干燥的营养粉。该方法可进一步包括喷雾干燥、干混或另外向喷雾干燥的营养粉中添加其他营养成分(包括本文所述的任一种或多种成分)的步骤。其他适合用于制备营养产品的方法例如描述于美国专利第6,365,218号(borschel等)、美国专利6,589,576(borschel等)、美国专利第6,306,908号(carlson等)、美国专利申请20030118703a1(nguyen等)中,其描述在其据此一致的程度上以引用的方式并入本文中。使用方法如本文所述的营养组合物可用于针对本文所论述的一种或多种疾病或疾病状态,或可用于向早产儿、婴儿、幼儿和儿童提供本文所述的一种或多种益处。使用本文所述的营养组合物的早产儿、婴儿、幼儿或儿童实际上可能患有或罹患所述疾病或疾病状态,或可能易患疾病或疾病状态或处于患疾病或疾病状态的风险中(即,实际上可能尚未患有疾病或疾病状态,但与一般人群相比,由于某些疾病状态、家族史等而处于患病的高风险中)。无论早产儿、婴儿、幼儿或儿童实际上患有疾病或疾病状态,或处于疾病或疾病状态的风险中或易患疾病或疾病状态,早产儿、婴儿、幼儿或儿童在本文中归类为“需要”帮助对付和抗击疾病或疾病状态。例如,早产儿、婴儿、幼儿或儿童实际上可能患有呼吸道炎症或可能由于例如家族史或其他医学疾病状态而处于患呼吸道炎症的风险中(易患呼吸道炎症)。无论早产儿、婴儿、幼儿或儿童实际上患有疾病或疾病状态,或仅处于疾病或疾病状态的风险中或易患疾病或疾病状态,用本文所述的营养组合物帮助早产儿、婴儿、幼儿或儿童均在本公开的范围内。基于上文,因为本公开的一些方法实施方案是有关特定经鉴别个体的子集或子类(即,“需要”帮助针对本文所述的一种或多种特定疾病或特定疾病状态的个体的子集或子类),所以并非所有早产儿、婴儿、幼儿和儿童均属于如本文对于某些疾病或疾病状态所述的早产儿、婴儿、幼儿和儿童的子集或子类内。如本文所述的营养组合物包含单独hmos或hmos与一种或多种其他组分的组合,以提供用于减少炎症如呼吸道炎症(例如呼吸道融合病毒诱导性炎症)、肠炎症和鼻咽炎症的营养来源。本公开的包含hmos的营养组合物也可提供婴儿胃肠和免疫系统的最佳发育和生长与成熟平衡,由此增强婴儿抵抗微生物感染和调节针对感染的炎性反应的能力(例如,增加吞噬作用和增加活性氧物质的产生)。营养组合物还提供婴儿肠道上皮细胞的生长和成熟。在一个特定实施方案中,给予本公开的包括hmos和核苷酸的营养组合物可进一步活化新生儿肠道上皮细胞的免疫活性或由新生儿肠道上皮细胞来活化免疫活性。此外,营养组合物中使用hmos可减少呼吸道病毒(例如,rsv、2型人类副流感病毒和a型流感病毒)的生长,因此减少病毒诱导性上呼吸道感染。因此,通过营养产品(如婴儿配方食品)中使用单独hmos或hmos与其他免疫增强因子的组合,现在有可能向婴儿提供更密切地模拟母乳益处的母乳的替代物或补充剂。与如上文所述的改善婴儿免疫系统的生长和成熟一起,本公开的营养组合物的用途也充当免疫调节剂,由此减少由婴儿、幼儿和儿童的感染(如呼吸道病毒诱导性感染)诱导的炎症,尤其是rsv诱导性炎症,和其他感染介导性炎性疾病。hmos的添加可进一步增加婴儿及在特定实施方案中为早产儿的身体和血液内的谷胱甘肽水平。当与lcpufas和/或抗氧化剂,尤其是与类胡萝卜素组合使用时,hmos可减少氧化应激,其为氧化生物分子,如脂质过氧化物及其分解产物,蛋白质羰基和氧化受损dna的产生和积累增加的代谢状况。氧化应激的结果范围为代谢的不当变化至炎症和细胞与组织死亡。因此,通过降低婴儿的未经调节的炎症和氧化的发病率,减少对组织内壁(lining)的损伤和细胞死亡,从而进一步降低炎性疾病如坏死性小肠结肠炎(nec)的发病率。除上文所论述的益处外,已发现包括hmos的营养产品可调节婴儿的来源于单核细胞的细胞因子的产生,甚至在病毒不存在下也可进行。此细胞因子的产生导致免疫性得到改善以进一步预防微生物感染和减少病毒生长。在一个特定实施方案中,通过给予本公开的营养组合物所产生的来源于单核细胞的细胞因子包括例如白介素-10、白介素-8、白介素-1α、白介素-1β、白介素-1ra及其组合。营养组合物中使用hmos的另一益处为,已发现hmos调节ip-10的产生,其为在针对病毒感染的炎性反应中起重要作用的趋化因子。具体而言,儿童的rsv临床感染严重程度与血清ip-10水平之间存在正相关。因此,减少ip-10信号可降低rsv感染的严重程度。在一个特定实施方案中,ip-10产生降低至未感染对照中所见的水平。与ip-10减少一起,已发现hmos可减少血小板-嗜中性粒细胞复合物(pnc)形成,其存在于人类血液中且由至多25%未受刺激的嗜中性粒细胞组成。因为pncs以聚集体形式存在,所以其具有较大的起始炎性过程的能力且可增加活性氧物质的产生。因此,pnc形成的减少可导致婴儿的氧化应激和炎症减少。实施例以下实施例说明本公开的营养组合物的特定实施方案和/或特点。提供所述实施例仅出于说明的目的而并不应理解为限制本公开,因为在不脱离本公开的精神和范畴的情况下其许多变化可能存在。除非另外规定,所有示例性的量均为以组合物的总质量计的重量百分数。示例性的组合物为根据本文所述的制造方法制备的贮存稳定的营养组合物,以使得除非另外规定,各示例性的组合物包括无菌处理实施方案和蒸煮包装实施方案。实施例1-5实施例1-5说明本公开的即食型营养乳液,其成分列于下表中。除非另外规定,所有成分量均以每1000千克批次产品的千克数列出。an=根据需要。实施例6-10实施例6-10说明本公开的即食型营养乳液,其成分列于下表中。除非另外规定,所有成分量均以每1000千克批次产品的千克数列出。an=根据需要。实施例11-15实施例11-15说明本公开的浓缩液乳液,其成分列于下表中。除非另外规定,所有成分量均以每1000千克批次产品的千克数列出。an=根据需要。实施例16-20实施例16-20说明本公开的即食型营养乳液,其成分列于下表中。除非另外规定,所有成分量均以每1000千克批次产品的千克数列出。an=根据需要。实施例21-25实施例21-25说明本公开的浓缩液体乳液,其成分列于下表中。除非另外规定,所有成分量均以每1000千克批次产品的千克数列出。an=根据需要。实施例26-30实施例26-30说明本公开的人乳强化剂液体,其成分列于下表中。除非另外规定,所有成分量均以每1000千克批次产品的千克数列出。an=根据需要。实施例31-35实施例31-35说明本公开的喷雾干燥的营养粉,其成分列于下表中。除非另外规定,所有成分量均以每1000千克批次产品的千克数列出。an=根据需要。实施例36在该实施例中,分析经纯化的人乳寡糖(hmo)对体外抑制病毒感染力的作用。通过将约500单元/ml至约1,000单元/ml的均一病毒剂量的三种呼吸道病毒:(1)呼吸道融合病毒(rsv);(2)人类副流感病毒(hpiv3);或(3)h1n1流感病毒之一与以下hmos之一共培育来制备样品:(1)3'-唾液酸乳糖(3'sl);(2)6'-唾液酸乳糖(6'sl);(3)3'-岩藻糖基乳糖(3'fl);(4)2'-岩藻糖基乳糖(2'fl);(5)乳酰-n-新四糖(lnnt);或(6)唾液酸(sa)。hmos的添加浓度为1mg/ml或10mg/ml。评估各种hmos对呼吸道病毒的抗病毒活性,且结果示于下表中:nt=未测试。结果显示浓度为1mg/ml(ic50~2-5mg/ml)的3'fl对所有三种呼吸道病毒均具有抗病毒活性。该结果出乎意料,因为先前公开的报道显示仅唾液酸化寡聚物形式提供抗病毒活性。sa在1mg/ml的浓度下显著抑制hpiv3和h1n1病毒。h1n1流感病毒也受浓度为1mg/ml的3'sl抑制。实施例37在该实施例中,分析各种hmos体外阻断h1n1流感病毒感染力的能力。通过观察细胞病变效应(cpe)和定量病毒病灶形成单位来评估病毒感染力。为形成病毒原种,h1n1流感病毒购自atcc(vr1469)并在madin-darby犬肾(mdck)上皮细胞(atccccl-34)中扩增。以等分试样冷冻无细胞的上清液以维持病毒原种。在初始病毒培养和扩增以形成病毒原种期间,观察细胞cpe。为定量病毒感染力,使用商购的针对与生物素标记抗-小鼠igg二级抗体偶合的病毒核蛋白的小鼠单克隆抗体进行免疫细胞化学病灶形成单位(ffu)试验。为显现受病毒感染的细胞病灶,使用strepavidinhrp(abc,来自vectorlaboratories,inc.)进行显色。尽管病毒病灶的总数呈现与感染病毒浓度成正比,但病灶相当大且分散,并存在许多未形成病灶的个别受感染细胞,尤其在较高病毒浓度下。因为这使得病毒感染力的定量困难且耗时,所以通过改变病毒浓度并通过应用黄蓍胶的覆盖培养基(overlaymedium)来帮助减少整个细胞层中病毒的布朗运动(brownianmovement)传播来进一步改进ffu试验。使用黄蓍胶通过减少个别受感染细胞的数目来改良试验,同时仍允许形成容易观察到的病灶。虽然病灶大小不同,其中一些非常大,但其仍容易通过在计数期间使用栅格技术进行定量并与病毒浓度或效价成正比。检验后,将该试验用于各种hmos以分析阻断h1n1病毒感染力的能力。具体而言,将浓度为0.01mg/ml、0.1mg/ml、1.0mg/ml和10mg/ml的hmos添加至接种病毒悬浮液中,在37℃下培育1小时,然后添加至mdck单层细胞中。在37℃下使该混合物结合于细胞层三十分钟。然后洗涤细胞层,并再培育细胞约18-24小时,随后固定并作免疫细胞化学染色处理。结果示于图1中。如图1中所示,当使用浓度为10mg/ml时,3'fl、3'sl和sa各自使病毒感染力抑制大于90%。2'fl和6'sl在10mg/ml下使感染力抑制约60%。实施例38在该实施例中,评估包括各种hmos的营养组合物对减少早产小猪的氧化应激的作用。通过剖腹生产术(caesariansection,cs)在92%妊娠期的情况下收集早产小猪。小猪接受总胃肠外营养(tpn)48小时。48小时后,停止tpn并将小猪随机分为三组:配方食品组(n=7),喂食enfamil®lacto-free,商购自meadjohnson,evansville,in;处理组(n=9),喂食enfamil®lacto-free并添加400mg/l6'sl、1500mg/l2'fl和200mg/llnnt的组合;以及初乳组(n=5),喂食牛初乳。以每kg体重120ml配方食品的速率给小猪经肠喂食其各自的饲料达下一48小时。然后在48小时肠道营养(en)后,或若小猪发展坏死性小肠结肠炎的病征,则更早地使小猪安乐死。通过脐动脉导管收集血液,并将血浆与血液分离,并储存在-70℃下直至分析。在恰好喂食时间之前(时间0)和喂食后6小时、12小时、24小时、36小时和48小时,使用市售试验(nwlss谷胱甘肽试验#nwk-gsh01,northwestlifesciencespecialties,vancouver,wa)测量取自小猪的血浆中的谷胱甘肽(gsh)浓度。结果示于图2中。如图2中所示,来自对照组的血浆中gsh的浓度自时间0至喂食后6小时降低。在对照组中gsh在en后24小时仍较低。相比之下,喂食含hmos组合的组合物的小猪具有与初乳小猪相当的血浆gsh水平模式。实施例39在该实施例中,说明3'sl、6'sl和lnnt体外减少病毒诱导性炎症的能力。具体而言,将浓度为0.1mg/ml、0.2mg/ml或0.5mg/ml的3'sl或6'sl添加至新鲜外周血液单核细胞(pbmcs)中并在37℃、5%co2下培育以预处理细胞约24小时。将浓度为0.1mg/ml、0.2mg/ml或1mg/ml的lnnt添加至pbmcs中并在37℃、5%co2下培育以预处理细胞约24小时。包括乳糖作为碳水化合物对照。包括匹配的内毒素单位浓度对照以使成分作用与固有低水平的内毒素区别开。然后在37℃、5%co2下将一些变体与rsv在感染倍数(moi)为0.1下一起培育约1小时。在37℃、5%co2下将未感染对照变体与培养基一起培育约1小时。约1小时后,将单独新鲜培养基或含有适当浓度的3'sl、6'sl、lnnt、乳糖或内毒素的新鲜培养基添加至适当试管中,并在37℃、5%co2下培育细胞48小时。在感染后24和48小时收集上清液。在24和48小时,对于各变体测量上清液中的细胞因子以评估hmos对针对rsv早期免疫反应的作用。使用来自bio-rad的定制bio-plex人类细胞因子试剂盒测量细胞因子。ip-10为吸引、结合并活化自然杀伤细胞和记忆t细胞上的cxcr3受体的cxc趋化因子。ip-10由单核细胞和许多其他细胞表达,并由干扰素诱导。儿童的rsv临床疾病严重程度(如通过以下测量:住院的时间长度、发热和需要补充o2的天数)与血清ip-10之间存在正相关。因此,ip-10减少表示所经历的rsv疾病的严重程度降低。3'sl和6'sl的ip-10结果描述于图3和4,其显示6'sl下调测试的两个供体的病毒感染变体中的ip-10。应注意,6'sl能够使ip-10降低至未感染对照中所见的水平。3'sl在供体b中无效,但在供体e中下调rsv诱导的ip-10。这些数据显示3'sl和6'sl均阻抑rsv诱导的ip-10,但6'sl更有效地下调ip-10。结果也表明低于0.1mg/ml的6'sl水平以及大于0.5mg/ml的水平可有效地减少一些个体的ip-10。lnnt的ip-10结果描述于图5和6并显示供体反应的一些可变性,但令人惊讶地是,lnnt明显下调两个供体的病毒感染变体中的ip-10。应注意,lnnt能够使ip-10降低至未感染对照中所见的水平。结果也表明介于0.2和1mglnnt/ml之间以及大于1mg/ml的水平可有效地减少一些个体的ip-10。包括匹配的内毒素单位浓度对照清楚地指示,ip-10的减少并不归因于lnnt中存在极低水平的内毒素。在图7和8中,细胞因子结果也令人惊讶地显示,6'sl在rsv存在或不存在下以剂量依赖性方式增加白介素10(il-10)浓度。lnnt的il-10结果示于图9和10中。令人惊讶地是,lnnt在rsv存在或不存在下以剂量依赖性方式增加il-10浓度。il-10由活化的cd8+t细胞产生,在抗原特异性和多克隆活化后由cd4+t细胞产生,和在细菌脂多糖活化细胞后由单核细胞产生。包括匹配的内毒素单位浓度对照清楚地推断,ip-10的增加并不归因于6'sl或lnnt中存在极低水平的内毒素。令人惊讶地是,发现由6'sl、3'sl或lnnt预处理24小时可有效地减少由rsv引起的炎症。此外,如通过ip-10减少所测量的,显示6'sl和lnnt比3'sl更有效地阻抑病毒诱导性炎症。此外,显示6'sl在病毒不存在下具有免疫调节性,因为6'sl的包括诱导和/或改良来源于单核细胞的细胞因子(如il-10、mip-1β、干扰素-γ、il-8、il-1α、il-1β和il-1ra)的产生。令人惊讶地是,3'sl在病毒存在或不存在下也具有免疫调节性,因为3'sl的包括诱导和/或改良来源于单核细胞的细胞因子(如mip-1β、干扰素-γ、il-8和il-1ra)的产生。令人惊讶地是,lnnt在病毒存在或不存在下也具有免疫调节性,因为lnnt的包括诱导和/或改良来源于单核细胞的细胞因子(如il-10、mip-1β、干扰素-γ、il-8、il-1α、il-1β和il-1ra)的产生。实施例40在该实施例中,说明2'fl在佛波醇十四酸酯乙酸酯(phorbalmyristateacetate,pma)存在或不存在下减少未感染和受rsv感染的外周血液单核细胞(pbmcs)中细胞外活性氧物质(ros)的能力。第0天,从全血分离新鲜人类pbmcs。将浓度为0.1mg/ml、0.2mg/ml或1mg/ml的2'fl添加至pbmcs中并在37℃、5%co2下培育约24小时。第1天,移出细胞上清液并在37℃、5%co2下将pbmcs与单独培养基或培养基加上呼吸道融合病毒(rsv)在感染倍率(moi)为1下一起培育约1小时。约1小时后,将单独新鲜培养基或含有适当浓度的2'fl的培养基添加至适当试管中,并在37℃、5%co2下培育细胞48小时。第3天,移出20%(3.5×105个细胞)的pbmc培养基以使用化学发光探针异鲁米诺(isoluminol)分析来源于nadph氧化酶的活性氧产生。将分离的细胞均匀地分入两个具有含异鲁米诺和辣根过氧化酶的反应混合物的试管。一个试管用佛波醇12-十四酸酯13-乙酸酯处理以诱导nadph氧化酶复合物的活化。经60分钟时段用发光计监测由活性氧产生的化学发光。通过经60分钟时段求曲线下面积的积分来定量活性氧产生。分别收集剩余的pbmc上清液和细胞溶解物,分成等分试样并冷冻储存在-70℃下以供稍后分析。如图11b中所示的结果指示,2'fl在佛波醇十四酸酯乙酸酯(pma)不存在下阻抑未感染(0.1-0.2mg2'fl/ml)和受感染细胞(0.1-1.0mg2'fl/ml)中细胞外活性氧物质(ros)的释放。此外,如图11a中所示的结果指示,2'fl在pma存在下阻抑未感染(0.1-1.0mg2'fl/ml)和受感染(0.1-0.2mg2'fl/ml)pbmcs中的ros。阻抑ros可减少对肺和其他组织的rsv诱导性氧化应激损伤。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1